определяют как произведение ионной доли катиона на ионную долю аниона и коэффициент активности катиона, величина которого учитывает взаимодейст– вие между компонентами расплава.
Метод В.А. Кожеурова предложен для определения активности оксидов железа, марганца, магния и фосфора в оксидных шлаках высокой основности, в состав которых входят оксиды FeO , MnO , CaO , MgO , SiO2 и P2O5 .
Метода В.А. Кожеурова предполагает, что структурными компонентами шлака являются простейшие одноатомные ионы Fe2+ , Mn2+ , Ca2+ , Mg 2+ ,
Si4+ и P5+ , которые окружены общими анионами O2− . Так как анион O2− является единственным анионом в шлаке, формула для вычисления активности оксида в шлаке будет иметь вид
|
a(MeO) |
= X |
2+·X |
O |
2−· γ |
Me |
2+ |
= X |
Me |
2+· γ |
Me |
2+ , (6.32) |
|
Me |
где γMe2+ – коэффициент активности катиона.
Если в составе оксида содержится больше одного не кислородного атома, его активность следует рассчитывать по формуле
|
a |
) |
= |
X m |
· γm |
( 2n/m)+ |
. |
(6.33) |
|
(Me O |
( 2n/m)+ |
||||||
|
m n |
Me |
Me |
Для обозначения ионной доли каждого из катионов в современной науч– но–технической литературе рекомендуют пользоваться символами:
|
X1 |
= X |
Fe |
2+ ; X |
2 |
= X |
2+ ; |
X 3 |
= X |
Ca |
2+ ; X |
4 |
= X |
Mg |
2+ ; |
|
Mn |
||||||||||||||
|
X 5 |
= X |
Si |
4+ та X |
6 |
= X |
5+ . Если придерживаться этих символов, пред– |
||||||||
|
P |
ложенные В.А. Кожеуровым формулы для расчета коэффициентов активности катионов будут иметь вид
|
lg γ |
= |
1000 |
[2,18 X |
X |
+ 5,9(X |
+ X |
)X |
+ 10,5 X |
X |
] , |
(6.34) |
||||||||
|
T |
2 |
5 |
3 |
4 |
5 |
3 |
6 |
||||||||||||
|
1 |
|||||||||||||||||||
|
lg γ |
= |
lg γ − |
2180 |
X |
, |
(6.35) |
|||||||||||||
|
2 |
5 |
||||||||||||||||||
|
1 |
T |
|
= − |
5900 |
+ X |
+ X |
||||||||||||
|
lg γ |
X |
1 |
2 |
3 |
X |
5 |
, |
(6.36) |
|||||||
|
T |
|||||||||||||||
|
4 |
|||||||||||||||
|
lg γ |
= |
lg γ |
− |
10500 |
X |
. |
(6.37) |
||||||||
|
3 |
|||||||||||||||
|
6 |
1 |
T |
Следует помнить, что пользоваться формулой (6.36) для определения ко– эффициента активности катиона магния можно только в тех случаях, когда в шлаке нет фосфора.
Согласно методу В.А. Кожеурова расчет активности оксидов в шлаке проводят в следующем порядке:
1.Рассчитывают эквивалентное содержание в FeO шлаке.
2.Определяют ионные доли каждого из катионов в шлаке.
3.По формулам (6.34) – (6.37) рассчитывают величины коэффициентов актив– ности катионов.
4.Определяют активности оксидов в шлаке по формулам (6.32) и (6.33).
6.3.4 Метод А.Г. Пономаренко
Разработанная А.Г. Пономаренко теория расплавленного шлака как фазы с коллективной электронной системой предполагает, что компонентами шлака являются электронейтральные атомы химических элементов. Электроны всех входящих в состав шлака атомов образуют единую квантово–механическую систему, которую термодинамически можно охарактеризовать при помощи хи– мического потенциала электронов. Это позволяет представить парциальную эн– тропию смешивания в виде двух составляющих, которые учитывают тепловое возбуждение ядер и электронов в отдельности.
Парциальную энтальпию смешивания, как и в теории совершенных ион– ных растворов, принимают равной нулю.
Согласно данной методике активность компонентов шлака может быть рассчитана с использованием атомных коэффициентов активности по формуле
|
a‘ |
= C ψ |
i |
, |
(6.38) |
|
i |
i |
где Ci – концентрация компонента i в шлаке, приведенная в атом–
ных долях;
ψi – атомный коэффициент активности компонента i .
Расчет атомных коэффициентов активности компонентов шлака следует выполнять по уравнению
|
k |
ε |
−1 |
||||||||
|
= |
exp |
− |
i− j |
|||||||
|
ψ |
∑ C |
, |
(6.39) |
|||||||
|
i |
j |
RT |
||||||||
|
j=1 |
где k – общее число компонентов шлака;;
j– какой–либо компонент шлака;
εi− j – энергия обмена компонентов i и j , Дж;
R – универсальная газовая постоянная, Дж/(моль·К); T – температура, К.
Для определения энергий обмена компонентов предложено соотношение
|
ε |
= |
1 |
χ |
1/ 2 |
− χ |
1/ 2 |
2 |
||||
|
i |
j |
, |
(6.40) |
||||||||
|
2 |
|||||||||||
|
i− j |
где χi и χ j – атомные параметры компонентов шлака, Дж.
Если в состав оксида входит только один не кислородный атом, актив– ность оксида в шлаке рассчитывают по формуле
|
a |
) |
= |
a‘· a‘ n/m . |
(6.41) |
|
(iO |
i O |
|||
|
n/m |
Следует помнить, что рассчитанная согласно приведенной выше методике ве– личина атомной активности кислорода в шлаке обычно близка к единице. По– этому активность оксида в шлаке с достаточной для практических целей точно– стью можно приравнять к активности не кислородного элемента.
Если требуется определить активность в шлаке оксида, в состав которого входит более одного не кислородного атома, расчеты следует проводить по формуле
|
= a‘ |
m |
n |
|||||
|
a |
) |
· a‘ |
. |
(6.42) |
|||
|
(i O |
i |
O |
|||||
|
m n |
Расчет активности компонента в шлаке по методу А.Г. Пономаренко про– водится в следующем порядке:
1.Определяют количество молей каждого из компонентов в 0,1 кг шлака.
2.Определяют атомные доли каждого из компонентов шлака.
3.Пользуясь справочными данными, выбирают значения атомных параметров элементов и проводят расчет энергий обмена компонентов шлака по форму–
ле (6.40).
4.Определяют атомные коэффициенты активности компонентов шлака по формуле (6.39).
5.Определяют атомные активности компонентов шлака по формуле (6.38).
6.Рассчитывают активности оксидов в шлаке по формулам (6.41) или (6.42).
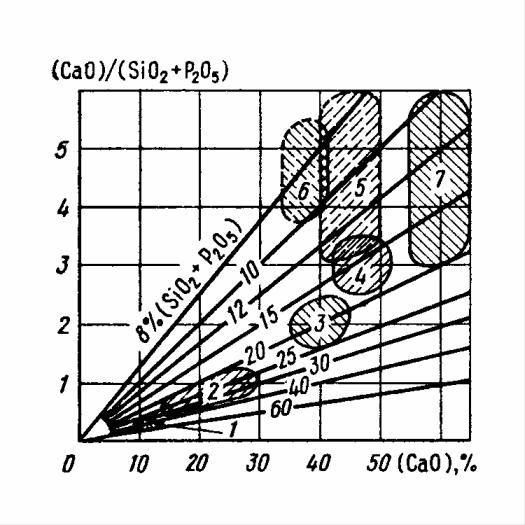
1 – доводка в кислой мартеновской печи при активном процессе; 2 – первая по– ловина периода плавления в основной мартеновской и дуговой электростале– плавильной печах; 3 – по расплавлению в основной мартеновской и в окисли– тельном периоде плавки в дуговой электросталеплавильной печи; 4 – в конце продувки в кислородном конвертере при переделе обычных чугунов и в основ– ной мартеновской печи при проведении доводки без значительного обновления шлака; 5 – доводка основной мартеновской плавки с многократным обновлени– ем шлака; 6 – в конце плавки при выплавке стали с содержанием углерода ме– нее 0,05%; 7 – восстановительный период плавки в дуговой электросталепла– вильной печи
Рисунок 6.1 – Изменение основности шлака и содержания (CaO) и
(SiO2 ) + (P2O5 ) в различные периоды плавки в разных сталеплавильных агрега–
тах

Рисунок 6.2 – Зависимость содержания оксидов железа в нейтральном шлаке от содержания углерода в металле и основности шлака (цифры у кривых) при
1600оС
Соседние файлы в папке TOMP
- #
- #
- #
- #
- #
- #
- #
- #
- #
|
Qij, |
FeO |
MnO |
CaO |
MgO |
SiO2 |
Р2О5 |
|
FeO |
0 |
0 |
0 |
0 |
0 |
0 |
|
MnO |
0 |
0 |
0 |
0 |
-42 |
0 |
|
CaO |
0 |
0 |
0 |
0 |
-113 |
-200 |
|
MgO |
0 |
0 |
0 |
0 |
–113 |
0 |
|
SiO2 |
0 |
-42 |
-113 |
-113 |
0 |
0 |
|
Р2О5 |
0 |
0 |
-200 |
0 |
0 |
0 |
Состав шлака варианта
№ 0 (массовая доля, %): FeO
– 18, MnO
– 6, CaO
– 44, MgO
– 7, SiO2
– 21, Al2O3
– 4. В.А. Кожеуров не рассматривал оксид алюминия в своих шлаках, но, как
правило, Al2O3
в этих системах ведёт себя как нейтральный компонент и можно принять, что его
энергии смешения равны нулю со всеми оксидами ().
Для нахождения
ионных долей катиона воспользуемся следующими молярными массами оксидов
(г/моль): FeO – 72, MnO
– 71, CaO
– 56, MgO
– 40, SiO2
– 60, Al2O3
– 102. Рассчитаем количество молей катионов Ʃni в 100 граммах шлака. В дальнейших расчетах, масса шлака сокращается, поэтому
удобно использовать 100 грамм шлака, так как в этом случае процентное
содержание оксида численно равно его массе:
.
Отношение массовой
доли оксида алюминия к его молярной массе необходимо умножить на 2, так как Al2O3
содержит два катиона металла. Для нахождения ионной доли катионов разделим
количество молей соответствующего катиона ni на
общее число молей всех катионов Ʃni:
;
;
.
Ионные доли
катионов целесообразно округлять до третьего знака после запятой. Выражение для
коэффициента активности катиона железа (1.9) удобно использовать в виде:
.
При температуре
1600 °С (1873 К) для шлака
заданного состава получаем
.
Активность FeO в шлаке при 1600 °С
.
Для расчета
равновесного кислорода и углерода под шлаком заданного состава необходимо знать
константы равновесия. При 1873 К КFeO
= 4,39 и КC
= 114 (см. приложение Е).
Равновесное
содержание кислорода под заданным шлаком:
.
Равновесное
содержание углерода под заданным шлаком:
.
Содержания
элементов целесообразно округлять до тысячных долей процентов.
Процесс дефосфорации
под окислительным шлаком описывают реакцией [5]:
.
(1.11)
За стандартное
состояние фосфора принят гипотетический однопроцентный раствор фосфора в жидком
железе, обладающий свойствами бесконечно разбавленного; для оксида фосфора –
чистый жидкий P2O5.
Константа равновесия реакции (1.11) KP имеет вид
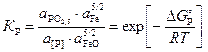
(1.12)
где – активность оксида РО2,5
в шлаке;
a[Р]
– активность фосфора в жидком железе.
Примем, что жидкий
металл – практически чистое железо, тогда . Подставляя
и
в
(1.12) получаем
.
(1.13)
Коэффициент
распределения фосфора LP
часто используют в виде LP
= (P)/[P],
где (P)
– массовая доля фосфора в шлаке, %. Ионная доля катиона фосфора в шлаке связана
с его массовой долей соотношением , так как
. Молярная масса фосфора 31
г/моль, тогда (1.13) примет вид
. (1.14)
Выражение (1.14)
позволяет по известным составам металла (fP)
и шлака (), и заданной
температуре (KP)
рассчитать коэффициент распределения фосфора. Для расчетов выражение (1.14)
удобно использовать в логарифмическом виде. Учтём, что и lgKP
= 1074/T –1,289. Тогда
. (1.15)
Коэффициент
активности катиона фосфора в шлаке можно найти по уравнению (1.10)
Значения
параметров взаимодействия из приложения 5 , начальное содержание
фосфора для варианта № 0 [P]
= 0,050%.
Для определения
конечного содержания фосфора в жидком металле составим систему уравнений
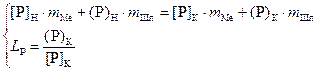
(1.16)
где mMe,
mШл
– массы металла и шлака соответственно;
[P]H,
[P]K,
(P)H,
(P)K
– начальные и конечные содержания фосфора в металле и шлаке, %.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание – внизу страницы.
15.05.2015
Рентгеноструктурный анализ кристаллических окислов и силикатов показал, что они построены не из молекул окислов, а из ионов. У окислов (СаО, MgO, FeO, NiO) в узлах кристаллической решетки расположены катионы металлов Ca2+, Mg2+, Fe2+ и анионы кислорода О2-; у силикатов — ионы металлов и сложные анионы, составленные из атомов кислорода и кремния. У кристаллических ортосиликатов (моносиликатов О:Si=4) существуют наиболее простые и подвижные анионы SiО4в4-, представляющие собой тетраэдр, сложенный четырьмя атомами кислорода, в центре которого находится атом кремния. Каждый атом кислорода аниона SiO4в4- обладает одной ненасыщенной валентностью, связывающей SiO4в4- с другими ионами. У более кислых силикатов появляются сложные кремнекислородные анионы, составленные из нескольких кремнекислородных тетраэдров, скрепленных общими атомами кислорода. Для метасиликатов (бисиликатов О:Si=3) характерны связи кремнекислородных тетраэдров в длинные цепочки или кольца, так что каждый тетраэдр связан с двумя соседними общими атомами кислорода. Кольца и цепочки тетраэдров являются сложными многозарядными анионами (SiO3)n2-; на каждый атом кремния такого аниона остаются две валентности для связывания катионов. Более кислые силикаты (О:Si<3) имеют цепочки или кольца, соединенные в двухмерные и трехмерные (пространственные) решетки кремнекислородных тетраэдров путем связывания тетраэдров тремя общими атомами кислорода. Наконец в чистом кремнеземе (О:Si=2) каждый из четырех атомов кислорода кремнекислородных тетраэдров принадлежит двум соседним тетраэдрам, образующим кристаллическую решетку кремнезема.
Химические связи кремния с кислородом и кремнекислородных тетраэдров между собою имеют ковалентный характер, а связи кремнекислородных анионов с простыми металлическими катионами являются ионными связями.
При плавлении окислов и силикатов характер химических связей между различными атомами не может коренным образом измениться, так что в жидких, расплавах должны быть в основном те же ионы, из которых сложено кристаллическое вещество. Это утверждение является исходным положением ионной теории строения шлаков.
Справедливость ионного строения расплавов галоидных солей одновалентных и двухвалентных металлов вполне доказана и не вызывает сомнений. Ионная теория строения шлаков распространяет положение о ионном строении расплавов на сложные многокомпонентные системы расплавов окислов, составляющие основу металлургических шлаков.
В соответствии с данными о строении кристаллических соединений принимается, что в расплавленных шлаках присутствуют простые катионы металлов (Ca2+ , Na+ , Fe2+ ,Al3+) и простые и сложные анионы [O2-, S2-, SiO4в4-, (SiO3)n2-, РO4в3-, АlO2-, FeO2-]; фосфорный ангидрид и барный ангидрид в кислых расплавах способны образовывать большие малоподвижные анионы из большого числа атомов фосфора (бора) и кислорода, так же как кремнекислота. В сложных анионах силикатов часть кремния может замещаться трехвалентным алюминием с образованием еще более сложных алюмосиликатных анионов.
С точки зрения ионной теории шлаков становится понятной причина высоких вязкостей и медленного уменьшения вязкости с ростом температуры у кислых шлаков. Такие шлаки имеют очень крупные составленные из большого числа атомов анионы, обладающие малой подвижностью из-за протяженности и взаимных связей цепочек и колец и распадающиеся на меньшие агрегаты только при значительном перегреве.
Наиболее убедительными доказательствами ионной природы шлаков является их поведение под действием электрического тока.
При прохождении постоянного тока через жидкий шлак на электродах получаются продукты электролиза и расплав в катодном пространстве обогащается веществам катионов, а в анодном пространстве — веществом анионов. Электропроводность реальных шлаков близ температур плавления составляет 0,1—16 ом-1*см-1 т. е. величины, недалекие от электропроводностей расплавленных галогенидов щелочных металлов (2,4—6,6 oм-1*cм-1), считающихся нацело диссоциированными на ионы. Высокие значения электропроводностей имеют место только у шлаков с высоким содержанием железа или марганца, обладающих, на ряду с ионной, также очень значительной электронной проводимостью. Расплавленные алюмосиликаты кальция обладают только ионной проводимостью, не превышающей 1 oм-1*cм-1.
Исследуя насыщенные кремнекислотой силикаты кальция и железа, О.А. Бсин с сотрудниками показал, что числа переноса катионов таких шлаков близки к единице. Отсюда следует, что ток переносится подвижными катионами металлов, а сложные кремнекислородные анионы практически не участвуют в переносе электричества. При понижении содержания кремнекислоты в железосодержащих шлаках числа переноса катионов уменьшаются вследствие появления подвижных анионов кислорода и увеличения роли электронной проводимости. При содержании закиси железа 90% число переноса катионов падает до нуля и практически весь ток переносится электронами.
Низкие электропроводности бедных железом кислых шлаков являются следствием высокой вязкости шлаков, во много раз большей вязкости расплавленных хлоридов щелочных металлов. По Френкелю, для ионных расплавов с ионами различного характера величина электропроводности определяется наиболее подвижными ионами, а величина вязкости — наименее подвижными частицами. Увеличение содержания кремнекислоты ведет к понижению электропроводности и возрастанию вязкости. Связь между величинами вязкости η и электропроводности шлака х описывается уравнением
ηn x = C,
где n — больше единицы;
С — не зависит от температуры.
Полезность ионных представлений о строении расплавленных шлаков была продемонстрирована А.М. Самариным, М.И. Темкиным и Л.А. Шварцманом при решении задачи о распределении серы между сталью и шлаком, не получившей удовлетворительного разрешения с позиций молекулярной теории. При решении задачи использовали развитую М.И. Темкиным теорию совершенных ионных растворов.
По М.И. Темкину, совершенный ионный раствор — аналог идеального раствора неэлектролитов, но характеризуется определенным порядком расположения ионов. Ближайшее окружение каждого катиона состоит только из анионов, а ближайшее окружение каждого из анионов — только из катионов. Теплота смешения компонентов при образовании совершенного ионного раствора равна нулю. В ионном растворе могут обмениваться местами только различные катионы и только различные анионы, обмен местами между катионами и анионами невозможен. Раствор двух нацело диссоциированных электролитов ведет себя как пара независимых, хотя и не отделимых друг от друга растворов — раствор катионов и раствор анионов.
Эти положения дают возможность вычислить величину энтропии смешения электролитов при образовании совершенного ионногo раствоpa. Haпримep, для совершенного ионного раствора а молей CaS и b молей Fe2SiO4 энтропия смешения равна
Первое выражение в скобках дает величину прироста энтропии при образовании идеального раствора а молей Ca2+ и 2b молей Fe+, второе — величину прироста энтропии при образовании раствора а мелей S2- и b молей SiO4-.
При расчетах равновесий ионных растворов пользуются величинами (ионная доля иона), равными отношению числа молей данного иона к сумме числа молей всех ионов того же знака заряда. Ионные доли — аналоги молярных долей для растворов неэлектролитов. Величины а/а+2b, а/а+2b в выражении энтропии смешения являются ионными долями Ca2+ , Fe2+.
Заметим, что молекулярная теория строения шлаков приводит к иному выражению энтропии смешения.
Согласно Льюису, величина активности соли в растворе связана с активностями ионов — продуктов диссоциации соли — следующим выражением:
Последняя формула позволяет вычислить величину активности каждого вещества, которое может присутствовать в данном ионном растворе, по величинам ионных долей, составляющих вещество ионов, и коэффициентам активности ионов.
В совершенном ионном растворе коэффициенты активности ионов равны единице, т. е. величины активностей ионов равны ионным долям. Для совершенного ионного раствора CaS и Fe2SiO4 активность FeS равна произведению ионных долей, составляющих его Fe2+ и S2-:
а активность Fe2SiO4 выражается через ионные доли Fe2+ и SiO4в4-следующим образом:
Расчет распределения серы между сталью и шлаком применительно к процессам производства стали с позиций ионной теории дал удовлетворительное совпадение с показателями реального процесса для основных шлаков (содержащих не выше 30% кремнекислоты). Такие шлаки близки к совершенным ионным растворам.
Применение ионной теории привело к успеху при решении задач о растворимости окислов в шлаках и растворимости сульфидов в сплавах окислов и сплавах сульфидов — штейнах.
При расчетах равновесий в шлаках со значительными содержаниями кислотных окислов необходимо допускать возможность существования в шлаке сложных кислотных анионов: SiO4в4-, РО4в3-, AlO2-.
Сложные кислые шлаки не могут считаться совершенными ионными растворами — образование шлака из окислов сопровождается значительными тепловыми эффектами. В таких шлаках между определенными ионами существуют химические связи, уменьшающие подвижность этих ионов.
Разработка теории несовершенных ионных растворов пока ограничивается растворами компонентов с общим ионом. Кожеуровым показано, что при решении ряда задач можно получить правильный ответ, не делая предположений о существовании сложных анионов.
Сравнение описаний шлаковых систем с точки зрения молекулярной и ионной теорий свидетельствует о преимуществе ионной теории. Однако нельзя сделать исчерпывающего описания свойств реальных шлаков при пользовании только положениями о совершенных ионных растворах. Простая схема совершенных ионных растворов является только первым приближением. Реальные шлаковые (и штейновые) системы содержат, наряду с обычными подвижными ионами, связанные между собой группы ионов, напоминающие своим поведением недиссоциированные молекулы. Некоторые реальные системы обладают, наряду с ионной проводимостью, также и электронной проводимостью, причем электронная проводимость может преобладать над ионной.
Ионная теория строения шлаков дает более правильную модель реальных шлаков по сравнению с молекулярной теорией. Однако математический аппарат ионной теории еще очень сложен, а экспериментальных материалов, трактуемых с позиций ионной теории, пока немного. Поэтому при расчетах нельзя отказаться от использования ценных экспериментальных материалов, освещенных с позиций старой молекулярной теории.
- Молекулярная теория строения шлаков
- Строение расплавленных шлаков
- Процесс образования металлургического шлака при плавке
- Вязкость металлургических шлаков
- Плавкость металлургических шлаков
- Химическая характеристика металлургических шлаков
- Роль внешнего давления в процессах испарения и конденсации
- Теория процессов конденсации
- Теория процессов перегонки
- Термодинамика процессов испарения в однокомпонентной системе
Ионная доля
Cтраница 1
Ионная доля определяется отношением числа килограмм-ионов данного элемента к сумме килограмм-ионов всех ионов того же знака.
[1]
Ионная доля кислорода является более точной мерой основности шлака. Установлено, что начальная стадия разъедания огнеупора шлаком находится в прямой зависимости от концентрации свободного кислорода в расплаве. В дальнейшем при образовании реакционного слоя продуктов реакции, как было отмечено выше, скорость коррозии зависит от диффузии.
[3]
Ионная доля ординарной связи С – N составляет всего около 6 %, но для пиррола Паулинг считает, что она составляет около 24 % в четырех ионных структурах.
[4]
Наряду с ионными долями в выражения для / Cs, LS и LQ приходится ввести коэффициенты активности ys2 и – iQz -, показывающие степень отклонения реального шлака от совершенного ионного раствора.
[5]
Ее EZ – ионная доля EG е – элементарный заряд h – постоянная Планка К, – постоянная закона действия масс ( гл.
[6]
ЛЭО сильно выражена ионная доля связи и координационное число ( к.
[7]
Величины N называют иногда эквивалентными ионными долями.
[8]
Концентрации выражены в ионных долях.
[10]
Герасименко [45] в выражение константы подставлял обычные ионные доли ( не по теории совершенных ионных растворов), а зависимость соответствующих коэффициентов активности от состава находил чисто эмпирическим путем.
[12]
При больших значениях ДЭО сильно выражена ионная доля связи и координационное число ( к. С ростом ДЭО ( по Полингу Дя) уменьшается подвижность электронов и дырок.
[13]
Легко видеть, что сумма всех ионных долей в совершенном ионном растворе, в отличие от идеального, равна не единице, а двум.
[14]
Активность совпадает, следовательно, с ионной долей, вычисленной, однако, таким образом, как если бы расплав состоял из двух независимых идеальных растворов.
[15]
Страницы:
1
2
3
4
Опубликовано 11.06.2017 по предмету Химия от Гость
>> <<
Определите формулу ионного соединения, массовые доли элементов в котором составляют: кальция 24,39%, азота 17,07%, кислорода 58,54%
Ответ оставил Гость
M(Ca) = 40 г/моль
n(Ca) = 24.39/40 = 0.6 моль
M(N)=14 г/моль
n(N) = 17.07/14 = 1.2 моль
M(O) = 16 гмоль
n(O) = 58.54 /16 = 3.66 моль
n(Ca) : n(N) : n(O) = 0.6 : 1.2 : 3.66 = 1 : 2 : 6
CaN2O6 или Ca(NO3)2
Оцени ответ
Подпишись на наш канал в телеграм. Там мы даём ещё больше полезной информации для школьников!






