Типичным веществом с ионной связью является натрий NaCl или поваренная соль. Его кристаллы точно соответствуют всем свойствам.
Ионная связь в химии — виды, типы, формулы и определения с примерами
Ионы образуются в результате снабжения или связывания электронов атомами. Атомы, заряженные валентными электронами, становятся положительно заряженными ионами, а атомы, принимающие электроны, становятся отрицательно заряженными ионами. Ионы — это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. Катионы состоят в основном из металлов и ионов аммония. Сами неметаллы не образуют катионов (кроме H + ). Из уроков физики видно, что положительно и отрицательно заряженные ионы притягиваются друг к другу. Поэтому между положительно и отрицательно заряженными ионами существует взаимное притяжение.
Химические связи, образующиеся между ионами в результате электростатического притяжения, называются ионными связями. Полученные соединения называются ионными или гетерополярными соединениями. Ионные связи образуются между металлами и неметаллами, т.е. между атомами элементов с радикально различной электроотрицательностью. Самые прочные ионные связи возникают в кислородсодержащих и бескислородных солях кислот (например, между металлами (щелочными и щелочноземельными) и галогенами) и оснований. Таким образом, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионная связь имеет несколько характерных свойств.
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH
В ионно-связанных соединениях число ионных связей равно произведению числа валентных катионов. Соли, содержащие базовые кислородсодержащие ионы и ионы аммония, имеют как ионные, так и полярные ковалентные связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению прочности центральных элементов на их индекс. Однако в кислотных солях число полярных ковалентных связей равно произведению силы центрального элемента и количества H индекса кислотного остатка.
| Вещества | Число ионных связей в молекуле | Число полярных ковалентных связей в молекуле |
| 3 | 3-4=12 | |
 |
2- 3=6 | 3-6=18 |
Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью.
Металлическая связь
Химическая связь, образующаяся между положительно заряженным ионом металла и относительно свободным электроном в кристаллической решетке, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Свободные электроны, удаленные от атома, перемещаются между катионами металла, образуя металлические связи, и эти электроны, по-видимому, связывают катионы в металлической решетке.
Металлические связи обладают несколькими характерными свойствами.
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
По определению, ионные химические связи — это соединения ионов с разными зарядами (положительным и отрицательным). Это особый случай ковалентной связи, т.е. экстремальной поляризации.
Ионная химическая связь
Ковалентные полярные химические связи, в которых электронные пары неравномерно распределены между атомами из-за небольших различий в электроотрицательности атомов (от 0,4 до 2,0), уже были кратко рассмотрены. Для тех, кто забыл, напомним, что электроотрицательность — это способность индивида притягивать к себе электроны.
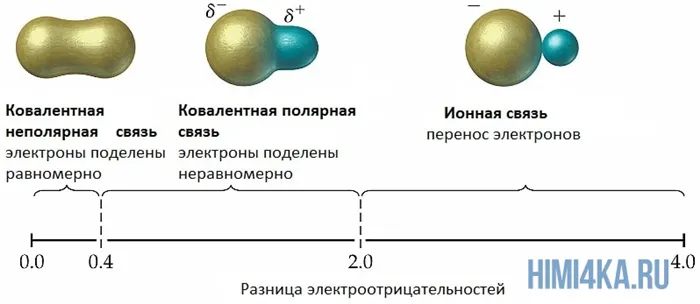
Однако, согласно электроимпульсной панели, если электроны атома отличаются более чем на два, пара электронов будет полностью находиться на наиболее электрифицированном атоме, что приведет к образованию ионно-химической связи. Ионно-химические связи обычно образуются только между металлами (потому что внешние электроны легко теряются) и неметаллами (из-за высоких электронов).
Положительные и отрицательные ионы
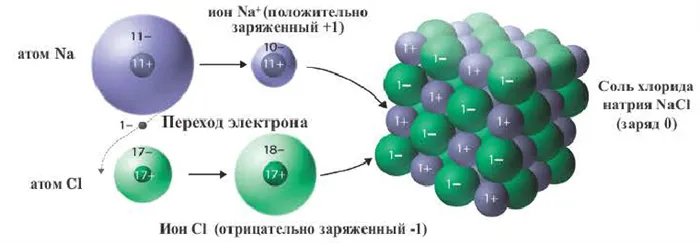
Хорошим примером ионно-химической связи является обычная поваренная соль NaCl, имеющаяся на всех кухнях. Отдельный натрий (и вообще все металлы) имеет низкую плотность электронов, в то время как атомы хлора имеют очень высокую плотность электронов, т.е. высокоэлектронные.
Поэтому при образовании молекулы NaCl каждый индивид NA теряет электрон (E-) и образует положительный ион натрия Na+; наоборот, все приобретают этот потерянный электрон натрия и отрицательный хлор Cl -Cl -Cl -Cl -. Это регистрируется как две реакции.
Запись ½ кл.2 Это было необходимо потому, что газ хлор в природе состоит из двухатомных молекул, а не из отдельных индивидуумов хлора.
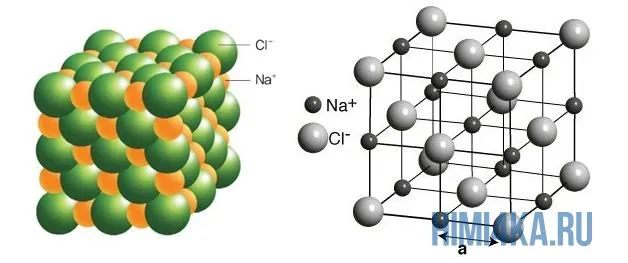
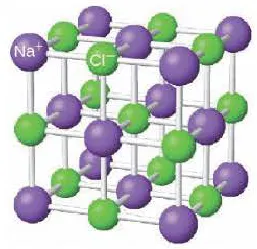
На диаграмме выше показана кристаллическая решетка NaCl. Здесь каждый клонированный ион хлора окружен со всех сторон соседними положительными ионами натрия, а ионы натрия Na+ окружены соседними ионами хлора Cl -Cl-. Этот ионный макет очень стабилен.
Положительно заряженные ионы называются катионами. В основном они содержат металлы, так как они в основном легко отдают от одного до трех электронов. Примерами катионов являются:.
Анионы являются неметаллами, поскольку они охотно присоединяют к себе электроны и превращаются в отрицательно заряженные ионы. Примеры анионов:.

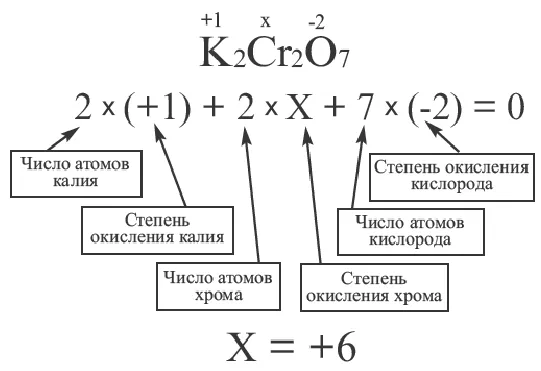
Степень окисления веществ
Простые однопесчаные ионные нагрузки, такие как Mg 2+ или F 2-, называются состояниями окисления. Состояние окисления — это количество электронов, добавленных (повышено) или удаленных (окислено) из иона, возвращая его в нейтральное состояние.
Процесс добавления электронов к человеку, или просто их смещение к этому человеку, называется реактивной реакцией, а удаление электронов от человека, или их полное удаление, называется окислительной реакцией. Это отличный лист с простыми ситуациями ионного окисления.

Пример 12.Окисление или восстановление хлора с образованием ионов хлора? В какой степени окисления находится этот ион? Решение: каждый хлор должен иметь прикрепленный к нему электрон, чтобы образовать ион хлора, поэтому хлор прослеживается. Ион хлора, Cl-, имеет степень окисления -1.
Пример 13.Окисляются ли металлы или убывают при образовании ионов? В какой степени окисления находится ион алюминия? РЕШЕНИЕ: При образовании ионов металлов они окисляются, поскольку с атомов металла удаляются электроны. Степень окисления иона алюминия, Al 3+, равна +3.
Дополнительным способом проверки правильности результатов является оценка физических свойств вещества. Если температура кипения или плавления высока, а электричество нагнетается, то связь, скорее всего, ионная.
Характеристика ионной связи
Химические взаимодействия, возникающие в результате притяжения ионов с разными зарядами, известны как ионные взаимодействия. Это происходит, когда существует значительная разница в электроотрицательности (т.е. способности притягивать электроны) связанных атомов, и электронная пара передается более электроотрицательному элементу. Этот перенос электронов от одного атома к другому приводит к образованию заряженных частиц (ионов). Между ними возникает притяжение.
Типичные металлы имеют самую низкую электроотрицательность, а типичные неметаллы — самую высокую. Поэтому ионы образуются в результате взаимодействия между типичными металлами и типичными неметаллами.
Атомы металла становятся положительно заряженными ионами (катионами), отдавая внешние электронные уровни, в то время как неметаллы получают электроны и становятся отрицательно заряженными ионами (анионами).
Атом переходит в более стабильное энергетическое состояние и завершает электронную конфигурацию.
Поскольку электростатические взаимодействия происходят во всех направлениях, ионы могут притягивать ионы противоположного знака во всех направлениях, так как ионные связи являются ненаправленными и ненасыщенными.
Ионное расположение таково, что вокруг каждого из них находится определенное количество противоположно заряженных ионов. Термин «молекула» не имеет значения для ионных соединений.
Примеры образования
Образование связей в хлориде натрия (nacl) обусловлено переносом электронов от атома Na к атому Cl с образованием соответствующего иона.
В хлориде натрия вокруг катиона натрия находятся шесть анионов хлора, а вокруг каждого иона хлора — шесть ионов натрия.
Во время образования взаимодействий между индивидами в сульфиде бария происходит следующий процесс
Ba отдает свои два электрона сере, образуя анион серы S2- и катион бария Ba2+.

Небольшое количество электронов на внешних энергетических уровнях металла легко вытесняется из ядра. В результате такого разделения образуются ионы металла и свободные электроны. Эти электроны называются «электронным газом». Электроны свободно перемещаются в объеме металла и постоянно связываются и отрываются от атомов.
Структура металлических веществ следующая. Кристаллическая решетка является основой материала, и электроны могут свободно перемещаться между ее узлами.
Приведите следующие примеры.
Ковалентная: полярная и неполярная
Наиболее распространенным типом химического взаимодействия является ковалентная связь. Значения электроотрицательности взаимодействующих элементов существенно не различаются. В этом соединении только одна общая электронная пара смещается в сторону более электроотрицательного атома.
Ковалентные взаимодействия могут формироваться по обменному или донорно-акцепторному механизму.
Механизм обмена возникает, когда на внешнем электронном уровне каждого атома есть неспаренные электроны, а перекрытие атомных орбиталей приводит к появлению электронных пар, которые уже принадлежат обоим атомам. Если один из атомов имеет одну электронную пару на внешнем электронном уровне, а другой — свободную орбиталь, перекрывание атомных орбиталей приводит к обобщению электронных пар и взаимодействий по донорно-акцепторному механизму.
Ковалентные связи разделяются по кратности следующим образом
Дуал обеспечивает два обобщения электронной пары одновременно, триплет — три.
В соответствии с распределением электронной плотности (полярности) между связанными атомами, ковалентные связи делятся следующим образом
Неполярные связи образуются одинаковыми атомами, а полярные — атомами с разной электроотрицательностью.

Взаимодействие людей рядом с электронами называется неполярной связью. Такая общая пара электронов в молекуле не притягивается ни к одному из индивидуумов, а принадлежит обоим.
Взаимодействие между элементами с разными электронами приводит к образованию полярных связей. Общая пара электронов при таком типе взаимодействия притягивается к наиболее электризованному элементу, но не полностью к нему (т.е. образование ионов не происходит). Если вам нужна любящая, оплачиваемая фея, умеющая заниматься сексом, вы пришли по адресу. По очень доступным ценам многие работники публикуют свои интимные и эротические фотографии и реальные номера телефонов! Девушки-проститутки Пензы могут приехать к вам в гости, пригласить вас побывать в их сауне или ресторане, поразить всех отличной партнершей и закончить вечер горячим и разнообразным сексом. В результате этого смещения электронной плотности человека возникает несколько нагрузок. Наиболее электроотрицательные грузы и наименее положительные.
В индивидуальных кристаллических решетках этих веществ ковалентные связи между индивидами сильны и характеризуются тоношитой и высокой температурой плавления.
Общая характеристика ионной химической связи
Ионы — это заряженные частицы, в которые превращаются индивиды в процессе предоставления или получения электронов. Они сильно притягиваются друг к другу, поэтому вещества с таким типом связи имеют высокие температуры кипения и плавления.
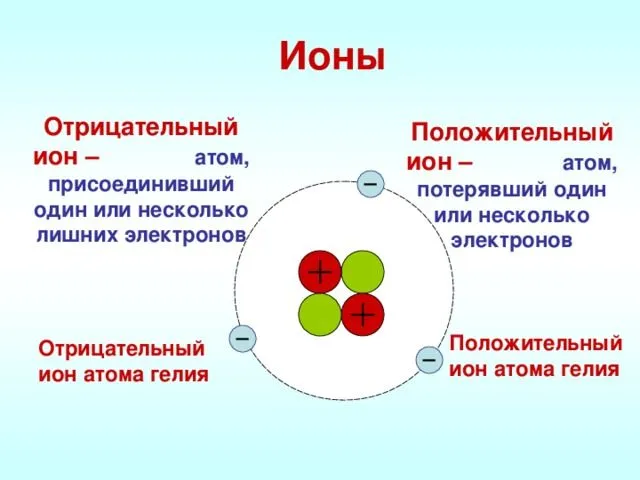
Рисунок 1.Ионы.
Ионные связи — это химические связи между противоположными ионами из-за электростатического притяжения. Разница между электронами связанных индивидов настолько велика, что при полном разделении зарядов это можно рассматривать как предельный случай ковалентной связи.
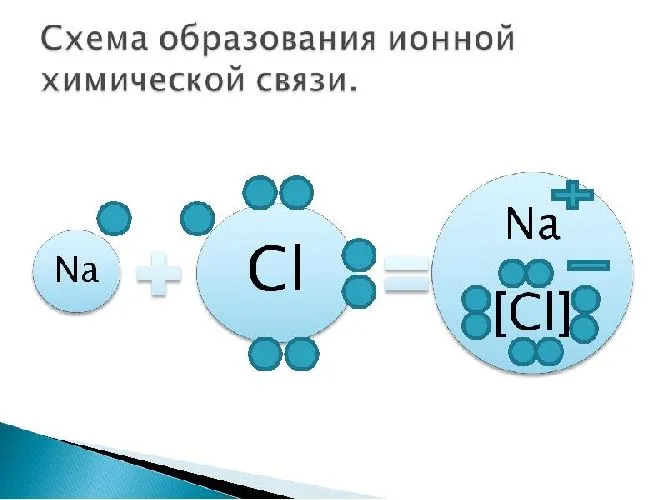
Рисунок 2. Ионная химическая связь.
Обычно говорят, что связь имеет электроотрицательность, если количество электронов в связи > 1,7.
Разница в электронах настолько велика, насколько элементы находятся друг в друге. Эта взаимосвязь характерна для металлов и неметаллов, особенно для тех, которые относятся к наиболее удаленным группам, таким как I и VII.
Примеры: поваренная соль, хлорид натрия NaCl:.
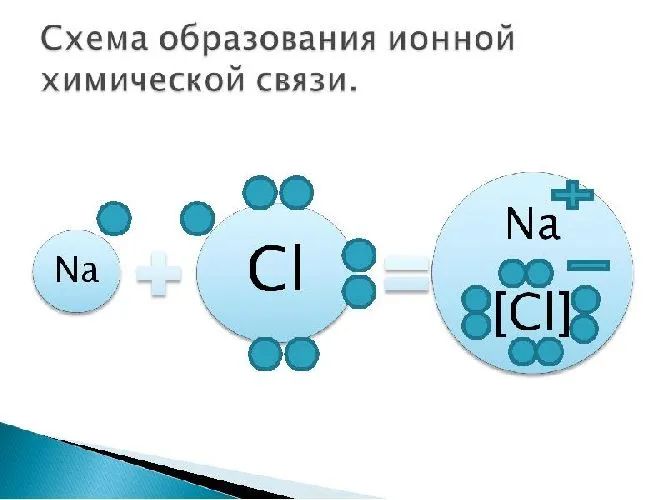
Рисунок 3. Схематическая диаграмма ионной химической связи хлорида натрия.
Ионные связи присутствуют в кристаллах, они прочные, длинные, ненасыщенные и ненаправленные. Ионная связь характерна только для сложных веществ, таких как соли, щелочи и оксиды некоторых металлов. В газообразном состоянии эти вещества существуют в виде ионных молекул.
Ионно-химические связи обычно образуются между металлами и неметаллами. Электроны вынуждены передаваться от металла к неметаллу, образуя ионы. В результате возникает электростатическое притяжение, называемое ионной связью.
На самом деле, полностью ионной связи не существует. Таким образом, ионные связи являются частично ионными и частично ковалентными. Однако сложные молекулярно-ионные связи могут рассматриваться как ионные.
Примеры образования ионной связи
Можно привести различные примеры образования ионных связей.
— Кальцию легче отдать два электрона, чем получить недостающий электрон.
— Фториду, с другой стороны, легче приобрести электрон, чем отдать семь электронов.
Найдем наименьшее общее кратное образовавшегося ионного заряда. 2. Определите количество атомов фтора, которые примут два электрона от атома кальция: 2:1 = 2. 4.
Сформулируйте тип ионно-химической связи.
Натрий относится к основной группе первой группы. Он может легко терять электроны.
-Кислород находится в главной подгруппе шестой группы. Конечно, легче получить два электрона, чем отдать шесть.
Найдем наименьшее общее кратное между образовавшимися ионными зарядами. Это 2:1 = 2. Найдите число атомов натрия, отдающих два электрона атому кислорода: 2,4.
Создайте схему образования ионной связи: 2.5.
Ионы – это атомы, потерявшие или получившие электроны и, как следствие, некоторый заряд. Для начала хотелось бы напомнить, что ионы бывают двух типов: катионы (положительный заряд ядра больше, чем количество электронов, несущих отрицательный заряд) и анионы (заряд ядра меньше количества электронов). Ионная связь образуется в результате взаимодействия двух ионов с разноименными зарядами.
Ионная и ковалентная связь
Данный тип связи является частным случаем ковалентной. Разность электроотрицательностей в данном случае столь велика (более чем 1,7 по Полингу), что общая пара электронов не частично смещается, а полностью переходит к атому с большей электроотрицательностью. Поэтому образование ионной связи является результатом возникновения сильного электростатического взаимодействия между ионами. Важно понимать, что не существует стопроцентно ионной связи. Данный термин применяется, если «ионные признаки» более выражены (т.е. электронная пара сильно смещена к более электроотрицательному атому).
Механизм ионной связи
Атомы, имеющие практически полную или практически пустую валентную (внешнюю) оболочку, наиболее охотно вступают в химические реакции. Чем меньше пустых орбиталей на валентной оболочке, тем выше шанс, что атом получит электроны извне. И наоборот – чем меньше электронов находится на внешней оболочке, тем вероятнее, что атом отдаст электрон.
Это способность атома притягивать к себе электроны, поэтому атомы с наиболее заполненными валентными оболочками более электроотрицательны.
Типичный металл охотно отдает электроны, тогда как типичный неметалл охотнее их забирает. Поэтому чаще всего ионную связь образуют металлы и неметаллы. Отдельно следует упомянуть другой тип ионной связи – молекулярную. Ее особенность в том, что в роли ионов выступают не отдельные атомы, а целые молекулы.
Схема ионной связи
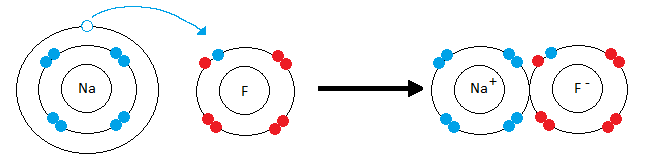
На рисунке схематически изображено формирование фторида натрия. Натрий имеет низкую электроотрицательность и всего один электрон на валентной оболочке (ВО). Фтор – значительно более высокую электроотрицательность, ему не хватает всего одного электрона для заполнения ВО. Электрон с ВО натрия, переходит на ВО фтора, заполняя орбиталь, в следствии чего оба атома приобретают разноименные заряды и притягиваются друг к другу.
Свойства ионной связи
Ионная связь достаточно сильна – разрушить ее при помощи тепловой энергии крайне сложно, а потому вещества с ионной связью имеют высокую температуру плавления. В то же время радиус взаимодействия ионов достаточно низкий, что обуславливает ломкость подобных соединений. Важнейшими ее свойствами являются ненаправленность и ненасыщаемость. Ненаправленность происходит из формы электрического поля иона, которое представляет собой сферу и способно взаимодействовать с катионами или анионами во всех направлениях. При этом поля двух ионов не компенсируются полностью, вследствие чего они вынуждены притягивать к себе дополнительные ионы, образуя кристалл, – это и есть явление, называемое ненасыщаемостью. В ионных кристаллах нет молекул, а отдельные катионы и анионы окружены множеством ионов противоположного знака, количество которых зависит в основном от положения атомов в пространстве.
Кристаллы поваренной соли (NaCl) – типичный пример ионной связи.
Таблица веществ с ионной связью
| Название | Формула | Применение и свойства |
|---|---|---|
| Бромид серебра | AgBr | Ионная связь в молекуле разрывается под воздействием фотонов (фотолиз), что широко применяется в фотографии и оптике. |
| Хлорводород | HCl | Как следует из формулы, ионная связь тут образуется между хлором и водородом, а потому водный раствор HCl (соляная кислота), широко применяется для получения различных хлоридов. |
| Оксид кальция | CaO | Негашеная известь. Широко применяется при производстве кирпича. |
| Фторид натрия | NaF | Применяется для укрепления зубной эмали, в производстве керамики. |
Тест по теме «Ионная связь»
Как определить ионную связь
Когда между атомами образуется химическая связь, происходит перераспределение электронной плотности. В результате, могут образоваться заряженные частицы – ионы. Если атом теряет электроны, он становится катионом – положительно заряженным ионом. Если же он притягивает к себе чужой электрон, становится анионом – отрицательно заряженным ионом. А поскольку частицы с разными зарядами могут притягиваться друг к другу, ионы образуют химическую связь. При этом образуются химические соединения. Эта связь так и называется ионная.

Инструкция
Существует закономерность: ионную связь образуют главным образом атомы щелочных и щелочноземельных металлов, соединяясь с атомами галогенов. То есть прежде всего посмотрите на химическую формулу вещества. Вот, например, поваренная соль – хлористый натрий, NaCl. Натрий – щелочной металл, находится в первой группе таблицы Менделеева, хлор – газ, галоген, находится в седьмой группе. Следовательно, в молекуле поваренной соли – ионная химическая связь. Или, например, фтористый калий, КF. Калий – также щелочной металл, причем еще более активный, чем натрий. Фтор – галоген, еще более активный, чем хлор. Поэтому в молекуле этого вещества – тоже ионная химическая связь.
Об ионном типе связи могут свидетельствовать некоторые физические признаки. Например, вещества с такой связью имеют высокие температуры плавления и кипения. У того же хлористого натрия они составляют 800,8 и 1465 градусов, соответственно. Растворы таких веществ проводят электрический ток. Если вы обнаружите подобные свойства – знайте, что это вещество с ионной связью.
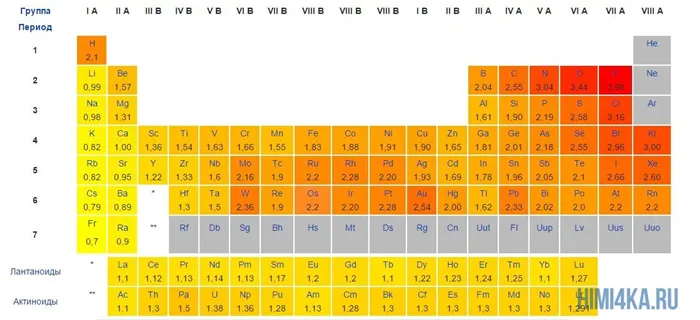
Можно воспользоваться значениями электроотрицательности каждого химического элемента, то есть показателем того, насколько легко атом этого элемента притягивает или отдает электроны. Существуют разные таблицы электроотрицательности. Наиболее широко известна шкала Полинга, названная в честь известного американского ученого. Минимальное значение электроотрицательности по этой шкале имеет самый активный щелочной металл франций (0,7), максимальное – самый активный галоген фтор (4,0).
Чтобы определить, имеет ли ионный тип связи вещество, состоящее из двух элементов, необходимо сделать следующее: найдите электроотрицательности этих элементов (по шкале Полинга).
Вычтите из большего значения меньшее значение. То есть установите разность электроотрицательностей (ЭО). Например, для той же самой поваренной соли она будет составлять: 3,16(Cl)–0,99(Na)=2,17. Сравните полученную величину ЭО с 1,7. Если она больше этого значения – связь в веществе ионная.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Ионная молекула
Cтраница 1
Ионные молекулы могут при известных условиях распадаться на ионы, из которых они получаются. Это распадание молекул на ионы называется диссоциацией. Если диссоциация происходит под влиянием высокой температуры, то такая диссоциация называется термической.
[1]
Ионные молекулы при известных условиях распадаются на образующие их ионы. Этот процесс называется диссоциацией.
[2]
Ионные молекулы состоят из противоположно заряженных ионов.
[3]
Ионные молекулы существуют в веществах, находящихся в газообразном состоянии. При охлаждении они образуют геометрически правильные структуры, составляющие основу кристалла.
[4]
Ионные молекулы существуют в веществах, находящихся в газообразном состоянии. При охлаждении они образуют геометрически правильные структуры, составляющие основу кристалла. Из кристалла невозможно выделить отдельные молекулы. Поэтому когда применяют к подобным кристаллическим ионным соединениям, слово молекула, то это допускается условно, чтобы показать состав и количественное соотношение ионов в соединении.
[6]
Ионные молекулы являются объектами, с которыми химику приходится встречаться несравненно реже, чем с частицами, где атомы связаны ковалентной связью.
[7]
Поэтому ионные молекулы в основном состоянии всегда диссоциируют на атомы, а не на ионы.
[8]
Когда ионные молекулы поглощают свет в момент наибольшего сближения ядер, то, как видно из рисунка, небольшие вариации в значении г ведут к значительному изменению длины стрелок. Поэтому вместо узких полосок в спектре получаются целые области абсорбции, которые отвечают различным степеням возбуждения продуктов распада молекул. Потенциальные кривые молекул с атомной и ионной связью, а также их спектры поглощения сильно отличаются, поэтому изучение спектров и характера потенциальных кривых позволяет устанавливать тип химической связи. Такого рода исследования показали, например, что молекулы галогеноводородных кислот НС1, HBr, HI, a также галогениды таллия и серебра в газообразном состоянии являются не ионными, а атомными.
[9]
Когда ионные молекулы поглощают свет в момент наибольшего сближении ядер, то, как видно из рис. 21, небольшие вариации в значении г ведут к значительному изменению длины стрелок.
[11]
Поэтому ионные молекулы в основном состоянии всегда диссоциируют на атомы, а не на ионы.
[12]
Поэтому ионные молекулы в основном состоянии всегда диссоциируют на атомы, а не на ионы.
[14]
Страницы:
1
2
3
4
5
Ионная химическая связь


4.3
Средняя оценка: 4.3
Всего получено оценок: 1172.
4.3
Средняя оценка: 4.3
Всего получено оценок: 1172.
Ионная химическая связь – это связь, которая образуется между атомами химических элементов (положительно или отрицательно заряженные ионы). Так что же такое ионная связь, и как происходит ее образование?
Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.
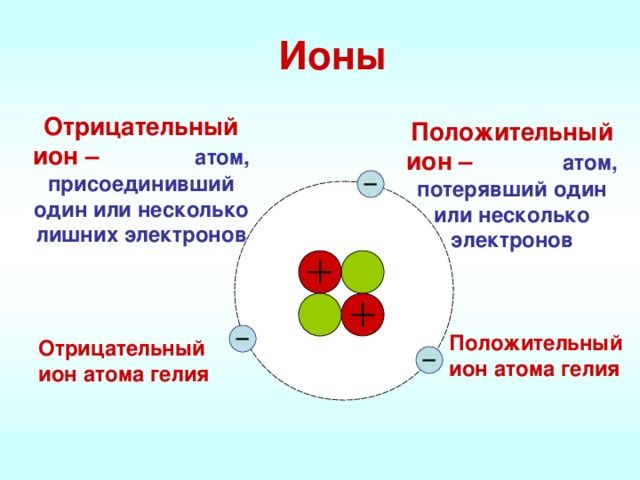
Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
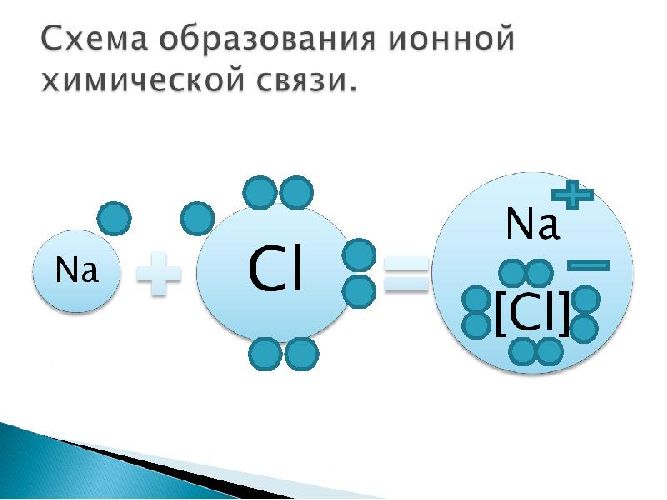
Пример: поваренная соль, хлорид натрия NaCl:
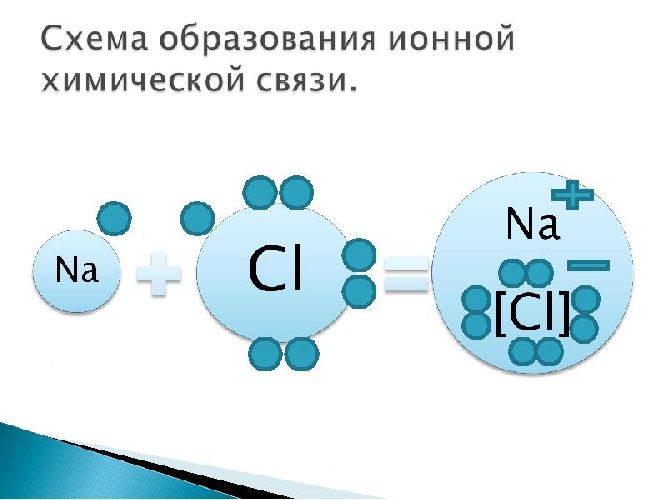
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
Ca0 (атом) -2e=Ca2+ (ион)
– кальцию легче отдать два электрона, чем получить недостающие.
F0 (атом)+1е= F- (ион)
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2 : 1 = 2. 4.
Составим формулу ионной химической связи:
Ca0+2F0 →Ca2+F−2.
- взаимодействие натрия и кислорода
Na0 (атом)-1e=Na+ (ион)
– натрий находится в главной подгруппе первой группы. Он с легкостью может отдавать один электрон.
O0 (атом)+2e=O2– (ион)
– кислород находится в главной подгруппе шестой группы. Естественно, что ему легче получить два электрона, чем отдать шесть.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2 : 1 = 2. Определим число атомов натрия, которые отдадут два электрона атому кислорода: 2. 4.
Составим схему образования ионной связи:
2Na0 +O0 →Na+2O2−.

Что мы узнали?
Ионная связь и ионы изучаются в 11 классе. Ионная химическая связь – связь между положительными и отрицательными ионами, осуществляемая между металлами и неметаллами.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Diamond Zack
7/10
-

Ales Ban
10/10
-

Алиса Кикадор
10/10
-

Андрей Трубников
10/10
-

Екатерина Залова
10/10
-

Саша Земляк
10/10
-

Надежда Северина
10/10
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 1172.
А какая ваша оценка?
