В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Содержание
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
Ионная химическая связь
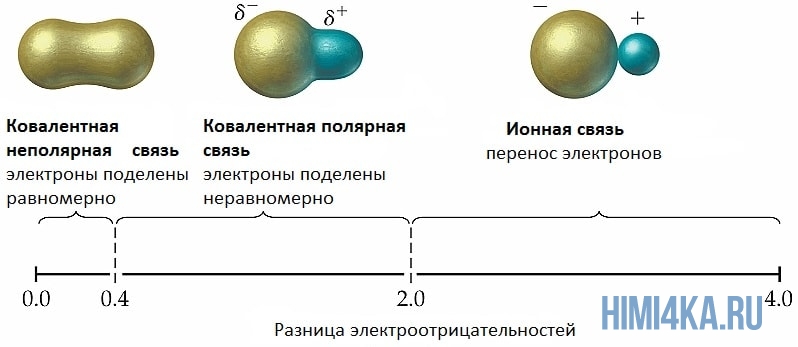
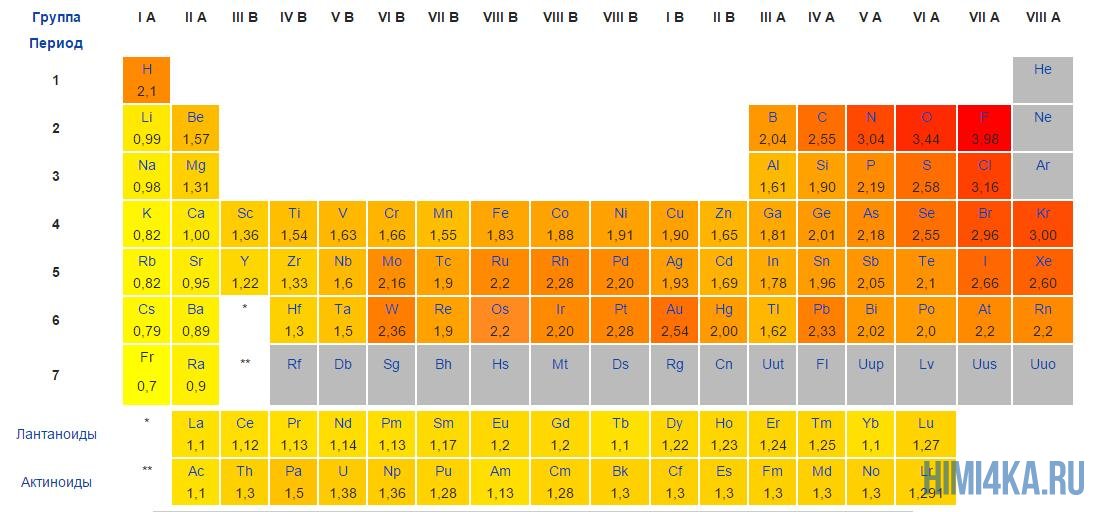
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
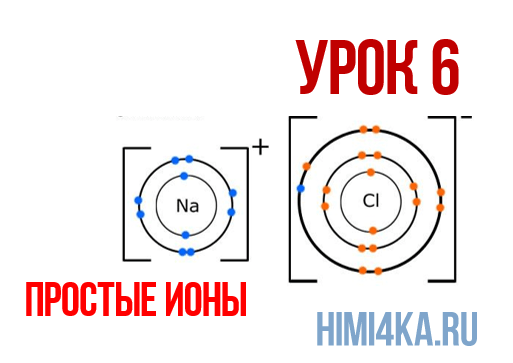
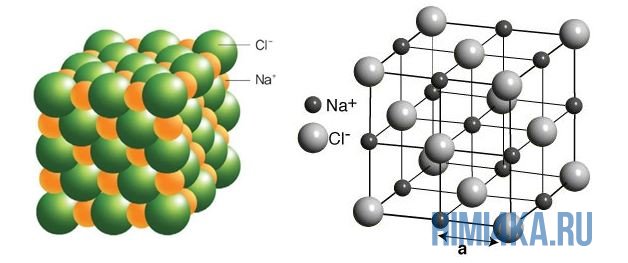
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Как определить заряд иона
В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион – это одноатомная или многоатомная заряженная частица. Очевидно, важнейшей характеристикой иона будет его заряд.

Вам понадобится
- Таблица химических элементов Д.И. Менделеева
Инструкция
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц – нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон – отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
При помощи связей атомы могут также соединяться в молекулы.
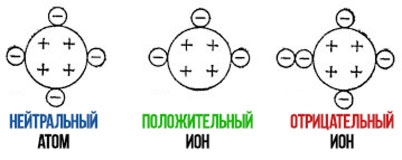
В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.
Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия). Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом Z = 11+(-10) = +1.
Обозначаться такой ион будет символом Na с плюсом сверху, в случае заряда +2 – двумя плюсами и.т.д. Соответственно для отрицательного иона используется знак «минус».
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Atoms have a desire to lose or gain an electron in order to be stable. Once they’ve either gained or lost some electrons, they have charge associated with them since their electron and proton numbers no longer balance out. But what determines what happens to the electrons an atom has? It all has to do with the number of electrons in the valence shell of an atom.
How Many Electrons Does an Atom Have?
In order to find how many electrons an atom has, you simply look at the atomic number. The number of electrons = the atomic number. Chlorine for example has an atomic number of 17. That means it has 17 electrons.
Whether or not chlorine will lose or gain electrons depends upon how these 17 electrons are configured around the nucleus.
Electron Configuration
The loss or gain of electrons takes place in order to make an atom more stable. As soon as this process occurs, it is no longer called an atom but an ion.
You can think about electrons being ordered into rings around the nucleus of an atom. The first ring must contain two electrons to be full. The next must contain eight. In general, once the valence shell is full, the atom is happy. It neither wants to gain or lose an electron.
What Is the Valence Shell of an Atom?
The valence shell is the outermost shell of electrons surrounding an atom. The number of electrons in this shell are important for determining how the atom will react and what the charge of the ion could become.
Many of the elements you think about most often in biology and chemistry class need eight electrons in their valence shell in order to be stable. This is referred to as the octet rule.
Say you know that some atom has 10 electrons (can you figure out which element this is?). How many would be in the valence shell? First you take away two from 10 since the first ring has 2 elections. This leaves eight electrons. That means in the valence shell there are eight electrons and that the valence shell is full.
If the valence shell is full then nothing will happen. The atom will not ionize. As a result there will be no charge on the atom.
In this example, you have neon (did you figure out it was neon?). Neon has a full valence shell and thus does not have a charge. So what happens when the valence shell isn’t full?
Becoming an Ion
Atoms want to have a full valence shell, and they want to do it as easily as possible.
For example, take a look at chlorine again. It has 17 electrons. How many are in the valence? The first two levels will be full with 10 electrons. That means there are seven electrons left in the valence shell. This means that chlorine wants to gain an electron in order to have a complete valence shell. Once it gains the one electron what happens to the charge?
To begin with, the electrons and protons are balanced. Chlorine has 17 electrons (a charge of -17) and 17 protons (a charge of +17), so the overall charge is zero. Once the chlorine gains an electron, however, the total just becomes -1 since there are now 18 electrons and still 17 protons. As a result chlorine is a negative charged ion. It is written as: Cl–.
Negatively charged ions are called anions. What about positively charged ions? They are called cations. Take a look at this example of how a cation forms:
Magnesium is atomic number 12. That means it has 12 electrons and 12 protons. Now, how are the elections configured, and how many electrons are in the valence shell?
The first two shells are full, the first with two electrons and the second with eight. All that is left are two electrons in the valence shell. Now, the atoms could gain six electrons to make it to eight for a full shell, or it could lose two to make it to a full shell. The second way is much easier. As a result, magnesium loses two electrons.
After losing two electrons, the charge on the atom becomes +2 since there are now 10 electrons (-10) and 12 protons (+12). It is written as: Mg2+.
Ion Charge and the Periodic Table
There is a trend to ion formation on the periodic table. Groups 1, 2, 13 and 14 tend to become positively charged. This means that they would rather lose some electrons to get to a complete valence shell.
Groups 15, 16 and 17 tend to have a negative charge because they would rather gain electrons to get to a complete valence shell.
Finally, in group 18, are the noble gases. These elements already have a complete valence shell. For this reason, they are unlikely to lose or gain an electron and are extremely stable.
Как определить заряд иона?
Химия – наука интересная и не очень простая, так что нередко у учащихся и даже взрослых людей возникают различного рода вопросы. Давайте сегодня поговорим о том, как определить заряд иона.
1
Инструкция по определению заряда
Для тех, кто не в курсе, молекулы, как и атомы, теряют электроны свои, либо же их приобретают. Именно такой процесс изменения «реконструкции» атомов и молекул является процессом формирования иона. Ионом называется частица, которая может состоять из одного или нескольких атомов, причем, эта частица заряжена. Итак, для того чтобы определить заряд иона, вам понадобится всего одна составляющая, а именно таблица Менделеева:
- Атом имеет две составляющих – ядро и оболочка электронного типа, при этом первая составляющая атома тоже состоит из двух компонентов, а именно из протонов и нейтронов. Что касается заряда нейронов, то в данном случае такое значение равно нулю, потому как у них отсутствует заряд электрического типа. Протоны – это положительные частички, значит их заряд будет равен «+1».
- Оболочка электронного типа также имеет свои составляющие, а именно – орбитали, которые, в свою очередь, также состоят из определенного количества электронов (система не из простых, как вы могли заметить). Электрон – частичка, которая заряжена негативно, а значит отрицательно, получается, что заряд его равен «-1».
- Если атом является нейтральной частицей, тогда и число протонов в данной ситуации будет равным количеству электронов, а значит, сумма их также равна нулю.
Для определения заряда иона нужно знать немного, а именно, их чего он состоит, то есть его конструкцию. Получается, что значения, которые понадобятся для расчета нужного нам параметра – это количество протонов и электронов (только первые находятся в ядре, а вот вторые – на орбиталях электронного типа).
В конечном итоге мы получаем совсем несложную формулу расчета заряда иона – суммируем количество электронов и протонов, которые входят в состав самого иона. Не стоит думать, что данные значения могут быть исключительно одинаковыми, нередко случается так, что количество протонов меньше количества электронов, так что стоит учитывать сей факт при расчете заряда. В данном случае такой ион считается негативным, в обратном случае, наоборот позитивным (когда протонов меньше, чем электронов в ионе).
Следующий шаг – определение ядерного номера, который легко определить в случае, если вы знаете сам химически элемент, и перед вами лежит таблица великого Менделеева.
Стоит отметить, что данный расчет заряда иона не является единственным, потому как существуют также другие методы определения данного значения, но вышеприведенный – наиболее простой и чаще всего используется на практике.
Как расставлять заряды ионов и Степень Окисления в Веществах?
По химии я очень мало чего понимаю, она мне просто не даётся. У нас контрольная работа скоро и я хотел бы узнать как расставлять заряды ионов и степень окисления в веществах. Для примера нам дали такие вещества – Al2(SO4)3 , Ba(NO3)2 , Na2SiO3 , Ni3(PO4)2.
Vatman
19 декабря 2018 · 123,9 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 22 февр 2019 ·
Что такое ион? 👻
Это частица, которая образуется из атома, если ему подарят электроны🙂ну или отберут их🙄
Есть элементы, которые имеют всегда один и тот же заряд иона) у других надо смотреть по обстоятельствам😊
Они находятся в 1А,2А и 3А группах в таблице Менлелеева😊
🔹Если 1 группа А подгруппа, то всегда +1 (у них достаточно забрать всего один электрон😊)
🔹Если 2А, то +2 (отбирают уже 2 электрона)
🔹Если 3А,то +3
👻Что такое степень окисления? 👻
Это условная величина, которая показывает заряд атома в соединении)
Максимальная степень окисления равна номеру группы, минимальная N группы-8🤯😱
Возьмём для примера Na2SiO3😊
Na имеет степень окисления +1, он лежит в 1А группе
О имеет всегда – 2,хотя и находится в 6А🤯 Это нужно запомнить
У Si +4, он лежит в 4А группе
А теперь с зарядами ионов разберемся)
У Na +1, но в Na2SiO3 таких ионов 2🙂
Значит, получаем SiO3 2-
55,0 K
Спасибо, всё по полаочкам разложила.
Комментировать ответ…Комментировать…
Специальность — аграрное хозяйство. В кругу интересов, хобби и изучения: арт, психология… · 22 янв 2020
Возьми таблицу растворимости, и выписывай из нее то, что есть в правом вернем углу; остальное просто посчитай по индексам, валентности. Например Fr2SO4; SO4 по таблице 2-, а так как после франция стоит индекс два от валентности SO4, степень окисления франция выходит 1+.
11,0 K
Комментировать ответ…Комментировать…