
Ион
Ион – это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
“электронная конфигурация атома”, каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr – e– = 24Cr + e+ = 24Cr+
24Cr – 3e– = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e– = 24Cr – e+ = 24Cr–
24Cr + 3e– = 24Cr – 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон “оторвётся” от атома. Чем ближе электрон
к ядру – тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные |
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы – катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора – 3.61 эВ, энергия ионизации – 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства – 0,78 эВ, потенциал ионизации – 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl–.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация – 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния – это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья?
/
Просмотров: 12 867
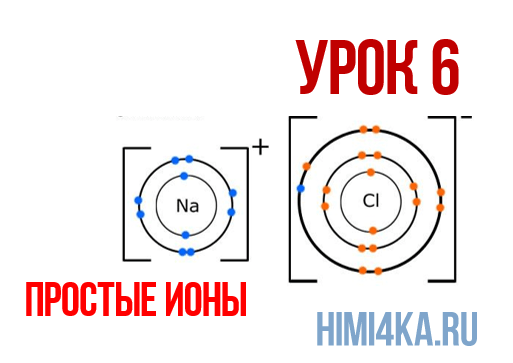
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Содержание
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
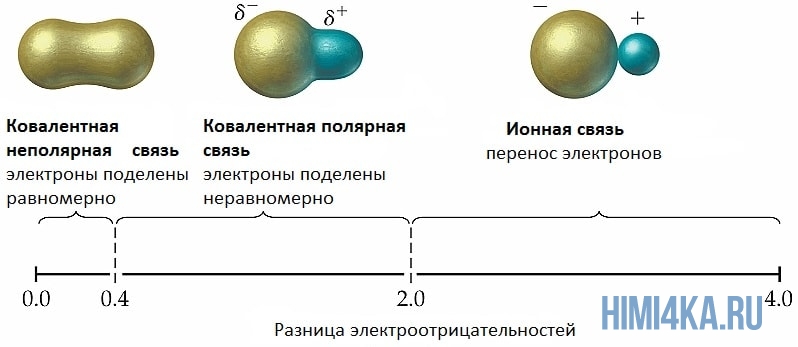
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
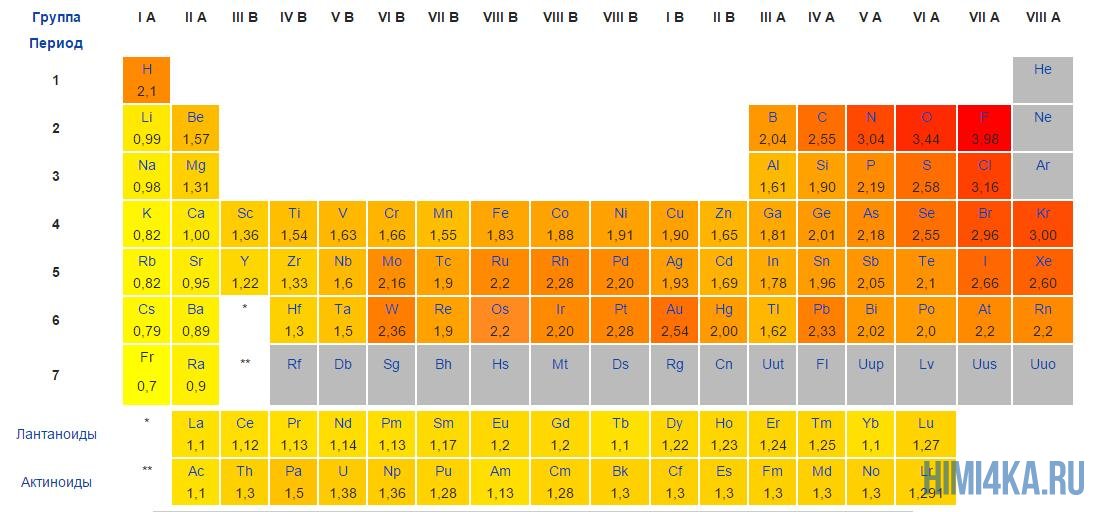
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
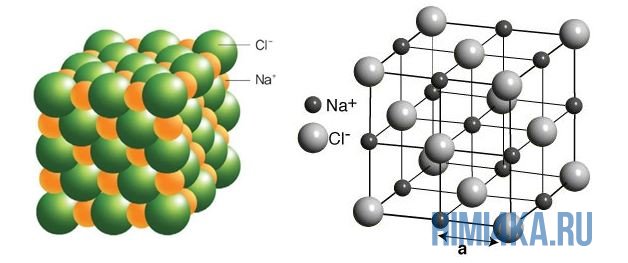
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Как определять ионы
Впереди лабораторная работа, а нужные навыки и умения по распознаванию химических веществ не наработаны. А может в химической лаборатории случайно отклеились этикетки с названиями соединений. Умение правильно определять химические вещества в силу своей специфичности может уже не потребоваться после окончания учебных заведений. Но зато эти знания могут понадобиться собственному ребенку, который придет за помощью. Что тогда ему ответить?

Вам понадобится
- Штатив с пробирками, реагенты для определения веществ, спиртовка, проволочка с петелькой, индикаторы
Инструкция
Химические вещества состоят из положительно и отрицательно заряженных ионов, образуя в целом электронейтральное соединение. Чтобы определить состав вещества необходимо руководствоваться качественными реакциями на различные ионы. И не обязательно их учить наизусть, а достаточно знать, что существуют такие реагенты, с помощью которых можно определить практически любое химическое соединение.
Кислоты. Все кислоты объединяет то, что в их состав входит ион водорода. Именно его присутствие обусловливает кислые свойства. Качественной реакцией на эту группу веществ можно считать индикаторы, то есть в кислой среде лакмус становится красным, а метиловый оранжевый – розовым.
Основания. Вещества этой группы также можно определить с помощью индикатора. Характерную реакцию дает фенолфталеин, который в щелочной среде становится малиновым. Это происходит за счет присутствия гидроксид-ионов.
Металлы. Чтобы определить ионы металлов, для этого нужно воспользоваться спиртовкой или горелкой. Возьмите медную проволочку, на одном конце сделайте петельку 6-10 мм в диаметре и внесите в пламя. Практически сразу увидите, что оно приобрело окраску красивого зеленого цвета. Это происходит как раз за счет ионов меди. Тот же самый результат будет наблюдаться, если проволочку сначала обмакнуть в соли меди (хлорид меди, нитрат меди, сульфат меди), а потом внести в пламя.
Чтобы определить наличие ионов щелочных металлов (натрия и калия) и щелочно-земельных (кальция и бария) нужно также внести соответствующие растворы солей в пламя спиртовки. Ионы натрия окрасят пламя в ярко-желтый цвет, ионы кальция – в кирпично-красный. Ионы бария, входящие в состав веществ дадут желто-зеленое окрашивание, а ионы калия – фиолетовое.
Для определения ионов кислотных остатков существует целый ряд качественных реакций. Сульфат-ион можно определить, выбрав в качестве реагента ион хлора, что в результате даст белый осадок. Чтобы узнать, что в пробирке находится карбонат-ион, возьмите любую разбавленную кислоту и в итоге увидите вскипание. Дополнительно пропустите образовавшийся углекислый газ через известковую воду, наблюдая при этом помутнение.
Чтобы определить ортофосфат-ион, достаточно прилить в пробирку с ним нитрат серебра, в результате реакции будет наблюдаться выпадение желтого осадка. Для распознавания солей аммония нужно провести реакцию с растворимыми щелочами. Визуального наблюдения не будет, но зато появится неприятный запах мочевины за счет образовавшегося аммиака.
Для распознавания галоген-ионов (хлора, брома, йода) реагентом для всех трех является нитрат серебра и во всех случаях произойдет выпадение осадка. В результате ион хлора с нитратом серебра даст белый осадок (хлорида серебра), ион брома – бело-желтый осадок (бромида серебра), а ион йода – осадок желтого цвета (образуется йодид серебра).
Видео по теме
Обратите внимание
При выполнении даже самых простых опытов обязательно соблюдайте правила техники безопасности
Полезный совет
Имеется достаточно много реакций, в которых реагентом выступает нитрат серебра. Если это вещество попадет на поверхность стола или одежду, то удалить пятна не удастся.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
План урока:
Основные понятия
Распознавание катионов щелочных металлов
Распознавание ионов щелочноземельных металлов
Качественные реакции на анионы
Основные понятия
Качественная реакция – это реакция, обладающая определенными признаками для того или иного соединения. К таким процессам предъявляется ряд требований: низкий порог чувствительности, специфичность, селективность.
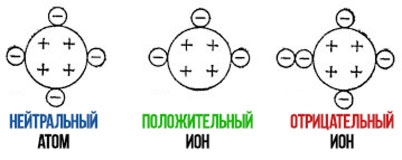
Определять можно ионы. Это заряженные частицы. Если ион заряжен положительно – это катион, если отрицательно – анион. Ионы могут быть простыми и сложными, но у каждого есть специфическая качественная реакция.
Индикаторы
Индикаторы – вещества, которые дают специфический продукт реакции (осадок, газ, соль определенного цвета) с тем или иным ионом.
Определять можно не только конкретное соединение, но и класс, к которому оно относится. Одним из первых индикаторов являются индикаторы среды: фенолфталеин, метилоранж и лакмус. Молекулы этих веществ меняют свою конфигурацию в зависимости от кислотности раствора, на чем основана их индикаторная значимость.

В лабораториях и на производстве часто используют не сам раствор, а бумажку, пропитанную им – индикаторную бумагу. Существует несколько типов таких бумаг:
- Универсальная;
- Фенолфталеиновая;
- Лакмусовая;
- Свинцовая и т.д.
Для каждого вида индикаторных бумажек есть шкала цвета, по которому можно определить значение того или иного результата.
Распознавание катионов щелочных металлов
Для некоторых ионов есть несколько способов их идентификации. Например, ионы щелочных металлов определяются сухим способом – окрашиванием пламени и реакциями в растворах.

Каждый ион щелочного металла окрашивает пламя в определенный цвет:
- натрий – ярко-желтый,
- калий – розово-фиолетовый,
- литий – карминово-красный,
- рубидий – темно-фиолетовый.
Для определения наличия катиона щелочного металла можно провести качественную реакцию. Для каждого катиона используется определенный реактив.
Таблица. Характеристика качественных реакций на ионы щелочных металлов.

Распознавание ионов щелочноземельных металлов
Щелочно-земельные металлы расположены во второй группе таблицы Менделеева. Они, так же, активны, но меньше щелочных. Их распространенность в природе намного выше. К этим металлам относятся: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Раньше первые два металла не относили к группе щелочно-земельных. Последние научные исследования подтвердили их принадлежность к этому ряду.
Эти металлы можно определять окрашиванием пламени, но различить правильный оттенок у некоторых из них довольно трудно:
- Be – красный;
- Mg – ярко-белый (сильное выделение тепла);
- Ca – оранжево-красный;
- Sr – карминово-красный;
- Ba – желтовато-зеленый;
- Ra – темно-красный.

Определение катионов бериллия
Бериллий имеет специфическое строение атома. Его электронная конфигурация больше свойственная инертным газам. Обычных химических реакций для определения этого катиона нет. Бериллий определяют электрометрическим титрованием. При этом, производится титрование (по каплям) бериллия фторидом аммония в кислой среде. Бериллий образует аквафторокомплексы [BeF4]2–, удерживая до четырех молекул воды.
Еще одним инновационным способом определения бериллия является нефелометрический метод с применением гидроксида аммиака. При этом получают мутные спеси с дальнейшим определением оптической плотности.
Описанные методы основаны не на химической реакции, а на процессе образования комплексных соединений.
Определение катионов магния
Для определения магния используют сильные щелочи, карбонат аммония или гидрофосфат натрия в присутствии солей аммония.
В первых двух случаях выпадает белый аморфный осадок. Его кристаллы настолько малы, что практически не оседаю на дно, оставаясь взвешенными в водном растворе.
Mg2+ + 2OH– → Mg(OH)2↓
2Mg2+ + 4NН4+ + 2CO32- + Н2O → Mg2+(OH)2CO3↓ + 4NН4+ + CO2
Во втором случае образуется, так же, белый осадок, но крупнокристаллический:
Mg2+ + NН4OH + НРО42- → MgNН4РО4↓ + Н2O
Определение катионов кальция
Для определения кальция чаще всего используют угольную или сернистую кислоту. Образующиеся соли белого цвета и не растворимы в вод. При этом, они хорошо растворимы в других кислотах:
CaCl2 + (NH4)2CO3 → CaCO3 ↓+ 2NH4Cl
Еще один способ – микрокристаллоскопическая реакция с серной кислотой. Образуются белые кристаллы игольчатой формы.
4Ca + 5H2SO4 → 4CaSO4↓ + 4H2O + H2S

Определение ионов стронция
Стронций образует белые нерастворимые осадки с серной кислотой, карбонатом аммония:
Sr + H2SO4 = SrSO4↓+ H2
Sr(NO3)2 + (NH4)2CO3 = SrCO3↓ + NH4NO3
Также, для индикации используют оксалат аммония. Образующийся белый осадок растворяется во всех кислотах:
Sr+ + C2O4– = Sr(C2O4) ↓
Одной из самых ярких реакций на ион стронция является реакция с родизонатом натрия. При этом образуется красно-бурый осадок:

Определение катионов бария

В растворе ионы бария определяют с помощью серной кислоты или ее растворимых солей.
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
При реакции образуется белый нерастворимый в кислотах осадок. Это микрокристаллоскопическая реакция, можно рассмотреть форму кристаллов под микроскопом.
Определение ионов меди
Для обнаружения ионов меди в растворе соли в него добавляют концентрат аммиачного раствора.
Cu2+ + 4NН3 → [Cu(NH3)4]2+
При этом, медь образует комплексную соль ярко-синего цвета.

еще один способ – реакция с гидроксидом натрия. В результате реакции образуется синий студенистый осадок.
Cu2+ + 2OH– = Cu(OH)2 ↓
При его нагревании происходит разложение с образованием черного оксида меди.
Cu(OH)2 → CuO + H2O
Медь можно определить сухим способов в пламени горелки. Она приведет к окрашиванию пламени в зеленый цвет.

Определение ионов двух- и трехвалентного железа
Железо имеет два основных иона: Fe2+ и Fe3+.
Ионы Fe3+ можно идентифицировать с помощью трех реактивов. Первый из них – щелочь. При этом образуется красно-бурый нерастворимый осадок:
FeCl₃ + 3NaOH = Fe(OH)₃↓+ 3NaCl.
Другой вариант – желтая кровяная соль K₃[Fe(CN)₆], при взаимодействии с которой трехвалентное железо образует комплексное соединение синего цвета.
Третий вариант – роданид калия (ядовитое вещество). При реакции образуется красная густая соль. Это соединение часто использовали в кинематографе в качестве искусственной крови.

Для определения Fe2+используют красную кровяную соль K₄[Fe(CN)₆]. В результате образуется соединение синего цвета (берлинская лазурь).

Определение катионов аммония
Катион аммония необычен тем, что состоят из молекулы аммиака с присоединенным за счет донорно-акцепторной связи водородом. Так, ион имеет вид NH4+. Соли аммония применяются в сельском хозяйстве, медицине.
Определить наличие этого катиона можно с помощью индикаторной бумаги. Над раствором соли аммония она синеет.

Значения цветов индикаторной бумаги
Гидроксид аммония – слабое соединение, которое распадается на аммиак и воду. Аммиак обладает характерным запахом (нашатырный спирт), по которому, так же, определяют наличие катиона аммония.
Качественная реакция на катион аммония: NH4Cl + NaOH → NaCl + NH3↑ + H2O
Другой способ индикации – с помощью реактива Несслера– K2[HgI4]. При взаимодействии с солями аммония образуется бурый цвет:
NH3 + 2[HgI4]2- + 3ОН– → [NH2Hg2O]I + 7I– + 2Н2О
Реакция очень чувствительная. При малом содержании катионов аммония, цвет будет желтый.
Качественные реакции на анионы
Сульфат-ион и сульфит-ион
Ионы серной и сернистой кислот дают одинаковую реакцию с растворимыми солями бария – образуется белый осадок:
BaCl2 + Na2SO3 = BaSO3↓ + 2NaCl
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Различить их можно добавлением к полученному раствору азотной кислоты. Осадок сульфита бария растворится с образованием газа, а сульфата – нет.
BaSO3+ 2HNO3 = Ba(NO3)2 +SO2 ↑ +H2O
Хлорид-, бромид-, йодид-ион
Для определения этих ионов используют один реактив – нитрат серебра. Во всех трех случаях выпадает творожистый осадок, но цвет у каждого – свой. Фторид-ион осадок с этим реактивом не дает.

Для индикации фторида используют нитрат кальция. При этом образуется белый осадок:
2NaF + Ca(NO3)2 → 2NaNO3 + CaF2↓
Карбонат-ион
Карбонат-ион определяется в две стадии. Первая – получение угольной кислоты:
CaCO3 + 2HCl⟶CaCl2 + H2O + CO2↑
Эта кислота слабая и быстро диссоциирует с образованием воды и углекислого газа.
Вторая реакция – пропускание выделяемого газа через известковую воду. Углекислый газ приводит к ее помутнению из-за образования нерастворимого карбоната кальция:
Ca(OH)2 + CO2 ⟶CaCO3↓ + H2O
Фосфат-ион
Фосфат-ион определяется с помощью нитрата серебра. При взаимодействии образуется ярко-желтый осадок:
Na3PO4 + 3AgNO3= Ag3PO4↓ +3NaNO3

Как найти символ иона
На чтение 2 мин. Просмотров 22 Опубликовано 05.06.2021
Эта решенная химическая задача демонстрирует, как определить символ иона, когда задано количество протонов и электронов.
Проблема : укажите символ иона, у которого 10 e – и 7 p + .
Решение : Обозначение e – относится к электронам и p + относится к протонам. Число протонов – это атомный номер элемента. Воспользуйтесь периодической таблицей, чтобы найти элемент с атомным номером 7. Этот элемент – азот, обозначенный символом N. Задача состоит в том, что электронов больше, чем протонов, поэтому мы знаем, что ион имеет отрицательный суммарный заряд. Определите чистый заряд, посмотрев на разницу в количестве протонов и электронов: 10-7 = на 3 электрона больше, чем протонов, или на 3 – заряд.
Ответ : N3-
Условные обозначения для написания ионов
При написании символа для иона сначала записывается одно- или двухбуквенный символ элемента, за которым следует верхний индекс. В верхнем индексе указано количество зарядов иона, за которым следует + (для положительных ионов или катионов) или – (для отрицательных ионов или анионов). Нейтральные атомы имеют нулевой заряд, поэтому верхний индекс не дается. Если заряд составляет +/- один, цифра «1» опускается. Так, например, заряд иона хлора будет записан как Cl – , а не Cl 1- .
Общие рекомендации по поиску ионов
Когда даны числа протонов и электронов, легко вычислить ионный заряд. Чаще всего вам не будут сообщать эту информацию. Вы можете использовать таблицу Менделеева, чтобы предсказать множество ионов. Первая группа (щелочные металлы) обычно имеет заряд +1; вторая группа (щелочноземельные) обычно имеют заряд +2; галогены обычно имеют заряд -1; а благородные газы обычно не образуют ионы. Металлы образуют самые разные ионы, обычно с положительным зарядом.
