Загрузить PDF
Загрузить PDF
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. Наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
-

1
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
- Атомная масса увеличивается слева направо и сверху вниз, поскольку в атомах элементов с бо́льшим номером содержится больше протонов и нейтронов. Каждый последующий элемент содержит больше протонов, чем предыдущий, поэтому возрастает и его атомная масса.
- В атомной массе не учитываются электроны, поскольку они весят намного меньше, чем протоны и нейтроны.[1]
-

2
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.[2]
- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-

3
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение.[3]
Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.[4]
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-

4
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.[5]
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 71 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-

5
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.[6]
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода — 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-

6
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы — в правой части таблицы. Металлоиды расположены между ними.[7]
- Помните, что по свойствам водород можно отнести как к щелочным металлам, так и к галогенам, поэтому он может иметь разный цвет и располагаться в двух ячейках.
- Металлические элементы блестят, являются твердыми при комнатной температуре (за исключением ртути), хорошо проводят тепло и электрический заряд и достаточно пластичны.
- Неметаллы не имеют выраженного блеска, плохо проводят тепло и электрический заряд, обладают низкой пластичностью. Как правило, при комнатной температуре неметаллические элементы представляют собой газ, но при определенных температурах и давлениях они могут принимать жидкое или твердое состояние.
- Металлоиды совмещают в себе свойства металлов и неметаллов.[8]
Реклама
-

1
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.[9]
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-

2
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.[10]
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-

3
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.[11]
- Атомный номер всегда является целым числом.
-

4
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент![12]
- По атомному номеру элемента можно также определить количество электронов и нейтронов в атоме.
-

5
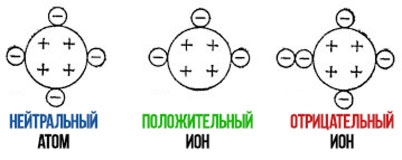
Обычно количество электронов равно числу протонов. Исключением является тот случай, когда атом ионизирован. Протоны имеют положительный, а электроны — отрицательный заряд. Поскольку атомы обычно нейтральны, они содержат одинаковое количество электронов и протонов. Тем не менее, атом может захватывать электроны или терять их, и в этом случае он ионизируется.[13]
- Ионы имеют электрический заряд. Если в ионе больше протонов, то он обладает положительным зарядом, и в этом случае после символа элемента ставится знак «плюс». Если ион содержит больше электронов, он имеет отрицательный заряд, что обозначается знаком «минус».
- Знаки «плюс» и «минус» не ставятся, если атом не является ионом.
Реклама
-

1
Найдите атомную массу. Обычно атомную массу указывают внизу ячейки, под символом элемента. Атомная масса представляет собой сумму масс частиц, составляющих ядро атома, то есть протонов и нейтронов. Однако элементы имеют изотопы, поэтому атомная масса является средней величиной с учетом их распространенности в природе.[14]
- Поскольку атомная масса представляет собой среднюю величину, для большинства элементов она записывается в виде десятичной дроби.
- Хотя может показаться, что атомная масса всегда возрастает при движении слева направо и сверху вниз, это справедливо не во всех случаях.
-
2
Найдите массовое число конкретного элемента. Поскольку в атомной массе учитываются все изотопы элемента, для определения массового числа достаточно округлить приведенную в таблице атомную массу до ближайшего целого числа.[15]
- Например, атомная масса углерода составляет 12,011, после округления получаем 12. Для железа, атомная масса которого равна 55,847, получаем 56.
-

3
Вычтите из массового числа атома его атомный номер, чтобы найти количество нейтронов. Масса атома представляет сумму масс протонов и нейтронов. Ввиду этого можно легко определить число нейтронов — достаточно вычесть из массового числа атомный номер, то есть количество протонов![16]
- Используйте следующую формулу: Число нейтронов = Массовое число – Число протонов.
- Например, массовое число углерода равно 12, и атом углерода имеет 6 протонов. Поскольку 12 – 6 = 6, атом углерода содержит 6 нейтронов.
- Массовое число железа составляет 56, и его атом содержит 26 протонов. Так как 56 – 26 = 30, в атоме железа содержится 30 нейтронов.
- Изотопы элементов имеют разное количество нейтронов, благодаря чему меняется их атомная масса.
Реклама
Советы
- Многим сложно освоить таблицу Менделеева. Не расстраивайтесь, если столкнетесь с определенными трудностями!
- Хотя цвета могут меняться, они передают одну и ту же информацию.
- Встречаются упрощенные таблицы. Например, в таблице могут содержаться лишь символы элементов и их атомные номера. Выберите такую таблицу, которая подходит для ваших целей.
Реклама
Об этой статье
Эту страницу просматривали 250 370 раз.
Была ли эта статья полезной?
Как найти символ иона
На чтение 2 мин. Просмотров 22 Опубликовано 05.06.2021
Эта решенная химическая задача демонстрирует, как определить символ иона, когда задано количество протонов и электронов.
Проблема : укажите символ иона, у которого 10 e – и 7 p + .
Решение : Обозначение e – относится к электронам и p + относится к протонам. Число протонов – это атомный номер элемента. Воспользуйтесь периодической таблицей, чтобы найти элемент с атомным номером 7. Этот элемент – азот, обозначенный символом N. Задача состоит в том, что электронов больше, чем протонов, поэтому мы знаем, что ион имеет отрицательный суммарный заряд. Определите чистый заряд, посмотрев на разницу в количестве протонов и электронов: 10-7 = на 3 электрона больше, чем протонов, или на 3 – заряд.
Ответ : N3-
Условные обозначения для написания ионов
При написании символа для иона сначала записывается одно- или двухбуквенный символ элемента, за которым следует верхний индекс. В верхнем индексе указано количество зарядов иона, за которым следует + (для положительных ионов или катионов) или – (для отрицательных ионов или анионов). Нейтральные атомы имеют нулевой заряд, поэтому верхний индекс не дается. Если заряд составляет +/- один, цифра «1» опускается. Так, например, заряд иона хлора будет записан как Cl – , а не Cl 1- .
Общие рекомендации по поиску ионов
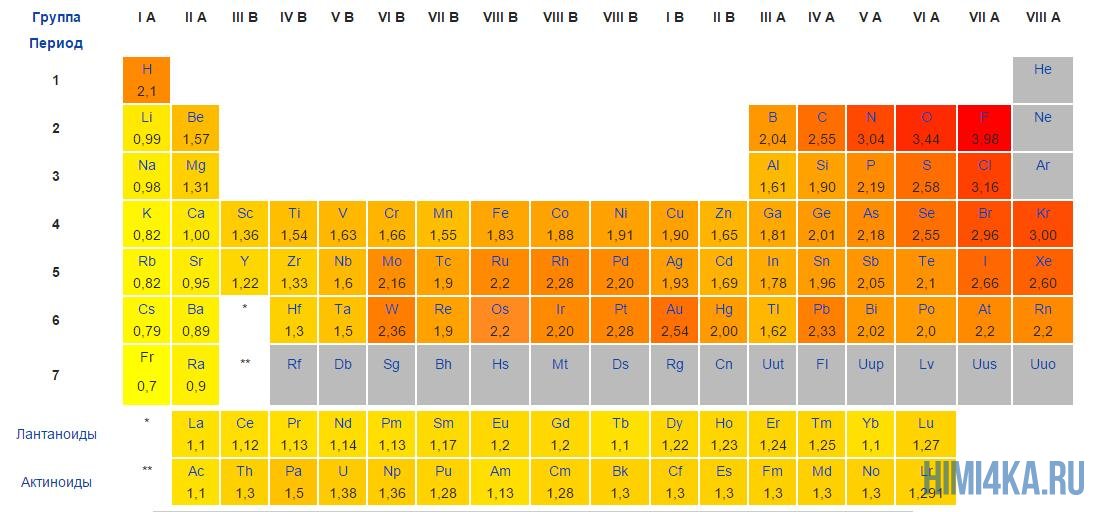
Когда даны числа протонов и электронов, легко вычислить ионный заряд. Чаще всего вам не будут сообщать эту информацию. Вы можете использовать таблицу Менделеева, чтобы предсказать множество ионов. Первая группа (щелочные металлы) обычно имеет заряд +1; вторая группа (щелочноземельные) обычно имеют заряд +2; галогены обычно имеют заряд -1; а благородные газы обычно не образуют ионы. Металлы образуют самые разные ионы, обычно с положительным зарядом.
Как определить заряд иона | Сделай все сам

В силу определенных причин атомы и молекулы могут либо приобретать, либо терять свои электроны. В этом случае образуется ион. Таким образом, ион – это одноатомная либо многоатомная заряженная частица. Видимо, важнейшей колляцией иона будет его заряд .
Вам понадобится
- Таблица химических элементов Д.И. Менделеева
Инструкция
1. Атом всякого вещества состоит из электронной оболочки и ядра. Ядро состоит из 2-х типов частиц – нейтронов и протонов.
Нейтроны не имеют электрического заряд а, то есть электрический заряд нейтронов равен нулю.
Протоны являются позитивно заряженными частицами и имеют электрический заряд , равный +1. Число протонов характеризует ядерный номер данного атома.
2. Электронная оболочка атома состоит из электронных орбиталей, на которых расположено различное число электронов. Электрон – негативно заряженная элементарная частица. Ее электрический заряд равен -1.При помощи связей атомы могут также соединяться в молекулы.
3. В нейтральном атоме число протонов равно числу электронов. Следственно его заряд равен нулю.Дабы определить зарядиона , нужно знать его конструкцию, а именно число протонов в ядре и число электронов на электронных орбиталях.
4. Суммарный зарядиона получается в итоге алгебраического суммирования заряд ов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет негативным. Если число электронов поменьше числа протонов, то ион будет правильным.
5. Зная химический элемент, по таблице Менделеева мы можем определить его ядерный номер, тот, что равен числу протонов в ядре атома этого элемента (скажем 11 у натрия). Если один из электронов оставил атом натрия, то у атома натрия будет теснее не 11, а 10 электронов.
Атом натрия станет одобрительно заряженным ионом с заряд ом Z = 11+(-10) = +1.Обозначаться такой ион будет символом Na с плюсом сверху, в случае заряд а +2 – двумя плюсами и.т.д. Соответственно для негативного иона применяется знак «минус».
Совет 2: Как определить заряд ядра
Атом химического элемента состоит из ядра и электронной оболочки. Ядро – это центральная часть атома, в котором сфокусирована примерно каждая его масса. В различие от электронной оболочки, ядро имеет позитивный заряд .
Вам понадобится
- Атомный номер химического элемента, закон Мозли
Совет 3: Как определять ионы
Впереди лабораторная работа, а необходимые навыки и знания по распознаванию химических веществ не наработаны. А может в химической лаборатории нечаянно отклеились этикетки с наименованиями соединений.
Знание верно определять химические вещества в силу своей специфичности может теснее не понадобиться позже окончания учебных заведений. Но но эти познания могут потребоваться собственному ребенку, тот, что придет за подмогой.
Что тогда ему ответить?
Вам понадобится
- Штатив с пробирками, реагенты для определения веществ, спиртовка, проволочка с петелькой, индикаторы
Совет 4: Как определить заряд у элемента
В обыкновенных условиях атом электрически нейтрален. При этом ядро атома, состоящее из протонов и нейтронов, заряжено одобрительно, а электроны несут негативный заряд. При избытке либо недостатке электронов атом превращается в ион.
Совет 5: Как определить электрический заряд
Электрический заряд – это величина, характеризующая способность физического тела быть источником электромагнитного поля и принимать участие во взаимодействии с другими сходственными источниками. Еще древние греки нашли, что если кусок янтаря потереть о шерсть, то он приобретет способность притягивать легкие предметы. Янтарь на древнегреческом языке именовался «электрон».
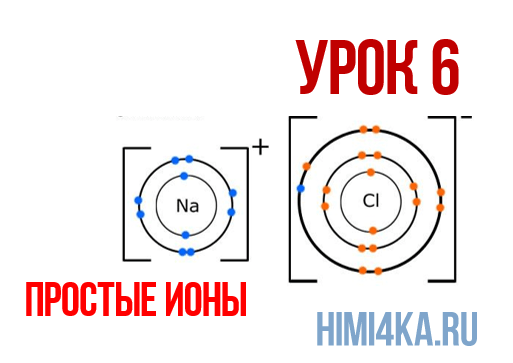
Урок 6. Простые ионы – HIMI4KA

Архив уроков › Основные законы химии
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e—), образуя положительный ион натрия Na+, а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl—. Это записывается в виде двух реакций:
- Na → Na+ + e— и ½Cl2 + e— → Cl—
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl— окружен со всех сторон соседними положительными ионами натрия Na+; ионы натрия Na+ точно также окружены ближайшими хлорид-ионами Cl—. Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:
Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:
Степень окисления веществ
Заряд простого, одноатомного иона, например Mg2+ или F2-, называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg2+ + 2e— → Mg
- Реакция окисления: F2- → F + 2e—
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:
Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl—, имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl3+, имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H+1, O-2 |
| CS2 | C(IV), S(II) | C+4, S-2 |
| CH4 | C(IV), H(I) | C-4, H+1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe2+ железо(II) или ион двухвалентного железа
- Fe3+ железо(III) или ион трехвалентного железа
- Сu+ медь(I) или ион одновалентной меди
- Cu2+ медь (II) или ион двухвалентной меди
- Sn2+ олово(II) или двухвалентного олова
- Sn4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe3+ + e— → Fe2+. Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Источник: https://himi4ka.ru/arhiv-urokov/urok-6-prostye-iony.html
Содержание
- Digitrode
- цифровая электроника вычислительная техника встраиваемые системы
- Как рассчитать заряд иона
- Урок 6. Простые ионы
- Ионная химическая связь
- Положительные и отрицательные ионы
- Степень окисления веществ
- Валентность химических элементов
- Название ионов
- Как определить заряд?
- Как определить заряд иона элемента металла
- Как определить заряд?
- Как определить заряд иона элемента металла
Digitrode
цифровая электроника вычислительная техника встраиваемые системы
Как рассчитать заряд иона
Как правило, атомы являются нейтральными, потому что они имеют такое же количество протонов (положительно заряженных частиц), что и электроны или отрицательно заряженные частицы. Однако многие атомы нестабильны, поэтому они образуют ионы (атомы или молекулы с положительным или отрицательным зарядом), теряя или приобретая электроны. Есть два типа ионов: катионы, которые заряжены положительно, потому что электроны потеряны, и анионы, которые имеют отрицательный заряд, потому что электроны получены.

Посмотрите на периодическую таблицу, чтобы определить, сколько протонов и электронов имеет атом, чтобы он был сбалансирован. Например, атом натрия имеет 11 протонов и электронов, потому что его атомный номер 11.
Вычтите количество электронов из числа протонов в атоме в качестве основного способа расчета заряда иона. Например, если атом натрия теряет один электрон, сработает 11 — 10 = 1. Ион натрия имеет заряд +1, обозначенный как Na+.
Рассмотрим количество электронов во внешней оболочке атома, известных как валентные электроны, чтобы определить, почему натрий отдает один электрон, образуя катион. Катионы — это электроны, отданные или добавленные для образования ионов или соединений.
Стабильные атомы должны иметь восемь валентных электронов. Когда атомы проходят химические реакции или образуют связи, они получают, теряют или делят электроны, чтобы поддерживать восемь валентных электронов. Натрий имеет два электрона на первом уровне и восемь электронов на втором, что оставляет один электрон во внешнем слое. Для натрия, чтобы иметь восемь валентных электронов, он теряет один в своем внешнем слое, поэтому второй слой, который имеет восемь электронов, становится внешним слоем, а атом является положительно заряженным ионом.
Следуйте общему правилу, что металлы теряют свои валентные электроны, образуя катионы, в то время как неметаллы обычно получают электроны, образуя анионы. Например, фосфор имеет пять валентных электронов. Он получает три электрона, чтобы получить восемь валентных электронов. Атомный номер фосфора составляет 15, поэтому он имеет 15 протонов, но добавление электронов дает ему 18 электронов. Ион фосфора имеет заряд -3, потому что 15 + (-18) = (-3).
Рассчитайте заряды многоатомных ионов или молекул с положительными или отрицательными зарядами, посмотрев на их степени окисления. Гидроксид-ион, например, имеет заряд -1. Кислород обычно имеет степень окисления -2, в то время как водород имеет +1. Заряд гидроксид-иона отрицателен, потому что (-2) + (+1) = -1.
Совет: благородные газы — единственные атомы, которые имеют стабильные конфигурации своих валентных электронов; все они уже имеют восемь электронов в своей внешней оболочке. Исключением из правила восьмивалентных электронов являются водород, бор, бериллий и литий, которые стабильны с двумя валентными электронами.
Источник
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
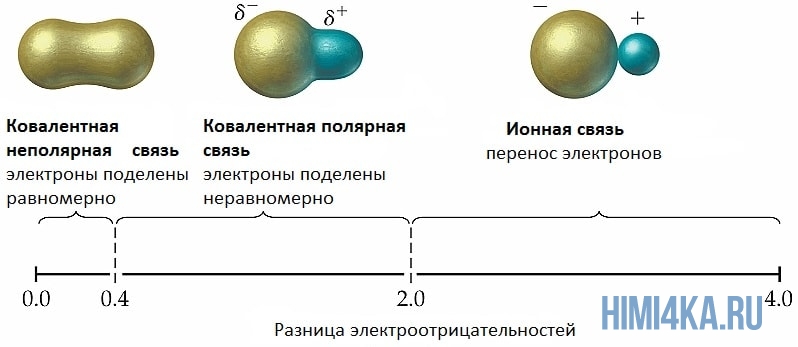
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
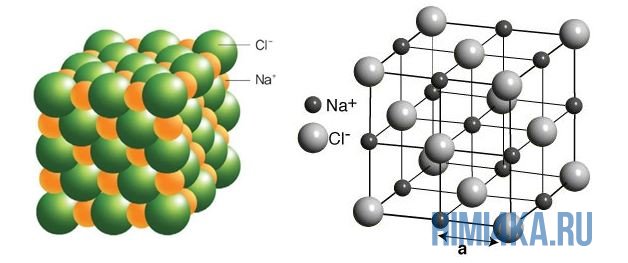
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Источник
Как определить заряд?
Заряд иона определяется следующим образом:
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц — нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
2
Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон — отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
При помощи связей атомы могут также соединяться в молекулы.
3
В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.
Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
4
Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
5
Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия) . Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом зарядовое число равно = 11+(-10) = +1.
Обозначаться такой ион будет символом натрий с плюсом сверху, в случае заряда +2 — двумя плюсами и. т. д. Соответственно для отрицательного иона используется знак «минус» .
Источник
1. Степень окисления-это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
1.1. Определите, является ли рассматриваемое вещество элементарным.
Степень окисления атомов вне химического соединения равна нулю. Это правило справедливо как для веществ, образованных из отдельных свободных атомов, так и для таких, которые состоят из двух- либо многоатомных молекул одного элемента. Например, Al и Cl2 имеют степень окисления 0, поскольку оба находятся в химически несвязанном элементарном состоянии.
1.2. Определите, состоит ли рассматриваемое вещество из ионов.
Степень окисления ионов равняется их заряду. Это справедливо как для свободных ионов, так и для тех, которые входят в состав химических соединений. Например, степень окисления иона Cl- равняется -1. Степень окисления иона Cl в составе химического соединения NaCl также равна -1. Поскольку ион Na, по определению, имеет заряд +1, мы заключаем, что заряд иона Cl -1, и т. О. Степень его окисления -1. Учтите, что ионы металлов могут иметь несколько степеней окисления. Атомы многих металлических элементов могут ионизироваться на разные величины. Например, заряд ионов такого металла как железо (Fe) равняется +2 либо +3. Заряд ионов металла (и их степень окисления можно определить по зарядам ионов других элементов, с которыми данный металл входит в состав химического соединения; в тексте этот заряд обозначается римскими цифрами: так, железо(III) имеет степень окисления +3. В качестве примера рассмотрим соединение, содержащее ион алюминия. Общий заряд соединения AlCl3 равен нулю. Поскольку нам известно, что ионы Cl- имеют заряд -1, и в соединении содержится 3 таких иона, для общей нейтральности рассматриваемого вещества ион Al должен иметь заряд +3. Таким образом, в данном случае степень окисления алюминия +3.
Источник
Как определить заряд?
Подскажите, как определить заряд у элемента (иона) , сколько он отдает/принимает электронов. Интересует не какой-либо конкретный элемент/соединение, а алгоритм (или что-то другое? ) нахождения данного параметра (может быть по таблице Менделеева можно как то?) .
Дамы и господа, если вам не чего ответить по существу, пожалуйста, лучше не пишите, не тратьте ни мое ни свое время, а главное, не выставляйте себя, пардон, дебилами. Спасибо!
Заряд иона определяется следующим образом:
Атом любого вещества состоит из электронной оболочки и ядра. Ядро состоит из двух типов частиц — нейтронов и протонов. Нейтроны не имеют электрического заряда, то есть электрический заряд нейтронов равен нулю. Протоны являются положительно заряженными частицами и имеют электрический заряд, равный +1. Количество протонов характеризует атомный номер данного атома.
2
Электронная оболочка атома состоит из электронных орбиталей, на которых расположено разное количество электронов. Электрон — отрицательно заряженная элементарная частица. Ее электрический заряд равен -1.
При помощи связей атомы могут также соединяться в молекулы.
3
В нейтральном атоме количество протонов равно количеству электронов. Поэтому его заряд равен нулю.
Чтобы определить заряд иона, необходимо знать его структуру, а именно количество протонов в ядре и количество электронов на электронных орбиталях.
4
Суммарный заряд иона получается в результате алгебраического суммирования зарядов входящих в него протонов и электронов. Число электронов в ионе может превышать число протонов, и тогда ион будет отрицательным. Если число электронов меньше числа протонов, то ион будет положительным.
5
Зная химический элемент, по таблице Менделеева мы можем определить его атомный номер, который равен количеству протонов в ядре атома этого элемента (например 11 у натрия) . Если один из электронов покинул атом натрия, то у атома натрия будет уже не 11, а 10 электронов. Атом натрия станет положительно заряженным ионом с зарядом зарядовое число равно = 11+(-10) = +1.
Обозначаться такой ион будет символом натрий с плюсом сверху, в случае заряда +2 — двумя плюсами и. т. д. Соответственно для отрицательного иона используется знак «минус» .

думаю, заряд вещества можно косвенно определить химическим путем через диссоциацию исследуемого вещества в нейтральном растворителе — воде. Зная плотность воды, определяем массовую долю растворенного вещества, его молярную массу. Затем титруем растворённое вещество (NaOH) активным реагентом с индикатором pH. Можно использовать реагенты, выпадающие в осадок при соединении. В общем, определяем кол-во реактива, пошедшего на титрацию. составляем уравнение обмена. Заряд вещества определяем по количеству затраченных анионов или катионов — носителей заряда.
Источник
Как правило, атомы являются нейтральными, потому что они имеют такое же количество протонов (положительно заряженных частиц), что и электроны или отрицательно заряженные частицы. Однако многие атомы нестабильны, поэтому они образуют ионы (атомы или молекулы с положительным или отрицательным зарядом), теряя или приобретая электроны. Есть два типа ионов: катионы, которые заряжены положительно, потому что электроны потеряны, и анионы, которые имеют отрицательный заряд, потому что электроны получены.
Определить протоны и электроны
Посмотрите на периодическую таблицу, чтобы определить, сколько протонов и электронов имеет атом, чтобы он был сбалансирован. Например, атом натрия имеет 11 протонов и электронов, потому что его атомный номер равен 11.
Вычесть электроны из протонов
Вычтите количество электронов из числа протонов в атоме в качестве основного способа расчета заряда иона. Например, если атом натрия теряет один электрон, сработает 11 — 10 = 1. Ион натрия имеет заряд +1, обозначенный как Na +.
Рассмотрим валентность электронов
Рассмотрим количество электронов во внешней оболочке атома, известных как валентные электроны, чтобы определить, почему натрий отдает один электрон, образуя катион. Катионы — это электроны, отданные или добавленные для образования ионов или соединений.
Стабильные атомы должны иметь восемь валентных электронов. Когда атомы проходят химические реакции или образуют связи, они получают, теряют или делят электроны, чтобы поддерживать восемь валентных электронов. Натрий имеет два электрона на первом уровне и восемь электронов на втором, что оставляет один электрон во внешнем слое. Для натрия, имеющего восемь валентных электронов, он теряет один в своем внешнем слое, поэтому второй слой, имеющий восемь электронов, становится внешним слоем, а атом является положительно заряженным ионом.
Соблюдайте Правило Металла / Неметалла
Следуйте общему правилу, что металлы теряют свои валентные электроны, образуя катионы, в то время как неметаллы обычно получают электроны, образуя анионы. Фосфор, например, имеет пять валентных электронов. Он получает три электрона, чтобы получить восемь валентных электронов. Атомный номер фосфора составляет 15, поэтому он имеет 15 протонов, но добавление электронов дает ему 18 электронов. Ион фосфора имеет заряд -3, потому что 15 + (-18) = (-3).
Применить числа окисления
Рассчитайте заряды многоатомных ионов или молекул с положительными или отрицательными зарядами, посмотрев на их степени окисления. Гидроксид-ион, например, имеет заряд -1. Кислород обычно имеет степень окисления -2, в то время как водород имеет +1. Заряд гидроксид-иона отрицателен, потому что (-2) + (+1) = -1.
Источник

Ион
Ион – это заряженная частица, образованная из молекулы или атома путём потери или приобретения одного электрона.
Отсюда следует, что в ионе количество протонов не равно количеству электронов.
После изучения статьи Вы узнаете, какими бывают заряженные частицы, что такое ионы, катионы и анионы, также
Вы сможете по номеру элемента узнать, каким зарядом он может обладать.
Число электронов в ионе
Количество электронов в нейтральном атоме равно количеству протонов в ядре, например, у хрома (24Cr)
24 протона, соответствено, вокруг ядра вращается 24 электрона. Как было рассказано в статье
“электронная конфигурация атома”, каждый
электрон двигается по некой орбитали, то есть обладает заданным количеством энергии.
Если ион образован из-за потери электрона, то заряд иона становится положительным (электрон имеет отрицательный
заряд), схема для запоминания:
24Cr – e– = 24Cr + e+ = 24Cr+
24Cr – 3e– = 24Cr + 3e+ = 24Cr3+
Аналогично при присоединении электрона:
24Cr + e– = 24Cr – e+ = 24Cr–
24Cr + 3e– = 24Cr – 3e+ = 24Cr3-
Энергия ионизации
Если электрону сообщить достаточное количество энергии, то электрон “оторвётся” от атома. Чем ближе электрон
к ядру – тем сложнее его отрывать, а значит, больше энергии необходимо передать. Энергия, необходимая для отрыва
электрона, называется энергией ионизации или ионизационный потенциал (I). Значения I затабулированы и могут быть
найдены в различных справочниках.
| # | Элемент | Название | кДж/моль |
|---|---|---|---|
| 1 | H | Водород | 1312 |
| 2 | He | Гелий | 2373 |
| 3 | Li | Литий | 520 |
| 4 | Be | Бериллий | 899.5 |
| 5 | B | Бор | 801 |
| 6 | C | Углерод | 1086 |
| 7 | N | Азот | 1402 |
| 8 | O | Кислород | 1314 |
| 9 | F | Фтор | 1681 |
| 10 | Ne | Неон | 2080.7 |
| 11 | Na | Натрий | 495 |
| 12 | Mg | Магний | 738 |
| 13 | Al | Алюминий | 578 |
| 14 | Si | Кремний | 787 |
| 15 | P | Фосфор | 1012 |
| 16 | S | Сера | 1000 |
| 17 | Cl | Хлор | 1251 |
| 18 | Ar | Аргон | 1520.6 |
| 19 | K | Калий | 418.8 |
| 20 | Ca | Кальций | 590 |
| 21 | Sc | Скандий | 633.1 |
| 22 | Ti | Титан | 658.8 |
| 23 | V | Ванадий | 650.9 |
| 24 | Cr | Хром | 652.9 |
| 25 | Mn | Марганец | 717.3 |
| 26 | Fe | Железо | 762.5 |
| 27 | Co | Кобальт | 760.4 |
| 28 | Ni | Никель | 737.1 |
| 29 | Cu | Медь | 745.5 |
| 30 | Zn | Цинк | 906.4 |
| 31 | Ga | Галлий | 578.8 |
| 32 | Ge | Германий | 762 |
| 33 | As | Мышьяк | 947 |
| 34 | Se | Селен | 941 |
| 35 | Br | Бром | 1142 |
| 36 | Kr | Криптон | 1350.8 |
| 37 | Rb | Рубидий | 403 |
| 38 | Sr | Стронций | 549 |
| 39 | Y | Иттрий | 600 |
| 40 | Zr | Цирконий | 640.1 |
| 41 | Nb | Ниобий | 652.1 |
| 42 | Mo | Молибден | 684.3 |
| 43 | Tc | Технеций | 702 |
| 44 | Ru | Рутений | 710.2 |
| 45 | Rh | Родий | 719.7 |
| 46 | Pd | Палладий | 804.4 |
| 47 | Ag | Серебро | 731 |
| 48 | Cd | Кадмий | 867.8 |
| 49 | In | Индий | 558.3 |
| 50 | Sn | Олово | 709 |
| 51 | Sb | Сурьма | 834 |
| 52 | Te | Теллур | 869 |
| 53 | I | Иод | 1008 |
| 54 | Xe | Ксенон | 1170.4 |
| 55 | Cs | Цезий | 375.7 |
| 56 | Ba | Барий | 503 |
| 57 | La | Лантан | 538.1 |
| 58 | Ce | Церий | 534.4 |
| 59 | Pr | Празеодим | 527 |
| 60 | Nd | Неодим | 533.1 |
| 61 | Pm | Прометий | 540 |
| 62 | Sm | Самарий | 544.5 |
| 63 | Eu | Европий | 547.1 |
| 64 | Gd | Гадолиний | 593.4 |
| 65 | Tb | Тербий | 565.8 |
| 66 | Dy | Диспрозий | 573 |
| 67 | Ho | Гольмий | 581 |
| 68 | Er | Эрбий | 589.3 |
| 69 | Tm | Тулий | 596.7 |
| 70 | Yb | Иттербий | 603.4 |
| 71 | Lu | Лютеций | 523.5 |
| 72 | Hf | Гафний | 658.5 |
| 73 | Ta | Тантал | 761 |
| 74 | W | Вольфрам | 770 |
| 75 | Re | Рений | 760 |
| 76 | Os | Осмий | 840 |
| 77 | Ir | Иридий | 880 |
| 78 | Pt | Платина | 870 |
| 79 | Au | Золото | 890.1 |
| 80 | Hg | Ртуть | 1007.1 |
| 81 | Tl | Таллий | 589.4 |
| 82 | Pb | Свинец | 715.6 |
| 83 | Bi | Висмут | 703 |
| 84 | Po | Полоний | 812.1 |
| 85 | At | Астат | 890 |
| 86 | Rn | Радон | 1037 |
| 87 | Fr | Франций | 380 |
| 88 | Ra | Радий | 509.3 |
| 89 | Ac | Актиний | 499 |
| 90 | Th | Торий | 587 |
| 91 | Pa | Протактиний | 568 |
| 92 | U | Уран | 597.6 |
| 93 | Np | Нептуний | 604.5 |
| 94 | Pu | Плутоний | 584.7 |
| 95 | Am | Америций | 578 |
| 96 | Cm | Кюрий | 581 |
| 97 | Bk | Берклий | 601 |
| 98 | Cf | Калифорний | 608 |
| 99 | Es | Эйнштейний | 619 |
| 100 | Fm | Фермий | 627 |
| 101 | Md | Менделевий | 635 |
| 102 | No | Нобелий | 642 |
| 103 | Lr | Лоуренсий | 470 |
| 104 | Rf | Резерфордий | 580 |
| Таблица 1. Энергия ионизации, справочные данные |
Энергия сродства электрону
Также электроны могут присоединяться к атому, в процессе присоединения электрон выделяет энергию, такая энергия
называется энергией сродства электрону, для каждого электрона конкретного атома энергия сродства численно равна
и противоположна по знаку энергии ионизации, например, 17Cl, что бы оторвать 17й электрон у атома
хлора, необходимо сообщить ему 13 эВ, любой другой электрон, который присоединится на место 17го электрона
также выделит 13 эВ.
Катионы и анионы
Атомы, в которых количество протонов не равно количеству электронов называются ионами, поскольку электрон имеет
отрицательный заряд, то если электронов больше протонов, то суммарный заряд отрицательный: S2-
означает, что в данном атоме серы количество электронов больше чем протонов на два электрона. Соответственно,
если электронов меньше чем протонов, то суммарный заряд положительный и обозначается H+.
Отрицательно заряженные атомы называются анионами, положительно заряженные атомы – катионами.
Какой заряд будет у атома?
Теоретически возможно отобрать все электроны у атома, но это возможно только в лабораторных условиях и за
пределами лаборатории атомы в таком состоянии находиться не будут, почему?
Вернёмся к устройству электронной оболочки. Вокруг атома электроны сгруппированы по энергетическим уровням,
каждый заполненный уровень экранирует ядро и является более стабильным, нежели не до конца заполненный
уровень. То есть электронная конфигурация стремиться к состоянию заполненного подуровня: если на p-оболочке
находится 5 электронов, то вероятнее атом примет один электрон, нежели отдаст пять. Так, например, у атома
хлора, пять электронов на 3p-подуровне, энергия сродства хлора – 3.61 эВ, энергия ионизации – 13 эВ. У натрия
на последнем подуровне один электрон, энергия сродства – 0,78 эВ, потенциал ионизации – 0,49 эВ, поэтому
вероятнее натрий отдаст один электрон, нежели примет его.
Зная потенциал ионизации и энергию сродства мы можем сделать предположение о взаимодействии веществ. Если
смешать натрий и хлор, и сообщить им энергию, то вероятнее всего Na будет отдавать один электрон Cl и
в результате получится смесь ионов Na+ и Cl–.
Пример
Так можно по номеру элемента предположить, какой заряд он будет иметь, например, 19й элемент, электронная
конфигурация – 1s 22s 22p 63s 23p64s 1,
вероятнее всего, такой элемент может либо отдать, либо принять один электрон.
У 27го элемента электронная конфигурация выглядит так:
1s 22s 22p 63s 23p64s 23d7,
у d-подуровня всего может быть 10 атомов, т.е. либо атом примет 1,2 или 3 электрона, либо отдаст
1,2,3…7 электронов, так, вероятнее, он примет 3, т.е. возможные состояния – это +1, +2 и +3,
Теперь Вы знаете, что такое ионы, осталось изучить химическую связи и Вы сможете составлять
окислительно-восстановительные реакции!
Вам понравилась статья?
/
Просмотров: 12 862
