При некоторой температуре равновесие гомогенной системы:
2NO + O2 = 2NO2
установилось при следующих концентрациях реагирующих веществ: [NO] = 0,2 моль/л; [O2] = 0,1 моль/л; [NO2] = 0,1 моль/л. Вычислите константу равновесия и исходную концентрацию NO и О2.
Решение задачи
Рассмотрим обратимую химическую реакцию:
![]()
Константой химического равновесия (K) отношение констант скоростей прямой и обратной реакций.
Константа равновесия данной реакции выражается уравнением:
![]()
Подставляя в него данные из условия задачи, получаем:
K = 0,01/0,04 ⋅ 0,1 = 2,5
Для нахождения исходных концентраций NO и О2 учтем, что, согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2. Поскольку по условию задачи в каждом литре системы образовалось 0,1 моль вещества NO2, то при этом было израсходовано 0,1 моль NO и 0,05 моль О2. Таким образом, искомые исходные концентрации равны:
![]()
![]()
Ответ:
константа равновесия 2,5;
исходная концентрация NO 0,3 моль/л;
исходная концентрация О2 0,15 моль/л.
Расчеты, связанные с равновесием химической системы
Задача 350.
Реакция СО + С12 ⇔ СОС12 протекает в закрытом сосуде при постоянной температуре; исходные вещества взяты в эквивалентных количествах. К моменту наступления равновесия остается 50% начального количества СО. Определить давление равновесной газовой смеси, если первоначальное давление равнялось 100 кПа (750 мм рт. ст.).
Решение:
Уравнение реакции имеет вид:
СО + С12 ⇔ СОС12
По условию задачи в реакцию вступило 50% СО. Из уравнения реакции следует, что из 1 моля СО и 1 моля С12 образуется 1 моль СОС12. Следовательно, из 0,5 моль СО и 0,5 моль С12 образовалось тоже 0,5 молей СОС12. Учитывая, что вещества реагируют друг с другом в эквивалентных количествах, значит, в 1л реакционной смеси содержится 2 моля исходных веществ (СО и С12), половина из которых прореагировало с образованием 0,5 молей СОС12.
Таким образом, количество системы уменьшилось на 0,5 молей и составило после протекания реакции 1,5 молей (2 – 0,5 = 1,5). Следовательно, давление равновесной газовой смеси определится из пропорции:
2 : 1,5 = 100 : х; х = (1,5 . 100)/2 = 75 кПа.
Ответ: 75кПа.
Задача 351.
В закрытом сосуде установилось равновесие: СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объемных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
Решение:
а) Уравнение реакции имеет вид
СО2(г.) + Н2(г.) ⇔ СО(г.) + +Н2О(г.)
Из уравнения следует, что из 1 моля СО2 и 1 моля Н2 образуется по 1 молю СО и Н2О.
Обозначим равновесную концентрацию СО и Н2О через х, тогда [CO] = [H2O]. Таким образом, равновесные концентрации СО2 и Н2 будут составлять, соответственно, (1 – х) и (5 – х)моль/л, а СО и Н2О – по х моль/л. Подставим эти значения в выражение константы равновесия реакции:
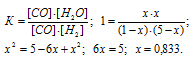
Таким образом, 83,3% СО2 подвергнется разложению в СО, учитывая, что [CO2] = 1 моль/л.
б) Находим количество Н2, которое вступило в реакцию: 5 . 0,9 = 4,5 моль/л. Остаток количества СО2 и Н2 одинаков и будет составлять 0,5 моль/л (5 – 4,5 = 0,5). Тогда объёмные соотношения СО2 и Н2, к моменту наступления равновесия, составляют:
V(H2) : V(CO2) = 4,5 : 0,5 = 9 : 1 .
Ответ: а) 83,3%; б) 9:1.
Задача 352.
При состоянии равновесия в системе:
N2(г) + 3H2(г) ⇔ 2NН3(г);  = -92,4 кДж
= -92,4 кДж
концентрации участвующих веществ равны: [N2] = 3 моль/л; [H2] = 9 моль/л; [NН3] = 4 моль/л. Определить: а) исходные концентрации Н2 и N2 б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие, если уменьшить объем реакционного сосуда?
Решение:
а) Для нахождения исходных концентраций веществ N2 и Н2 учтём, что, согласно уравнению реакции из 1 моля N2 и 3 молей Н2 образуется 2 моля NH3. Поскольку по условию задачи в каждом литре системы образовалось 4 моля NH3, то при этом было израсходовано 1/2 . 4 = 2 моля N2 и 3/4 . 4 = 6 молей Н2. Таким образом, искомые исходные концентрации N2 и Н2 равны:
[N2]0 = 3 + 2 = 5 моль/л;
[H2]0 = 6 + 3 = 9 моль/л.
б) Из уравнения реакции следует, что данная реакция экзотермическая, т.е. протекает с выделением теплоты. Поэтому при повышении температуры в экзотермической системе, согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения действия температуры, т.е. влево.
в) Реакция протекает с уменьшением числа молей газообразных веществ, т.е. с уменьшением объёма и, соответственно, с уменьшением давления в системе. Поэтому при уменьшении объёма реакционного сосуда равновесие системы сместится в сторону образования аммиака, вправо, т.е. согласно принципу Ле Шателье, в сторону уменьшения действия (повышения давления при уменьшении объёма реакционного сосуда).
Ответ: а) [N2]0 = 5 моль/л, [H2]0 = 6 + 3 = 9 моль/л; б) влево; в) вправо.
Задача 353.
Константа равновесия реакции FeO(к) + CO(г) ⇔ Fe(к) + CO2(г), при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации этих веществ составляли: [СО] = 0,05 моль/л, [СО2] = 0,01 моль/л.
Решение:
Для нахождения равновесных концентраций веществ учтем, что, согласно уравнению реакции из 1 моля СО образуется 1 моль СО2. Обозначим количество, прореагировавшего вещества СО за x моль. Учитывая, что моль СО2 образуется при реакции, то при этом равновесная концентрация СО будет равна (0,05 – х)моль/л, а СО2 – (0,01 + х) моль/л.
Таким образом, подставив в выражение константы равновесия реакции эти концентрации, найдём значение:
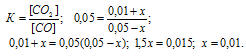
Отсюда искомые равновесные концентрации веществ равны:
[СО]равн. = 0,05 – 0,01 = 0,04 моль/л;
[СО2]равн. = 0,01 + 0,01 = 0,02 моль/л.
Ответ: [СО] = 04 моль/л; [СО2] = 0,02 моль/л.
Задача 354.
Равновесие в системе H2(г) + I2(г) ⇔ 2HI(г) установилось пи следующих концентрациях: [H2] = 0,025 моль/л; [I2] = 0,005 моль/л; [HI] = 0,09 моль/л. Определить исходные концентрации йода и водорода.
Решение:
Для нахождения исходных концентраций йода и водорода учтём, что согласно уравнению реакции, из 1 моля йода и 1 моля водорода образуется 2 моля йодоводорода. Поскольку по условию задачи в каждом литре системы образовалось 0,09 молей вещества HI, то при этом было затрачено 0,045 (0,09/2 = 0,045) молей H2 и, соответственно 0,045 молей I2.
Отсюда находим исходные концентрации водорода и йода:
[I2]исх. = 0,005 + 0,045 = 0.0 5моль/л;
[H2]исх. =.0,025 + 0,045 = 0,07 моль/л.
Ответ: [H2]исх. = 0,07 моль/л; [I2]исх. = 0.05 моль/л.
Задача 355.
При некоторой температуре равновесие в системе 2NO2 ⇔ 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,006 моль/л; [NO] = 0,024 моль/л. Найти константу равновесия реакции и исходную концентрацию NO2.
Решение:
Константа равновесия данной реакции выражается уравнением:
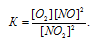
Учитывая, что равновесная концентрация О2 будет составлять 1/2 концентрации NO, т.е. 0,012 моль/л (0,024/2 = 0,012), рассчитаем константу равновесия:
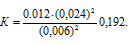
Для нахождения исходной концентрации NO2 учтём, что согласно уравнению реакции из 1 моля NO2 образуется 1 моль NO. Поскольку по условию задачи в каждом литре системы образовалось 0,024 моля NO, то при этом было израсходовано 0,024 моля NO2.
Таким образом, искомая исходная концентрация NO равна:
[NO2]исх. = 0,006 + 0,024 = 0,03 моль/л.
Ответ: К = 0,192; [NO2]исх. = 0,03 моль/л.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,658 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,962 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Найдите правильный ответ на вопрос ✅ «В момент равновесия системы 2NO2 ↔ 2NO + O2 концентрации веществ равны (моль/л) : [NO2] = 1,2; [O2] = 1,4. Определите исходную концентрацию …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » В момент равновесия системы 2NO2 ↔ 2NO + O2 концентрации веществ равны (моль/л) : [NO2] = 1,2; [O2] = 1,4. Определите исходную концентрацию NO2.
Как решать задание 23 в ЕГЭ по химии в 2022-2023? Установить исходную концентрацию веществ, найти известное вещество, по которому будут проводиться расчеты. Затем провести расчеты по уравнению реакции и найти неизвестные концентрации.
Особенности задания
Как решать новое задание 23 в ЕГЭ по химии, которое появилось только в 2022 году? Разумеется, хорошенько подготовившись – аналогов этой задаче до сих пор не было, в 2023 году она будет использоваться лишь второй раз. Поэтому важно заранее получить максимум информации о том, как можно найти правильный ответ.
Прежде чем разбираться, как решать номер 23 в ЕГЭ по химии, отметим, что задание относится к повышенному уровню сложности. Соответственно, за правильное решение можно заработать два первичных балла. На выполнение отводится в среднем 5-7 минут.
В задании проверяются ваши знания и умения в следующих областях:
- Обратимые и необратимые химические реакции;
- Химическое равновесие и его смещение под воздействием различных факторов;
- Расчеты количества вещества, его массы или объема газов по известному количеству вещества, массе или объему одного из участвующих в реакции веществ.
Если вкратце: вот как делать 23 задание на ЕГЭ по химии: проанализировать исходные данные и установить известные концентрации вещества. После этого произвести расчеты по уравнению реакции и вычислить неизвестные вещества.

Демонстрационные задания
А теперь на практике покажем, как решать задачи 23 в ЕГЭ по химии – используем несколько демонстрационных вариантов. Помните, что нет никакой гарантии, что именно эти задачки попадутся в вашем комплекте заданий. Но ими можно руководствоваться как примером.
Итак, первый вариант решения 23 номера ЕГЭ по химии.
Дано:
В замкнутый реактор поместили газообразную смесь оксида азота (II) с кислородом и нагрели. В результате протекания обратимой реакции 2NO(г) + O2(г) ⇄ 2NO2(г) в системе установилось равновесие.
Используя данные, приведенные в таблице, определите равновесные концентрации оксида азота (II) (Х) и кислорода (Y).
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | |
| Равновесная концентрация (моль/л) | 0,2 |
На основании приведенных данных рассказываем, как решать 23 задание ЕГЭ по химии:
Сначала производим базовый расчет: исходя из приведенной информации, следует, что в реакторе не было NO2, а значит, исходная концентрация NO2 равна нулю.
Известное вещество (с известной исходной и равновесной концентрацией) – это NO2, которого образовалось 0,2 моль.
Теперь переходим к стехиометрическим расчетам. Подставляем нужные цифры:
- 2NO(г) + O2(г) ⇄ 2NO2(г)
- 0,2 + 0,1 ⇄ 0,2
Из уравнения реакции становится ясно, что прореагировали 0,2 моль NO и 0,1 моль О2.
Наконец, переходим к окончательным расчетам. Еще раз представим перед собой таблицу и подставим нужные значения:
| Реагент | NO | O2 | NO2 |
| Исходная концентрация (моль/л) | 0,5 | 0,8 | 0 |
| Равновесная концентрация (моль/л) | 0,3 | 0,7 | 0,2 |
Итого, получаем следующий ответ:
- х = 0,5 – 0,2 = 0,3
- у = 0,8 – 0,1 = 0,7
Еще один разбор 23 задачи ЕГЭ по химии 2022-2023. Хороший пример, который может помочь вам разобраться.
Дано:
В реактор для синтеза метанола постоянного объема поместили водород и угарный газ. В результате протекания обратной химической реакции 2Н2(г) + СО(г) ⇄ СН3ОН(г) в системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определите равновесную концентрацию угарного газа (Х) и исходную концентрацию водорода (Y).
| Реагент | Н2 | СО | СН3ОН |
| Исходная концентрация (моль/л) | Y | 2 | 0 |
| Равновесная концентрация (моль/л) | 1,2 | Х | 0,4 |
Решение демо 23 задания ЕГЭ по химии 2022 выглядит так:
Так как в первоначальный момент в системе не было метанола (а в состоянии равновесия метанола стало 0,4 моль), соответственно, изменения в ходе реакции по метанолу будет равно +0,4 моль.
Далее необходимо определить, сколько угарного газа было потрачено на реакцию. Концентрация угарного газа в ходе реакции уменьшается, из уравнения реакции следует, что n(CH3ОН):n(CO) = 1:1. Отсюда следует, что n(CO) = n(CH3ОН) = 0,4 моль.
Равновесную концентрацию угарного газа можно посчитать так: [СО]равн = [СО]исх – [CO]измен = 2 моль/л = 0,4 моль/л = 1,6 моль/л.
Первая часть разбора 23 задания ЕГЭ по химии 2022г. окончена, теперь посчитаем второе неизвестное значение:
Из уравнения реакции следует, что n(CH3ОН):n(Н2) = 1:2, отсюда следует, что n(Н2) = 2n(CH3ОН) = 2х0,4 = 0,8 моль.
Концентрация водорода в ходе реакции уменьшается. Чтобы найти исходную концентрацию водорода: [H2]исх – [H2]измен = 1,2 моль/л.
[H2]исх = [H2]измен + [H2]равн = 1,2 моль/л + 0,8 моль/л = 2 моль/л.
Ответ: х = 1,6 моль/л, у = 2 моль/л.

Как вам такое объяснение 23 задания ЕГЭ по химии 2022 года? Как видите, задачи действительно сложные – нужно знать довольно много вещей и свободно оперировать химическими формулами. Что может быть довольно сложно, если на уроках вы уделяли недостаточно внимания этим темам. Хорошо, что еще есть время на подготовку!
Решение задачи 23 в ЕГЭ по химии 2022-2023 вполне доступно каждому. Конечно, если вы понимаете смысл нужных понятий и умеете пользоваться вычислениями по химическим формулам и уравнениям. Задание это новое, поэтому лучше прорешать все доступные демонстрационные варианты перед экзаменом, чтобы хорошенько подготовиться!
