Энтропия при изохорном процессе
Поскольку в системе
при изохорном процессе происходит
теплообмен
с внешней средой, то происходит изменение
энтропии.
Из определения энтропии следует:
Выше была выведена
формула для определения количества
теплоты.
Перепишем ее в дифференциальном виде:
,
где ν — количество
вещества,
—молярная
теплоемкость
при постоянном объеме. Итак, микроскопическое
изменение энтропии при изохорном
процессе можно определить по формуле:
Или, если
проинтегрировать последнее выражение,
полное изменение энтропии в этом
процессе:
В данном случае
выносить выражение молярной теплоемкости
при постоянном объеме за знак интеграла
нельзя, поскольку она является функцией,
которая зависит от температуры.
На графиках
изображается линиями, которые называются
изохоры.
Для идеального газа они являются прямыми
во всех диаграммах, которые связывают
параметры: T
(температура), V
(объем) и P
(давление).
-
Процессы в
идеальном газе. Изобарический процесс.
Изобарный
процесс
— термодинамический
процесс,
происходящий в системе при постоянном
давлении
и постоянной массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе
.
Работа, совершаемая
газом при расширении или сжатии газа,
равна
.
Количество теплоты,
получаемое или отдаваемое газом,
характеризуется изменением энтальпии:
.
Теплоёмкость
Молярная теплоёмкость при постоянном
давлении обозначается как
.
В идеальном газе она связана с теплоёмкостью
при постоянном объёмесоотношением
Майера.
Молекулярно-кинетическая теория
позволяет вычислить приблизительные
значения молярной теплоёмкости для
различных газов через значение
универсальной
газовой постоянной:
-
для одноатомных газов
,
то есть около 20.8 Дж/(моль·К); -
для двухатомных газов
,
то есть около 29.1 Дж/(моль·К); -
для многоатомных газов
,
то есть около 33.3 Дж/(моль·К).
Теплоёмкости можно также определить
исходя из уравнения Майера, если известен
показатель
адиабаты, который можно измерить
экспериментально (например, с помощью
измерения скорости звука в газе или
используя метод Клемана — Дезорма).
Изменение энтропии
Изменение энтропииприквазистатическомизобарном процессе равно
В случае, если изобарный процесс
происходит в идеальном газе, то,
следовательно, изменение энтропии можно
выразить как
Если пренебречь зависимостьюот
температуры, то
-
Процессы в
идеальном газе. Изотермический процесс.
Изотермический
процесс—термодинамический
процесс,
происходящий в физической системе при
постоянной температуре.
Для осуществления
изотермического процесса систему обычно
помещают в термостат
(массивное тело, находящееся в тепловом
равновесии),
теплопроводность
которого велика, так что теплообмен с
системой происходит достаточно быстро
по сравнению со скоростью протекания
процесса, и, температура системы в любой
момент практически не отличается от
температуры термостата. Можно осуществить
изотермический процесс иначе — с
применением источников или стоков
тепла, контролируя постоянство температуры
с помощью термометров.
К изотермическим процессам относятся,
например, кипение
жидкости или плавление
твёрдого тела при постоянном давлении.
Графиком изотермического процесса
является изотерма.
В идеальном
газе
при изотермическом процессе произведение
давления
на объём постоянно (закон
Бойля-Мариотта).
Изотермы идеального газа в координатах
—гиперболы,
расположенные на графике тем выше, чем
выше температура, при которой происходит
процесс (см. рисунок).
При изотермическом
процессе системе, вообще говоря,
сообщается определённое количество
теплоты
(или она отдаёт теплоту) и совершается
внешняя работа. Альтернативный процесс,
при котором теплообмен с окружающей
средой отсутствует (термодинамическая
система находится в энергетическом
равновесии — система не поглощает
и не выделяет тепло), называется
адиабатическим
процессом.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна
,
где—
число частиц газа,—
температура,и
—
объём газа в начале и конце процесса,—постоянная
Больцмана
.
В твёрдом теле и
большинстве жидкостей изотермические
процессы очень мало изменяют объём
тела, если только не происходит фазовый
переход.
Первый
закон термодинамики
для изотермического процесса записывается
в виде:
где учитывается, что внутренняя
энергиясистемы в изотермическом
процессе не изменяетс
-
Процессы в
идеальном газе. Адиабатический процесс.
Адиабати́ческий,
или адиаба́тный
проце́сс—термодинамический
процесс
в макроскопической системе, при котором
система не обменивается теплотой
с окружающим пространством.
Серьёзное исследование адиабатических
процессов началось в XVIII веке[1].
Адиабатический
процесс является частным случаем
политропного
процесса,
так как при нём теплоёмкость
газа равна нулю и, следовательно,
постоянна[2].
Адиабатические процессы обратимы
только тогда, когда в каждый момент
времени система остаётся равновесной
(например, изменение состояния происходит
достаточно медленно) и изменения энтропии
не происходит. Некоторые авторы (в
частности, Л. Д. Ландау)
называли адиабатическими только
обратимые адиабатические процессы[3].
Обратимый
адиабатический процесс для идеального
газа
описывается уравнением Пуассона.
Линия, изображающая адиабатный процесс
на термодинамической диаграмме,
называется адиабатой
Пуассона.
Примером необратимого адиабатического
процесса может быть распространение
ударной
волны
в газе. Такой процесс описывается ударной
адиабатой.
Адиабатическими можно считать процессы
в целом ряде явлений природы. Так же
такие процессы получили ряд применений
в технике.
-
Круговой процесс.
Цикл Карно
Круговой процесс—процесс, при
котором газ, пройдя через ряд состояний,
возвращается в исходное.
Если круговой
процесс на диаграмме P-V протекает по
часовой стрелке, то часть тепловой
энергии, полученной от нагревателя,
превращается в работу. Так работает
тепловая машина.
Цикл Карно́
— это обратимый круговой процесс,
состоящий из двух адиабатических
и двух изотермических
процессов[1].
В процессе Карно термодинамическая
система выполняет механическую работу
и обменивается теплотой
с двумя тепловыми резервуарами, имеющими
постоянные, но различающиеся температуры.
Резервуар с более высокой температурой
называется нагревателем, а с более
низкой температурой — холодильником[2].
-
Основное уравнение
молекулярно-кинетической теории газа.Содержание
Величина
Наименование
–
основное уравнение МКТ идеального
газа. Выведено в предположении, что
давление газа есть результат ударов
его молекул о стенки сосуда.Это
же уравнение в другой записи:p – давление
Па = Н/м2
n – концентрация газа
1/м3
k = 1,38 .10-23
Дж/К
m0– масса
молукулыкг
v – средняя скорость
молекулм/с
T – абсолютная
температура газа (to+ 273)К
Eк– средняя
кинетическая энергия молекул газаДж
-
Средняя
кинетическая энергия молекул газа
|
Содержание |
Величина |
Наименование |
|
С Другие формулы, где С О |
Eк – средняя кинетическая |
Дж |
|
v – средняя скорость |
м/с |
|
|
n – концентрация |
1/м3 |
|
|
m0– масса |
кг |
|
|
p – давление |
Па = Н/м2 |
|
|
i – число степеней |
– |
|
|
T – абсолютная |
К |
|
|
k = 1,38 .10-23 |
Дж/К |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
15.03.2015935.94 Кб141MS.DOC
- #
- #
- #
- #
Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
- физике;
- химии;
- билогии;
- космологии;
- теории информации.
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Определение 1
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
$dS=frac{delta Q}{T}left( 1 right)$,
где $delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Замечание 1
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW, left( 2 right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
$S_{2}-S_{1}=klnfrac{W_{2}}{W_{1}}left( 2.1 right)$).
«Изменение энтропии» 👇
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$delta Q=dU+pdV, left( 3 right)$,
где $dU$ – изменение внутренней энергии идеального газа; $pdV$=$delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
$frac{delta Q}{T}=C_{V}frac{dT}{T}+frac{p}{T}dVleft( 4 right)$.
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$pV=RTto frac{p}{T}=frac{R}{V}left( 5 right)$.
Учтем:
$frac{dT}{T}=dleft( ln T right),, frac{dV}{V}=dleft( ln V right)left( 6 right)$.
в этом случае мы можем записать для уравнения (4):
$frac{delta Q}{T}=dleft( C_{V}lnT+RlnV right)left( 7 right)$.
По определению (1), и принимая во внимание (7), запишем:
$dS=dleft( C_{V}lnT+RlnV right)left( 8 right)$.
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=dleft( C_{V}lnT+RlnV right)=d(C_{V}lnT)left( 9 right)$.
После интегрирования (9), получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)left( 10 right)$.
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)+Rln {left( frac{V_{2}}{V_{1}} right)left( 11 right).}$
Запишем уравнение адиабатного процесса в параметрах $T,V$:
$T_{1}V_{1}^{gamma -1}=T_{2}V_{2}^{gamma -1}left( 12 right)$.,
где $gamma =frac{C_{p}}{C_{V}}-$ показатель адиабаты. Возьмем натуральные логарифмы от обеих частей выражения (12), имеем:
$ln left( frac{T_{2}}{T_{1}} right)=left( gamma -1 right)ln left( frac{V_{1}}{V_{2}} right)=-left( gamma -1 right)ln left( frac{V_{2}}{V_{1}} right)left( 13 right)$.
Преобразуем выражение (11), приняв во внимание формулу (13):
$S_{2}-S_{1}=C_{V}left[ -left( gamma -1 right)ln left(frac{V_{2}}{V_{1}} right) right]+Rln left( frac{V_{2}}{V_{1}} right)=-C_{V}left( frac{C_{p}}{C_{V}}-1 right)ln left( frac{V_{2}}{V_{1}}right)$
$+Rln {left( frac{V_{2}}{V_{1}} right)=left[ -C_{V}left(frac{C_{p}}{C_{V}}-1 right)+R right]ln {left( frac{V_{2}}{V_{1}}right)=left[ C_{V}-C_{p}+R right]ln left( frac{V_{2}}{V_{1}} right)}}left( 14 right)$.
Вспомним соотношение Майера:
$R=C_{p}-C_{V}left( 15 right)$
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
$S_{2}-S_{1}=0.$
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
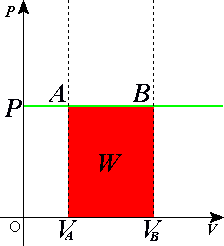
Рассмотрим пример. Два сосуда разного объема содержат по $nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $frac{T_{1}+T_{2}}{2}$. Найдем изменение энтропии каждого из газов по отдельности:
$Delta S_{1}=intlimits_a^b frac{dT}{T} =nu c_{p}ln left(frac{T_{1}+T_{2}}{2T_{1}} right)left( 16 right)$,
где $a=T_{1};b=frac{T_{1}+T_{2}}{2}$ $c_p$ – молярная теплоемкость газа при постоянном давлении.
Изменение энтропии второго газа запишем аналогично:
$Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{2}} right)left( 17right)$.
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
$Delta S_{2}=Delta S_{1}+Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{1}} right)+c_{p}ln left(frac{T_{1}+T_{2}}{2T_{2}} right)=nu c_{p}ln frac{left( T_{1}+T_{2} right)^{2}}{4T_{1}T_{2}}=2nu$ $c_{p}lnleft( frac{T_{1}+T_{2}}{2sqrt {T_{1}T_{2}} } right)$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Таблицы DPVA.ru – Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Изобарный (изобарический) и изохорный процессы. Энтропия, работа, количество теплоты.
|
|||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 сентября 2021 года; проверки требуют 3 правки.
| Статья является частью одноименной серии. |
| Тепловые процессы |
|---|
 |
|
| См. также «Физический портал» |
Изохо́рный, или изохори́ческий проце́сс (от др.-греч. ἴσος — «равный» и χώρος — «место») — термодинамический изопроцесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать или охлаждать вещество в сосуде неизменного объёма.
При изохорическом процессе давление идеального газа прямо пропорционально его температуре (см. Закон Шарля). В реальных газах закон Шарля выполняется приближённо.
На графиках в координатах состояния (



История[править | править код]
Иллюстрация зависимости давления от температуры при постоянном объёме
Наиболее часто первые исследования изохорного процесса связывают с Гийомом Амонтоном. В своей работе «Парижские мемуары» в 1702 году он описал поведение газа в фиксированном объёме[Комм 1] внутри так называемого «воздушного термометра». Жидкость в нём находится в равновесии под воздействием давления газа в резервуаре и атмосферным давлением. При нагревании давление в резервуаре увеличивается, и жидкость вытесняется в выступающую трубку. Зависимость между температурой и давлением была установлена в виде[1][Комм 2]:
В 1801 году Джон Дальтон в двух своих эссе опубликовал эксперимент, в котором установил, что все газы и пары, исследованные им при постоянном давлении, одинаково расширяются при изменении температуры, если начальная и конечная температура одинакова[2][3][4]. Данный закон получил название закона Гей-Люссака, так как Гей-Люссак вскоре провёл самостоятельные эксперименты и подтвердил одинаковое расширение различных газов, причём получив практически тот же самый коэффициент, что и Дальтон[4]. Впоследствии он же объединил свой закон с законом Бойля — Мариотта[5], что позволило описывать в том числе и изохорный процесс.
Термодинамика процесса[править | править код]
График изохорного процесса на диаграмме в координатах
Из определения работы следует, что элементарная работа при термодинамическом процессе равна[6][Комм 3]:
Чтобы определить полную работу процесса проинтегрируем данное выражение[6]:
но, поскольку объём неизменен, то есть 
Это же можно показать на графике изохорного процесса. С математической точки зрения, работа процесса равна площади такого графика[6]. Но график изохорного процесса является прямой перпендикулярной к оси объёма. Таким образом, площадь под ним равна нулю.
Изменение внутренней энергии идеального газа можно найти по формуле[8]:
- где
— число степеней свободы, которое зависит от количества атомов в молекуле газа (3 — для одноатомной (например, неон), 5 — для двухатомной (например, кислород) и 6 — для трёхатомной и более (например, молекула углекислого газа)).
Из определения и формулы теплоёмкости формулу для внутренней энергии можно переписать в виде[8]:
- где
— молярная теплоёмкость при постоянном объёме.
Используя первое начало термодинамики можно найти количество теплоты при термодинамическом процессе[9]:
Но при изохорном процессе газ не выполняет работу[7]. То есть, имеет место равенство:
таким образом, вся теплота, которую получает газ, идёт на изменение его внутренней энергии.
Энтропия при изохорном процессе[править | править код]
Поскольку в системе при изохорном процессе происходит теплообмен с внешней средой, то происходит изменение энтропии. Из определения энтропии следует[10]:
- где
— элементарное количество теплоты[11][Комм 3].
Выше была выведена формула для определения количества теплоты. Если её переписать в дифференциальном виде[12][Комм 4]:
- где
— количество вещества,
— молярная теплоемкость при постоянном объёме.
Микроскопическое изменение энтропии при изохорном процессе можно определить по формуле[12]:
Или, если проинтегрировать последнее выражение, полное изменение энтропии в этом процессе[12]:
В данном случае выносить выражение молярной теплоемкости при постоянном объёме за знак интеграла нельзя, поскольку она является функцией, которая зависит от температуры.
Практическое применение теории изохорного процесса[править | править код]

При идеальном цикле Отто, который приближённо воспроизведён в бензиновом двигателе внутреннего сгорания, такты 2—3 и 4—1 являются изохорными процессами.
Работа, совершаемая на выходе двигателя, равна разности работ, которую произведёт газ над поршнем во время третьего такта (то есть рабочего хода), и работы, которую затрачивает поршень на сжатие газа во время второго такта. Так как в двигателе, работающем по циклу Отто используется система принудительного зажигания смеси, то происходит сжатие газа в 7—12 раз[13].
Анимация классического двигателя Стирлинга с конфигурацией бета-типа, при которой рабочий и вытеснительный поршни скомпонованы в одном цилиндре
В цикле Стирлинга также присутствуют два изохорных такта. Для его осуществления в двигателе Стирлинга добавлен регенератор. Газ, проходя через наполнитель в одну сторону, отдаёт тепло от рабочего тела к регенератору, а при движении в другую сторону отдаёт его обратно рабочему тему[14]. Идеальный цикл Стирлинга достигает обратимости и тех же величин КПД что и цикл Карно[15]. Изохорный процесс – также процесс, протекающий в автоклавах и пьезометрах
См. также[править | править код]
- Молекулярно-кинетическая теория
- Изотермический процесс
- Изобарный процесс
Примечания[править | править код]
Комментарии[править | править код]
Источники[править | править код]
- ↑ Кудрявцев, 1956, с. 292—293.
- ↑ J. Dalton, 1802, с. 550—574.
- ↑ J. Dalton, 1802, с. 595—602.
- ↑ 1 2 Кудрявцев, 1956, с. 393.
- ↑ Кудрявцев, 1956, с. 396.
- ↑ 1 2 3 Савельев, 2001, с. 19—21.
- ↑ 1 2 Савельев, 2001, с. 37.
- ↑ 1 2 Савельев, 2001, с. 61.
- ↑ Савельев, 2001, с. 17.
- ↑ Савельев, 2001, с. 93.
- ↑ Савельев, 2001, с. 18.
- ↑ 1 2 3 Сивухин, 1975, с. 128.
- ↑ Кириллин, 2008.
- ↑ Romanelli, 2017.
- ↑ Крестовников А. Н., Вигдорович В. Н., Химическая термодинамика, 1973, с. 63.
Список литературы[править | править код]
- Кириллин В. А., Сычёв В. В., Шейндлин А. Е. Техническая термодинамика: учебник для вузов. — М.: Издательство МЭИ, 2008. — 496 с. Архивная копия от 24 ноября 2011 на Wayback Machine
- Крестовников А. Н., Вигдорович В. Н. Химическая термодинамика. — 2-е изд., испр. и доп. — М.: Металлургия, 1973. — 256 с.
- Кудрявцев П. С. История физики. — М.: Гос. учебно-педагог. изд-во, 1956. — Т. 1. От античной физики до Менделеева. — 564 с. — 25 000 экз.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — Издание 5-е. — М.: Физматлит, 2005. — 616 с. — («Теоретическая физика», том V). — ISBN 5-9221-0054-8.
- Савельев И. В. Курс общей физики:Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
- Сивухин Д. В. Общий курс физики. — М.: Наука, 1975. — Т. II. Термодинамика и молекулярная физика. — 519 с.
- J. Dalton. 2 // Memoirs of the Literary and Philosophical Society of Manchester. — 1802. — Т. 5. — 701 с.
- Alejandro Romanelli. Alternative thermodynamic cycle for the Stirling machine. — Montevideo, Uruguay: Instituto de Física, Facultad de Ingeniería, 2017.
Основными процессами в термодинамике являются:
- изохорный, протекающий при постоянном объеме;
- изобарный, протекающий при постоянном давлении;
- изотермический, происходящий при постоянной температуре;
- адиабатный, при котором теплообмен с окружающей средой отсутствует;
- политропный, удовлетворяющий уравнению pvn= const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p—v иT—s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
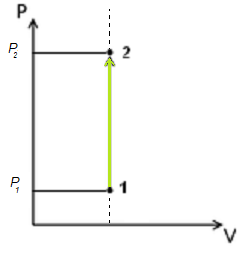
Изохорный процесс

Изохорный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT) следует:
p/T = R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p2/p1 = T2/T1.
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при cv = const определяется по формуле:
q= cv(T2 — T1).
Т. к.l = 0, то на основании первого закона термодинамики Δu = q, а значит изменение внутренней энергии можно определить по формуле:
Δu = cv(T2 — T1).
Изменение энтропии в изохорном процессе определяется по формуле:
s2 – s1= Δs = cvln(p2/p1) = cvln(T2/T1).
Изобарный процесс
Изобарный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v/T = R/p = const
или
v2/v1 = T2/T1,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l = p(v2 – v1).
Т. к. pv1 = RT1 и pv2 = RT2, то
l = R(T2 – T1).
Количество теплоты при cp = const определяется по формуле:
q = cp(T2 – T1).
Изменение энтропии будет равно:
s2 – s1= Δs = cpln(T2/T1).
Изотермический процесс
Изотермический процесс в p, v— , T, s— и i, s-координатах (диаграммах)
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
или
p2/p1 = v1/v2,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l = RTln (v2 – v1) = RTln (p1 – p2).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q = l.
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s2 – s1= Δs = Rln(p1/p2) = Rln(v2/v1).
Адиабатный процесс
Адиабатный процесс в p, v— , T, s— и i, s-координатах (диаграммах)
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du + pdv = 0
или
Δu+ l = 0,
следовательно
Δu= —l.
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через cад, и условие dq = 0 выразим следующим образом:
dq = cадdT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (cад = 0).
Известно, что
сp/cv = k
и уравнение кривой адиабатного процесса (адиабаты) в p, v-диаграмме имеет вид:
pvk = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
kвоздуха = 1,4
kперегретого пара = 1,3
kвыхлопных газов ДВС = 1,33
kнасыщенного влажного пара = 1,135
Из предыдущих формул следует:
l= — Δu = cv(T1 – T2);
i1 – i2= cp(T1 – T2).
Техническая работа адиабатного процесса (lтехн) равна разности энтальпий начала и конца процесса (i1 – i2).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным. В T, s-диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом.
Политропный процесс
Политропным называется процесс, который описывается уравнением:
pvn= const.
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p, vи Tв любых двух точках на политропе:
p2/p1 = (v1/v2)n; T2/T1 = (v1/v2)n-1; T2/T1 = (p2/p1)(n-1)/n.
Работа расширения газа в политропном процессе равна:
В случае идеального газа эту формулу можно преобразовать:
Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
q = (u2 – u1) + l.
Поскольку
представляет собой теплоемкость идеального газа в политропном процессе.
При cv, k и n = const cn = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p, v координатах в зависимости от показателя политропа n.
pv0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p0v = const, p1/∞v = const, pv∞ = const – изохора;
pvk = const (n = k) – адиабата.
n > 0 – гиперболические кривые,
n < 0 – параболы.
По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. — М. :КНОРУС, 2011. — 352 с.


 редняя
редняя редняя
редняя сновное
сновное
 Изохорный процесс происходит при постоянном объёме, при этом давление идеального газа прямо пропорционально его температуре
Изохорный процесс происходит при постоянном объёме, при этом давление идеального газа прямо пропорционально его температуре







































