Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
- физике;
- химии;
- билогии;
- космологии;
- теории информации.
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Определение 1
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
$dS=frac{delta Q}{T}left( 1 right)$,
где $delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Замечание 1
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW, left( 2 right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
$S_{2}-S_{1}=klnfrac{W_{2}}{W_{1}}left( 2.1 right)$).
«Изменение энтропии» 👇
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$delta Q=dU+pdV, left( 3 right)$,
где $dU$ – изменение внутренней энергии идеального газа; $pdV$=$delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
$frac{delta Q}{T}=C_{V}frac{dT}{T}+frac{p}{T}dVleft( 4 right)$.
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$pV=RTto frac{p}{T}=frac{R}{V}left( 5 right)$.
Учтем:
$frac{dT}{T}=dleft( ln T right),, frac{dV}{V}=dleft( ln V right)left( 6 right)$.
в этом случае мы можем записать для уравнения (4):
$frac{delta Q}{T}=dleft( C_{V}lnT+RlnV right)left( 7 right)$.
По определению (1), и принимая во внимание (7), запишем:
$dS=dleft( C_{V}lnT+RlnV right)left( 8 right)$.
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=dleft( C_{V}lnT+RlnV right)=d(C_{V}lnT)left( 9 right)$.
После интегрирования (9), получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)left( 10 right)$.
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)+Rln {left( frac{V_{2}}{V_{1}} right)left( 11 right).}$
Запишем уравнение адиабатного процесса в параметрах $T,V$:
$T_{1}V_{1}^{gamma -1}=T_{2}V_{2}^{gamma -1}left( 12 right)$.,
где $gamma =frac{C_{p}}{C_{V}}-$ показатель адиабаты. Возьмем натуральные логарифмы от обеих частей выражения (12), имеем:
$ln left( frac{T_{2}}{T_{1}} right)=left( gamma -1 right)ln left( frac{V_{1}}{V_{2}} right)=-left( gamma -1 right)ln left( frac{V_{2}}{V_{1}} right)left( 13 right)$.
Преобразуем выражение (11), приняв во внимание формулу (13):
$S_{2}-S_{1}=C_{V}left[ -left( gamma -1 right)ln left(frac{V_{2}}{V_{1}} right) right]+Rln left( frac{V_{2}}{V_{1}} right)=-C_{V}left( frac{C_{p}}{C_{V}}-1 right)ln left( frac{V_{2}}{V_{1}}right)$
$+Rln {left( frac{V_{2}}{V_{1}} right)=left[ -C_{V}left(frac{C_{p}}{C_{V}}-1 right)+R right]ln {left( frac{V_{2}}{V_{1}}right)=left[ C_{V}-C_{p}+R right]ln left( frac{V_{2}}{V_{1}} right)}}left( 14 right)$.
Вспомним соотношение Майера:
$R=C_{p}-C_{V}left( 15 right)$
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
$S_{2}-S_{1}=0.$
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $frac{T_{1}+T_{2}}{2}$. Найдем изменение энтропии каждого из газов по отдельности:
$Delta S_{1}=intlimits_a^b frac{dT}{T} =nu c_{p}ln left(frac{T_{1}+T_{2}}{2T_{1}} right)left( 16 right)$,
где $a=T_{1};b=frac{T_{1}+T_{2}}{2}$ $c_p$ – молярная теплоемкость газа при постоянном давлении.
Изменение энтропии второго газа запишем аналогично:
$Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{2}} right)left( 17right)$.
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
$Delta S_{2}=Delta S_{1}+Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{1}} right)+c_{p}ln left(frac{T_{1}+T_{2}}{2T_{2}} right)=nu c_{p}ln frac{left( T_{1}+T_{2} right)^{2}}{4T_{1}T_{2}}=2nu$ $c_{p}lnleft( frac{T_{1}+T_{2}}{2sqrt {T_{1}T_{2}} } right)$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Изменение энтропии в процессе изотермического расширения идеального газа
При
условии Т = const
из уравнения (14) получаем
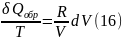
Поскольку
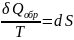
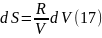
Уравнения
(16), (17) и есть искомые уравнения, описывающие
изменение энтропии при изотермическом
расширении идеального газа. Их можно
получить и более последовательно, исходя
из выражения первого закона термодинамики
для обратимых процессов (12). Поскольку
внутренняя энергия идеального газа
зависит только от температуры, при Т =
const
dU
= 0 и
δQобр
=
PdV
PdV
= δWобр
Таким
образом для работы изотермического
расширения идеального газа
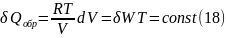
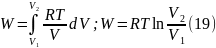
Из
соотношений (18), (19) следуют две особенности
изотермического расширения идеального
газа: во-первых, работа, вычисляемая по
уравнению (19) – это работа равновесного
процесса;
и во-вторых, в этом процессе подводимая
из вне теплота полностью расходуется
на производство работы.
Разделив
соотношение (18) почленно на Т имеем
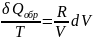
что
ведет к уравнению (16). В интегральном
виде
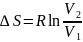
Исходя
из уравнения (16) можно получить соотношение,
которое описывает изменение энтропии
через параметр Р. Из уравнения состояния
идеального газа при постоянной температуре
имеем
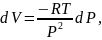
что
в сочетании с (16) дает
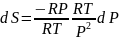
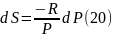
Из
уравнения (17)
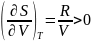
Положительное
значение производной означает, что
энтропия идеального газа при постоянной
Т монотонно возрастающая функция объема.
И наоборот
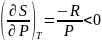
В
этом случае при Т = const
энтропия убывает при увеличении давления.
Оба эти следствия находятся в определенной
согласованности с физической интерпретацией
энтропии как меры беспорядка.
При
интегрировании (20)
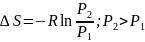
Уравнения
(17), (20) описывают изменение энтропии при
любой произвольной температуре Т,
которая постоянна. Хотя Т в явном виде
не входит в эти соотношения они справедливы
при условии, что температура в начале
и конце процесса одна и та же.
Уравнения
(17), (20) можно получить и более общим
путем, не касаясь конкретных равновесных
процессов. Из объединенного выражения
первого и второго законов термодинамики,
которое рассматривается ниже, для
произвольного равновесного процесса
следует, что для чистого вещества в
любом агрегатном состоянии
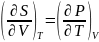
или

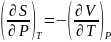
и
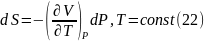
Уравнения
(21) и (22) в самом общем виде описывают
зависимость энтропии чистых веществ
от объема и давления при постоянной
температуре.
Используя
уравнение состояния идеального газа
получаем (17) и (20).
Поскольку
для чистого вещества
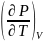
и
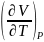
– сугубо положительные величины, из
уравнений следует, что для чистого
вещества в любом агрегатном состоянии
энтропия возрастает с увеличением
объема и понижается с повышением
давления.
Изменение изменения энтропии в неравновесных процессах
В
основе этого определения лежит соотношение
∆Sнеобр
= ∆Sобр
(23)
Для
определения ∆S
в
необратимом процессе необходимо
сконструировать виртуальный процесс,
протекающий равновесно, для которого
известны физико-математические уравнения,
подобные () – (), позволяющие вычислить
изменение энтропии.
Соотношение
типа (23) справедливо для изменения любого
свойства системы, например, U,
H,
температуры или объема. Но в отличие от
S
изменение энтальпии и внутренней энергии
в некоторых необратимых процессах,
например, в химических реакциях, можно
определить экспериментально по теплоте
реакции. Поэтому в этом случае отсутствует
необходимость в построении равновесного
процесса. С другой стороны изменение
энтропии в неравновесных процессах не
связано точным соотношением с каким-либо
экспериментально определяемым эффектом.
Это обстоятельство ведет к необходимости
вычислять изменение энтропии в реальных
процессах по ее изменению в равновесном
процессе.
В
связи с этим целесообразно сделать
следующее замечание. Способ соединения
конечных и начальных состояний в
неравновесных процессах с помощью
совокупности квазистатических процессов
не требует, чтобы последние проходили
в тех же условиях, что и реальный процесс.
Можно воспользоваться любым квазистатическим
способом, для которого существует
математическое описание. Главное условие
состоит в том, что параметры состояния
в начале и конце квазистатического
процесса (или их совокупности) были бы
такие же как и обычном процессе. По этому
поводу русский физик К. Путилов писал:
«В термодинамике допустимо пользоваться
какими угодно воображаемыми
идеализированными по своим свойствам
телами и приспособлениям без риска,
применяя эти представления в рассуждениях
прийти к невероятным результатам, если
предварительно доказано, что их
реализация, как бы ни были неправдоподобны
их свойства, не противоречили бы ни
первому, ни второму началу термодинамики.
Условие, что изменение функций состояния
в равновесных и неравновесных процессах
равны между собой, если параметры
конечных и начальных состояний в этих
процессах одинаково базируются на этих
началах и на математических свойствам
функций состояния».
В
качестве примера рассмотрим вычисление
энтропии в неравновесном процессе
изотермического расширения идеального
газа. Схема его проведения как равновесного
процесса рассмотрена в разделе 1. Заметим,
что в этом случае изменение энтропии
системы равно: ∆S
=
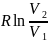
.
С другой стороны изменение энтропии
окружающей среды (теплоисточника) при
Т = const
в соответствии с концепцией Планка
∆Sокр
=
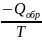
где
Qобр
–
теплота, переходимая от теплоисточника
к системе в процессе равновесного
расширения.
В
силу равенства
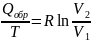
суммарное
изменение энтропии системы и окружающей
среды равно нулю
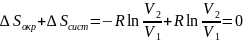
В
этом же разделе описано неравновесное
изотермическое расширение идеального
газа. В этом случае Wравн
=
Wнеравн,
где
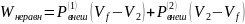
Но
поскольку S
– функция состояния, то и в этом случае
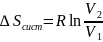
как в равновесном процессе.
Видоизменим
условие проведения неравновесного
процесса. Примем (раздел1, рис. 1), что
поршень закреплен в исходном состоянии
(Т, V1,
P1)
ограничительными устройствами (рис.
3). Кроме того поршень имеет сквозное
отверстие закрытое тонким металлическим
кругом (чтобы не оказывать существенного
влияния на объем V2
–
V1).
В положении V2
также
находится поршень с ограничительным
устройством. Далее примем, что из объема
∆V
= V2
–
V1
откачан воздух до очень низкого давления.
Объем с очень низким давлением газа
обычно называют пустотой.
V2
а



∆V
=
V2
− V1
∆V
=
V2
− V1
а
V1

б![]()
Т
V1
Р1

Рис.3
Схема процесса расширения идеального
газа в пустоту
а)
ограничительные устройства, б) тонкий
металлический круг
Передвигая
металлический круг можно достичь
состояния, когда отверстие в поршне
соединит объемы ∆V
и V1.
В результате произойдет самопроизвольный
неравновесный процесс расширения
идеального газа из объема V1
в пустоту.
Процесс
проходит без совершения объемной работы,
поскольку отсутствуют внешние силы
сопротивления, на преодоление которых
была бы направлена работа
W
= 0
По
этой причине количество теплоты
поступившей от теплоисточника также
равно нулю.
Внутренняя
энергия идеального газа функция только
температуры и не зависит ни от объема,
ни от давления. Поэтому температура
идеального газа в конце расширения газа
в пустоту будет такой же как и в начале
процесса. В этом еще раз можно убедиться,
если исходить из первого закона
термодинамики: PdV
= 0; δQ
= 0; dU
= 0
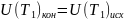
где
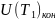
– внутренняя энергия идеального газа
в конечном состоянии;

– внутренняя энергия в исходном
состоянии. Из приведенного рассмотрения
следует, что расширение идеального газа
в пустоту – изотермический процесс*.
Таким образом, изменение энтропии при
расширении идеального газа в пустоту
можно вычислить по любому из уравнений,
рассмотренных выше
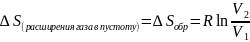
Поскольку
теплота, поступающая из окружения равна
нулю то и
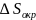
=
0. Поэтому изменение общей энтропии при
расширении идеального газа в пустоту
определяется соотношением
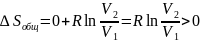
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Мы уже решали задачи на первый закон термодинамики. Как известно, где первый – там и второй. В сегодняшней статье занимаемся физикой и разбираем примеры задач на второе начало термодинамики.
Хотите ежедневно получать интересную и полезную для студентов рассылку? Присоединяйтесь к нам в телеграме.
Второй закон термодинамики: задачи с решениями
Задача на второй закон термодинамики №1
Условие
Определить изменение энтропии 14 г азота при изобарном нагревании eгo oт 27°C дo 127°C.
Решение
Изменение энтропии вычисляем по формуле:
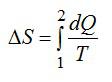
Для элементарного количества теплоты в изобарном процессе можно записать:
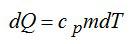
Удельная теплоемкость при постоянном давлении:
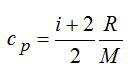
Для двухатомного газа число степеней свободы молекулы i=5 (три поступательных и две вращательных).
С учетом сказанного, формулу для энтропии можно переписать так:
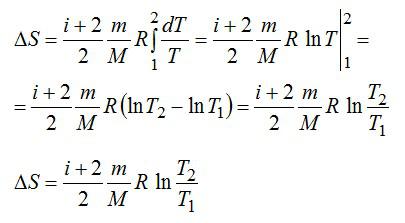
Выполним проверку размерности и подставим значения, не забывая переводить Цельсии в Кельвины:
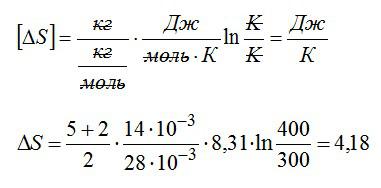
Ответ: 4,18 кДж/К.
Задача на второй закон термодинамики №2
Условие
1 кмоль гелия, изобарически расширяясь, увеличил объем в 4 раза. Найти изменение энтропии при этом расширении.
Решение
Изменение энтропии:
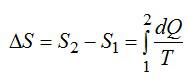
При постоянном давлении (в изобарном процессе) элементарное количество теплоты, полученное газом при температуре Т и молярная теплоемкость, запишутся так:
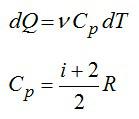
где ν – число молей газа, i – число степеней свободы молекулы газа (для молекулы инертного газе Не i=3). С учетом этого можно записать выражение для изменения энтропии:
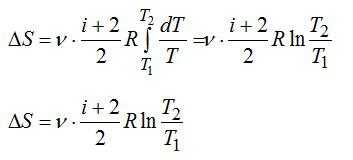
При изобарном процессе справедлив закон Гей-Люссака:
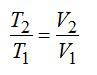
По условию задачи:
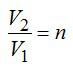
Решая уравнения, получаем ответ:
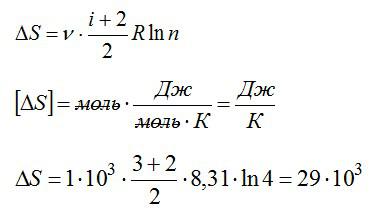
Ответ: 29 Дж/К.
Задача на второй закон термодинамики №3
Условие
С идеальным газом определенного числа молей последовательно провели два процесса, указанных на рисунке. Какое приращение энтропии в результате получили? Считать, что число степеней свободы молекулы газа равно i.
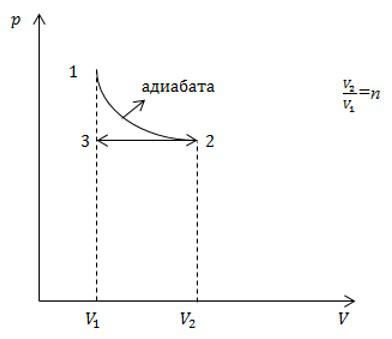
Решение
Процесс 1-2 является адиабатным. Энтропия в адиабатном процессе не изменяется, следовательно, изменение энтропии происходит только в процессе 2-3, который является изобарным. Запишем в соответствии со вторым началом термодинамики:
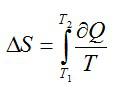
Теперь запишем первое начало термодинамики для изобарного процесса:
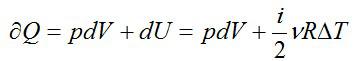
Давление в процессе остается постоянным, поэтому:
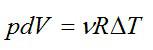
Подставим это выражение в выражение для энтропии, и с учетом первого начала, запишем:
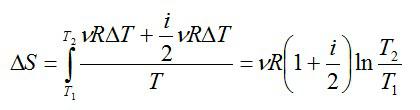
Для изобарного процесса выполняется закон Гей-Люссака:
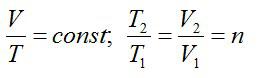
С учетом этого, запишем окончательное решение:
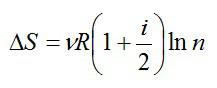
Ответ: см. выше.
Задача на второй закон термодинамики №4
Условие
Найдите изменение энтропии двухатомного азота массой 0,560 кг при изотермическом расширении. Известно, что объем увеличился в 5 раз.
Решение
Запишем первое начало термодинамики для изотермического процесса:
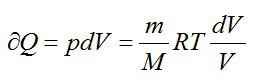
Изменение энтропии вычислим следующим образом:
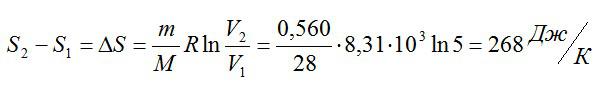
Ответ: 268 Дж/К.
Задача на второй закон термодинамики №5
Условие
Как изменилась энтропия воды массой 0,1 кг при ее охлаждении с Т1=293 К до Т2=273 К?
Решение
Изменение энтропии находим в соответствии со вторым началом термодинамики:
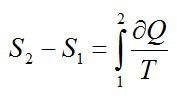
Считая, что изменение происходит при постоянном объеме, для элементарного этапа можно записать:
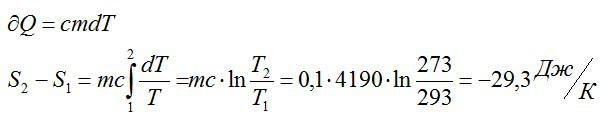
Ответ: -29,3 Дж/ К.
Вопросы на 2 закон термодинамики
Вопрос 1. Сформулируйте второй закон (второе начало) термодинамики.
Ответ. Второй закон термодинамики устанавливает:
В изолированных системах самопроизвольно могут протекать только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Второе начало термодинамики имеет несколько формулировок, первая из которых принадлежит Сади Карно. Вот пример второго закона термодинамики в его формулировке: теплота не может самоприозвольно переходить от холодного (менее нагретого) тела к горячему (более нагретому).
Хотите больше объяснений и примеров второго закона термодинамики? Читайте нашу отдельную статью на эту тему.
Вопрос 2. Что такое энтропия?
Ответ. Энтропия – физическая величина, одна из функций состояния термодинамической системы. Приращение энтропии вычисляется по формуле:
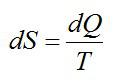
Энтропия показывает направление процессов и является мерой неупорядоченности в системе. Например, сахар в стакане лежит в виде кусочка, а потом его размешивают по всему стакану. В первом случае энтропия мала, а во втором – велика.
Вопрос 3. Что такое вечный двигатель второго рода?
Ответ. Вечный двигатель второго рода, или перпетум мобиле второго рода – это такая тепловая машина, которая превращает всю теплоту, полученную от нагревателя, в работу. По сути, это тепловая машина, которая работает без холодильника, а коэффициент ее полезного действия равен единице.
Эмпирически установлено, что создание такой машины невозможно.
Вопрос 4. Сформулируйте постулат второго начала термодинамики.
Ответ. Это постулат, вытекающий из невозможности построения вечного двигателя второго рода:
Невозможен круговой процесс, единственным результатом которого было бы произведение работы за счет охлаждения теплового резервуара.
Данная формулировка принадлежит Томсону.
Вопрос 5. Что такое тепловая смерть Вселенной?
Ответ. Это гипотеза, предложенная Клаузиусом в 1865 году. Главная ее идея состоит в том, что энтропия Вселенной, согласно 2 началу термодинамики, постоянно растет. Это значит, что со временем все макроскопические процессы прекратятся, и Вселенная придет в состояние термодинамического равновесия с температурой абсолютного нуля. Данная гипотеза считается ошибочной, так как Больцман объяснил, что Вселенную нельзя рассматривать как замкнутую систему.
Нужна помощь в решении задач на 2 закон термодинамики и написании студенческих работ? Обращайтесь в проверенный студенческий сервис с любыми заданиями в любое время.

