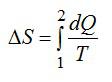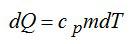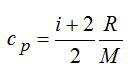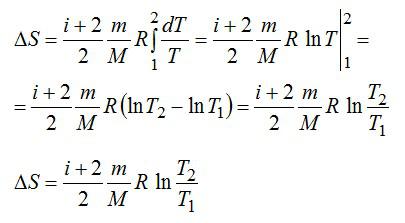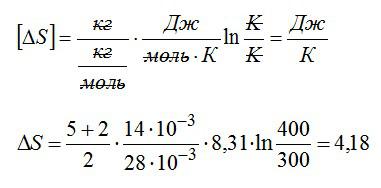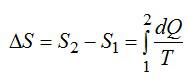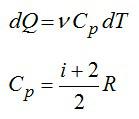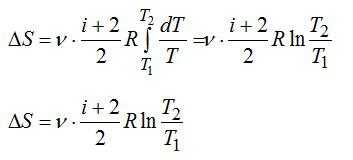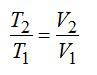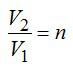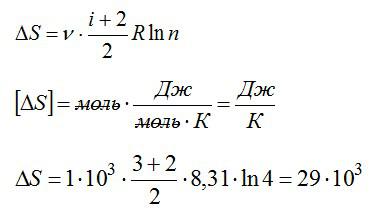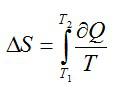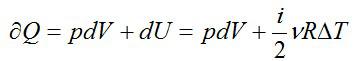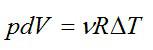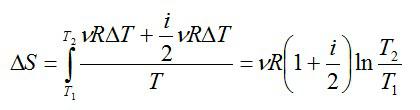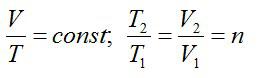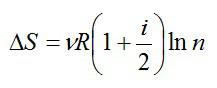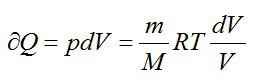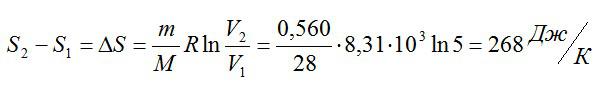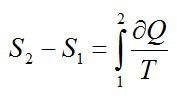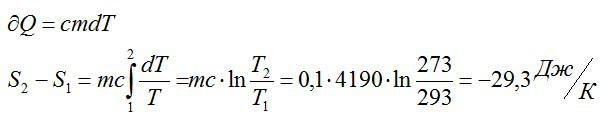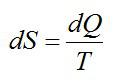∆Sист = ∆Sхол ,аизменениеэнтропиисистемыбудетравнонулю.Ра-
венство Т1 и Т2 в процессе теплообмена указывает на обратимость процесса (4.4).
Изменение энтропии при нагревании (или охлаждении) различных веществот температуры Т1 до Т2 припостоянном объеме или постоянном давлении определяется из уравнения (4.7). Принимая во внимание, что δQV = nCV dT , δQp = nC p dT получаем
|
T2 |
C |
(4.10) |
||
|
∆S = n ∫ |
V dT , |
|||
|
T1 |
T |
|||
|
T |
C p |
|||
|
∆S = n ∫2 |
dT , |
(4.11) |
||
|
T1 |
T |
а интегрирование при условии СV = const или Cp = const дает
V T1
∆S = nC p ln T2 , T1
где n – число моль веществ.
Учитывая зависимость теплоемкости от температуры
C = a + bT + cT 2
или
C = a + bT + c′T -2,
уравнения (4.10) и (4.11) записываются в виде
|
∆S = nT∫2(a + bT + cT 2 )dT |
|||||
|
T1 |
T |
||||
|
или |
) |
||||
|
T2 |
′ |
−2 |
dT |
, |
|
|
∆S = n ∫(a +bT +c T |
T |
||||
|
T1 |
|||||
(4.13)
(4.14)
(4.15)
(4.16)
(4.17)
и после интегрирования представляются в виде следующих формул для расчета ∆S :
71

|
T2 |
с |
(4.18) |
|||||||||
|
∆S = n a ln |
+b(T2 −T1) + |
(T22 −T12 ) |
|||||||||
|
T1 |
2 |
||||||||||
|
или |
|||||||||||
|
T2 |
1 |
1 |
|||||||||
|
∆S = n a ln |
+b(T2 −T1) + c′( |
− |
) . |
(4.19) |
|||||||
|
T |
T |
T |
|||||||||
|
1 |
1 |
2 |
4.1.2. Расчет энтропии при фазовых переходах
При фазовых переходах (плавлении, испарении и т.д.), если сохраняется постоянным давление, изменение энтропии (с учетом уравнения (4.8) и постоянства температуры при фазовых переходах) рассчитывается по формуле
|
∆S = |
∆Hф.п. |
, |
(4.20) |
|
|
Т |
||||
где ∆Hф.п. – теплота фазового перехода. Для n моль формула (4.20) переписывается в виде
|
∆S = |
n∆Hф.п. |
. |
(4.21) |
|
|
Т |
||||
В общем случае для обратимого процесса при постоянном объеме, когда изменение внутренней энергии равно U, или при постоянном давлении, когда изменение энтальпии равно Н, изменение
энтропии равно:
|
∆S = |
∆U |
(при V = const), ∆S = |
∆H |
(при р = соnst). |
(4.22) |
|
|
T |
T |
|||||
4.1.3. Изменение энтропии идеального газа. Диффузия газов
Изменение энтропии при переходе n моль идеального газа из одного состояния в другое вычисляется из объединенного уравнения I и II законов термодинамики:
|
TdS = dU + pdV |
(4.23) |
||
|
или, учитывая, что dU = nCV dT , p = nRT V |
|||
|
dS = nC |
dT |
+nR dV . |
(4.24) |
|
V |
T |
V |
При интегрировании, допуская постоянство теплоемкости, имеем
72

|
∆S = n C |
ln |
Т2 |
+ R ln V2 |
(4.25) |
|||
|
V |
Т |
V |
|||||
|
1 |
1 |
или, заменяя V2 = p1 , СV на Cp, получаем
V1 p2
|
∆S = n C |
ln Т2 |
+ Rln |
p1 |
|||
|
p |
. |
(4.26) |
||||
|
Т1 |
p2 |
|||||
Учитывая зависимость теплоемкости от температуры, получаем уравнения (4.27) и (4.28):
|
∆S = n aln |
T2 |
+b(T |
−T ) + |
с |
(T 2 |
−T 2 ) + Rln V2 |
, |
(4.27) |
||||||
|
2 |
||||||||||||||
|
T |
2 |
1 |
2 |
1 |
V |
|||||||||
|
1 |
1 |
|||||||||||||
|
∆S = n aln T2 |
+b(T |
−T ) + |
с |
(T 2 |
−T 2 ) + Rln |
p1 |
||||||||
|
T |
2 |
1 |
2 |
2 |
1 |
p |
. |
(4.28) |
||||||
|
1 |
2 |
Используя соотношение T2 = p2V2 , энтропию идеального газа
T1 p1V1
можно рассчитать по формуле
|
∆S = n C ln |
p2 |
+C |
ln V2 |
|||||
|
p |
P |
. |
(4.29) |
|||||
|
V |
V |
|||||||
|
1 |
1 |
Изменение энтропии при адиабатическом расширении идеального газа определяют по уравнению
|
p V γ |
||||||
|
∆S = nC |
ln |
2 |
2 |
, |
(4.30) |
|
|
p V γ |
||||||
|
V |
||||||
|
1 |
1 |
где γ = Сp .
СV
Изменение энтропии для процессов изотермического расширения илисжатияможнорассчитать,используяуравненияМаксвелла*** (1):
*** Соотношения Максвелла (см. раздел 5.2)
73
|
∂S |
∂p |
||||||||||||
|
= |
. |
||||||||||||
|
∂V T |
∂T |
V |
|||||||||||
|
Тогда |
|||||||||||||
|
V2 |
∂S |
V2 |
∂p |
||||||||||
|
∆S = ∫ |
dV = ∫ |
dV . |
|||||||||||
|
V |
∂V |
V |
∂T |
||||||||||
|
1 |
T |
1 |
V |
||||||||||
|
Так как p = n |
RT |
, |
|||||||||||
|
V |
∆S = nR ln V2 . V1
Если использовать уравнение Максвелла (2):
|
∂S |
∂V |
, |
||
|
= − |
||||
|
∂T p |
||||
|
∂p T |
(4.31)
(4.32)
(4.33)
(4.34)
тогда
|
p2 |
∂S |
p2 |
∂V |
p1 |
|||||||
|
∆S = ∫ |
dp = − ∫ |
dP = nR ln |
. |
(4.35) |
|||||||
|
p2 |
|||||||||||
|
p |
∂p |
p |
∂T |
p |
|||||||
|
1 |
T |
1 |
Этот же результат можно получить, если воспользоваться выражением для теплоты изотермического обратимого расширения идеального газа (табл. 3.1)
Qобр = nRT ln(V2 

Подставляя его в (4.8) получаем
|
∆S = |
Q |
= nRT ln(V2 /V1) = nR ln V2 |
, |
(4.36) |
|||
|
T |
T |
V |
|||||
|
1 |
|||||||
|
∆S = nRT ln( p1 / p2 ) = nR ln |
p1 |
. |
(4.37) |
||||
|
T |
p2 |
||||||
|
В процессе |
диффузии при |
смешении |
идеальных |
газов (при |
р = соnst и T = const), т.е. в изобарно – изотермическом процессе изменение энтропии вычисляется по уравнению
|
∆S = n R ln |
V |
+ n |
2 |
R ln |
V |
(4.38) |
|
|
1 |
V1 |
V2 |
|||||
или
74
Необратимый процесс замерзания воды при температуре –3 °С можно представить в виде последовательности обратимых процессов:
1) нагревание воды от –3 °С до температуры замерзания (0 °С);
2) замерзание воды при 0 °С;
3) охлаждение льда от 0 до –3 °С. Т.к. энтропия – функция состояния, общее изменение энтропии равно сумме по этим трем процессам:
∆Sобщ. = ∆S1 + ∆S2 + ∆S3.
1. ∆S1 = cрln(Т2/T1) = 75,3ln(273/270) = 0,832 Дж/(моль * К).
2. ∆S3 = cрln(T1/T2) = 34,7ln(270/273) = -0,383 Дж/(моль * К).
3. ∆S2 = ∆Н°пл./Тзам. = -6010/273 = -22,014 Дж/(моль * К).
4. ∆Sобщ. = ∆S1 + ∆S2 + ∆S3 = 0,832 + -0,383 + -22,014 = -21,564 Дж/(моль * К).
Таким образом, энтропия при замерзании убывает, хотя процесс самопроизвольный. Это связано с тем, что в окружающую среду выделяется теплота и энтропия окружающей среды увеличивается, причем это увеличение больше, чем 21,564 Дж/К, как и полагается в необратимом процессе.
http://buzani.ru/
Мы уже решали задачи на первый закон термодинамики. Как известно, где первый – там и второй. В сегодняшней статье занимаемся физикой и разбираем примеры задач на второе начало термодинамики.
Хотите ежедневно получать интересную и полезную для студентов рассылку? Присоединяйтесь к нам в телеграме.
Второй закон термодинамики: задачи с решениями
Задача на второй закон термодинамики №1
Условие
Определить изменение энтропии 14 г азота при изобарном нагревании eгo oт 27°C дo 127°C.
Решение
Изменение энтропии вычисляем по формуле:
Для элементарного количества теплоты в изобарном процессе можно записать:
Удельная теплоемкость при постоянном давлении:
Для двухатомного газа число степеней свободы молекулы i=5 (три поступательных и две вращательных).
С учетом сказанного, формулу для энтропии можно переписать так:
Выполним проверку размерности и подставим значения, не забывая переводить Цельсии в Кельвины:
Ответ: 4,18 кДж/К.
Задача на второй закон термодинамики №2
Условие
1 кмоль гелия, изобарически расширяясь, увеличил объем в 4 раза. Найти изменение энтропии при этом расширении.
Решение
Изменение энтропии:
При постоянном давлении (в изобарном процессе) элементарное количество теплоты, полученное газом при температуре Т и молярная теплоемкость, запишутся так:
где ν – число молей газа, i – число степеней свободы молекулы газа (для молекулы инертного газе Не i=3). С учетом этого можно записать выражение для изменения энтропии:
При изобарном процессе справедлив закон Гей-Люссака:
По условию задачи:
Решая уравнения, получаем ответ:
Ответ: 29 Дж/К.
Задача на второй закон термодинамики №3
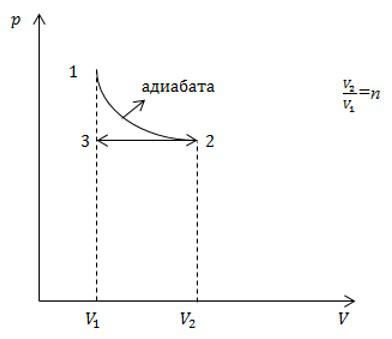
Условие
С идеальным газом определенного числа молей последовательно провели два процесса, указанных на рисунке. Какое приращение энтропии в результате получили? Считать, что число степеней свободы молекулы газа равно i.
Решение
Процесс 1-2 является адиабатным. Энтропия в адиабатном процессе не изменяется, следовательно, изменение энтропии происходит только в процессе 2-3, который является изобарным. Запишем в соответствии со вторым началом термодинамики:
Теперь запишем первое начало термодинамики для изобарного процесса:
Давление в процессе остается постоянным, поэтому:
Подставим это выражение в выражение для энтропии, и с учетом первого начала, запишем:
Для изобарного процесса выполняется закон Гей-Люссака:
С учетом этого, запишем окончательное решение:
Ответ: см. выше.
Задача на второй закон термодинамики №4
Условие
Найдите изменение энтропии двухатомного азота массой 0,560 кг при изотермическом расширении. Известно, что объем увеличился в 5 раз.
Решение
Запишем первое начало термодинамики для изотермического процесса:
Изменение энтропии вычислим следующим образом:
Ответ: 268 Дж/К.
Задача на второй закон термодинамики №5
Условие
Как изменилась энтропия воды массой 0,1 кг при ее охлаждении с Т1=293 К до Т2=273 К?
Решение
Изменение энтропии находим в соответствии со вторым началом термодинамики:
Считая, что изменение происходит при постоянном объеме, для элементарного этапа можно записать:
Ответ: -29,3 Дж/ К.
Вопросы на 2 закон термодинамики
Вопрос 1. Сформулируйте второй закон (второе начало) термодинамики.
Ответ. Второй закон термодинамики устанавливает:
В изолированных системах самопроизвольно могут протекать только такие процессы, при которых энтропия системы возрастает, и процесс может идти самопроизвольно до такого состояния, при котором энтропия обладает максимальным для данных условий значением.
Второе начало термодинамики имеет несколько формулировок, первая из которых принадлежит Сади Карно. Вот пример второго закона термодинамики в его формулировке: теплота не может самоприозвольно переходить от холодного (менее нагретого) тела к горячему (более нагретому).
Хотите больше объяснений и примеров второго закона термодинамики? Читайте нашу отдельную статью на эту тему.
Вопрос 2. Что такое энтропия?
Ответ. Энтропия – физическая величина, одна из функций состояния термодинамической системы. Приращение энтропии вычисляется по формуле:
Энтропия показывает направление процессов и является мерой неупорядоченности в системе. Например, сахар в стакане лежит в виде кусочка, а потом его размешивают по всему стакану. В первом случае энтропия мала, а во втором – велика.
Вопрос 3. Что такое вечный двигатель второго рода?
Ответ. Вечный двигатель второго рода, или перпетум мобиле второго рода – это такая тепловая машина, которая превращает всю теплоту, полученную от нагревателя, в работу. По сути, это тепловая машина, которая работает без холодильника, а коэффициент ее полезного действия равен единице.
Эмпирически установлено, что создание такой машины невозможно.
Вопрос 4. Сформулируйте постулат второго начала термодинамики.
Ответ. Это постулат, вытекающий из невозможности построения вечного двигателя второго рода:
Невозможен круговой процесс, единственным результатом которого было бы произведение работы за счет охлаждения теплового резервуара.
Данная формулировка принадлежит Томсону.
Вопрос 5. Что такое тепловая смерть Вселенной?
Ответ. Это гипотеза, предложенная Клаузиусом в 1865 году. Главная ее идея состоит в том, что энтропия Вселенной, согласно 2 началу термодинамики, постоянно растет. Это значит, что со временем все макроскопические процессы прекратятся, и Вселенная придет в состояние термодинамического равновесия с температурой абсолютного нуля. Данная гипотеза считается ошибочной, так как Больцман объяснил, что Вселенную нельзя рассматривать как замкнутую систему.
Нужна помощь в решении задач на 2 закон термодинамики и написании студенческих работ? Обращайтесь в проверенный студенческий сервис с любыми заданиями в любое время.
Андрей Геннадьевич Блохин
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Энтропия – это фундаментальная физическая величина. Введение этого понятия завершило этап становления понятийного аппарата термодинамики. Следующим этапом развития этой науки было выяснение физического смысла энтропии.
Установление принципа Больцмана (формулы Больцмана) и таким образом связи между термодинамикой и статистической физикой, позволило энтропии покинуть пределы физики и войти в другие области знаний.
Энтропия – это общезначимое понятие, применяемое во множестве наук, например, в:
- физике;
- химии;
- билогии;
- космологии;
- теории информации.
Введено это понятие было Р. Клаузиусом. Важные работы посвятил энтропии Л. Больцман, М. Планк.
Определение 1
Функция состояния полным дифференциалом которой является δQ/T называется энтропией ($S$):
$dS=frac{delta Q}{T}left( 1 right)$,
где $delta Q$ – элементарное тело, получаемое термодинамической системой; $T$- термодинамическая температура.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
Замечание 1
Отметим, что формула (1) справедлива только для обратимых процессов. Например, для процессов, проводимых в идеальном газе.
Важно, что выражение (1) определяет не саму энтропию, а ее изменение, или разность энтропий. При помощи данной формулы можно вычислить, каково изменение энтропии, если термодинамическая система переходит из одного состояния в другое, но нельзя понять, какова энтропия каждого из этих состояний.
Напомним формулу Больцмана для энтропии, так как она нам поможет понять физический смысл, процессов, которые происходят с энтропией:
$S=klnW, left( 2 right)$
где ($W$) – термодинамическая вероятность (статистический вес состояния), то есть количество способов, реализации данного состояния термодинамической системы. $W$ ≥1; $k$- постоянная Больцмана.
Изменение энтропии, исходя из статистической формулы Больцмана, найдем как:
$S_{2}-S_{1}=klnfrac{W_{2}}{W_{1}}left( 2.1 right)$).
«Изменение энтропии» 👇
Вычисление изменения энтропии в изотермическом процессе
Вычислим изменение энтропии в одном моле идеального газа при изотермическом процессе ($T=const$). Оттолкнемся от первого начала термодинамики в дифференциальной форме:
$delta Q=dU+pdV, left( 3 right)$,
где $dU$ – изменение внутренней энергии идеального газа; $pdV$=$delta A$ – работа, совершаемая газом.
Найдем отношение всех слагаемых выражения (3) и температуры:
$frac{delta Q}{T}=C_{V}frac{dT}{T}+frac{p}{T}dVleft( 4 right)$.
где $C_V$ – теплоемкость газа при $V=const$.
Для идеального газа справедливо уравнение Менделеева – Клапейрона, учитывая, что у нас 1 моль газа:
$pV=RTto frac{p}{T}=frac{R}{V}left( 5 right)$.
Учтем:
$frac{dT}{T}=dleft( ln T right),, frac{dV}{V}=dleft( ln V right)left( 6 right)$.
в этом случае мы можем записать для уравнения (4):
$frac{delta Q}{T}=dleft( C_{V}lnT+RlnV right)left( 7 right)$.
По определению (1), и принимая во внимание (7), запишем:
$dS=dleft( C_{V}lnT+RlnV right)left( 8 right)$.
Формула (8) показывает нам, что в изотермическом процессе изменяется только второе слагаемое правой части:
- при увеличении объема энтропия увеличивается,
- с уменьшением объема энтропия уменьшается.
Данный результат очевиден, так как если увеличивается объем, то возрастает количество мест, которое смогут занять частицы при неизменяющемся их количестве. Следовательно, растет число разных возможностей расположения на этих местах (увеличивается количество пространственных микросостояний). Увеличение числа микросостояний означает увеличение энтропии (см формулу (2)).
Изменение энтропии в изохорическом процессе
Рассмотрим изохорный процесс в идеальном газе ($V=const$ или $dV=0$). Из формулы (7) для изохорного процесса следует:
$dS=dleft( C_{V}lnT+RlnV right)=d(C_{V}lnT)left( 9 right)$.
После интегрирования (9), получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)left( 10 right)$.
Формула (10) показывает, что в изохорическом процессе при увеличении температуры происходит рост энтропии. Данный результат можно пояснить так:
- при увеличении температуры растет средняя энергия частиц газа;
- увеличивается количество возможных энергетических состояний.
Изменение энтропии в адиабатном процессе
Адиабатный процесс характеризуется тем, что он происходит без теплообмена (δQ=0). Исследуя адиабатный процесс в идеальном газе, за основу для вычисления энтропии примем выражение (8). Найдем интеграл правой и левой частей этого выражения, получим:
$S_{2}-S_{1}=C_{V}ln left( frac{T_{2}}{T_{1}} right)+Rln {left( frac{V_{2}}{V_{1}} right)left( 11 right).}$
Запишем уравнение адиабатного процесса в параметрах $T,V$:
$T_{1}V_{1}^{gamma -1}=T_{2}V_{2}^{gamma -1}left( 12 right)$.,
где $gamma =frac{C_{p}}{C_{V}}-$ показатель адиабаты. Возьмем натуральные логарифмы от обеих частей выражения (12), имеем:
$ln left( frac{T_{2}}{T_{1}} right)=left( gamma -1 right)ln left( frac{V_{1}}{V_{2}} right)=-left( gamma -1 right)ln left( frac{V_{2}}{V_{1}} right)left( 13 right)$.
Преобразуем выражение (11), приняв во внимание формулу (13):
$S_{2}-S_{1}=C_{V}left[ -left( gamma -1 right)ln left(frac{V_{2}}{V_{1}} right) right]+Rln left( frac{V_{2}}{V_{1}} right)=-C_{V}left( frac{C_{p}}{C_{V}}-1 right)ln left( frac{V_{2}}{V_{1}}right)$
$+Rln {left( frac{V_{2}}{V_{1}} right)=left[ -C_{V}left(frac{C_{p}}{C_{V}}-1 right)+R right]ln {left( frac{V_{2}}{V_{1}}right)=left[ C_{V}-C_{p}+R right]ln left( frac{V_{2}}{V_{1}} right)}}left( 14 right)$.
Вспомним соотношение Майера:
$R=C_{p}-C_{V}left( 15 right)$
и сделаем вывод о том, что изменение энтропии в адиабатном процессе нет:
$S_{2}-S_{1}=0.$
Адиабатный процесс является изоэнтропийным ($S=const$).
При адиабатном расширении газа увеличение энтропии может идти только за счет увеличения объема, но при этом происходит уменьшение температуры, и энтропия уменьшается из-за уменьшения температуры. Данные тенденции взаимно компенсируют друг друга.
Рассмотрим пример. Два сосуда разного объема содержат по $nu$ молей одинакового идеального газа. Температуры газов равны $ T_1$ и $ T_2$. Сосуды соединяют, газы перемешиваются. Система приходит в состояние равновесия. Определим изменение энтропии в этом процессе.
Рисунок 1. Изменение энтропии в адиабатном процессе. Автор24 — интернет-биржа студенческих работ
Будем считать, что изобарное расширение каждого из газов до конечного объема является обратимым. В этом процессе температура каждой из газовых компонент изменяется до конечной температуры $frac{T_{1}+T_{2}}{2}$. Найдем изменение энтропии каждого из газов по отдельности:
$Delta S_{1}=intlimits_a^b frac{dT}{T} =nu c_{p}ln left(frac{T_{1}+T_{2}}{2T_{1}} right)left( 16 right)$,
где $a=T_{1};b=frac{T_{1}+T_{2}}{2}$ $c_p$ – молярная теплоемкость газа при постоянном давлении.
Изменение энтропии второго газа запишем аналогично:
$Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{2}} right)left( 17right)$.
Поскольку энтропия является аддитивной величиной, то полное изменение энтропии найдем как сумму:
$Delta S_{2}=Delta S_{1}+Delta S_{2}=nu c_{p}ln left( frac{T_{1}+T_{2}}{2T_{1}} right)+c_{p}ln left(frac{T_{1}+T_{2}}{2T_{2}} right)=nu c_{p}ln frac{left( T_{1}+T_{2} right)^{2}}{4T_{1}T_{2}}=2nu$ $c_{p}lnleft( frac{T_{1}+T_{2}}{2sqrt {T_{1}T_{2}} } right)$.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме