Как найти в физике начальную и конечную температуру через количество теплоты, удельную теплоту и массу?
Домашние задания
Николай Маслихов
21 декабря 2020 · 3,6 K
Ответить1Уточнить
Сергей Иванов
Математика
158
Мне интересно и нравятся: математика. физика. астрономия, информатика, астрофизика, науки… · 26 дек 2020 · ivanov610.narod.ru
Формула связи такая Q = cm(t2-t1). Если даны: количество теплоты, удельную теплоту и массу, то из этой формулы можно выразить только изменение температуры. t2-t1 =Q/cm. Чтобы найти конечную или начальную температуры, нужно какую-то из них тоже знать. Знаем конечную, найдем начальную и наоборот.
4,2 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
Thermodynamics is the field of physics concerned with temperature, heat and, ultimately, energy transfers. Although the laws of thermodynamics can be a little tricky to follow, the first law of thermodynamics is a simple relationship between the work done, heat added, and the change in internal energy of a substance. If you have to calculate a change in temperature, it’s either a simple process of subtracting the old temperature from the new one, or it may involve the first law, the amount of energy added as heat, and the specific heat capacity of the substance in question.
TL;DR (Too Long; Didn’t Read)
A simple change in temperature is calculated by subtracting the final temperature from the initial temperature. You may need to convert from Fahrenheit to Celsius or vice-versa, which you can do using a formula or an online calculator.
When heat transfer is involved, use this formula: change in temperature = Q / cm to calculate the change in temperature from a specific amount of heat added. Q represents the heat added, c is the specific heat capacity of the substance you’re heating, and m is the mass of the substance you’re heating.
What’s the Difference Between Heat and Temperature?
The key bit of background you need for a temperature calculation is the difference between heat and temperature. The temperature of a substance is something you are familiar with from everyday life. It’s the quantity you measure with a thermometer. You also know that the boiling points and melting points of substances depend on their temperature. In reality, temperature is a measure of the internal energy a substance has, but that information isn’t important for working out the change in temperature.
Heat is a bit different. This is a term for the transfer of energy through thermal radiation. The first law of thermodynamics says that the change in energy equals the sum of the heat added and the work done. In other words, you can give more energy to something by warming it up (transferring heat to it) or by physically moving or stirring it (doing work on it).
Simple Change in Temperature Calculations
The simplest temperature calculation you may have to do involves working out the difference between a starting and finishing temperature. This is easy. You subtract the final temperature from the starting temperature to find the difference. So if something starts at 50 degrees Celsius and finishes at 75 degrees C, then the change in temperature is 75 degrees C – 50 degrees C = 25 degrees C. For decreases in temperature, the result is negative.
The biggest challenge for this type of calculation occurs when you need to do a temperature conversion. Both temperatures must be either Fahrenheit or Celsius. If you have one of each, convert one of them. To switch from Fahrenheit to Celsius, subtract 32 from the amount in Fahrenheit, multiply the result by 5, and then divide it by 9. To convert from Celsius to Fahrenheit, first multiply the amount by 9, then divide it by 5, and finally add 32 to the result. Alternatively, just use an online calculator.
Calculating Temperature Change From Heat Transfer
If you’re doing a more complicated problem involving heat transfer, calculating the change in temperature is more difficult. The formula you need is:
Change in temperature = Q / cm
Where Q is the heat added, c is the specific heat capacity of the substance, and m is the mass of the substance you’re heating up. The heat is given in joules (J), the specific heat capacity is an amount in joules per kilogram (or gram) °C, and the mass is in kilograms (kg) or grams (g). Water has a specific heat capacity of just under 4.2 J/g °C, so if you’re raising the temperature of 100 g of water using 4,200 J of heat, you get:
Change in temperature = 4200 J ÷ (4.2 J/g °C × 100 g) = 10 °C
The water increases in temperature by 10 degrees C. The only thing you need to remember is that you have to use consistent units for mass. If you have a specific heat capacity in J/g °C, then you need the mass of the substance in grams. If you have it in J/kg °C, then you need the mass of the substance in kilograms.
Термодинамика – это область физики, которая занимается передачей температуры, тепла и, в конечном итоге, энергии. Хотя следовать законам термодинамики может быть непросто, первый закон термодинамики таков: простая взаимосвязь между проделанной работой, добавленным теплом и изменением внутренней энергии вещество. Если вам нужно рассчитать изменение температуры, это простой процесс вычитания старой температуры из новой. один, или он может включать в себя первый закон, количество энергии, добавленной в виде тепла, и удельную теплоемкость вещества в вопрос.
TL; DR (слишком длинный; Не читал)
Простое изменение температуры рассчитывается путем вычитания конечной температуры из начальной. Возможно, вам потребуется преобразовать градусы Фаренгейта в градусы Цельсия или наоборот, что вы можете сделать с помощью формулы или онлайн-калькулятора.
Когда речь идет о теплопередаче, используйте следующую формулу: изменение температуры = Q / см, чтобы рассчитать изменение температуры на основе определенного количества добавленного тепла.
Q представляет добавленное тепло, c – удельная теплоемкость вещества, которое вы нагреваете, и м масса нагреваемого вещества.
В чем разница между жарой и температурой?
Ключевым моментом, необходимым для расчета температуры, является разница между теплом и температурой. Температура вещества – это то, с чем вы знакомы из повседневной жизни. Это количество, которое вы измеряете термометром. Вы также знаете, что температуры кипения и плавления веществ зависят от их температуры. На самом деле температура – это мера внутренней энергии вещества, но эта информация не важна для расчета изменения температуры.
Тепло немного другое. Это термин для передачи энергии посредством теплового излучения. Первый закон термодинамики гласит, что изменение энергии равно сумме добавленного тепла и проделанной работы. Другими словами, вы можете дать чему-то больше энергии, нагревая его (передавая ему тепло) или физически перемещая или перемешивая его (выполняя над ним работу).
Простое изменение расчетов температуры
Самый простой расчет температуры, который вам может потребоваться, включает определение разницы между начальной и конечной температурами. Это легко. Вы вычитаете конечную температуру из начальной, чтобы найти разницу. Итак, если что-то начинается при 50 градусах Цельсия и заканчивается при 75 градусах Цельсия, то изменение температуры составляет 75 градусов Цельсия – 50 градусов Цельсия = 25 градусов Цельсия. При понижении температуры результат отрицательный.
Самая большая проблема для этого типа расчета возникает, когда вам нужно выполнить преобразование температуры. Обе температуры должны быть либо по Фаренгейту, либо по Цельсию. Если у вас есть по одному, конвертируйте один из них. Чтобы переключиться с градуса Фаренгейта на градус Цельсия, вычтите 32 из суммы в градусах Фаренгейта, умножьте результат на 5, а затем разделите на 9. Чтобы преобразовать градусы Цельсия в градусы Фаренгейта, сначала умножьте полученное значение на 9, затем разделите на 5 и, наконец, прибавьте 32 к результату. Или просто воспользуйтесь онлайн-калькулятором.
Расчет изменения температуры по теплопередаче
Если вы решаете более сложную задачу, связанную с теплопередачей, вычислить изменение температуры будет сложнее. Необходимая вам формула:
Изменение температуры = Q / см
Где Q добавлено тепло, c – удельная теплоемкость вещества, а м масса нагреваемого вещества. Теплота указывается в джоулях (Дж), удельная теплоемкость – это количество в джоулях на килограмм (или грамм) ° C, а масса – в килограммах (кг) или граммах (г). Вода имеет удельную теплоемкость чуть ниже 4,2 Дж / г ° C, поэтому, если вы поднимете температуру 100 г воды, используя 4200 Дж тепла, вы получите:
Изменение температуры = 4200 Дж ÷ (4,2 Дж / г ° C × 100 г) = 10 ° C
Температура воды повышается на 10 градусов по Цельсию. Единственное, что вам нужно помнить, это то, что вы должны использовать согласованные единицы измерения массы. Если у вас есть удельная теплоемкость в Дж / г ° C, то вам нужна масса вещества в граммах. Если у вас она в Дж / кг ° C, то вам нужна масса вещества в килограммах.
Формулы по физике
8 класс
Количество теплоты при нагревании
Q=c*m*(t2–t1)=с*m*∆t
Q – количество теплоты [Дж]
(Джоуль)
с –
удельная теплоёмкость [Дж/(кг*ºС), Дж/(кг*ºК)] (Джоуль на килограмм-градус
Цельсия, Джоуль на килограмм-градус Кельвина)
m – масса [кг] (килограмм)
t2 – конечная температура [ºC, ºK] (градус Цельсия, градус
Кельвина)
t1 – начальная температура [ºC, ºK] (градус Цельсия, градус
Кельвина)
∆t – изменение температуры [ºC,
ºK] (градус Цельсия, градус Кельвина)
Q>0 – выделение, отдача тепла
(энергии)
Q<0 – поглощение, забор тепла
(энергии)
Теплота сгорания
Q=q*m
Q – количество теплоты [Дж]
(Джоуль)
q – удельная теплота сгорания [Дж/кг]
(Джоуль на килограмм)
m – масса [кг] (килограмм)
Теплота плавления
Q=λ*m
Q – количество теплоты [Дж]
(Джоуль)
λ –
удельная теплота плавления [Дж/кг] (Джоуль на килограмм)
m – масса [кг] (килограмм)
В
течение процесса плавления (отвердевания) температура остается постоянной!
Теплота парообразования
Q=L*m
Q – количество теплоты [Дж]
(Джоуль)
L – удельная теплота парообразования
[Дж/кг] (Джоуль на килограмм)
m – масса [кг] (килограмм)
В
течение процесса парообразования (конденсации) температура остается постоянной!
Сила электрического тока
I=![]()
I – сила тока [А] (Ампер)
q – заряд [Кл] (Кулон)
t – время [с] (секунда)
 А – Амперметр, прибор для
А – Амперметр, прибор для
измерения силы тока, подключается последовательно.
Электрическое напряжение
U=![]()
U – напряжение [В] (Вольт)
А –
работа электрического тока [Дж] (Джоуль)
q – заряд [Кл] (Кулон)
 V – вольтметр, прибор для измерения напряжения, подключается
V – вольтметр, прибор для измерения напряжения, подключается
параллельно
Сопротивление проводника
R=ρ*![]()
R – сопротивление проводника [Ом]
(Ом)
ρ –
удельное сопротивление [Ом*мм2/м, Ом*м] (Ом-квадратный миллиметр на
метр, Ом-метр)
l – длина проводника [м] (метр)
s – площадь поперечного сечения
проводника [мм2,м2] (квадратный миллиметр, квадратный
метр)
Закон Ома
I=![]()
I – сила тока [А] (Ампер)
R – сопротивление проводника [Ом]
(Ом)
U – напряжение [В] (Вольт)
Сопротивление
проводника не зависит от силы тока или напряжения, зависит только от
геометрических параметров (длина, площадь поперечного сечения и удельное
сопротивление материала)
Соединение проводников
 1)Последовательное
1)Последовательное
Rобщее=R1+R2
Iобщая=I1=I2
Uобщее=U1+U2
 2)Параллельное
2)Параллельное
![]() =
=![]() +
+![]()
Iобщая=I1+I2
Uобщее=U1=U2
Работа электрического тока
A=I*U*t
А –
работа электрического тока [Дж] (Джоуль)
I – сила тока [А] (Ампер)
U – напряжение [В] (Вольт)
t – время [с] (секунда)
Закон Джоуля-Ленца
Q=I2*R*t
Q – количество теплоты,
выделяющееся на проводнике [Дж] (Джоуль)
I – сила тока [А] (Ампер)
R – сопротивление проводника [Ом]
(Ом)
t – время [с] (секунда)
Мощность электрического тока
P=![]() =I*U
=I*U
P – мощность электрического тока
[Вт] (Ватт)
А –
работа электрического тока [Дж] (Джоуль)
t – время [с] (секунда)
I – сила тока [А] (Ампер)
U – напряжение [В] (Вольт)
Основные формулы работы электрического
тока (теплоты) и мощности
|
A(Q)=U*I*t |
P=U*I |
|
A(Q)=I2*R*t |
P=I2*R |
|
A(Q)= |
P= |
|
A(Q)=P*t |
P= |
Три закона распространения света
1)
В однородной
среде свет распространяется равномерно и прямолинейно
2)
При
отражении света от поверхности угол падения равен углу отражения (углом падения/отражения
называется угол между падающим/отражённым лучом и перпендикуляром к
поверхности)
3)
При переходе
света из одной среды в другую луч преломляется. При переходе света из менее
плотной среды в более плотную луч отклоняется ближе к перпендикуляру к
поверхности, и наоборот.

![]() =
=![]()
α – угол падения
β
– преломлённый угол
n1 – показатель преломления более плотной
среды (β)
n2 – показатель преломления менее плотной
среды (α)
Оптическая сила линзы
D=![]()
D – оптическая сила линзы [дптр]
(диоптрия)
F – фокусное расстояние линзы [м]
(метр)
Формула тонкой линзы
![]() =
=![]() +
+![]()
F – фокусное расстояние линзы [м]
(метр)
f – расстояние от линзы до
изображения [м] (метр)
d – расстояние от предмета до
линзы [м] (метр)
Содержание:
Температура:
Перед тем как, например, пойти на пляж, многие интересуются прогнозом погоды. И если ожидается температура воздуха 10 °С, то, скорее всего, планы будут изменены. А стоит ли отказываться от прогулки, если прогнозируется температура 300 К (кельвинов)? И что на самом деле вкладывают физики в понятие «температура»?

Что такое температура
Эксперименты показывают, что макроскопическая система может переходить из одного состояния в другое. Например, если в морозный день занести в комнату шарик, наполненный гелием, то гелий в шарике будет нагреваться и при этом будут изменяться давление, объем и некоторые другие параметры газа. После того как шарик пробудет в комнате некоторое время, изменения прекратятся. Один из постулатов молекулярной физики и термодинамики — его еще называют нулевое начало термодинамики — гласит: любое макроскопическое тело или система тел при неизменных внешних условиях самопроизвольно переходит в термодинамическое равновесное состояние (состояние теплового равновесия), после достижения которого все части системы имеют одинаковую температуру. Нулевое начало термодинамики фактически вводит и определяет понятие температуры.
Температура — физическая величина, характеризующая состояние теплового равновесия макроскопической системы.
Состояние теплового равновесия — это такое состояние макроскопической системы, при котором все макроскопические параметры системы остаются неизменными сколь угодно долго.
В состоянии теплового равновесия все части системы имеют одинаковую температуру; другие макроскопические параметры неизменны, но могут быть разными. Вспомните пример с шариком: после того как установится тепловое равновесие, температура окружающего воздуха и температура гелия в шарике будут одинаковыми, а давление, плотность и объем — разными.
Как работают термометры
Температура — это физическая величина, и ее можно измерять. Для этого нужно установить шкалу температур. Самые распространенные температурные шкалы — шкалы Цельсия, Кельвина, Фаренгейта (рис. 29.1).
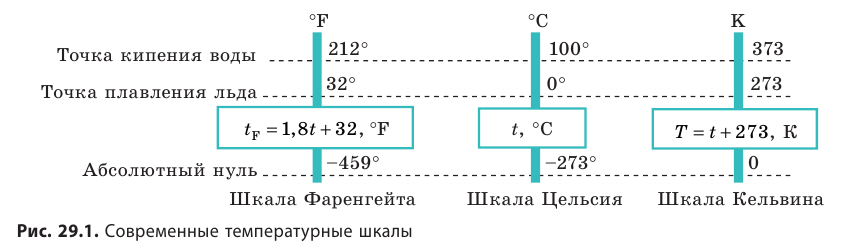
Построение шкалы температур начинается с выбора реперных (опорных) точек, которые должны быть однозначно связаны с какими-либо физическими процессами, которые легко воспроизвести. Например, за нулевую точку температурной шкалы Цельсия принята температура таяния льда при нормальном атмосферном давлении ( t = 0 °С). Температуре кипения воды при нормальном атмосферном давлении приписывают значение t =100 °С. Единица температуры по шкале Цельсия — градус Цельсия: 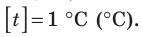 .
.

Рис. 29.2. различные виды термометров: а — жидкостный (принцип действия: изменение объема жидкости при изменении температуры); б — термометр сопротивления (изменение электрического сопротивления проводника при изменении температуры); в — биметаллический деформационный (изменение длин двух разных металлических пластин при изменении температуры)
Приборы для измерения температуры — термометры (рис. 29.2). Основные части любого термометра — термометрическое тело (ртуть или спирт в жидкостном термометре, биметаллическая пластина в металлическом деформационном термометре и т. д.) и шкала. Если термометрическое тело привести в контакт с телом, температуру которого нужно измерить, система придет в неравновесное состояние. При переходе в равновесное состояние будут изменяться некоторые параметры термометрического тела (объем, сопротивление и т. п.). Зная, как эти параметры зависят от температуры, определяют температуру тела.
Обратите внимание!
- Термометр фиксирует собственную температуру, равную температуре тела, с которым термометр находится в термодинамическом равновесии.
- Термометрическое тело не должно быть массивным, иначе оно существенно изменит температуру тела, с которым контактирует.
Температура и средняя кинетическая энергия молекул
То, что температура тела должна быть связана с кинетической энергией его молекул, следует из простых соображений. Например, с увеличением температуры увеличивается скорость движения броуновских частиц, ускоряется диффузия, повышается давление газа, а это значит, что молекулы движутся быстрее и их кинетическая энергия становится больше. Можно предположить: если газы находятся в состоянии теплового равновесия, средние кинетические энергии молекул этих газов одинаковы. Но как это доказать, ведь непосредственно измерить эти энергии невозможно?
Обратимся к основному уравнению МКТ идеального газа: 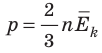 . По определению
. По определению 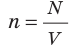 , поэтому
, поэтому 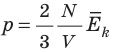 . После преобразований получим:
. После преобразований получим: 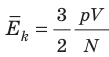 .
.
Таким образом, чтобы экспериментально убедиться в равенстве средних кинетических энергий молекул различных газов при одинаковой температуре, нужно измерить объемы (V), давления (p) и массы (m) газов и, зная их молярную массу (M), найти число молекул каждого газа (N) по формуле 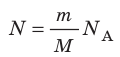 .
.
Чтобы обеспечить одинаковую температуру, можно, например, погрузить баллоны с различными газами в сосуд с водой и дождаться состояния теплового равновесия (рис. 29.3).
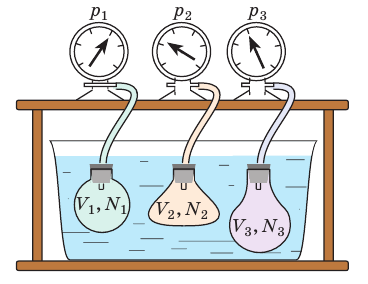
Рис. 29.3. опыт, позволяющий установить связь между температурой и средней кинетической энергией поступательного движения молекул газа. Газы в сосудах находятся в состоянии теплового равновесия со средой, а следовательно, и друг с другом
Эксперименты показывают, что для всех газов в состоянии теплового равновесия отношение 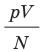 одинаково, а следовательно, одинаковыми являются и средние кинетические энергии молекул газов. (Отношение
одинаково, а следовательно, одинаковыми являются и средние кинетические энергии молекул газов. (Отношение 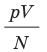 часто обозначают символом θ (тета).)
часто обозначают символом θ (тета).)
Например, при температуре 0 °С (сосуды с газами погрузили в тающий лед) 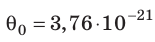 , Дж, то есть
, Дж, то есть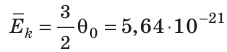 Дж; при температуре 100 °С (сосуды погрузили в кипящую воду)
Дж; при температуре 100 °С (сосуды погрузили в кипящую воду) 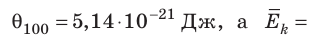
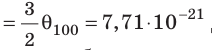 Дж. Так как в состоянии теплового равновесия значение θ для любых газов одинаково, то температуру можно измерять в джоулях.
Дж. Так как в состоянии теплового равновесия значение θ для любых газов одинаково, то температуру можно измерять в джоулях.
Абсолютная шкала температур
Понятно, что в джоулях представлять температуру неудобно (прежде всего потому, что значения θ очень малы), к тому же неудобно полностью отказываться от шкалы Цельсия. В 1848 г. английский физик Уильям Томсон (лорд Кельвин) (1824–1907) предложил абсолютную шкалу температур (сейчас ее называют шкалой Кельвина).
Температуру Т, измеренную по шкале кельвина, называют абсолютной температурой.
Единица абсолютной температуры — кельвин — основная единица СИ: [T] = 1 К (К).
Шкала Кельвина построена следующим образом:
- изменение температуры по шкале Кельвина равно изменению температуры по шкале Цельсия: ∆ = T t ∆ , то есть цена деления шкалы Кельвина равна цене деления шкалы Цельсия: 1 °С = 1 К; температуры, измеренные по шкалам Кельвина и Цельсия, связаны соотношениями:
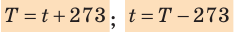
- температура по шкале Кельвина связана с величиной
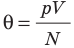 соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа:
соотношением θ = kT, где k — постоянная Больцмана — коэффициент пропорциональности, не зависящий ни от температуры, ни от состава и количества газа: 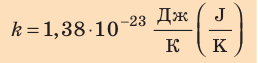
- абсолютная температура имеет глубокий физический смысл: средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре:
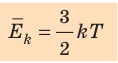 (1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться (
(1) То есть, если газ охладить до температуры T= 0 К, движение его молекул должно прекратиться ( ). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
). Таким образом, нулевая точка шкалы Кельвина — это самая низкая теоретически возможная температура. На самом деле движение молекул не прекращается никогда, поэтому достичь температуры 0 К (–273 °С) невозможно.
Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Давление p газа полностью определяется его абсолютной температурой T и концентрацией n молекул газа: p=nkT (2).
Выводы:
- Физическая величина, характеризующая состояние теплового равновесия макроскопической системы, называется температурой. Абсолютный нижний предел температуры, при котором движение молекул и атомов должно прекратиться, называют абсолютным нулем температуры. Шкала, за нулевую точку которой взят абсолютный нуль температуры, называется абсолютной шкалой температур (шкалой Кельвина). Единица абсолютной температуры — кельвин (К) — основная единица СИ. Температуры по шкале Кельвина и Цельсия связаны соотношением: T=t + 273; t=T – 273.
- Средняя кинетическая энергия поступательного движения молекул идеального газа прямо пропорциональна абсолютной температуре, а давление газа определяется абсолютной температурой и концентрацией молекул газа:
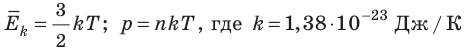 — постоянная Больцмана.
— постоянная Больцмана.
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Твердые тела и их свойства в физике
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
- Уравнение состояния идеального газа
