Молекулы белков представляют собой амфотерные основания, поскольку содержат свободные амино- и карбоксигруппы. При рН раствора меньше 7 они имеют отрицательный заряд, а при рН больше 7 – положительный. При равенстве данных зарядов, которое достижимо при установлении в растворе определенной кислотности или щелочности, устанавливается так называемая изоэлектрическая точка белка.
Понятие об изоэлектрической точке
Белки состоят из аминокислот. Некоторые из этих соединений (аргинин, аспарагиновая кислота, гистидин, глутаминовая кислота, лизин) представлены в виде радикалов, содержащих ионогенные группы, то есть такие группы, которые способны к ионизации. Помимо них к ионизации способны альфа-карбоксильная и аминогруппы, расположенные на углеродном и азотном концах полипептидных цепей. Если рН раствора равен 7 или приближен к данной отметке, то в ионизированном состоянии находятся все ионогенные группы. По мере удаления от данного значения рН в ту или иную сторону, причем преимущественно в кислую, белок начинает переход в изоэлектрическое состояние, при котором молекула данного вещества становится электронейтральной, число ионизированных групп стремится к нулю. Величина рН, при которой белки переходят в изоэлектрическое состояние, называется изоэлектрической точкой белков (ИЭТ).

Физико-химическая природа белков
Из-за того, что в состав белков входят карбокси- и аминные группы, они могут диссоциировать как основания и как кислоты. Свободная карбоксильная группа при диссоциации отдает положительно заряженный ион водорода и анион COO-. В результате ион водорода присоединяется к аминогруппе, что характеризует основные свойства белка, в результате чего образуются частицы белка с отрицательным и положительным зарядами. При помещении белка в кислый раствор его кислотная диссоциация будет подавляться из-за значительного присутствия катионов водорода. И наоборот, при помещении его в основный раствор его основная диссоциация будет подавляться из-за присутствия анионов COO-.
Пропускание через белковый раствор электрического тока приведет к тому, что анионы начнут двигаться к катоду, а катионы – к аноду. В любом белке есть определенная величина рН, при которой движение ионов при пропускании тока не будет происходить. В этом случае говорят о равенстве разнонаправленных ионов и равенстве различных степеней (основной и кислой) в белковой молекуле, что характеризуется изоэлектрическим состоянием.
Как известно, вода представляет собой диполь, поэтому она располагает свои частицы вокруг белковой молекулы в зависимости от того, как она заряжена. В изоэлектрической точке молекула белка не имеет гидратно-ориентированной оболочки. Если осуществляется осаждение белков, необходимо, прежде всего, разрушить гидратную оболочку, сняв электрический заряд.
Использование ИЭТ в промышленности
В изоэлектрическом состоянии некоторые свойства раствора белка, такие как набухание, вязкость, осмотическое давление, светопропускание, имеют минимальные значения, при этом показатель преломления и оптическая плотность достигают, наоборот, максимальной величины. Изоэлектрическую точку белка можно определить опытным путем, определяя зависимость указанных выше свойств белкового раствора: от величины рН, при этом по положению экстремумов на графиках определяют ИЭТ. В изоэлектрическом состоянии казеин способен осаждаться, что применяется при производстве сыров и кисломолочных продуктов, для получения казеина из обезжиренного молока, как сырья в различных производствах (казеиновые клеи, искусственные продукты питания и т. д.). Измерение ИЭТ позволяет оценить качество белка, в частности, молочного продукта на наличие примесей. Это актуально на сегодняшний день, поскольку введение растительных добавок в молочную основу позволяет заменить часть животного белка растительным, который является более дешевым.
Помимо этого, изоэлектрическая точка белка может использовать при очистке сточных вод от птицефабрик. Так, основная доля загрязнений сточных вод убойного цеха птицефабрики приходится на белки крови. Учитывая то, что ИЭТ большинства белков находится в зоне слабокислой реакции среды, наиболее полное извлечение белков будет происходить при слабокислой реакции среды при величине рН, стремящейся к ИЭТ.
Факторы, оказывающие влияние на ИЭТ

На ИЭТ оказывает влияние несколько факторов. Рассмотрим, от чего зависит изоэлектрическая точка белков. Прежде всего, она определяется преобладанием аминных или карбоксигрупп в составе молекулы белка. Большая часть белков представляют собой более сильные кислоты по сравнению с основаниями, поэтому для них ИЭТ меньше 7. Имеется группа белков, которые являются более сильными основаниями, чем кислотами, для них ИЭТ больше 7. Установлена сильная корреляционная зависимость между изоэлектрической точкой белка и содержанием ионов солей в растворе. Концентрация белка не оказывает никакого влияния на данный показатель. Рассмотренные факторы позволяют понять, почему изоэлектрическая точка различна для разных белков.

Примеры ИЭТ белков:
- пепсин имеет значение ИЭТ около 1;
- казеин и желатин – 4,7;
- яичный альбумин – 4,8;
- муцин – 2,7;
- пепсиноген – 3,7;
- альбумины – 4,6;
- инсулин – 5,3;
- оксигемоглобин – 6,8;
- карбоксигемоглобин – около 6,9;
- миоглобин – 7,0;
- химотрипсин – 8,6;
- цитохром С – 10,5;
- сальмин – 12.
ИЭТ и ее определение

Все методы определения изоэлектрической точки белков основаны на приготовлении буферных растворов, имеющих отличающуюся реакцию среды. Во все эти растворы помещаются одинаковые навески изучаемого белка, который может быть как в сухом виде, так и в виде раствора. Используются различные методы определения ИЭТ. Как определить изоэлектрическую точку белка?
Основными методами определения ИЭТ являются электрофорез, по минимуму вязкости и связанный с применением водоотнимающих веществ. Могут использоваться и некоторые другие методы, такие, как определение по степени набухания сухого белка, скорости застудевания, но они менее точные и требуют наличия большого количества белка.
Электрофорез
При использовании данного метода в прибор для его осуществления помещаются полоски хромотографической или фильтровальной бумаги, смоченные определенным буферным раствором. Посередине каждой полоски делается карандашная отметка, в которую при помощи пипетки наносится одна капля изучаемого раствора белка. Затем прибор включают и через эти полоски пропускают электрический ток. Макромолекулы изменяют свой заряд в зависимости от величины рН буферного раствора. Если величина рН превышает ИЭТ, то наблюдается отрицательный заряд макромолекул, и наоборот.

Если рН равно ИЭТ, то макромолекулы становятся нейтрально заряженными. Через определенное время подача тока прекращается, полоски бумаги достаются из прибора и высушиваются, после чего пятна белка опрыскивают нингидрином для их проявления. ИЭТ устанавливают по буферному раствору полоски бумаги, где белковое пятно осталось там же, где была нанесена капля. При необходимости этот метод может быть применен и для тонкого фракционирования белков.
Применение других методов для определения ИЭТ
При нахождении в изоэлектрическом состоянии молекулы белков менее гидратированы, поэтому изоэлектрическую точку белка можно определить, используя метод по минимуму вязкости. Для его применения необходимо наличие вискозиметра. С помощью этого прибора определяют относительную вязкость буферных растворов. Молекулы белка, находящегося в изоэлектрическом состоянии, свернуты, поэтому самая небольшая вязкость будет у раствора, в котором его рН будет совпадать с ИЭТ.
На этом же свойстве основан метод, связанный с действием водоотнимающих средств. В качестве таких средств могут выступать ацетон, эфир или спирт. Выделение белков из соответствующих растворов потенциально происходит тем быстрее и полнее, чем полнее соответствует реакция среды ИЭТ. В изоэлектрической точке растворы белков неустойчивы.
Таким образом, существуют различные методы определения изоэлектрической точки белка. И ее определение должно выполняться в зависимости от имеющегося оборудования, материалов, количества белка.
Устойчивость белка в ИЭТ
В изоэлектрической точке белка силы отталкивания между белковыми частицами в макромолекуле ослабевают, благодаря чему происходи агрегация этих молекул и белок выпадает в осадок. Это свидетельствует о том, что в ИЭТ белок неустойчивый за счет потери заряда, который является фактором стабилизации водных белковых растворов. Если к белку добавить кислоту или основание, то молекулы перезаряжаются, белок осуществляет переход в раствор.

В заключение
Таким образом, изоэлектрическая точка белка представляет собой значение реакции среды (рН), при котором в белковой молекуле отмечается равенство разнонаправленных (отрицательных и положительных) зарядов и равенство различных степеней (основных и кислотных) диссоциации. В данной точке белок теряет заряды и становится неустойчивым, вследствие чего выпадает в осадок. Молекула белка сворачивается, в то время, когда она несет в себе определенные заряды, она распрямлена в виде нити.
Белки
– сложные органические азотсодержащие
полимерные соединения, состоящие из
аминокислот. Аминокислоты в белках
соединяются ковалентными пептидными
связями, возникающими при взаимодействии
аминогруппы одной аминокислоты с
карбоксильной группы другой аминокислоты.
Свободные амино- и карбоксильные группы
диаминомонокарбоновых и моноаминодикарбоновых
аминокислот и другие боковые радикалы
белков определяют их кислотно-основные
свойства (амфотерность) и заряд. Проявление
этих свойств зависит от кислотности
среды.
В
кислой среде, в результате подавления
диссоциации свободных карбоксильных
групп, белки заряжаются положительно,
т.е. становятся катионами:
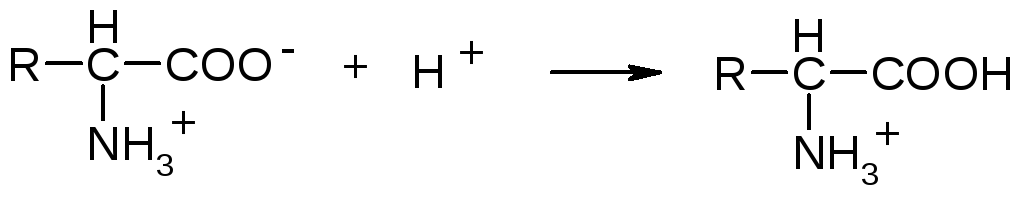
В
щелочной среде подавляется диссоциация
свободных амино-групп, молекулы белков
заряжаются отрицательно и ведут себя
как анионы:
![]()
Кислотность
среды, при которой устанавливается
равенство положительных и отрицательных
зарядов и белок становится электронейтральным,
называется изоэлектрической точкой
(ИЭТ).
Белки, у
которых ИЭТ находится в кислой среде,
называются кислыми. Белки, у которых
значение ИЭТ находится в щелочной среде,
называются основными. У большинства
растительных белков ИЭТ находится в
слабокислой среде.
В
изоэлектрической точке белок обладает
наименьшей растворимостью и легко
выпадает в осадок при воздействиях,
снижающих гидратацию его молекул
(добавлении органических растворителей
или солей). При этом молекулы белка
слипаются, образуя более крупные частицы,
и выпадают из раствора в виде осадка.
Цель
работы.
Определить значения ИЭТ белков различных
фракций (альбуминов, глобулинов,
глютелинов, проламинов).
Ход
работы. В 8
пронумерованных пробирок приливают
воду, 0,01 н. или 0,1 н. раствор уксусной
кислоты в количествах, указанных в табл.
5 и тщательно перемешивают, получая
растворы с различными значениями
рН. В каждую пробирку приливают по 1 мл
раствора белка и содержимое пробирок
перемешивают. Затем в пробирки добавляют
по 2 мл ацетона или спирта, снова
перемешивают содержимое и оставляют
на 30…40 мин при комнатной температуре.
При значении рН, равном или близком к
ИЭТ белка, раствор мутнеет или из него
выпадает осадок. В таблице 5 отмечают
интенсивность помутнения раствора (+),
выпадение осадка (++) или его отсутствие
(–). ИЭТ белка устанавливают по кислотности
среды в пробирке, в которой выпадает
больше осадка, либо в которой интенсивность
помутнения раствора наибольшая.
Т
а б л и ц а 5. Схема
приготовления растворов с различными
значениями рН
и результаты опыта
|
Номер пробирки |
Внесено в пробирки, |
рН |
Помутнение (+),
(++) |
||
|
воды |
0,01 |
0,1 |
|||
|
1. |
8,40 |
0,60 |
– |
5,9 |
|
|
2. |
7,75 |
1,25 |
– |
5,6 |
|
|
3. |
8,75 |
– |
0,25 |
5,3 |
|
|
4. |
8,5 |
– |
0,50 |
5,0 |
|
|
5. |
8,0 |
– |
1,0 |
4,7 |
|
|
6. |
7,0 |
– |
2,0 |
4,4 |
|
|
7. |
5,0 |
– |
4,0 |
4,1 |
|
|
8. |
1,0 |
– |
8,0 |
3,8 |
После
выполнения работы сравнивают значения
изоэлектрической точки анализируемых
белков и делают выводы об их аминокислотном
составе и свойствах.
Вопросы:
-
Как
классифицируют белки (по строению и
составу)? -
Назовите свойства
и функции белков. -
Что
понимают под изоэлектрической точкой
белка? Значение этого показателя?
Материалы
и оборудование:
растворы белков или белковых фракций
семян зерновых и зернобобовых культур
(1,0 г белковых препаратов растворяют
в 20 мл 0,5 н. раствора СН3СООNа
при нагревании на водяной бане, объем
доводят водой до 100 мл), белок куриного
яйца (разводят в 10 раз водой и фильтруют
через два слоя марли), 0,1 н. раствор
СН3СООН
(6 мл ледяной уксусной кислоты разбавляют
водой до литра), 0,01 н. раствор СН3СООН
(0,1 н. раствор СН3СООН
разбавляют в 10 раз), этиловый спирт
или ацетон, пробирки, штативы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ОПРЕДЕЛЕНИЕ ИЗОЭЛЕКТРИЧЕСКОЙ ТОЧКИ БЕЛКА
- Авторы
- Файлы работы
- Сертификаты
Нарожнева А.О. 1, Салищева О.В. 1
1Кемеровский технологический институт пищевой промышленности (университет)
Комментарии
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
В пищевой промышленности для приготовления продукта важное место занимает величина рН. От нее зависят многие производственные характеристики. Водородный показатель рН можно рассматривать как показатель качества. Однако, применение рН в качестве показателя качества еще не в полной мере предусмотрено национальными стандартами отдельных стран. В мировом масштабе наблюдается тенденция к включению рН молочных продуктов, главным образом сычужных сыров, в оценку их качества. Молочные продукты удовлетворительного качества характеризуются определенным значением рН, например, цельное молоко — 6,6 — 6,8; сгущенное — 6,1 — 6,4; йогурты — 4,0 — 4,3; творожная сыворотка — 4,3 — 4,6 и т. д. рН — как фактор управления производственным процессом. При различных технологических процессах рекомендуется следить за изменением величины рН, т. к. от этого зависят качество и выход готового продукта. Например, при регулировании созревания сливок при производстве кисло-сливочного масла требуемая величина рН должна лежать в пределах 4,7 — 4,95. Если она сокращена, то продукт переквашен, появляется порок — кислый металлический привкус, если превышено рН, то образуется недостаточное количество диацетила — порок пустой, творожный вкус; или сычужное свертывание проводят при рН 6,1 — 6,4; в свежем сыре 4,7 — 5,3; зрелый сыр — 5,2 — 5,7; сокращении или превышения вызывает пороки консистенции и т. д.
В кислой и щелочной средах молекулы белка обладают нескомпенсированным зарядом, распределенным по всей длине молекул. Такие молекулы вытянуты в виде нитей, они не могут объединяться в агрегаты и сворачиваться в плотные клубки.
В изоэлектрическом состоянии отрицательные и положительные заряды на молекуле белка скомпенсированы и в целом молекула электрически нейтральна. В этом состоянии молекулы белка сворачиваются в плотные клубки и способны объединяться в крупные агрегаты, выпадающие в осадок.
В изоэлектрическом состоянии такие свойства белкового раствора, как набухание, светопропускание, осмотическое давление, вязкость имеют минимальные значения, а оптическая плотность, показатель преломления – максимальные.
Изоэлектрическую точку белка определяют экспериментально, выявляя зависимость указанных свойств от рН белкового раствора: положение минимума или максимума на соответствующих графиках соответствует ИТБ.
Цель работы заключалась в определении изоэлектрической точки казеина и сухого молока «Распак».
Свойство казеина осаждаться в изоэлектрической точке используют при производстве всех кисломолочных продуктов и сыров, а также для получения казеина из обезжиренного молока, как сырья в самых различных производствах (казеиновые клеи, искусственные продукты питания и т.д.).
Порядок выполнения работы. Определение изоэлектрической точки казеина и сухого молока в данной работе основано на экспериментальном выявлении связи между рН белкового раствора и его прозрачностью. С этой целью готовили серию растворов казеина с различным содержанием СН3СООН, обеспечивающим различные значения рН в этих растворах. Путем сопоставления визуальных наблюдений за прозрачностью растворов со значениями их рН, измеренными с помощью рН-метра, определяли интервал рН, в котором находится изоэлектрическая точка.
Таблица 1. Определение изоэлектрической точки казеина
|
Жидкость |
Номер колбы и количество приливаемой в нее жидкости, см³ |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
СН3СООН с = 0,01 моль/дм³ |
3,1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
СН3СООН с = 0,1 моль/дм³ |
0 |
1,2 |
2,5 |
5,0 |
10,0 |
0 |
0 |
|
СН3СООН с = 1,0 моль/дм³ |
0 |
0 |
0 |
0 |
0 |
4,0 |
8,0 |
|
Исходный раствор казеина |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
Н2О |
Добавляли столько, чтобы объем раствора в колбе довести до метки |
||||||
|
рН раствора |
6,0 |
5,5 |
5,2 |
4,9 |
4,6 |
3,9 |
3,5 |
|
Прозрачность раствора (визуально: – мутный, + прозрачный с осадком) |
– |
– |
– |
– |
+ |
– |
– |
В колбе №5 казеин находится в изоэлектрическом состоянии. Визуально наблюдаем: осадок в виде белых хлопьев. Изоэлектрическая точка казеина 4,6.
Таблица 2. Определение изоэлектрической точки сухого молока «Распак»
|
Жидкость |
Номер колбы и количество приливаемой в нее жидкости, см³ |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
СН3СООН с = 0,01 моль/дм³ |
3,1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
СН3СООН с = 0,1 моль/дм³ |
0 |
1,2 |
2,5 |
5,0 |
10,0 |
0 |
0 |
|
СН3СООН с = 1,0 моль/дм³ |
0 |
0 |
0 |
0 |
0 |
4,0 |
8,0 |
|
Исходный раствор сухого молока |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
Н2О |
Добавляли столько, чтобы объем раствора в колбе довести до метки |
||||||
|
рН раствора |
5,9 |
5,3 |
5,1 |
4,8 |
4,5 |
3,8 |
3,4 |
|
Прозрачность раствора (визуально: – мутный, + прозрачный с осадком) |
– |
– |
+ |
– |
– |
– |
– |
В колбе №3 белок молока сухого «Распак» находится в изоэлектрическом состоянии, изоэлектрическая точка 5,1. Наблюдаем в колбе осадок в виде белых хлопьев. Изоэлектрическая точка сухого молока отличается от изоэлектрической точки казеина. По-видимому, это связано с составом сухого молока, содержащего следы горчичного порошка, глютена, яичного порошка и кунжута.
Таким образом, измеряя изоэлектрическую точку белка, можно оценить качество белкового продукта на предмет примесей. Введение растительных добавок в молочную основу позволяет заменить часть животного белка растительным.
Просмотров работы: 2658
Код для цитирования:
Эта тема входит в бесплатную часть моего курса по биохимии.
Белки — это полимерные молекулы, которые состоят из молекул поменьше — мономеров. Этими мономерами будут аминокислоты. Если упростить, то белок — это большой кирпичный дом. Где кирпичики — это аминокислоты. В этой статье мы посмотрим на эти кирпичики: какие они бывают, сколько их и какие у них свойства. Потом соединим аминокислоты вместе — синтезируем пептид. Подробно поговорим о пептидной связи, удерживающей аминокислоты вместе. А в конце небольшой подарок — торсионные углы.
Строение аминокислот
По названию понятно, что в аминокислоте должны быть две вещи: аминогруппа и карбоксильная группа. Аминокислот довольно много, но в белках встречаются только такие:
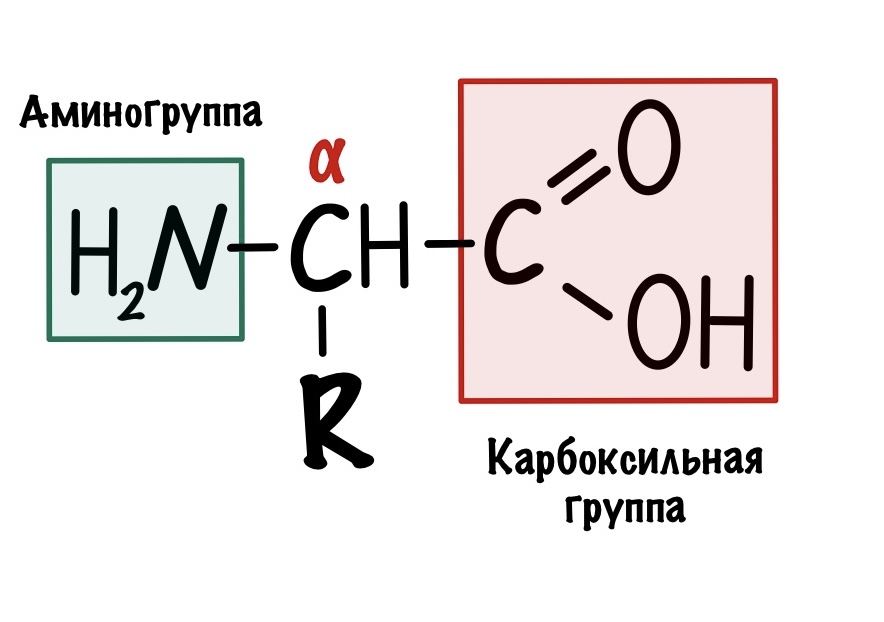
Это альфа-аминокислоты. В них есть центральный атом углерода, который связан с четырьмя заместителями: водородом, аминогруппой, карбоксильной группой и радикалом. Над этим атомом стоит греческая буква — альфа, почему? Это способ нумерации атомов углерода, входящих в органическое соединение. Для нумерации используют буквы греческого алфавита: альфа, бета, гамма, дельта и так далее. Нумерацию начинают с атома углерода, который следует после карбоксильной группы.
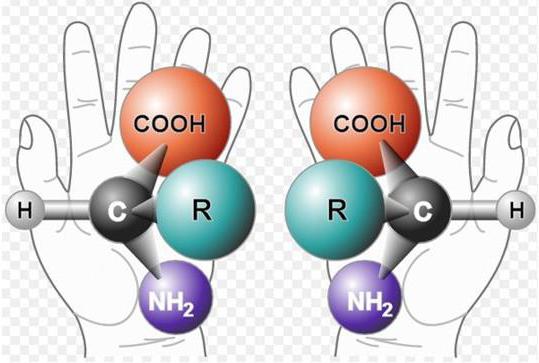
Альфа-углерод связан с четырьмя разными заместителями. Ещё разок повторим, что это — водород, аминогруппа, карбоксильная группа и радикал. Такие атомы называются хиральными центрами. Если в молекуле есть хиральный центр, то она хиральна. Что это значит? Это значит, что у молекулы есть изомер — он является её зеркальным отражением. Две этих молекулы будут несопоставимы в пространстве — они разные! Самый простой пример хиральности — левая и правая рука. Руки являются зеркальным отражением друг друга, но у нас не получится идеально сопоставить их в пространстве. Для этого пришлось бы превратить правую руку в левую. Или левую в правую.
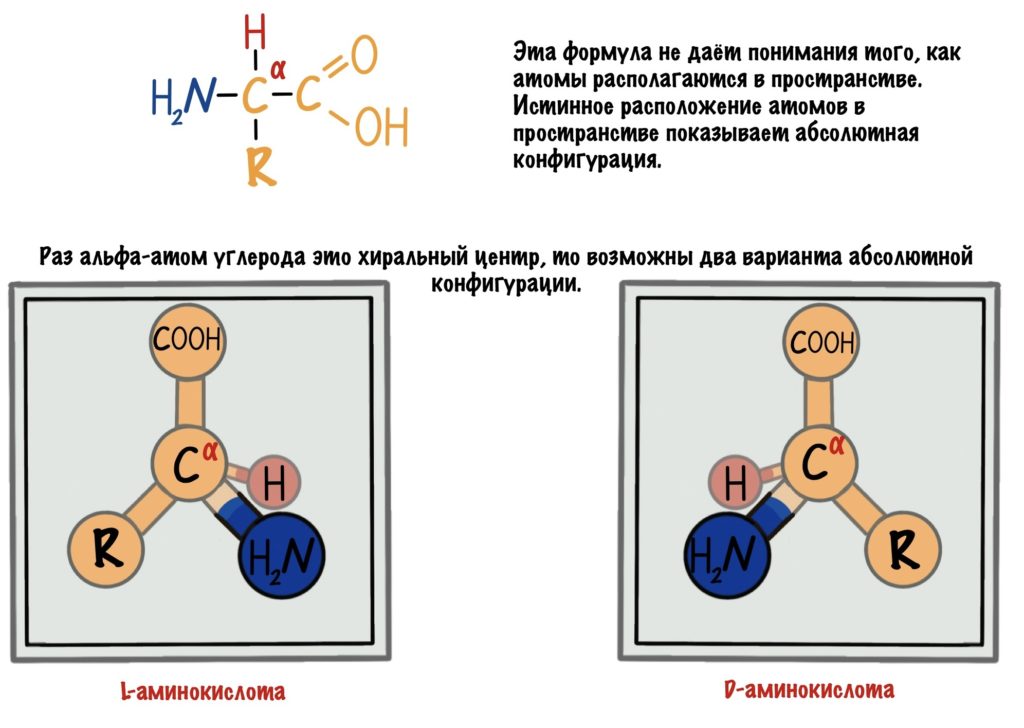
Живые организмы используют и синтезируют только L-аминокислоты.
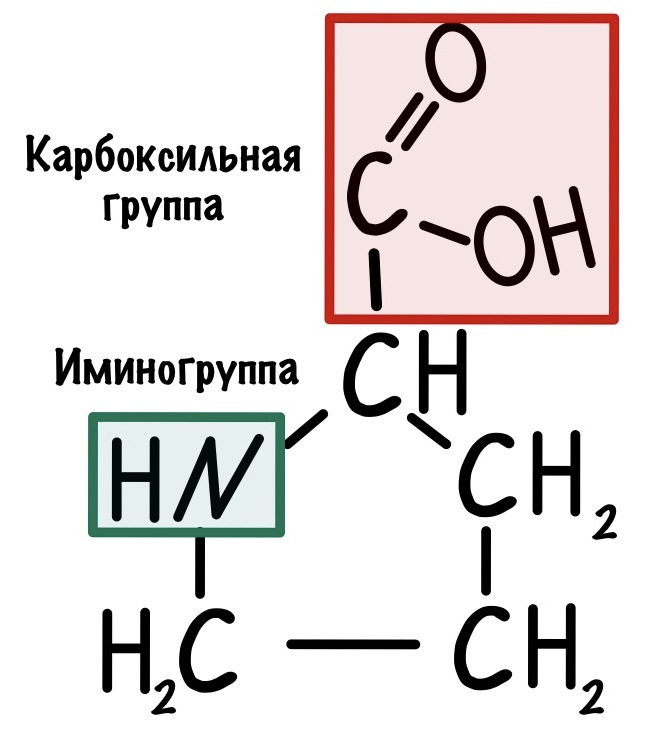
Альфа-аминокислоты будут различаться по своим радикалам. Всего нам нужно запомнить 20 аминокислот. Одна из них будет иметь особое строение — правильнее было бы назвать её иминокислотой. Вот наша легенда — пролин.
Вернемся к различиям между аминокислотами. Есть несколько классификаций радикалов, но мы возьмем самую полезную для нас — по полярности. А если говорить простыми словами, то по растворимости радикала в воде. Радикалы делятся на неполярные и полярные. Первые не растворимы в воде, а вторые растворимы. Когда будем говорить о строении белка, то поймем почему нас интересует именно эта классификация.
Неполярные радикалы аминокислот
У этих ребят нет групп, которые могут образовать водородные связи с водой, поэтому они нерастворимы. Вместо этого у них есть алифатические и ароматические группы. Радикалы выделены фиолетовым цветом.
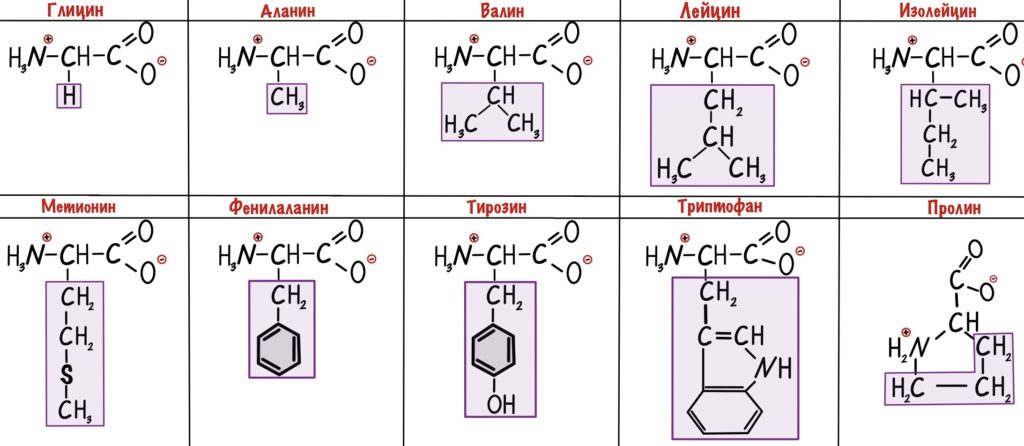
У глицина радикал — атом водорода. Выходит, что у его альфа-атома углерода два одинаковых заместителя — он не является хиральным атомом.
Полярные радикалы аминокислот
Перед этим остановимся на одной вещичке. Я писал формулы аминокислот так, как будто они не находятся в растворе. Но если мы заглянем в клетку, pH в цитоплазме которой 7 и 0, то увидим такую картину.
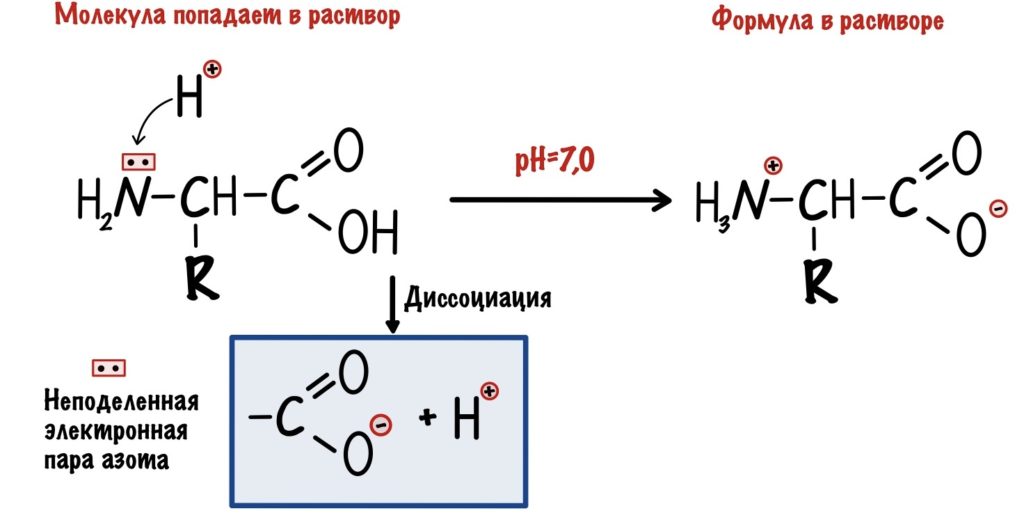
Еще разок, в цитоплазме клетки pH 7,0, то есть в в ней равное количество H+ и OH—. Так как у азота есть неподеленная электронная пара, то он может присоединить протон водорода по донорно-акцепторному механизму. А остаток кислоты диссоциирует с образованием протона. Понятное дело, что радикалы подчиняются таким же правилам.
Полярные радикалы можно разделить на две группы: полярные незаряженные и полярные заряженные.
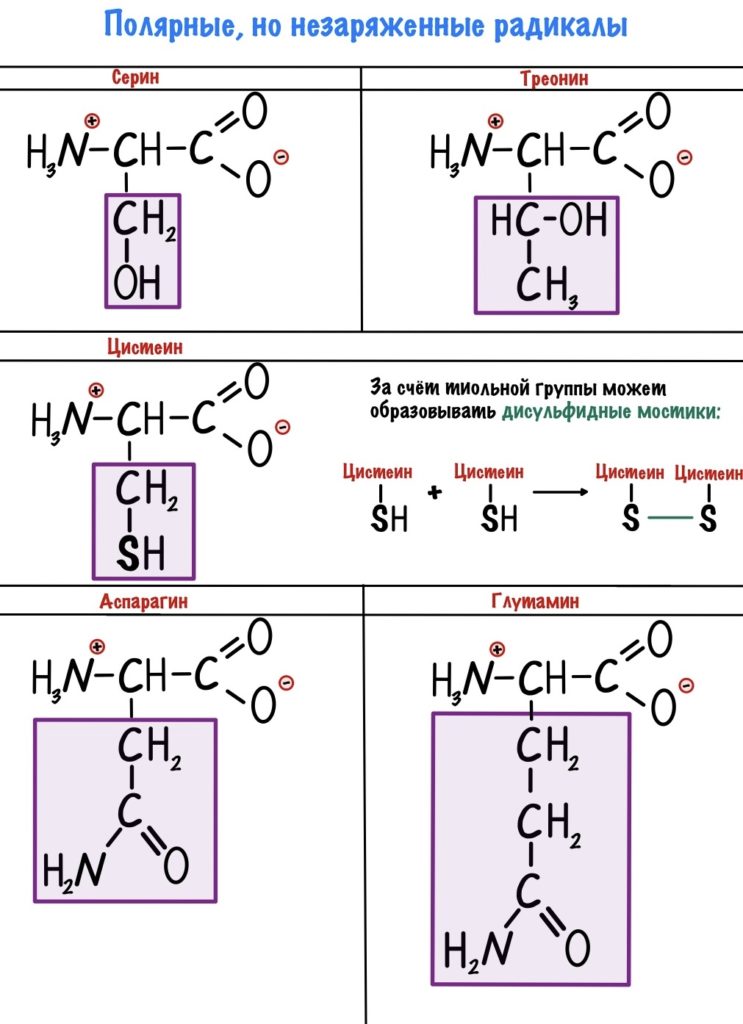
В этих аминокислотах есть сильно электроотрицательные атомы — азот, кислород и сера. С их помощью молекулы образуют водородные связи и растворяются в воде. Но заряда у них нет.
Заряд у радикала может быть положительным или отрицательным, поэтому здесь небольшое деление.
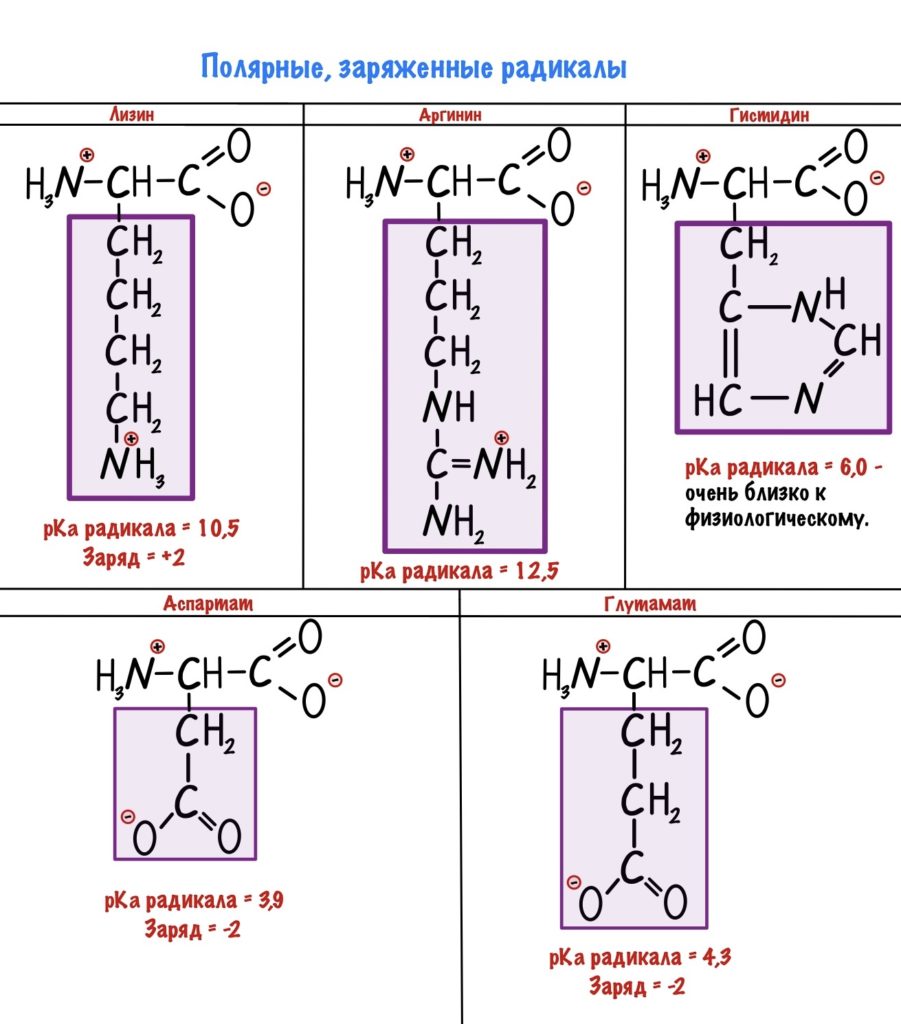
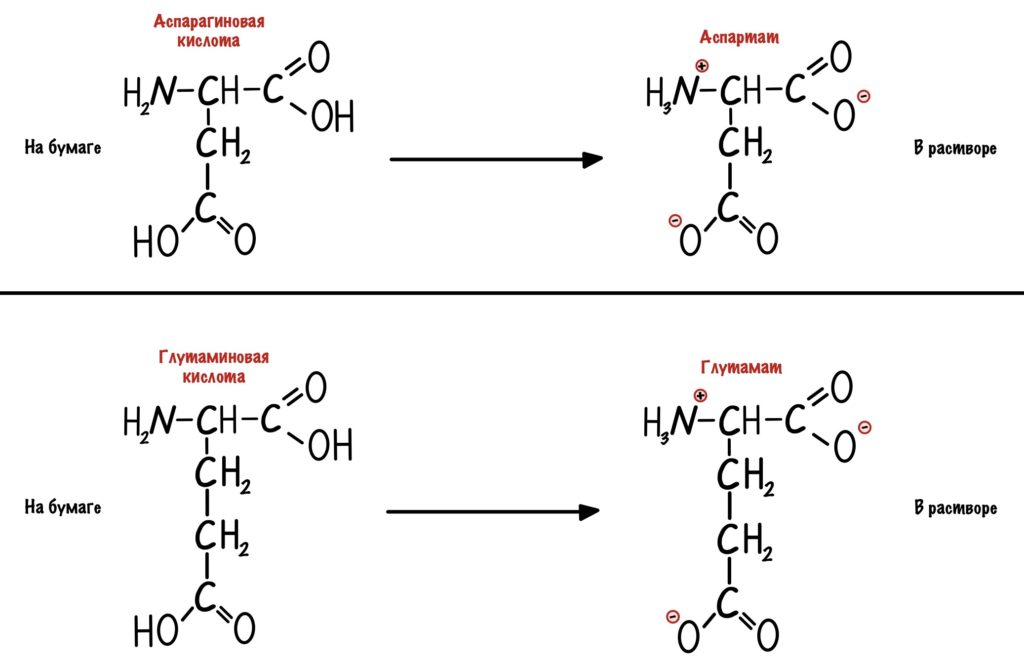
Кстати, лучше растворимы в воде заряженные радикалы. Но разница между полярными заряженными и незаряженными не слишком большая. И еще одно — аспартат и глутамат это название аспарагиновой и глутаминовой кислот в растворе.
Аминокислоты делятся на полярные и неполярные. Полярные аминокислоты могут быть заряженными или незаряженными.
Аминокислоты называли по месту их выделения или физическим свойствам, поэтому у них такие странные названия. Гликос с греческого — сладкий, вот и глицин сладковат. Так что придется зазубрить это.
Изоэлектрическая точка
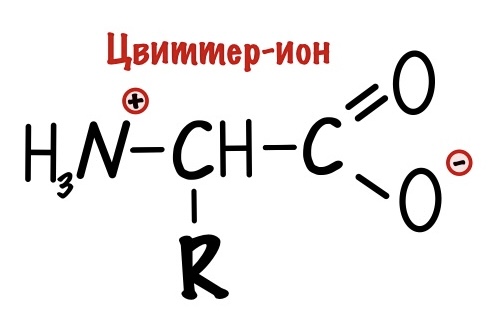
Вы уже заметили, что у аминокислот есть положительная и отрицательная части. Не так много молекул имеют такую особенность. Так что аминокислоты — это такой гибрид, поэтому их так и назвали — гибридные ионы. Правда на немецком…. А звучит это так: «Цвиттер-ион». Но как всегда есть один нюанс — у гибридного иона общий заряд молекулы равен нулю.
И вы уже смекнули, что не у всех аминокислот будет общий заряд равен нулю. Для неполярных и полярных незаряженных аминокислот это верно, но че делать с заряженными? До этого мы разбирали заряд аминокислот в клетке, то есть при нейтральном pH. Но что будет с ними, если поместить их в другие значения среды, например, в сильнощелочную или кислотную? Аминокислоты будут менять свой заряд и сейчас посмотрим как.
Для начала возьмем что-нибудь простенькое — пусть это будет глицин. Нужно понять, что мы берём раствор — у него будет определённая кислотность среды (pH) равная 7,0. В этом растворе будет множество молекул глицина. Добавляем в этот раствор кислоту. Прямо по капле. Сначала ничего не меняется, но при значении pH=2,34 половина карбоксильных групп глицина присоединит к себе протон водорода. Продолжим уменьшать pH (добавлять кислоту) — всё большее количество глицина присоединяет протон. Что же получается? При снижении pH менее 2,34 большая часть карбоксильных групп глицина присоединит к себе протон. Заряд молекул глицина изменится — теперь он равен +1. Начнем добавлять к этому же раствору щелочь по капле. Дойдем до pH равного 9,6 и от половины аминогрупп глицинов отлетит водород. Заряд молекулы будет -1. Чуть дальше будет хорошая картинка, на которой можно будет проследить за всеми изменениями.
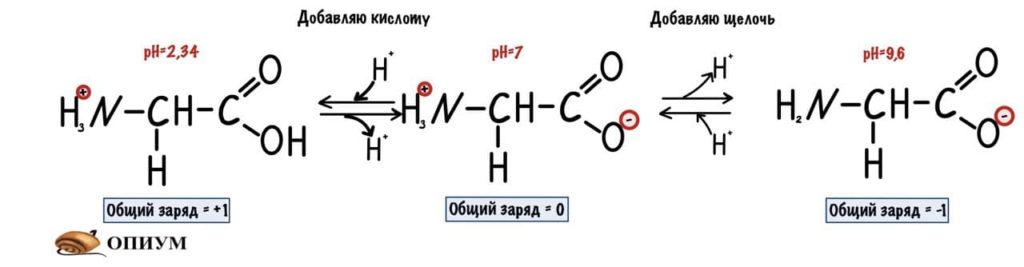
Как же назвать pH при котором происходит переход из одной формы в другую? Очень просто, показатель константы диссоциации или pKa. Константа диссоциации показывает при каком pH среды половина функциональных групп связана с протоном, а другая половина не связана. Получается, что в молекуле глицина pKa карбоксильной группы = 2,34, а pKa аминогруппы = 9,6. Я написал про молекулу глицина, потому что в остальных аминокислотах значения немного отличаются.
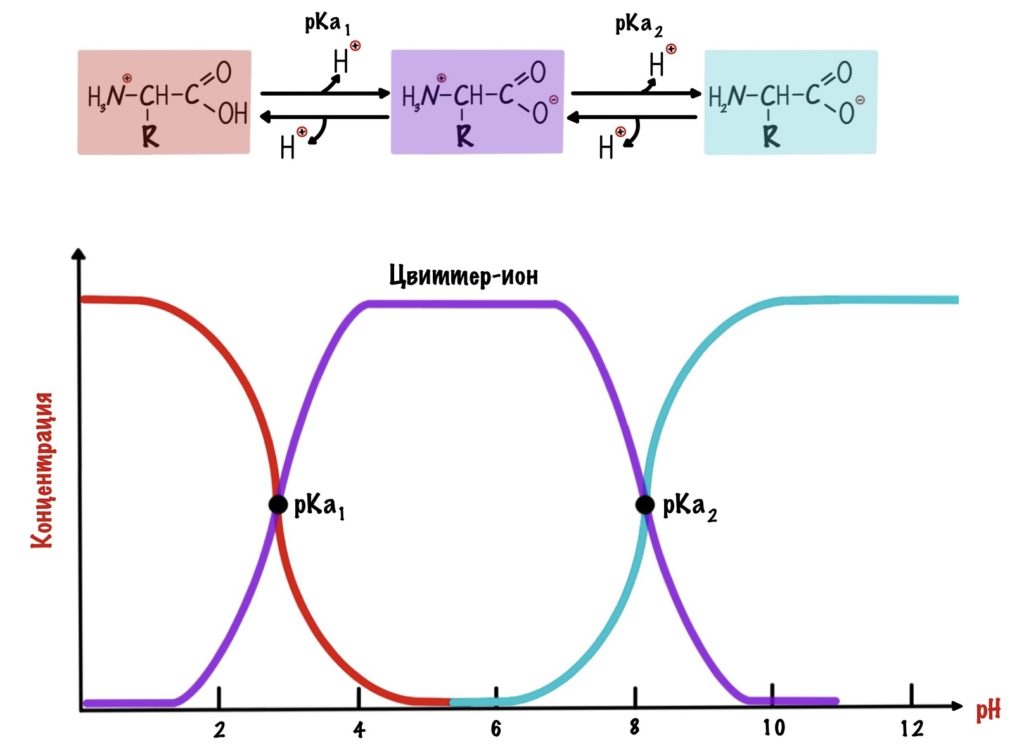
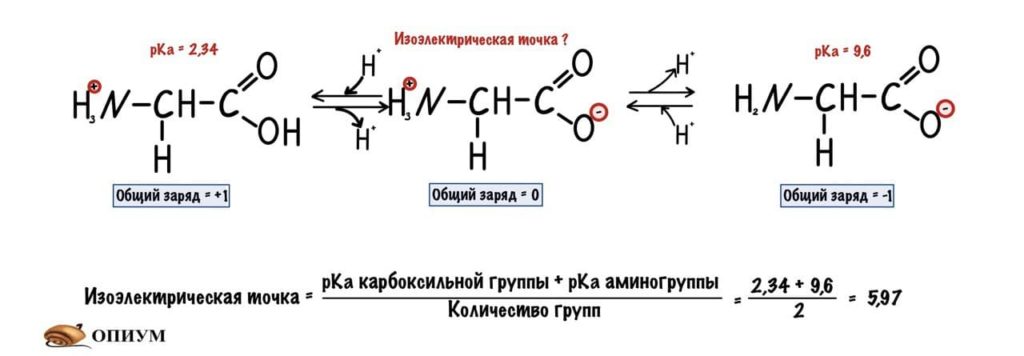
А теперь о том, ради чего все это затевалось — изоэлектрическая точка.
Изоэлектрическая точка — это pH среды, при которой заряд молекулы равен нулю. Да, вот так вот просто. Ее, кстати, можно посчитать — для этого нужно сложить pKa двух ближних функциональных групп и поделить на их количество. А их количество — две.
Сделаем тоже самое с молекулами посложнее, начнем с гистидина.
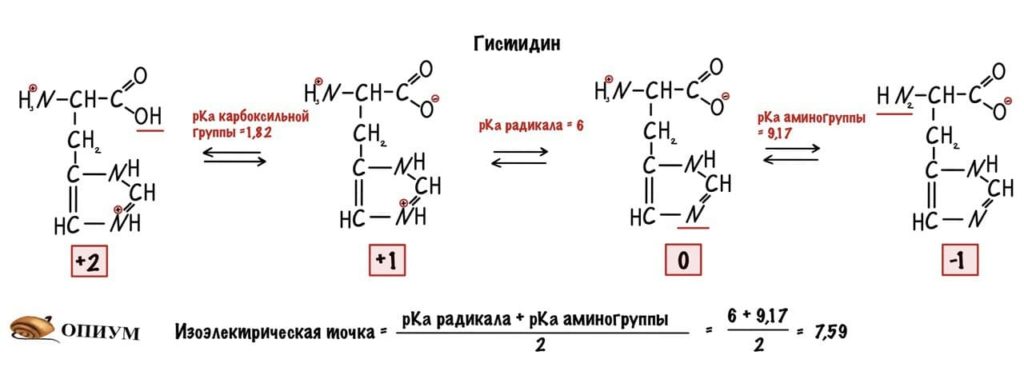
У гистидина есть заряженная группа, поэтому у него побольше вариантов заряда, чем у глицина. Мы видим, что у гистидина карбоксильная группа присоединяет водород при pH =1,82, а аминогруппа отдает протон водорода при pH=9,17. Вот про эти отличия я и говорил до этого, но так-то они не слишком большие. Радикал же отдает протон водорода при pH=6.
Сделаем тоже самое с глутаматом.
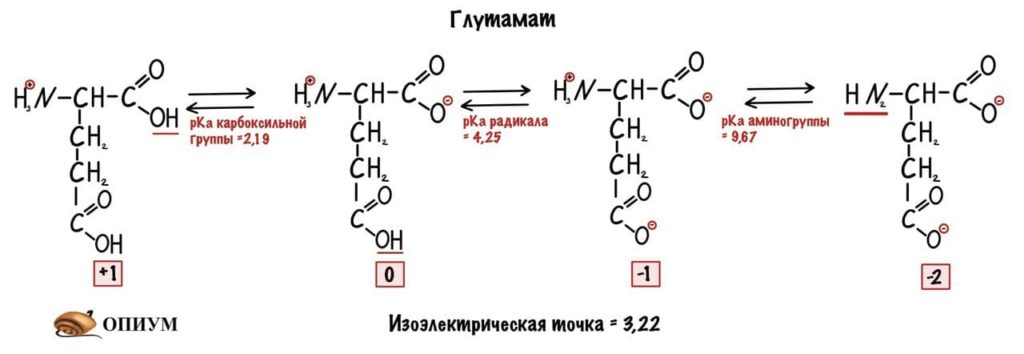
Думаю, что смысл понятен. У каждой аминокислоты своя собственная изоэлектрическая точка. Точки уже давно подсчитаны — достаточно найти их в интернете.
Сделаем красивый вывод:
Любая аминокислота цвиттер-ион, но только в изоэлектрической точке
Зачем это нужно? Ну давайте посмотрим. Мы знаем, что каждая аминокислота несет определенный заряд, но этот заряд меняется от pH среды. Если мы поместим аминокислоты в нейтральную среду и закинем туда катод и анод, то положительно заряженные аминокислоты направятся к аноду, а отрицательные к катоду. Остальные аминокислоты можно будет разделить с помощью изменения pH среды, ведь в изоэлектрической точке у аминокислоты не будет заряда. Нет заряда — нет движения к катоду или аноду, аминокислота стоит на месте. Вот мы и разделили аминокислоты в растворе, можно их изучить.
Образование пептидов
Теперь давайте соединим между собой парочку аминокислот, пусть это будет глицин и аланин. Соединяем их с помощью реакции дегидратации — отщепляем молекулу воды и получаем пептид.
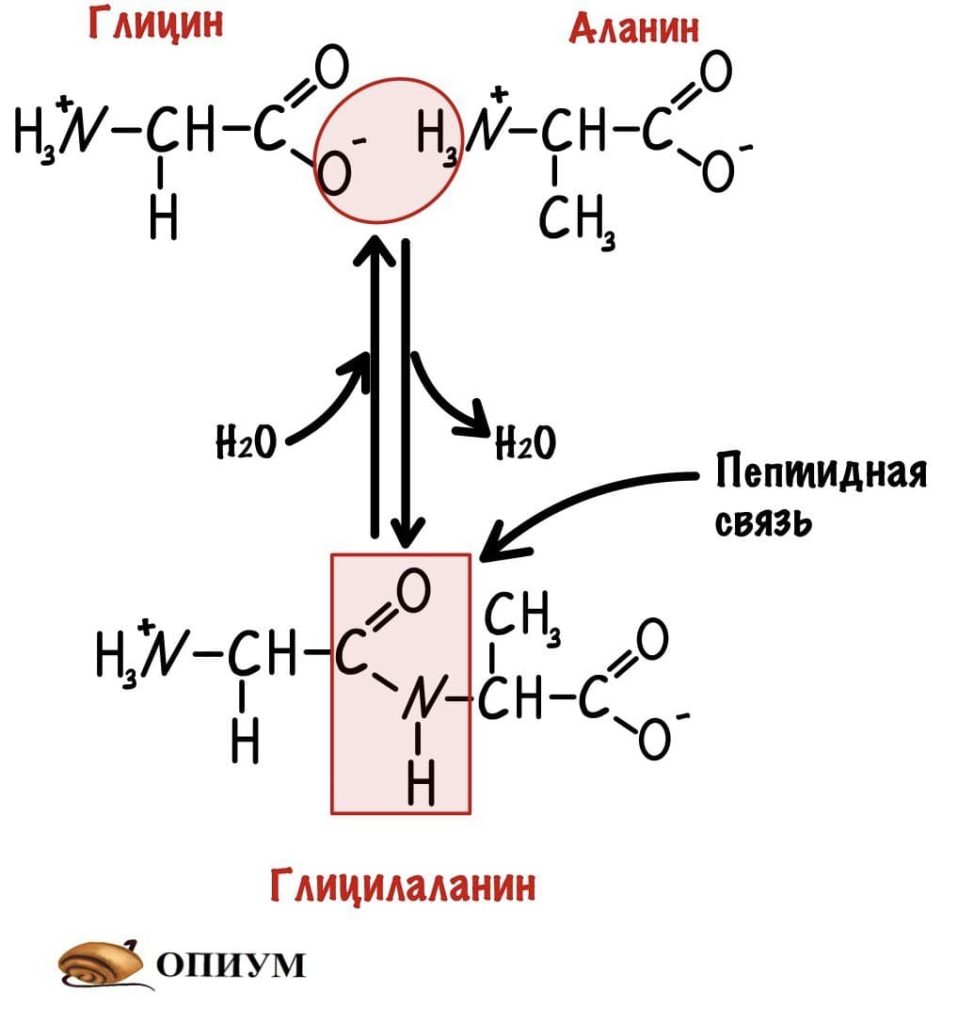
Какие группы вступали в реакцию? Да, аминогруппа и карбоксильная группа. Получается, что пептидная связь — это связь между аминогруппой одной аминокислоты с карбоксильной группой другой аминокислоты. Так как соединены две аминокислоты, то название молекулы — дипептид. Ничего не мешает мне присоединить еще одну.
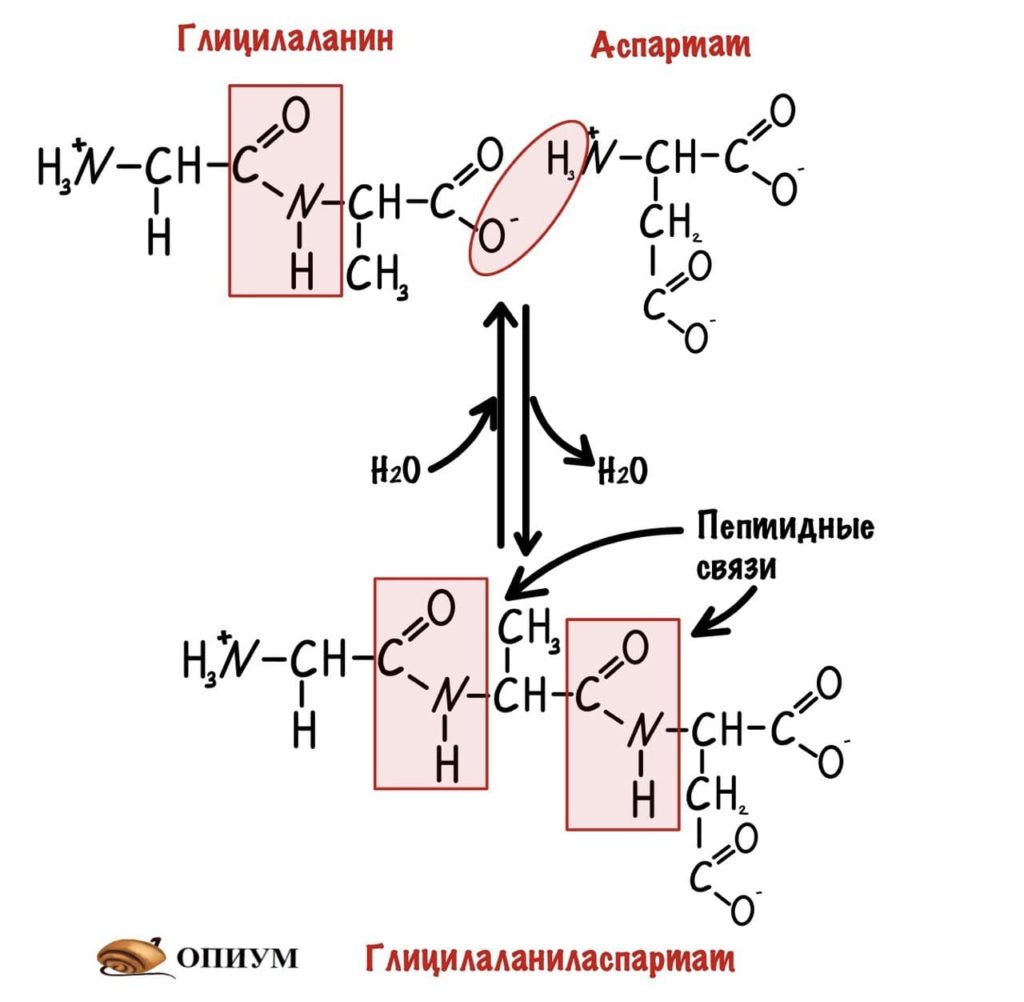
И это уже трипептид. Если соединены до 10 пептидов, то это олигопептид. От 10 до 50 — полипептид, ну а если больше 50, то это белок. Как видите реакция обратима, можно провести гидратацию по пептидной связи и пептид разрушится. На самом деле реакция гидратации идет намного лучше, а вот для дегидратации нужен источник энергии — АТФ, и рибосомальная РНК. Так что для синтеза пептидов/белков организм неплохо так тратится.
Ну и вы заметили, что я располагаю радикалы с разных сторон — то сверху, а то снизу. Это транс положение, оно более устойчиво, но можете писать как хотите.
Белок — это пептид, который содержит более 50 остатков аминокислот
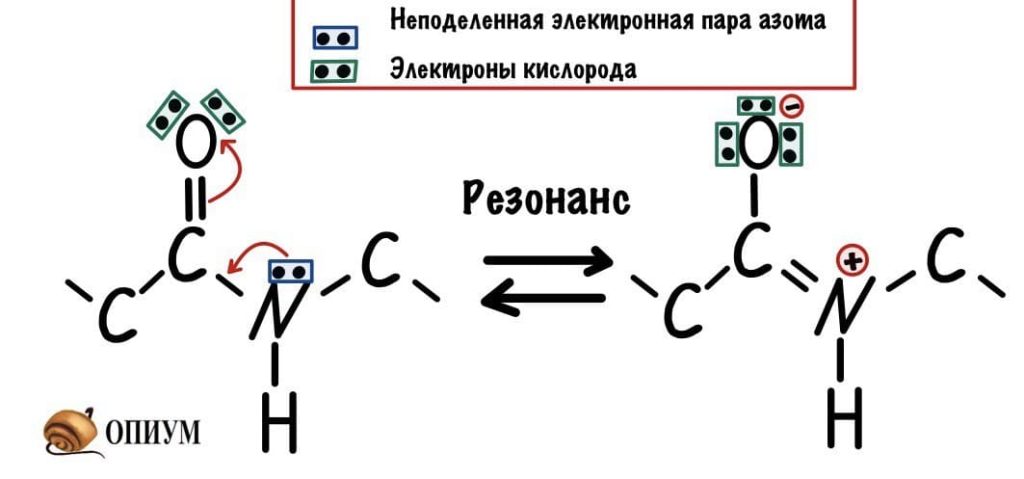
Пептидная связь
У пептидной связи есть свои секретики, но мы не дадим ей хранить их просто так. Главный секрет в том, что двойная связь находится не у кислорода, а у азота… Хотя это не совсем двойная связь, но близка к ней. Как же это происходит? У азота есть неподеленная электронная пара, электроны могут перейти от азота к кислороду, а двойная связь перейдет от кислорода к азоту — неплохой такой обменчик. Это явление называется резонанс пептидной связи, именно из-за него во всех учебниках пишут про «частично-двойной характер пептидной связи».
Пойдем еще немного дальше, о чем нам говорит двойная связь? Правильно, о гибридизации углерода — она здесь sp2. А значит угол между связями углерода 120 градусов, здесь они не прямо 120 градусов, но близки к этому. Идем дальше. Азот здесь тоже в sp2 гибридизации, понятно какие углы и у него. Но к чему я это все? Ах да, как будет выглядеть молекула?
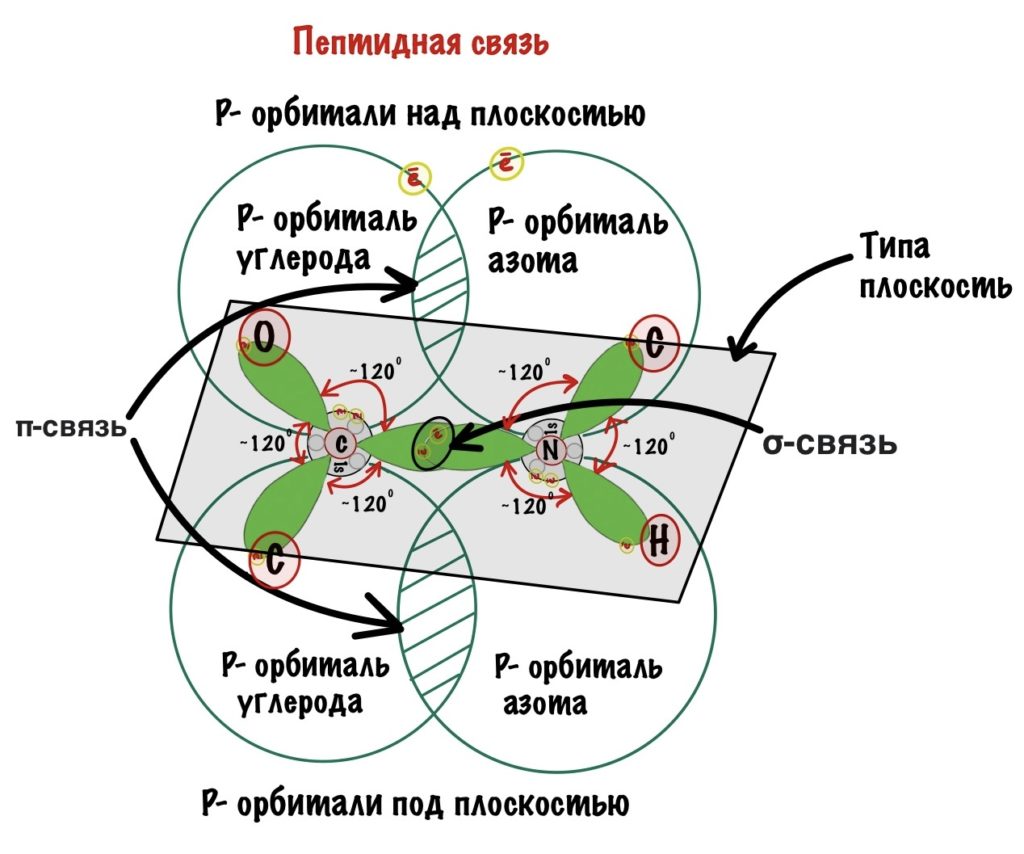
Так как все углы по 120 градусов, то все 6 атомов — 3 углерода, азот, водород и кислород, лежат в одной плоскости, как будто на ладошке. За счет того, что углерод и азот образуют две связи — одну пи и одну сигму, вращение вокруг этих связей практически невозможно. Но об этом чуть позже, сейчас давайте упростим эту схему.
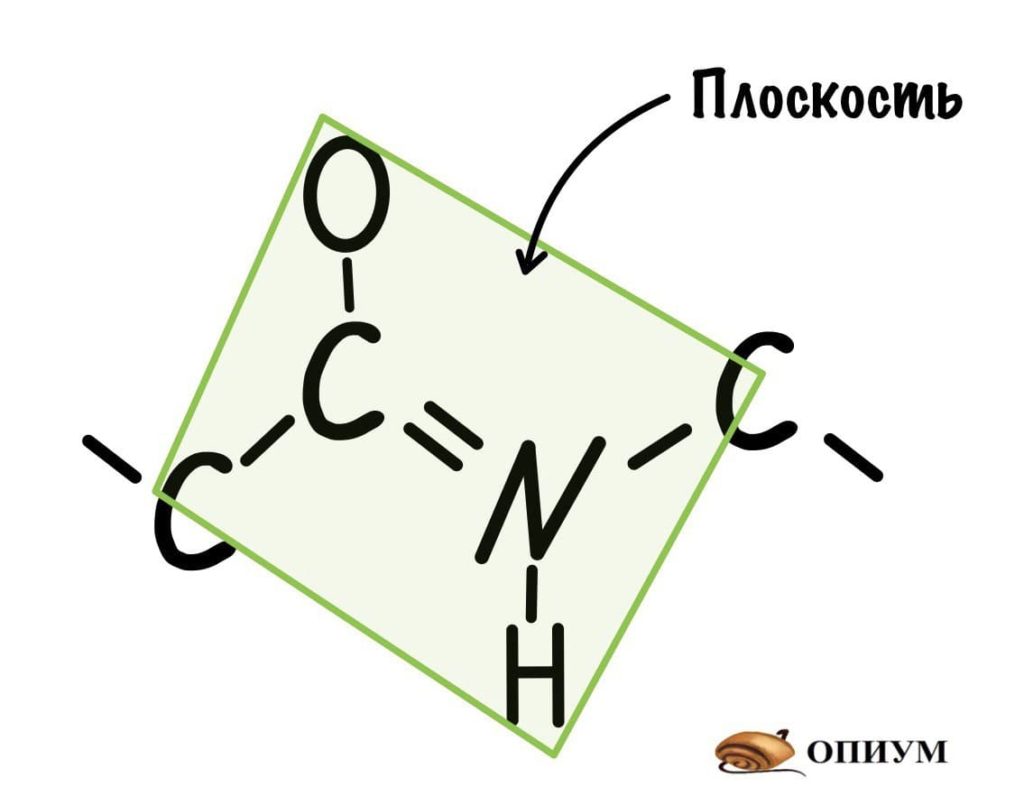
Это мы сделали только с одной пептидной связью, но что если добавить вторую? Получится кое что интересненькое…
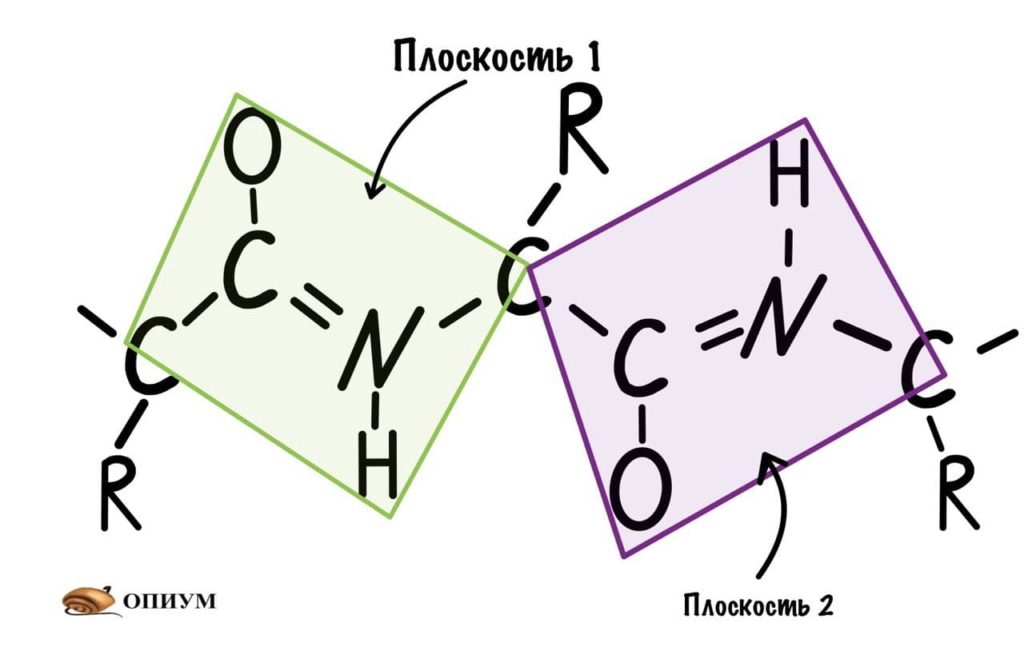
Следующая пептидная связь такая же, как и предыдущая. Получается, что опять 6 атомов лежат в одной плоскости, вы видите, что один атом углерода принадлежит сразу к двум плоскостям и это удивительно! Можно даже подумать, что все эти пептидные связи будут лежать в одной и той же плоскости, но это не так, а виной этому — вращение вокруг связей.
Диэдральные или торсионные углы
Название пугающее, но сейчас как устроим этим углам! Так, мы уже говорили о том, что вокруг пептидной связи не повращаться из-за того, что она частично двойная. Но ведь есть и другие связи, вокруг которых можно устроить веселуху.
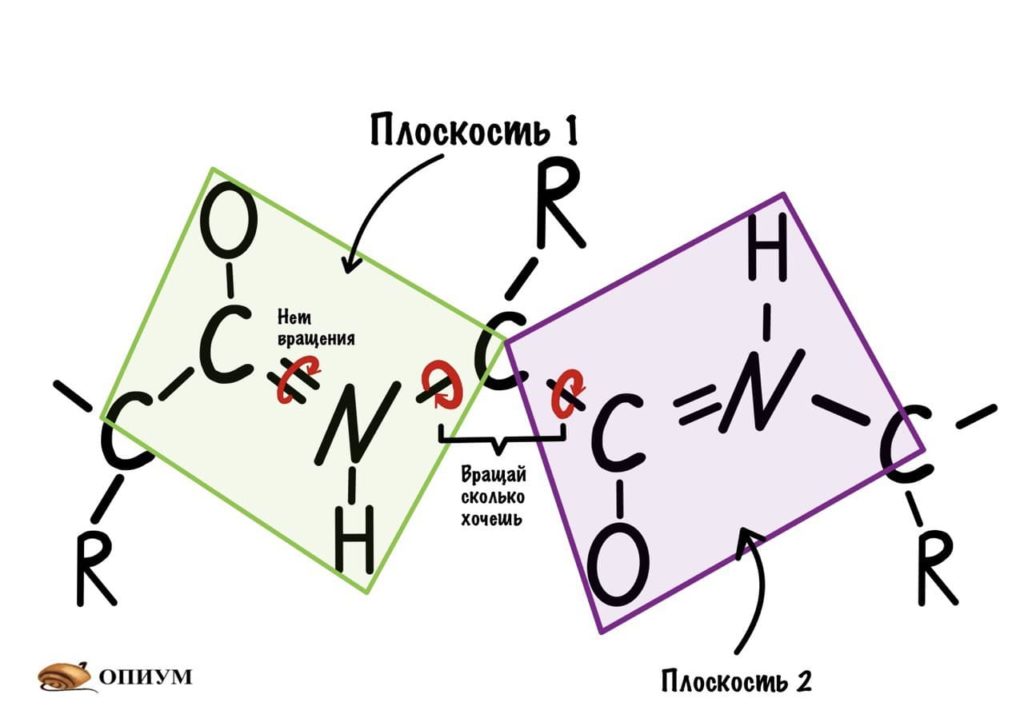
Понимаю, что представить это не так уж и легко, но можно попробовать сделать! Получится конечно не совсем так, но принцип поймем. Возьмем ручку и два колпачка, засунем бумажку под каждый колпачок и начнем крутить. Условимся, что мои пальцы — альфа-углеродный атом, то есть место пересечения двух плоскостей.



Теперь мы поняли, как происходит вращение, но это еще не все. Существуют определенные углы между плоскостями и всего их два. Представьте, что нам захочется найти угол между углеродами, у которых карбоксильная группа, двух плоскостей. Или угол между двумя атомами азота, опять же, двух разных плоскостей. Задачка кажется сложной… Но перед этим, а зачем я вообще мучаю вас этим? Дело в том, что когда мы дойдем до конформации белковых молекул, то благодаря этим углам мы поймем: как и почему образуется альфа-спираль, тоже самое с бета-складчатостью. Так что потерпите немного!
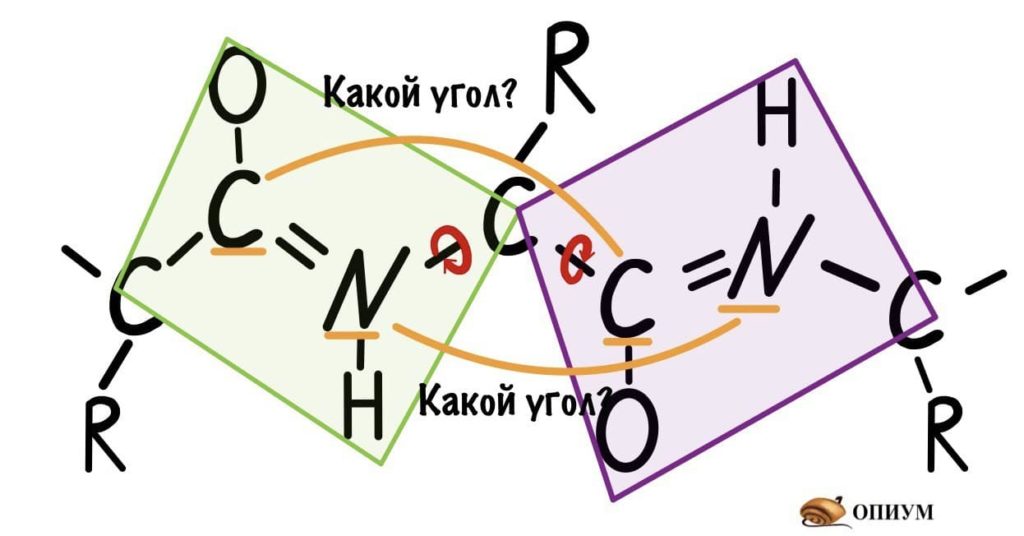
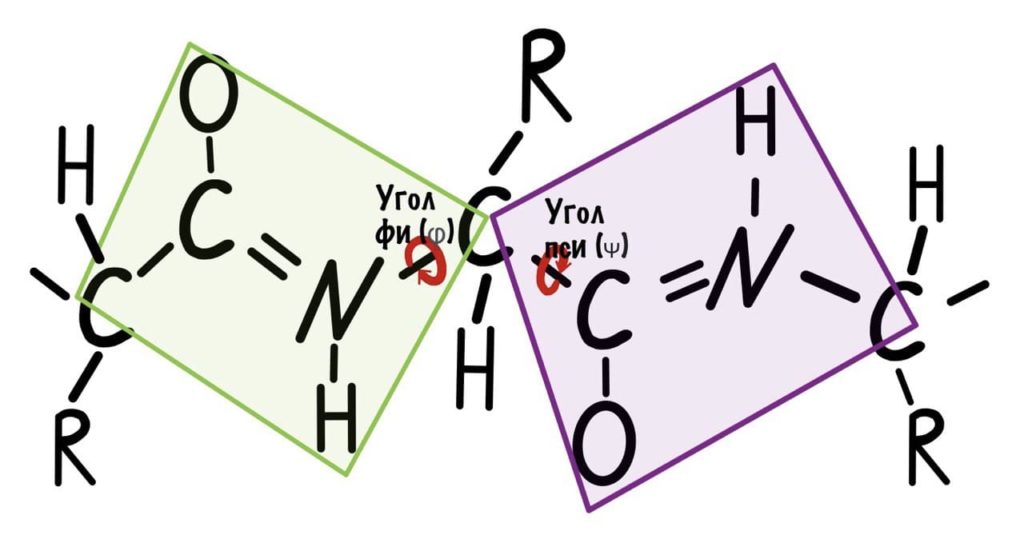
Если посмотреть на эту схему, то можно кое-что прикинуть: если мы будем вращать связь между N и C, то углерод с карбоксильной группой изменит положение относительно углерода другой плоскости, а вот азот останется на том же месте — угол между двумя азотами не изменится. А вот если начнем вращать связь между C и C, то все будет наоборот: угол между азотами изменится, но вот углероды с карбоксильной группой останутся на месте. Сложновато, но чуть дальше я дам пространственную картинку. Пока что мы пришли к выводу, что связь между N и C влияет на угол между углеродами — этот угол называется фи. А вот связь между C и C влияет на угол между атомами азота — угол пси.
Теперь можно и добавить атомы водорода в схему, они скоро нам понадобятся.
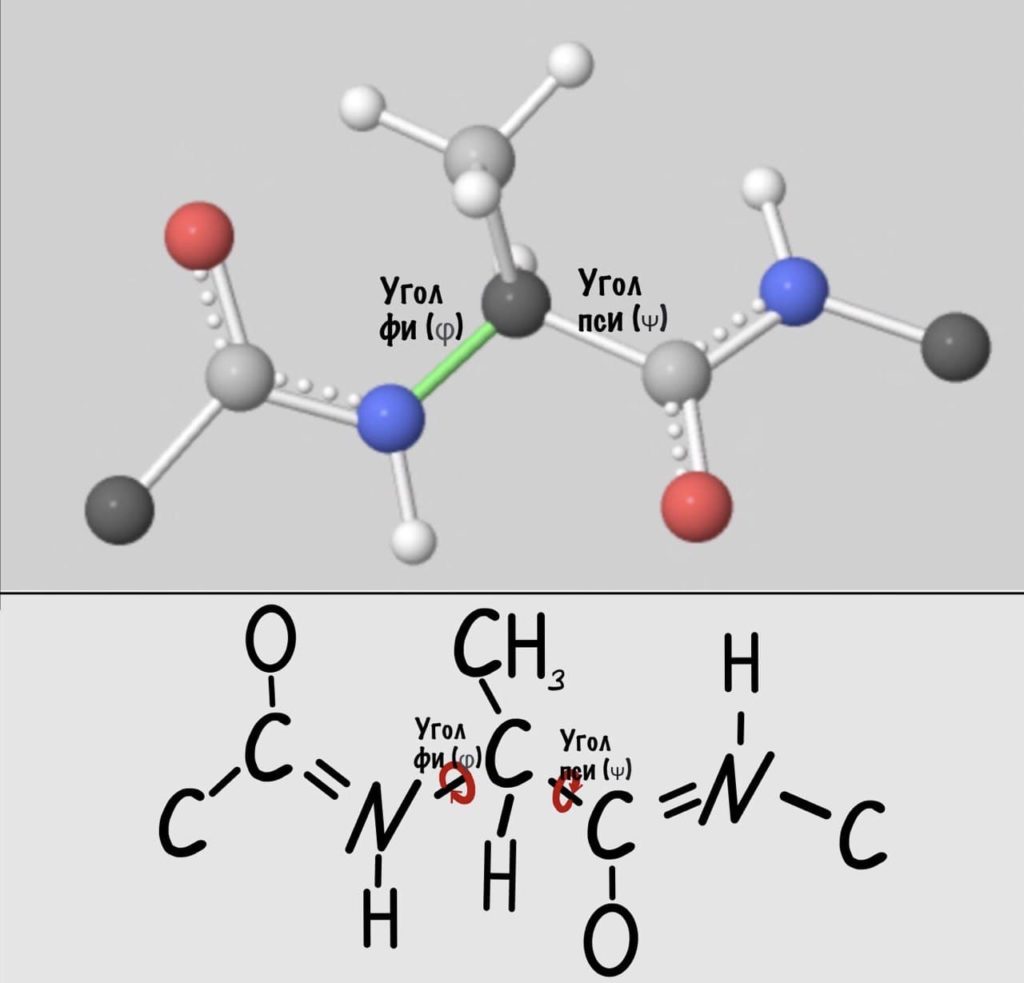
Добавим реалистичности, центральным радикалом у нас будет -CH3, а остальные радикалы уберем.
А теперь главный вопрос — как измерить эти углы? Хорошо, что уже это придумали… И мы можем сделать это вместе — заходите сюда и поехали! Первым делом нам нужно перевернуть молекулу так, чтобы расположить атом углерода с карбоксильной группой сверху. Зачем такие выкрутасы? Расскажу позже. А теперь посмотрим прямо в альфа атом углерода, да так что за ним спрятался азот. Как-то это странно звучит, но давайте попробуем.
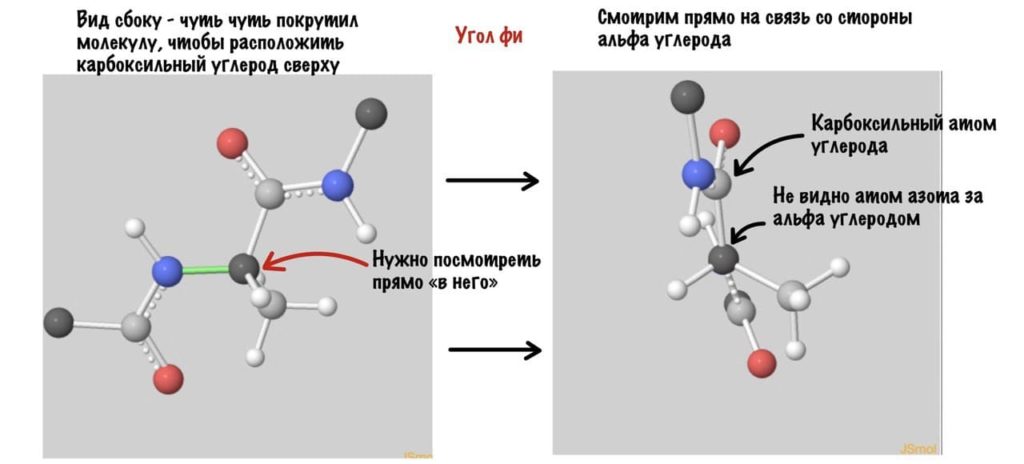
Еще это можно посмотреть графически с помощью проекций Ньюмана.
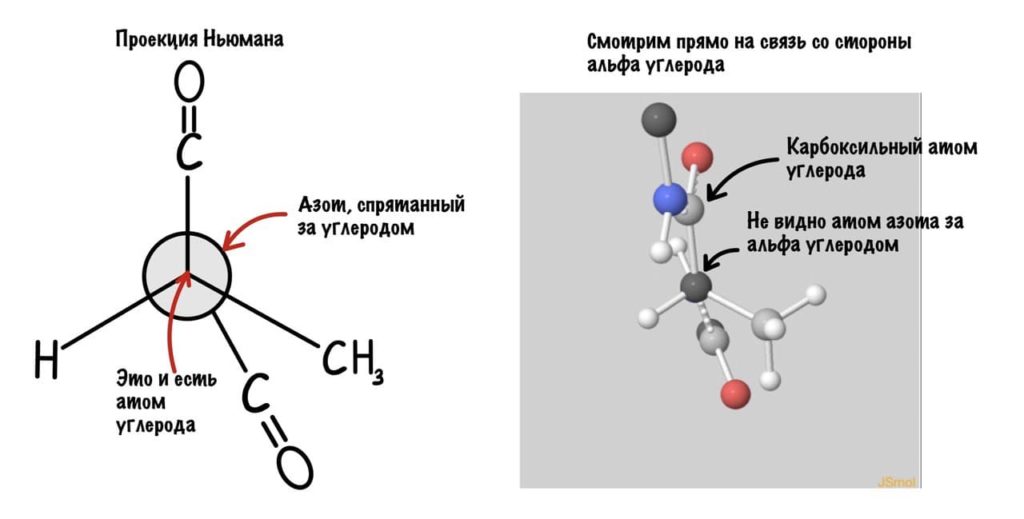
Так, повторим что такое угол фи — это угол между двумя карбоксильными атомами углерода. На рисунке уже их видно.
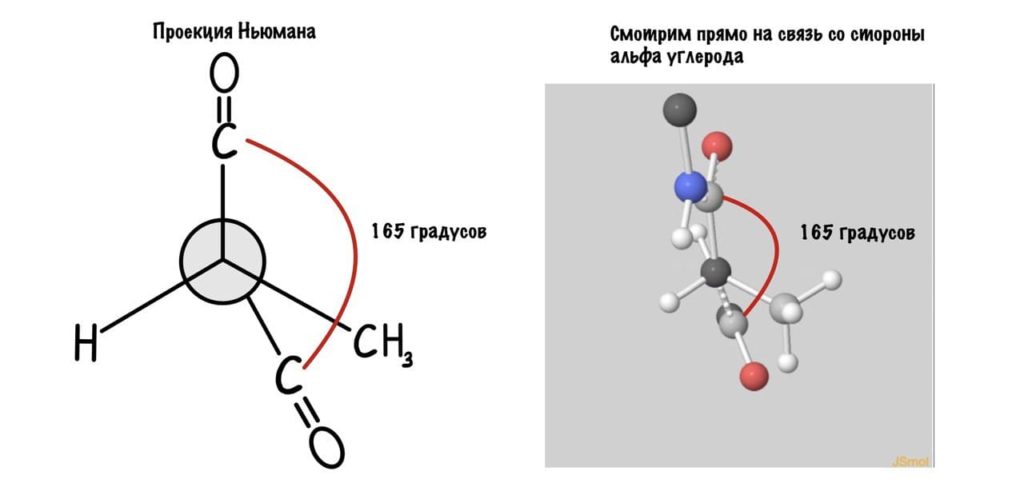
Поняли зачем так крутили молекулу? Да, просто так нам удобнее смотреть угол. А теперь начнем вращать и посмотрим как меняются углы.
Угол пси по такой же логике. Крутим молекулу, чтобы атом азота оказался сверху и смотрим прямо в альфа атом углерода.
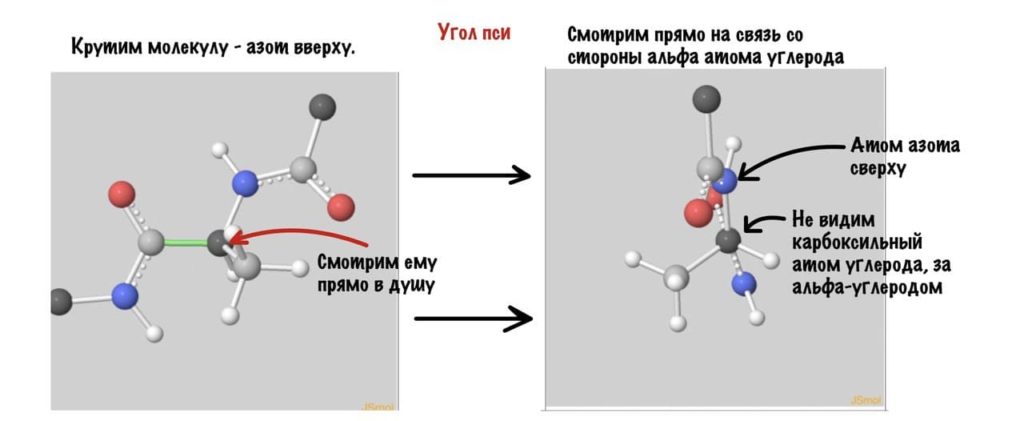
Еще разок построим проекцию Ньюмана, она немного отличается, и сразу же отметим углы.
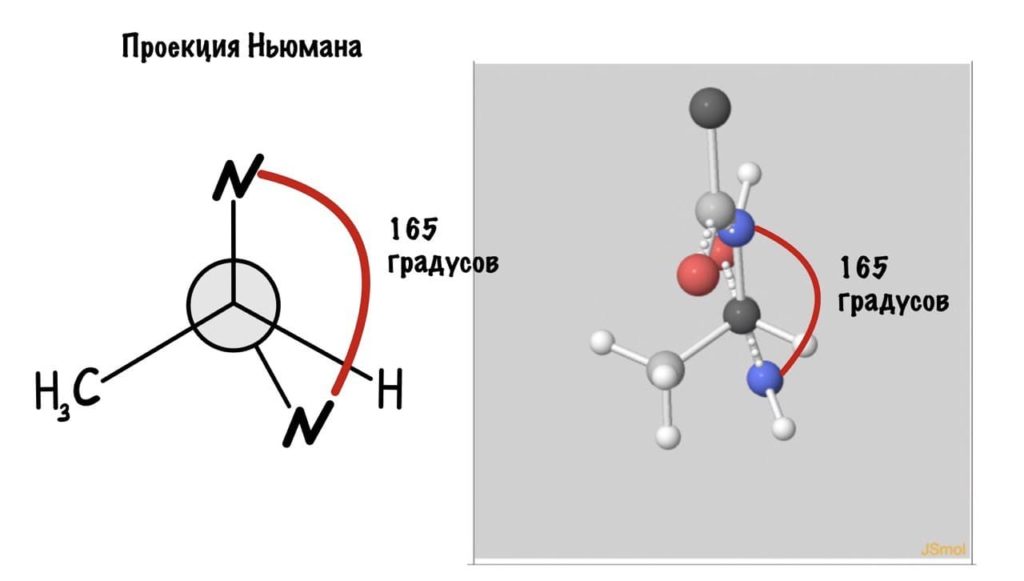
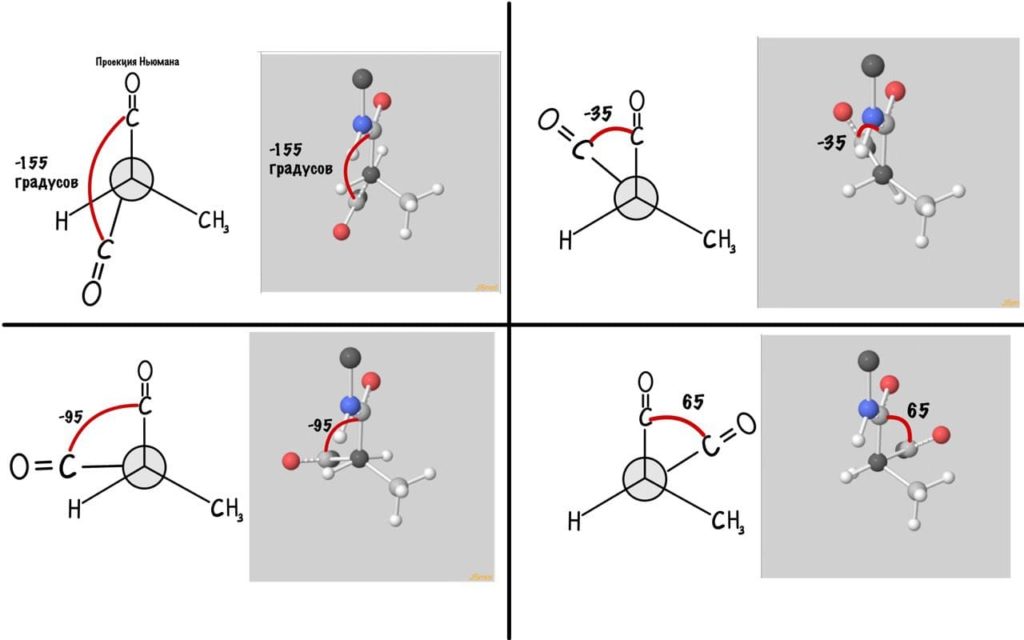
Думаю, что принцип понятен. Дальше можете покрутить сами, правильно? Я не сказал про одно большое «НО» — не каждый угол возможен, так как у атомов есть электронные оболочки, которые заряжены отрицательно. Если электронные оболочки подходят слишком близко, то они отталкиваются и угол меняется. Какие углы возможны? Для этого еще разок зайдите сюда и включите на панельке справа силы Ван-дер-Вальса и show clashes.
Подробнее о влиянии этих углов в следующей статье.
From Wikipedia, the free encyclopedia
The isoelectric point (pI, pH(I), IEP), is the pH at which a molecule carries no net electrical charge or is electrically neutral in the statistical mean. The standard nomenclature to represent the isoelectric point is pH(I).[1] However, pI is also used.[2] For brevity, this article uses pI. The net charge on the molecule is affected by pH of its surrounding environment and can become more positively or negatively charged due to the gain or loss, respectively, of protons (H+).
Surfaces naturally charge to form a double layer. In the common case when the surface charge-determining ions are H+/HO−, the net surface charge is affected by the pH of the liquid in which the solid is submerged.
The pI value can affect the solubility of a molecule at a given pH. Such molecules have minimum solubility in water or salt solutions at the pH that corresponds to their pI and often precipitate out of solution. Biological amphoteric molecules such as proteins contain both acidic and basic functional groups. Amino acids that make up proteins may be positive, negative, neutral, or polar in nature, and together give a protein its overall charge. At a pH below their pI, proteins carry a net positive charge; above their pI they carry a net negative charge. Proteins can, thus, be separated by net charge in a polyacrylamide gel using either preparative gel electrophoresis, which uses a constant pH to separate proteins or isoelectric focusing, which uses a pH gradient to separate proteins. Isoelectric focusing is also the first step in 2-D gel polyacrylamide gel electrophoresis.
In biomolecules, proteins can be separated by ion exchange chromatography. Biological proteins are made up of zwitterionic amino acid compounds; the net charge of these proteins can be positive or negative depending on the pH of the environment. The specific pI of the target protein can be used to model the process around and the compound can then be purified from the rest of the mixture. Buffers of various pH can be used for this purification process to change the pH of the environment. When a mixture containing a target protein is loaded into an ion exchanger, the stationary matrix can be either positively-charged (for mobile anions) or negatively-charged (for mobile cations). At low pH values, the net charge of most proteins in the mixture is positive – in cation exchangers, these positively-charged proteins bind to the negatively-charged matrix. At high pH values, the net charge of most proteins is negative, where they bind to the positively-charged matrix in anion exchangers. When the environment is at a pH value equal to the protein’s pI, the net charge is zero, and the protein is not bound to any exchanger, and therefore, can be eluted out.[3]
Calculating pI values[edit]
For an amino acid with only one amine and one carboxyl group, the pI can be calculated from the mean of the pKas of this molecule.[4]
The pH of an electrophoretic gel is determined by the buffer used for that gel. If the pH of the buffer is above the pI of the protein being run, the protein will migrate to the positive pole (negative charge is attracted to a positive pole). If the pH of the buffer is below the pI of the protein being run, the protein will migrate to the negative pole of the gel (positive charge is attracted to the negative pole). If the protein is run with a buffer pH that is equal to the pI, it will not migrate at all. This is also true for individual amino acids.
Examples[edit]
In the two examples (on the right) the isoelectric point is shown by the green vertical line. In glycine the pK values are separated by nearly 7 units. Thus in the gas phase, the concentration of the neutral species, glycine (GlyH), is effectively 100% of the analytical glycine concentration.[5] Glycine may exist as a zwitterion at the isoelectric point, but the equilibrium constant for the isomerization reaction in solution
is not known.
The other example, adenosine monophosphate is shown to illustrate the fact that a third species may, in principle, be involved. In fact the concentration of (AMP)H2+3 is negligible at the isoelectric point in this case.
If the pI is greater than the pH, the molecule will have a positive charge.
Isoelectric point of peptides and proteins[edit]
A number of algorithms for estimating isoelectric points of peptides and proteins have been developed. Most of them use Henderson–Hasselbalch equation with different pK values. For instance, within the model proposed by Bjellqvist and co-workers the pK’s were determined between closely related immobilines, by focusing the same sample in overlapping pH gradients.[6] Some improvements in the methodology (especially in the determination of the pK values for modified amino acids) have been also proposed.[7][8] More advanced methods take into account the effect of adjacent amino acids ±3 residues away from a charged aspartic or glutamic acid, the effects on free C terminus, as well as they apply a correction term to the corresponding pK values using genetic algorithm.[9] Other recent approaches are based on a support vector machine algorithm[10] and pKa optimization against experimentally known protein/peptide isoelectric points.[11]
Moreover, experimentally measured isoelectric point of proteins were aggregated into the databases.[12][13] Recently, a database of isoelectric points for all proteins predicted using most of the available methods had been also developed.[14]
In practice, a protein with an excess of basic aminoacids (arginine, lysine and/or histidine) will bear an isoelectric point roughly greater than 7 (basic), while a protein with an excess of acidic aminoacids (aspartic acid and/or glutamic acid) will often have an isoelectric point lower than 7 (acidic).
The electrophoretic linear (horizontal) separation of proteins by Ip along a pH gradient in a polyacrylamide gel (also known as isoelectric focusing), followed by a standard molecular weight linear (vertical) separation in a second polyacrylamide gel (SDS-PAGE), constitutes the so called two-dimensional gel electrophoresis or PAGE 2D. This technique allows a thorough separation of proteins as distinct “spots”, with proteins of high molecular weight and low Ip migrating to the upper-left part of the bidimensional gel, while proteins with low molecular weight and high Ip locate to the bottom-right region of the same gel.
Ceramic materials[edit]
The isoelectric points (IEP) of metal oxide ceramics are used extensively in material science in various aqueous processing steps (synthesis, modification, etc.). In the absence of chemisorbed or physisorbed species particle surfaces in aqueous suspension are generally assumed to be covered with surface hydroxyl species, M-OH (where M is a metal such as Al, Si, etc.).[15] At pH values above the IEP, the predominant surface species is M-O−, while at pH values below the IEP, M-OH2+ species predominate. Some approximate values of common ceramics are listed below:[16][17]
| Material | IEP |
|---|---|
| WO3[18] | 0.2-0.5 |
| Sb2O5[18] | <0.4-1.9 |
| V2O5[18][19] | 1-2 (3) |
| δ-MnO2 | 1.5 |
| SiO2[18] | 1.7-3.5 |
| SiC[20] | 2-3.5 |
| Ta2O5[18] | 2.7-3.0 |
| TiO2[21] | 2.8-3.8 |
| γ-Fe2O3[18] | 3.3-6.7 |
| SnO2[22] | 4-5.5 (7.3) |
| ZrO2[18] | 4-11 |
| ITO[23] | 6 |
| Cr2O3[18][19] | 6.2-8.1 (7) |
| Fe3O4[18] | 6.5-6.8 |
| CeO2[18] | 6.7-8.6 |
| Y2O3[18] | 7.15-8.95 |
| γ-Al2O3 | 7-8 |
| β-MnO2[19] | 7.3 |
| Tl2O[24] | 8 |
| α-Al2O3 | 8-9 |
| α-Fe2O3[18] | 8.4-8.5 |
| ZnO[18] | 8.7-10.3 |
| Si3N4[22] | 9 |
| CuO[22] | 9.5 |
| La2O3 | 10 |
| NiO[22] | 10-11 |
| PbO[18] | 10.7-11.6 |
| MgO[18] | 12-13 (9.8-12.7) |
Note: The following list gives the isoelectric point at 25 °C for selected materials in water. The exact value can vary widely, depending on material factors such as purity and phase as well as physical parameters such as temperature. Moreover, the precise measurement of isoelectric points can be difficult, thus many sources often cite differing values for isoelectric points of these materials.
Mixed oxides may exhibit isoelectric point values that are intermediate to those of the corresponding pure oxides. For example, a synthetically prepared amorphous aluminosilicate (Al2O3-SiO2) was initially measured as having IEP of 4.5 (the electrokinetic behavior of the surface was dominated by surface Si-OH species, thus explaining the relatively low IEP value).[25] Significantly higher IEP values (pH 6 to 8) have been reported for 3Al2O3-2SiO2 by others.[22] Similarly, also IEP of barium titanate, BaTiO3 was reported in the range 5-6[22] while others got a value of 3.[26] Mixtures of titania (TiO2) and zirconia (ZrO2) were studied and found to have an isoelectric point between 5.3-6.9, varying non-linearly with %(ZrO2).[27] The surface charge of the mixed oxides was correlated with acidity. Greater titania content led to increased Lewis acidity, whereas zirconia-rich oxides displayed Br::onsted acidity. The different types of acidities produced differences in ion adsorption rates and capacities.
Isoelectric point versus point of zero charge[edit]
The terms isoelectric point (IEP) and point of zero charge (PZC) are often used interchangeably, although under certain circumstances, it may be productive to make the distinction.
In systems in which H+/OH− are the interface potential-determining ions, the point of zero charge is given in terms of pH. The pH at which the surface exhibits a neutral net electrical charge is the point of zero charge at the surface. Electrokinetic phenomena generally measure zeta potential, and a zero zeta potential is interpreted as the point of zero net charge at the shear plane. This is termed the isoelectric point.[28] Thus, the isoelectric point is the value of pH at which the colloidal particle remains stationary in an electrical field. The isoelectric point is expected to be somewhat different from the point of zero charge at the particle surface, but this difference is often ignored in practice for so-called pristine surfaces, i.e., surfaces with no specifically adsorbed positive or negative charges.[15] In this context, specific adsorption is understood as adsorption occurring in a Stern layer or chemisorption. Thus, point of zero charge at the surface is taken as equal to isoelectric point in the absence of specific adsorption on that surface.
According to Jolivet,[19] in the absence of positive or negative charges, the surface is best described by the point of zero charge. If positive and negative charges are both present in equal amounts, then this is the isoelectric point. Thus, the PZC refers to the absence of any type of surface charge, while the IEP refers to a state of neutral net surface charge. The difference between the two, therefore, is the quantity of charged sites at the point of net zero charge. Jolivet uses the intrinsic surface equilibrium constants, pK− and pK+ to define the two conditions in terms of the relative number of charged sites:
For large ΔpK (>4 according to Jolivet), the predominant species is MOH while there are relatively few charged species – so the PZC is relevant. For small values of ΔpK, there are many charged species in approximately equal numbers, so one speaks of the IEP.
See also[edit]
- Henderson-Hasselbalch equation
- Isoelectric focusing
- Zeta potential
- Electrophoretic deposition
- Isoionic point
- pK acid dissociation constant
- QPNC-PAGE
References[edit]
- ^ Acceptable variants on pH(I) would include pHI, pHIEP, etc; the main point is that one cannot take the ‘power’ of I, rather one measures the pH subject to a nominated condition.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (2006–) “isoelectric point in electrophoresis“. doi:10.1351/goldbook.I03275
- ^ Dayton, W. R. (1983). “Protein Separation Techniques” (PDF). Reciprocal Meat Conference Proceedings. 36: 98–102.
- ^ For derivation of this expression see acid dissociation constant
- ^ Jensen, Jan H.; Gordon, Mark S. (August 1995). “On the Number of Water Molecules Necessary To Stabilize the Glycine Zwitterion”. Journal of the American Chemical Society. 117 (31): 8159–8170. doi:10.1021/ja00136a013. ISSN 0002-7863.
- ^ Bjellqvist, B.; Hughes, G. J.; Pasquali, C.; Paquet, N.; Ravier, F.; Sanchez, J. C.; Frutiger, S.; Hochstrasser, D. (1993-10-01). “The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences”. Electrophoresis. 14 (10): 1023–1031. doi:10.1002/elps.11501401163. ISSN 0173-0835. PMID 8125050. S2CID 38041111.
- ^ Gauci, Sharon; van Breukelen, Bas; Lemeer, Simone M.; Krijgsveld, Jeroen; Heck, Albert J. R. (2008-12-01). “A versatile peptide pI calculator for phosphorylated and N-terminal acetylated peptides experimentally tested using peptide isoelectric focusing”. Proteomics. 8 (23–24): 4898–4906. doi:10.1002/pmic.200800295. ISSN 1615-9861. PMID 19003858. S2CID 21527631.
- ^ Gasteiger, Elisabeth; Gattiker, Alexandre; Hoogland, Christine; Ivanyi, Ivan; Appel, Ron D.; Bairoch, Amos (2003-07-01). “ExPASy: the proteomics server for in-depth protein knowledge and analysis”. Nucleic Acids Research. 31 (13): 3784–3788. doi:10.1093/nar/gkg563. ISSN 0305-1048. PMC 168970. PMID 12824418.
- ^ Cargile, Benjamin J.; Sevinsky, Joel R.; Essader, Amal S.; Eu, Jerry P.; Stephenson, James L. (2008-07-01). “Calculation of the isoelectric point of tryptic peptides in the pH 3.5-4.5 range based on adjacent amino acid effects”. Electrophoresis. 29 (13): 2768–2778. doi:10.1002/elps.200700701. ISSN 0173-0835. PMID 18615785.
- ^ Perez-Riverol, Yasset; Audain, Enrique; Millan, Aleli; Ramos, Yassel; Sanchez, Aniel; Vizcaíno, Juan Antonio; Wang, Rui; Müller, Markus; Machado, Yoan J. (2012-04-03). “Isoelectric point optimization using peptide descriptors and support vector machines”. Journal of Proteomics. 75 (7): 2269–2274. doi:10.1016/j.jprot.2012.01.029. ISSN 1876-7737. PMID 22326964.
- ^ Kozlowski, LP. (2016). “IPC – Isoelectric Point Calculator”. Biol Direct. 11 (1): 55. doi:10.1186/s13062-016-0159-9. PMC 5075173. PMID 27769290.
- ^ Hoogland, C.; Mostaguir, K.; Sanchez, JC.; Hochstrasser, DF.; Appel, RD. (2004). “SWISS-2DPAGE, ten years later”. Proteomics. 4 (8): 2352–6. doi:10.1002/pmic.200300830. PMID 15274128. S2CID 31933242.
- ^ Bunkute, E.; Cummins, C.; Crofts, FJ.; Bunce, G.; Nabney, IT.; Flower, DR. (2015). “PIP-DB: the Protein Isoelectric Point database”. Bioinformatics. 31 (2): 295–6. doi:10.1093/bioinformatics/btu637. PMID 25252779.
- ^ Kozlowski, LP. (2016). “Proteome-pI: proteome isoelectric point database”. Nucleic Acids Res. 45 (D1): D1112–D1116. doi:10.1093/nar/gkw978. PMC 5210655. PMID 27789699.
- ^ a b
Hanaor, D.A.H.; Michelazzi, M.; Leonelli, C.; Sorrell, C.C. (2012). “The effects of carboxylic acids on the aqueous dispersion and electrophoretic deposition of ZrO2“. Journal of the European Ceramic Society. 32 (1): 235–244. arXiv:1303.2754. doi:10.1016/j.jeurceramsoc.2011.08.015. S2CID 98812224. - ^ Haruta, M (2004). “Nanoparticulate Gold Catalysts for Low-Temperature CO Oxidation”. Journal of New Materials for Electrochemical Systems. 7: 163–172.
- ^ Brunelle JP (1978). ‘Preparation of Catalysts by Metallic Complex Adsorption on Mineral Oxides’. Pure and Applied Chemistry vol. 50, pp. 1211-1229.
- ^ a b c d e f g h i j k l m n o Marek Kosmulski, “Chemical Properties of Material Surfaces”, Marcel Dekker, 2001.
- ^ a b c d Jolivet J.P., Metal Oxide Chemistry and Synthesis. From Solution to Solid State, John Wiley & Sons Ltd. 2000, ISBN 0-471-97056-5 (English translation of the original French text, De la Solution à l’Oxyde, InterEditions et CNRS Editions, Paris, 1994).
- ^ U.S. Patent 5,165,996
- ^ Anodic Aqueous Electrophoretic Deposition of Titanium Dioxide Using Carboxylic Acids as Dispersing Agents Journal of the European Ceramic Society, 31(6), 1041-1047, 2011
- ^ a b c d e f Lewis, JA (2000). “Colloidal Processing of Ceramics”. Journal of the American Ceramic Society. 83 (10): 2341–2359. CiteSeerX 10.1.1.514.1543. doi:10.1111/j.1151-2916.2000.tb01560.x.
- ^ Daido, T; Akaike, T (1993). “Electrochemistry of cytochrome c: influence of coulombic attraction with indium tin oxide electrode”. Journal of Electroanalytical Chemistry. 344 (1–2): 91–106. doi:10.1016/0022-0728(93)80048-m.
- ^ Kosmulski, M; Saneluta, C (2004). “Point of zero charge/isoelectric point of exotic oxides: Tl2O3”. Journal of Colloid and Interface Science. 280 (2): 544–545. Bibcode:2004JCIS..280..544K. doi:10.1016/j.jcis.2004.08.079. PMID 15533430.
- ^ Jara, A.A.; Goldberg, S.; Mora, M.L. (2005). “Studies of the surface charge of amorphous aluminosilicates using surface complexation models”. Journal of Colloid and Interface Science. 292 (1): 160–170. Bibcode:2005JCIS..292..160J. doi:10.1016/j.jcis.2005.05.083. hdl:10533/176403. PMID 16051258.
- ^ Vamvakaki, Maria; Billingham, Norman C.; Armes, Steven P.; Watts, John F.; Greaves, Stephen J. (2001). “Controlled structure copolymers for the dispersion of high-performance ceramics in aqueous media”. Journal of Materials Chemistry. 11 (10): 2437–2444. doi:10.1039/b101728o. ISSN 0959-9428.
- ^ Drisko, Glenna L; Luca, Vittorio; Sizgek, Erden; Scales, Nicolas F.; Caruso, Rachel A. (2009). “Template Synthesis and Adsorption Properties of Hierarchically Porous Zirconium Titanium Oxides”. Langmuir. 25 (9): 5286–5293. doi:10.1021/la804030h. ISSN 0743-7463. PMID 19397363.
- ^ A.W. Adamson, A.P. Gast, “Physical Chemistry of Surfaces”, John Wiley and Sons, 1997.
Further reading[edit]
- Nelson DL, Cox MM (2004). Lehninger Principles of Biochemistry. W. H. Freeman; 4th edition (Hardcover). ISBN 0-7167-4339-6
- Kosmulski M. (2009). Surface Charging and Points of Zero Charge. CRC Press; 1st edition (Hardcover). ISBN 978-1-4200-5188-9
External links[edit]
- IPC – Isoelectric Point Calculator — calculate protein isoelectric point using over 15 methods
- prot pi – protein isoelectric point — an online program for calculating pI of proteins (include multiple subunits and posttranslational modifications)
- CurTiPot — a suite of spreadsheets for computing acid-base equilibria (charge versus pH plot of amphoteric molecules e.g., amino acids)
- pICalculax — Isoelectric point (pI) predictor for chemically modified peptides and proteins
- SWISS-2DPAGE — a database of isoelectric points coming from two-dimensional polyacrylamide gel electrophoresis (~ 2,000 proteins)
- PIP-DB — a Protein Isoelectric Point database (~ 5,000 proteins)
- Proteome-pI — a proteome isoelectric point database (predicted isoelectric point for all proteins)


![{mathrm {p}}K^{-}-{mathrm {p}}K^{+}=Delta {mathrm {p}}K=log {{frac {left[{mathrm {MOH}}right]^{2}}{left[{mathrm {MOH}}{_{2}^{+}}right]left[{mathrm {MO}}^{-}right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e3191d7ab56090ff3c419b53868c6c52134d80a)
