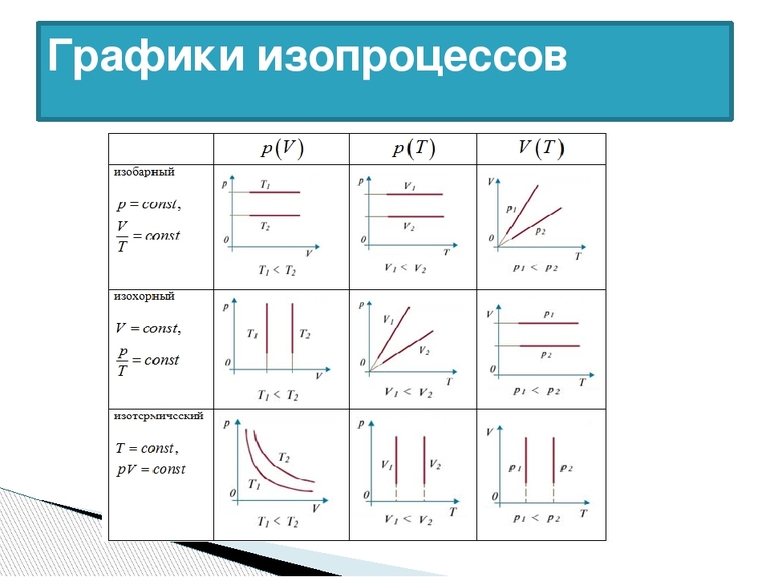
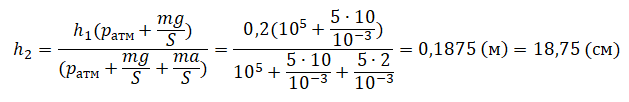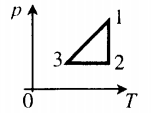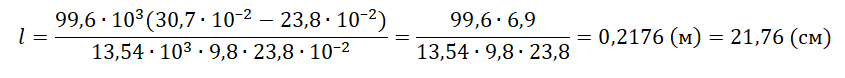Изопроцессы в МКТ — это процессы, протекающие в газах с каким-нибудь неизменным параметром. Для начала мы рассмотрим газ, у которого постоянная масса и химический состав. То есть в газе не меняется количество вещества ν . В этом случае мы можем упростить уравнение Менделеева-Клайперона.
Я не буду углубляться в названия газовых законов, вы это прочтете в учебниках. Займемся чистой математикой
Итак, у нас есть некий газ постоянной массы. Основные характеристики его состояния определяются . То есть, если мы будем на этот газ как-то воздействовать, меняя его характеристики, то
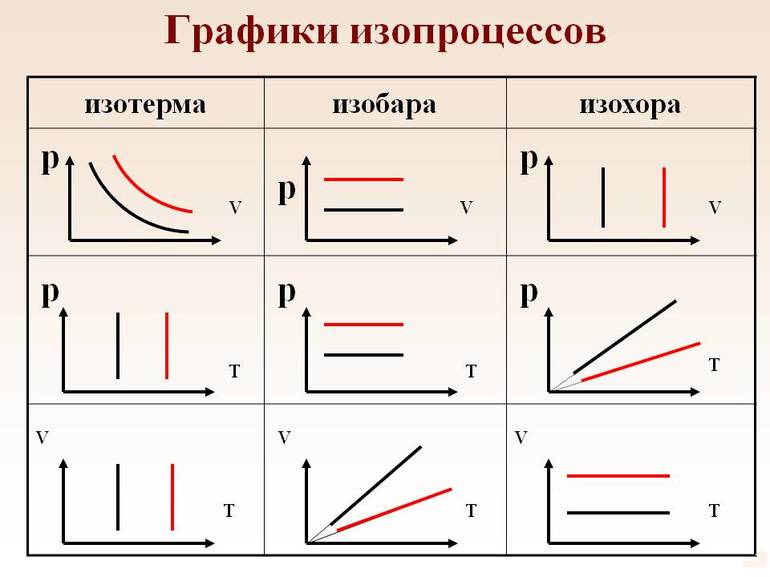
Получается, что все три его характеристики связаны. Но можно рассмотреть случаи, когда один из этих компонентов не меняется. это и будут изопроцессы. Посмотрим, как будут выглядеть графики изопроцессов в осях p(V), p(T), V(T).
Теперь рассмотрим график конкретного циклического процесса, представленного на рисунке в координатах V-T :

ВC: Изохора
CD: Изобара
DA: Изотерма

А теперь можно построить этот же циклический процесс на графиках с другими координатами.
Обратите внимание, что значения в эти графики из риунка1 можно перенести только на оси температуры и объема. Значения для давления произвольные, но… ВС — изохора, следовательно, прямая, ей соответствующая, обязательно должна начинаться в нуле в осях Р-Т! В осях P-V изотерма DA — кривая (гипербола)
Разбор некоторых задач →
- ГЛАВНАЯ >
- ПРЕДМЕТЫ >
- МОЛЕКУЛЯРНАЯ ФИЗИКА >
- ГРАФИКИ ИЗОХОРНОГО ПРОЦЕССА
Графики изохорного процесса
Без воды — краткий вариант ответа,
легко понять и
запомнить
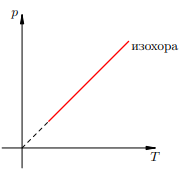
График изохорного процесса называется изохорой. На pT-диаграмме изохора p = const · T является прямой линией.(рис. 1)
Рисунок 1. Изохора на pT-диаграмме
Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах.
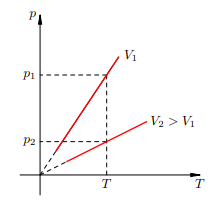
Далее, чем больше объём, тем ниже идёт изохора на pT-диаграмме(рис.2)
Рисунок 2.Чем ниже изохора, тем больше объём
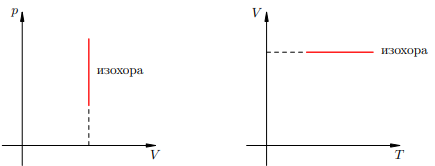
Доказательство аналогично предыдущему. Фиксируем температуру T и видим, что p2 < p1. Но при фиксированной температуре давление тем меньше, чем больше объём (снова закон Бойля — Мариотта). Стало быть, V2 > V1. В оставшихся двух системах координат изохора является прямой линией, перпендикулярной оси V
Рисунок 3. Изохоры на pV – и V T-диаграммах
Теперь на ZNZN можно делать свои конспекты
Легко создавать, делиться и просматривать с устройств
Доступно в ПК-версии сайта
Изопроцессы – виды графиков, формулы законов и уравнения
Трактовка понятий
Газ является одним из существующих агрегатных состояний вещества, для которого характерна слабая связь между компонентами и большая подвижность частиц. Последние передвигатся хаотично и свободно. При их столкновения изменяется характер движения.
Реальный газ считается высоко перегретым паром. Его свойства несколько отличаются от идеального компонента. В термодинамики различаются два состояния:
- насыщенные пары либо системы с двумя фазами;
- перегретые пары либо однофазовые системы.
Газы, как и жидкости, обладают текучестью. Они хорошо сопротивляются деформации. В отличие от воды, газ не имеет фиксированного объёма. Он стремится заполнить весь сосуд. Изопроцессы в газах подчиняются законам, которые определяют зависимость между двумя параметрами вещества при постоянном значении третьего. Так как уравнение справедливо для любой смеси, поэтому формула изотермического процесса (ИЗ) выражается следующим образом: T=const.
Само понятие ИЗ трактуется как новое состояние вещества, которое протекает при неизменной температуре. Процесс соответствует закону Бойля — Мариотта: для газа определённой массы произведение объёма на давление постоянно, если не изменяется температура. Равенство отображается на графике изопроцессов с помощью гиперболы и координат. Отдельно отмечаются изотермы при разных значениях температуры. В последнем случае соблюдается неравенство: Т1 23 молекул. Это считается числом Авогадро.
По закону Дальтона, давление смеси равно сумме парциальных P, входящих в состав. Выражение записывается следующим образом: P cm=P1+P2+…Pn. Последний показатель Pn является давлением газа, который бы занимал весь объёмом сосуда.
Чаще в старших классах физике рассматриваются изохорические процессы, когда переходит идеальный газ из одного состояния в другое, при этом не изменяется его объёмом. Явление впервые рассмотрел француз Жак Шарль. Закон записывается следующим образом: PV=vRT. Так как v= const и V=const, поэтому для любых разных состояний веществ используется равенство: P1/T1=P2/T2=….Pn/Tn. Закон Шарля математически записывается так: P/T=const.
Из выражения следует, что между температурой и давлением наблюдается прямо пропорциональная связь. Если увеличивается P, тогда повышается T, и наоборот. График зависимости данных величин называется изохорой. На промежутке абсолютного нуля для кривых предусмотрена условная зависимость. Прямая доводится до начала координат с помощью пунктирных линий.
Подобная зависимость T от P и V при изобарных и изохорных процессах определяет точность и эффективность измерения температуры газовыми термометрами. Первыми ученые открыли эти явления, которые считаются частными случаями уравнения состояния. Позже физики утвердили закон Клапейрона и Менделеева.
Если следовать хронологии, сначала изучались процессы, которые протекали при постоянной температуре, а затем при одном объеме. Последними рассматривались изобарические процессы. Редким и интересным явлением считается изоэнтропия, когда изменяется термодинамическая система при условии постоянной энтропии. Последнее записывается как S=const.
Примером подобного считается адиабатический обратимый процесс. Чтобы вычислить идеальный газ, используется уравнение: pV γ = const, где γ — показатель адиабаты (определяется типом газа). Для адиабатического явления характерно отсутствие теплоприёма и теплоотдачи. Физики считают такие процессы быстро протекающими.
Изопроцессы в газах.
Изопроцессами называются процессы, протекающие при неизменном значении одного из параметров: давления (p), объема (V), температуры (T).
Изопроцессами в газах являются термодинамические процессы, на протяжении течения которых количество вещества и давление, объём, температура либо энтропия не поддаются изменениям. Таким образом, при изобарном процессе не изменяется давление, при изохорном – объём, при изотермическом – температура, при изоэнтропийном – энтропия (к примеру, обратимый адиабатический процесс). И линии, которые отображают перечисленные процессы на некой термодинамической диаграмме, называют, соответственно, изобара, изохора, изотерма и адиабата. Все эти изопроцессы являются частными случаями политропного процесса.
В идеальном газе эти процессы подчиняются газовым законам.
Газовыми законами называются количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра.
Изобарный процесс.
Изобарный (или изобарический) процесс — это изменение термодинамической системы с условием не изменения давления (P = const). Изобарой называют линию, которая отображает изобарический процесс на графике. Этот процесс описывает закон Гей-Люссака.
Изохорный процесс.
Изохорный (или изохорический) процесс — это изменение термодинамической системы с условием не изменения объема (V = const). Изохорой называют линию, которая отображает изохорический процесс на графике. Этот процесс описывает закон Шарля.
Изотермический процесс.
Изотермический процесс — это изменение термодинамической системы с условием не изменения температуры (T = const). Изотермой называют линию, которая отображает изотермический процесс на графике. Этот процесс описывает закон Бойля-Мариотта.
Изоэнтропийный процесс.
Изоэнтропийный процесс — это изменение термодинамической системы с условием не изменения энтропии (S = const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где γ — показатель адиабаты, определяемый типом газа.
Объединенный газовый закон и изопроцессы
теория по физике 🧲 молекулярная физика, МКТ, газовые законы
Объединенный газовый закон был открыт экспериментально. Он также является следствием основного уравнения состояния идеального газа. Согласно ему:
При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной:
p V T . . = c o n s t и л и p 1 V 1 T 1 . . = p 2 V 2 T 2 .
Объединенный газовый закон применительно к изопроцессам
Объединенный газовый закон объединяет три независимых газовых закона: Бойля — Мариотта, Шарля и Гей-Люссака. Газовые законы действуют в частных случаях — изопроцессах.
Изопроцессы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным.
Изотермический процесс. Закон Бойля — Мариотта.
Изотермический процесс — термодинамический процесс, происходящий в системе при постоянной температуре и массе:
Для изотермического процесса действует закон Бойля — Мариотта:
Закон Бойля — Мариотта
Для газа данной массы произведение газа на его объем постоянно, если температура газа не меняется.
Изохорный процесс. Закон Шарля.
Изохорный процесс — термодинамический процесс, происходящий в системе при постоянном объеме и массе:
Для изохорного процесса действует закон Шарля:
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
p T . . = c o n s t ( p 1 T 1 . . = p 2 T 2 . . )
Изобарный процесс. Закон Гей-Люссака.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и массе:
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
V T . . = c o n s t ( V 1 T 1 . . = V 2 T 2 . . )
Пример №1. Идеальный газ изобарно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,6 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина.
Так как газ нагревают, то:
Запишем закон Шарля применительно к данному случаю:
p T 1 . . = 1 , 6 p 240 + T 1 . .
Сделаем некоторые преобразования и вычислим начальную температуру:
p T 1 . . = 1 , 6 p 240 + T 1 . .
240 + T 1 = 1 , 6 T 1
T 1 = 240 0 , 6 . . = 400 ( К )
Подсказки к задачам на газовые законы
Газ под невесомым поршнем:
p — давление газа;
pатм — давление, оказываемое на газ со стороны поршня.
На невесомый поршень действует сила:
p = p а т м + F S . .
F — сила, действующая на поршень;
S — площадь поршня.
На невесомый поршень поставили груз. В данном случае на поршень дополнительно будет действовать сила тяжести:
p = p а т м + F т я ж S . . = p а т м + M g S . .
Fтяж — сила тяжести, действующая на поршень со стороны груза;
g — ускорение свободного падения.
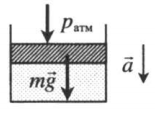
Газ под массивным поршнем. В данном случае на него дополнительно будет действовать сила тяжести поршня:
p = p а т м + m g S . .
m — масса поршня.
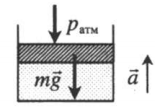
На массивный поршень поставили груз. В данном случае на поршень дополнительно будут действовать силы тяжести со стороны поршня и груза:
p = p а т м + M g S . . + m g S . .
На массивный поршень действует сила. В данном случае газ сдавливается как атмосферным давлением, так и силой тяжести поршня, а также силой, которая на него действует:
p = p а т м + m g S . . + F S . .
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вверх. Когда ускорение движения лифта противоположно направлено ускорению свободного падения, вес тел увеличивается. Поэтому:
p = p а т м + m g S . . + m a S . .
a — модуль ускорения, с которым движется лифт.
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вниз. Когда ускорение движения лифта направлено в сторону вектора ускорения свободного падения, вес тел уменьшается. Поэтому:
p = p а т м + m g S . . − m a S . .
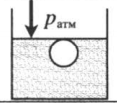
«Пузырек у поверхности воды» — на пузырек действует только атмосферное давоение:
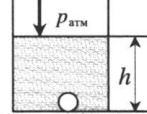
«Пузырек на глубине» — на пузырек действует атмосферное давление и давление столба жидкости:
ρ — плотность жидкости; h — глубина, на которой находится пузырек.
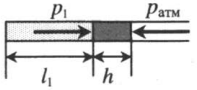
Газ, находящийся в горизонтальной пробирке, отделен от атмосферы столбиком ртути. Объем газа можно вычислить, используя параметры пробирки:
V1— объем газа; l1 — длина части пробирки, которую занимает газ; S — площадь поперечного сечения пробирки. Давление газа равно атмосферному давлению:
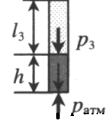
Пробирку поворачивают открытым концом вверх. В этом случае кроме атмосферного давления на газ давит давление со стороны ртути:
Объем газа можно вычислить, используя параметры пробирки:
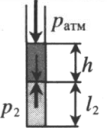
Пробирку поворачивают открытым концом вниз. В этом случае сумма давлений газа и ртути в пробирке равна атмосферному давлению. Отсюда давление газа равно:
Объем газа можно вычислить, используя параметры пробирки:
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
 |
|||||||||||||||||
| Шар или понтон поднимается вверх в воздухе или жидкости | Архимедова сила больше силы тяжести:
Пример №2. Поршень площадью 10 см 2 массой 5 кг может без трения перемещаться в вертикальном цилиндрическом сосуде, обеспечивая при этом герметичность. Сосуд с поршнем, заполненный газом, покоится на полу неподвижного лифта при атмосферном давлении 100 кПа, при этом расстояние от нижнего края поршня до дна сосуда 20 см. Каким станет это расстояние, когда лифт поедет вверх с ускорением, равным 2 м/с 2 ? Изменение температуры газа не учитывать. 10 см 2 = 10 –3 м 2 100 кПа = 10 5 Па Составим уравнения для 1 и 2 случая. Когда лифт находится в покое, давление газа равно сумме атмосферного давления и давления, оказываемое массивным поршнем: p 1 = p а т м + m g S . . Когда лифт начал двигаться, появилось дополнительное давление, связанное с увеличением веса поршня при ускоренном движении вверх: p 2 = p а т м + m g S . . + m a S . . Так как изменением температуры можно пренебречь, можно считать, что это процесс изотермический. Следовательно: Объемы в 1 и 2 случае будут определяться формулами: h1 — расстояние от нижнего края поршня до дна сосуда в первом случае. h2 — та же самая величина, но во втором случае (искомая величина). Запишем закон Бойля — Мариотта для обоих случаев с учетом объемов: p 1 V 1 = S h 1 ( p а т м + m g S . . ) p 2 V 2 = S h 2 ( p а т м + m g S . . + m a S . . ) Так как это изотермический процесс, правые части уравнений можно приравнять: S h 1 ( p а т м + m g S . . ) = S h 2 ( p а т м + m g S . . + m a S . . ) Графики изопроцессовИзопроцессы можно изобразить графически в координатах (p;V), (V;T) и (p;T). Рассмотрим все виды графиком для каждого из процессов.
|
Объединенный газовый закон был открыт экспериментально. Он также является следствием основного уравнения состояния идеального газа. Согласно ему:
Определение
При постоянной массе газа и его неизменной молярной массе отношение произведения давления на объем к его абсолютной температуре остается величиной постоянной:
pVT=const или p1V1T1=p2V2T2
Объединенный газовый закон применительно к изопроцессам
Объединенный газовый закон объединяет три независимых газовых закона: Бойля — Мариотта, Шарля и Гей-Люссака. Газовые законы действуют в частных случаях — изопроцессах.
Определение
Изопроцессы — термодинамические процессы, во время которых количество вещества и один из параметров состояния: давление, объём, температура или энтропия — остаётся неизменным.
Изотермический процесс. Закон Бойля — Мариотта.
Изотермический процесс — термодинамический процесс, происходящий в системе при постоянной температуре и массе:
m = const (m1 = m2)
T = const (T1 = T2)
Для изотермического процесса действует закон Бойля — Мариотта:
Закон Бойля — Мариотта
Для газа данной массы произведение газа на его объем постоянно, если температура газа не меняется.
pV = const (p1V1 = p2V2)
Изохорный процесс. Закон Шарля.
Изохорный процесс — термодинамический процесс, происходящий в системе при постоянном объеме и массе:
m = const (m1 = m2)
V = const (V1 = V2)
Для изохорного процесса действует закон Шарля:
Закон Шарля
Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
pT=const (p1T1=p2T2)
Изобарный процесс. Закон Гей-Люссака.
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении и массе:
m = const (m1 = m2)
p = const (p1 = p2)
Закон Гей-Люссака
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется.
VT=const (V1T1=V2T2)
Пример №1. Идеальный газ изобарно нагревают так, что его температура изменяется на ∆T = 240 К, а давление — в 1,6 раза. Масса газа постоянна. Найдите начальную температуру газа по шкале Кельвина.
Так как газ нагревают, то:
T2 – T1 = 240 (К)
Отсюда:
T2 = 240 + T1 (К)
p1 = p
p2 = 1,6p
Запишем закон Шарля применительно к данному случаю:
pT1=1,6p240+ T1
Сделаем некоторые преобразования и вычислим начальную температуру:
pT1=1,6p240+ T1
240+ T1=1,6T1
0,6T1=240
T1=2400,6=400 (К)
Подсказки к задачам на газовые законы
 |
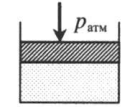
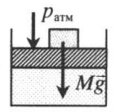
Газ под невесомым поршнем: p = pатм p — давление газа; pатм — давление, оказываемое на газ со стороны поршня. |
 |
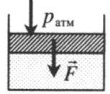
На невесомый поршень действует сила: p=pатм+FS F — сила, действующая на поршень; S — площадь поршня. |
 |
На невесомый поршень поставили груз. В данном случае на поршень дополнительно будет действовать сила тяжести: p=pатм+FтяжS=pатм+MgS Fтяж — сила тяжести, действующая на поршень со стороны груза; M — масса груза; g — ускорение свободного падения. |
 |
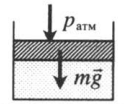
Газ под массивным поршнем. В данном случае на него дополнительно будет действовать сила тяжести поршня: p=pатм+mgS m — масса поршня. |
 |
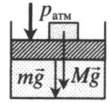
На массивный поршень поставили груз. В данном случае на поршень дополнительно будут действовать силы тяжести со стороны поршня и груза: p=pатм+MgS+mgS |
 |
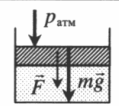
На массивный поршень действует сила. В данном случае газ сдавливается как атмосферным давлением, так и силой тяжести поршня, а также силой, которая на него действует: p=pатм+mgS+FS |
 |
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вверх. Когда ускорение движения лифта противоположно направлено ускорению свободного падения, вес тел увеличивается. Поэтому: p=pатм+mgS+maS a — модуль ускорения, с которым движется лифт. |
 |
Газ, находящийся в цилиндре под массивным поршнем, находится в лифте, ускорение которого направлено вниз. Когда ускорение движения лифта направлено в сторону вектора ускорения свободного падения, вес тел уменьшается. Поэтому: p=pатм+mgS−maS |
 |
«Пузырек у поверхности воды» — на пузырек действует только атмосферное давоение: p = pатм |
 |
«Пузырек на глубине» — на пузырек действует атмосферное давление и давление столба жидкости: p = pатм + ρgh ρ — плотность жидкости; h — глубина, на которой находится пузырек. |
 |
Газ, находящийся в горизонтальной пробирке, отделен от атмосферы столбиком ртути. Объем газа можно вычислить, используя параметры пробирки: V1 = l1S V1 — объем газа; l1 — длина части пробирки, которую занимает газ; S — площадь поперечного сечения пробирки. Давление газа равно атмосферному давлению: p1 = pатм |
 |
Пробирку поворачивают открытым концом вверх. В этом случае кроме атмосферного давления на газ давит давление со стороны ртути: P2 = pатм + ρgh Объем газа можно вычислить, используя параметры пробирки: V2 = l2S |
 |
Пробирку поворачивают открытым концом вниз. В этом случае сумма давлений газа и ртути в пробирке равна атмосферному давлению. Отсюда давление газа равно: P3 = pатм – ρgh Объем газа можно вычислить, используя параметры пробирки: V3 = l3S |
| Шар или понтон поднимается вверх в воздухе или жидкости | Архимедова сила больше силы тяжести:
FA > Fтяж |
Пример №2. Поршень площадью 10 см2 массой 5 кг может без трения перемещаться в вертикальном цилиндрическом сосуде, обеспечивая при этом герметичность. Сосуд с поршнем, заполненный газом, покоится на полу неподвижного лифта при атмосферном давлении 100 кПа, при этом расстояние от нижнего края поршня до дна сосуда 20 см. Каким станет это расстояние, когда лифт поедет вверх с ускорением, равным 2 м/с2? Изменение температуры газа не учитывать.
10 см2 = 10–3 м2
20 см = 0,2 м
100 кПа = 105 Па
Составим уравнения для 1 и 2 случая. Когда лифт находится в покое, давление газа равно сумме атмосферного давления и давления, оказываемое массивным поршнем:
p1=pатм+mgS
Когда лифт начал двигаться, появилось дополнительное давление, связанное с увеличением веса поршня при ускоренном движении вверх:
p2=pатм+mgS+maS
Так как изменением температуры можно пренебречь, можно считать, что это процесс изотермический. Следовательно:
p1V1 = p2V2
Объемы в 1 и 2 случае будут определяться формулами:
V1 = Sh1
V2 = Sh2
h1 — расстояние от нижнего края поршня до дна сосуда в первом случае. h2 — та же самая величина, но во втором случае (искомая величина).
Запишем закон Бойля — Мариотта для обоих случаев с учетом объемов:
p1V1=Sh1(pатм+mgS)
p2V2=Sh2(pатм+mgS+maS)
Так как это изотермический процесс, правые части уравнений можно приравнять:
Sh1(pатм+mgS)= Sh2(p
атм+mgS+maS)
Отсюда:
Графики изопроцессов
Изопроцессы можно изобразить графически в координатах (p;V), (V;T) и (p;T). Рассмотрим все виды графиком для каждого из процессов.
| Изопроцесс | График в координатах (p;V) | График в координатах (V;T) | График в координатах (p;T) |
| Изотермический (график — изотерма) | 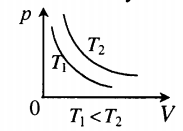
Изотерма в координатах (p;V) — гипербола. Чем ближе изотерма к началу координат и осям, тем меньшей температуре она соответствует. Характер изменения переменных величин хорошо виден на графике. |
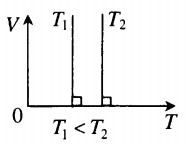
Изотерма в координатах (V;T) — прямая, перпендикулярная оси OT и параллельная оси OV. Чем ближе изотерма к оси OV, тем меньшей температуре она соответствует. С увеличением объема давление уменьшается. |
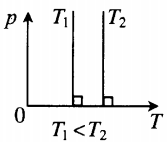
Изотерма в координатах (p;T) — прямая, перпендикулярная оси OT и параллельная оси Op. Чем ближе изотерма к оси Op, тем меньшей температуре она соответствует. С увеличением давления объем уменьшается. |
| Изохорный (график — изохора) | 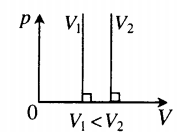
Изохора в координатах (p;V) — прямая, перпендикулярная оси OV и параллельная оси Op. Чем ближе изохора к оси Op, тем меньшему объему она соответствует. С увеличением давления увеличивается температура. |
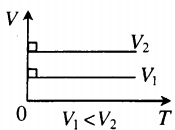
Изохора в координатах (V;T) — прямая, перпендикулярная оси OV и параллельная оси OT. Чем ближе изохора к оси OT, тем меньшему объему она соответствует. С увеличением температуры увеличивается давление. |
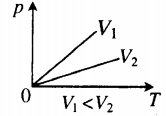
Изохора в координатах (p;T) — прямая, исходящая из начала координат. Чем меньше угол наклона изохоры к оси OT, тем меньшему объему она соответствует. Характер изменения переменных величин хорошо виден на графике. |
| Изобарный (график — изобара) | 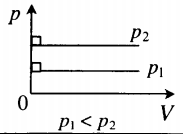
Изобара в координатах (p;V) — прямая, перпендикулярная оси Op и параллельная оси OV. Чем ближе изобара к оси OV, тем меньшему давлению она соответствует. С увеличением объема температура растет. |
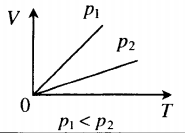
Изобара в координатах (V;T) — прямая, исходящая из начала координат. Чем меньше угол наклона изобары к оси OT, тем меньшему давлению она соответствует. Характер изменения переменных величин хорошо виден на графике. |

Изобара в координатах (p;T) — прямая, перпендикулярная оси Op и параллельная оси OT. Чем ближе изобара к оси OT, тем меньшему давлению она соответствует. С увеличением температуры объем растет. |
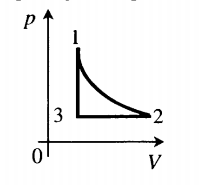
Пример №3. На рисунке представлен график циклического процесса. Вычертить его в координатах (p;T).
Определим характер изменения величин:
- Процесс 1–2. Гипербола — это изотерма. Следовательно T12 = const. В координатах (p;T) изотерма будет выглядеть как прямая, перпендикулярная оси OT.
- Процесс 2–3. Прямая линия, перпендикулярная оси Op — это изобара. Следовательно p23 = const. В координатах (p;T) изобара будет выглядеть как прямая, перпендикулярная оси Op.
- Процесс 3–1. Прямая линия, перпендикулярная оси OV — это изохора. Следовательно V31 = const. В координатах (p;T) изохора будет выглядеть как прямая, выходящая из начала координат.
Теперь, зная, какими будут графики всех величин в координатах (p;T), можно построить сам график. Он примет следующий вид:
Задание EF19012

Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17615
1 моль идеального газа изохорно охлаждают на 200 К, при этом его давление уменьшается в 2 раза. Какова первоначальная абсолютная температура газа?
Ответ:
а) 600 К
б) 400 К
в) 350 К
г) 300 К
Алгоритм решения
1.Записать исходные данные.
2.Определить вид изопроцесса.
3.Выбрать и записать подходящий для данного изопроцесса газовый закон.
4.Выполнить решение в общем виде.
5.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Изменение температуры ∆T = 200 К.
• Первоначальный объем p1 = 2p.
По условию задачи это изохорный процесс, следовательно он происходит в соответствии с законом Шарля:
p1T1=p2T2
Выразим конечную температуру и получим:
T2 = T1 – ∆T
Перепишем закон Шарля применительно к задаче и выразим первоначальную температуру:
2pT1=pT1−ΔT
2(T1−ΔT)=T1
2T1−T1=2ΔT
T1=2ΔT=2·200=400 (К)
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18859
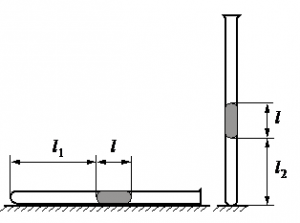
Алгоритм решения
1.Записать исходные данные и перевести единицы измерения физических величин в СИ.
2.Определить вид изопроцесса и записать для него газовый закон.
3.Выполнить решение в общем виде.
4.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Длина столбика воздуха под столбиком ртути в первоначальном состоянии: l1 = 30,7 см.
• Длина столбика воздуха под столбиком ртути в конечном состоянии: l2 = 23,8 см.
• Атмосферное давление: pатм = 747 мм рт. ст.
30,7 см = 30,7∙10–2 м
23,8 см = 23,8∙10–2 м
1 мм рт. ст. = 133,322 Па
747 мм рт. ст. = 99,6∙103 Па
Плотность ртути равна: ρрт = 13,54∙103 кг/м3.
Так как процесс изменения состояния газа происходит при постоянной температуре, процесс можно считать изотермическим. Для него действует газовый закон Бойля — Мариотта:
p1V1 = p2V2
Первоначальное давление на столбик воздуха равно атмосферному давлению:
p1 = pатм
Конечное давление на столбик воздуха равно сумме атмосферного давления и давления, оказываемое силой тяжести столбика ртути:
p2=pатм+mртgS
S —площадь поперечного сечения трубки.
Масса ртути равна произведению плотности на объем столбика металла. Объем в свою очередь равен произведению длины столбика ртути на площадь поперечного сечения трубки. Поэтому:
p2=pатм+ρртVртgS=pатм+ρртlSgS=pатм+ρртlg
Первоначальный объем столбика воздуха равен произведению площади поперечного сечения трубки на высоту этого столбика:
V1 = Sl1
Конечный объем столбика воздуха равен произведению площади поперечного сечения трубки на высоту этого столбика:
V2 = Sl2
Выразив первоначальные и конечный величины, можем записать закон Бойля — Мариотта применительно к данной задаче:
pатмSl1=(pатм+ρртlg)Sl2
Преобразуем уравнение, выразим искомую величину и произведем вычисления:
pатмl1=pатмl2+ρртlgl2
ρртlgl2=pатмl1−pатмl2
l=pатм(l1−l2)ρртgl2
Ответ: 21,76
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18139
Паук-серебрянка медленно спускается на дно равномерно прогретого озера, неся между волосками брюшка пузырьки воздуха для своего подводного жилища. Какой процесс происходит с воздухом в пузырьках по мере погружения паука?
Ответ:
а) изобарное сжатие
б) изохорное нагревание
в) изотермическое сжатие
г) адиабатное сжатие
Алгоритм решения
- Установить, какие величины меняются по мере погружения пузырьков воздуха на глубину.
- Выяснить, какие величины сохраняются постоянными.
- Установить вид изопроцесса.
Решение
Когда паук спускается в воде на глубину, давление постепенно увеличивается. На пузырьки воздуха будет действовать сумма атмосферного давления и давления столба воды. Под действием этого давления пузырек будет сжиматься. То есть, давление будет уменьшаться. Но само давление воздуха в пузырьке при этом будет равно давлению, оказываемому на него со стороны внешней среды. Следовательно, давление в пузырьке будет увеличиваться. При условии, что количество вещества в пузырьке при этом не меняется, величина температуры также должна оставаться постоянной. Это следует из уравнения состояния идеального газа. Следовательно, воздух в пузырьках претерпевает изотермическое сжатие.
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 11.6k
- Подробности
- Обновлено 30.05.2018 20:15
- Просмотров: 1449
Задачи по физике – это просто!
Вспомним
Изопроцессы – это термодинамические процессы при неизменной массе и постоянном значении одного из параметров.
1. Изотерический процесс описывается законом Бойля-Мариотта.
Выше представлены изотермы (графики изменения параметров газа при изотермическом процессе) в разных координатных осях.
(х)1 – начальное состояние газа
(х)2 – последующее состояние газа
Стрелочкой на графике показывают направление перехода из состояния 1 в состояние 2.
2. Изобарный процесс описывается законом Гей-Люсака.
Ниже представлены изобары в разных координатных осях.
3. Изохорный процесс описывается законом Шарля.
Ниже представлены изохоры в разных координатных осях.
Не забываем
Решать задачи надо всегда в системе СИ!
А теперь к задачам!
Элементарные задачи из курса школьной физики по теродинамике на процессы в газах.
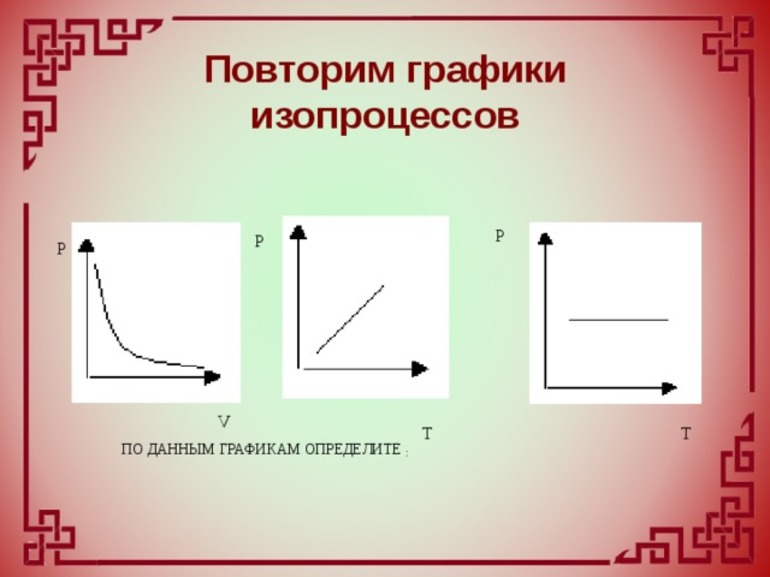
Задача 1
Задан процесс изменения состояния газа в координатах VОТ.
На каждом участке
1). Назвать процессы и указать законы, их описывающие, показать изенения макропарамметров газа.
2). Начертить графики изменения состояния газа в координатах pOT и pOV.
Задача 2
Задан процесс изменения состояния газа в координатах рОТ.
На каждом участке
1). Назвать процессы и указать законы, их описывающие, показать изменения макропараметров газа.
2). Начертить графики изменения состояния газа в координатах pOV и VOT.
Задача 3
Задан процесс изменения состояния газа в координатах VОТ.
На каждом участке
1). Назвать процессы и указать законы, их описывающие, показать изменения макропараметров газа.
2). Начертить графики изменения состояния газа в координатах pOT и pOV.
Задача 4
Задан процесс изменения состояния газа в координатах VОТ.
На каждом участке
1). Назвать процессы и указать законы, их описывающие, показать изменения макропараметров газа.
2). Начертить графики изменения состояния газа в координатах pOV и pOT.