Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
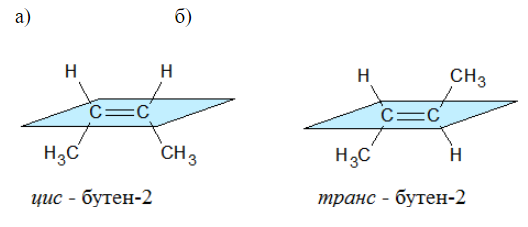
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.

2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Подскажите,пожалуйста как строить изомеры путем углеродного скелета,вообще не понимаю как…
Профи
(647),
закрыт
9 лет назад
Q
Просветленный
(30807)
13 лет назад
Изомеры – это органические вещества, имеющие одинаковый состав, но различный порядок соединения атомов (различное строение) . То есть Вам дан набор атомов, например, С5Н12, и надо из этого набора построить различные молекулы, соблюдая правила валентности – у углерода валентность 4, у водорода – 1, у кислорода – 2. Химические связи между атомами изображаются черточками, число черточек у каждого атома равно валентности.
Самое простое строение – линейная молекула. Например, С5Н12.
Рисуем цепочку из 5 углеродов: С-С-С-С-С
Добавляем атомы водорода с учетом валентности. У первого углерода 1 связь со вторым углеродом, значит, оставшиеся 3 связи будут с водородом. У второго водорода 2 связи с соседними углеродами, значит, остаются 2 связи для водорода, и т. д. В результате получается:
СН3-СН2-СН2-СН2-СН3
Это вещество называется нормальный пентан или н-пентан.
Чтобы составить второй изомер, укорачиваем цепь на 1 углерод и присоединяем этот углерод к любому углероду, кроме крайних, для этого рисуем черточку-связь вверх или вниз (я пишу этот боковой атом в скобках) : С-С (С) -С-С
Затем добавляем водороды: СН3-СН (СН3)-СН2-СН3
Это вещество называется 2-метилбутан.
Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан ![]() имеет три структурные формулы изомеров:
имеет три структурные формулы изомеров:

Изомерия положения кратной связи
При общей формуле ![]() пентен имеет два изомера, различающихся расположением двойной связи:
пентен имеет два изомера, различающихся расположением двойной связи:
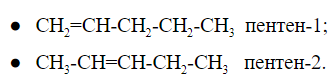
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
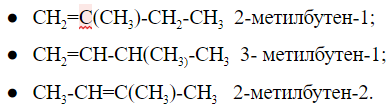
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
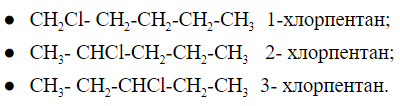
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
![]() бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:

Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу ![]() имеют два вещества:
имеют два вещества:
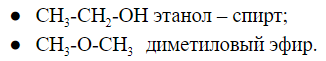
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-![]() :
:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
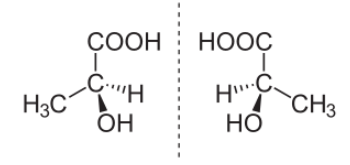
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.

Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
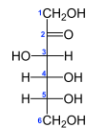
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
§4. Изомерия органических соединений
До появления теории химического строения А. М. Бутлерова оставалось неизвестным существование веществ, которые имеют один и тот же состав и одну и ту же молекулярную массу, но различающиеся расположением атомов. Эти вещества обладали разными свойствами. Способность атомов углерода к образованию четырёх ковалентных связей, в том числе и с другими атомами углерода, открывает возможность существования нескольких соединений одного элементного состава. Такое явление было названо изомерией.
До создания теории химического строения было известно всего лишь одно вещество состава `”C”_4″H”_(10)` – бутан, который имеет линейное строение углеродной цепи. А. М. Бутлеров предположил возможность существования ещё одного вещества с такой же молекулярной формулой, но с другой последовательностью расположения атомов углерода в молекуле. Таким образом, был получен изомер бутана, который получил название изобутана (имеет разветвлённое строение).
Для пентана существует три изомера:
Температуры кипения бутана и пентана отличаются между собой, что служит доказательством того, что свойства соединений находятся в зависимости от строения их молекул.
это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение (различные структурные формулы), а, следовательно, обладают различными свойствами.
В органической химии существует несколько типов изомерии. Самым простым является структурная изомерия.
называют изомеры, отвечающие различным структурным формулам органических соединений (с разным порядком соединений атомов).
В этом случае изомеры отличаются друг от друга только порядком связи между атомами в молекуле. Структурная изомерия имеет несколько разновидностей.
Изомерия углеродного скелета зависит от порядка соединения между собой атомов углерода в цепи (см. изомеры бутана и пентана).
Для правильного составления изомеров углеродного скелета необходимо соблюдать некоторые правила:
1. Записать углеродный скелет согласно числу атомов углерода.
$$ stackrel{1}{mathrm{C}}-stackrel{2}{mathrm{C}}-stackrel{3}{mathrm{C}}-stackrel{4}{mathrm{C}}-stackrel{5}{mathrm{C}}$$
2. Отрывают крайние атомы углерода (`”C”_1` или `”C”_5`) и располагают их у оставшихся в цепи атомов углерода, добиваясь максимально возможного числа перестановок. В результате чего первоначально записанный углеродный скелет укорачивается и принимает разветвлённое строение:
Следует иметь в виду, что произвольное укорачивание углеродной цепи исходного углеводорода не приводит к появлению нового изомера, а зачастую представляют собой одно и то же соединения.
Например, приведённые ниже формулы представляют собой вещество – пентан.
3. Соблюдая условие четырёхвалентности атомов углерода, необходимо заполнить оставшиеся валентности атомами водорода
(*н – означает углеводород нормального (неразветвленного) строения).
Другой разновидностью структурной изомерии является
Например, положения кратной связи:
| `”CH”_2=”CH”-“CH”_2-“CH”=”CH”_2` | `”CH”_2=”CH”-“CH”=”CH”-“CH”_3` | |
| пентадиен-1,4 | пентадиен-1,3 |
Или изомерия положения функциональной группы:
Если гидроксильных групп две, то число изомеров может также определяться взаимным расположением этих групп:
| `”HOCH”_2-“CH”_2-“CH”_2″OH”` | `”HOCH”_2-“CH”(“OH”)-“CH”_3` | |
| пропандиол-1,3 | пропандиол-1,2 |
Ещё одним видом изомерия является
Например, одной и той же молекулярной формуле `”C”_2″H”_6″O”` соответствуют два разных по строению вещества, относящиеся к различным классам органических соединений – этиловый спирт и диметиловый эфир.
| `”CH”_3-“CH”_2-“OH”` | `”CH”_3-“O”-“CH”_3` |
Различное расположение в соединении атомов между собой является причиной различных химических свойств этих соединений. Например, кислотные свойства проявляет только этанол при взаимодействии с металлическим натрием. Этиловый спирт – жидкость, диметиловый эфир – газообразное вещество.
Другим примером межклассовой изомерии являются карбоновые кислоты и сложные эфиры, например:
| `”CH”_3-“CH”_2″COOH”` | `”CH”_3-“COOCH”_3` | `”HCOOC”_2″H”_5` | ||
| Пропановая кислота | Метилацетат | Этилформиат |
Виды пространственной изомерии
называют соединения, имеющий одинаковый состав и одинаковый порядок соединения атомов, но отличающиеся расположением атомов в пространстве.
Геометрическая изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах часто возможно провести условную плоскость таким образом, что заместители у различных атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от этой плоскости. Если изменение ориентации этих заместителей относительно плоскости возможно только за счёт разрыва одной из химических связей, то говорят о наличии геометрических изомеров.
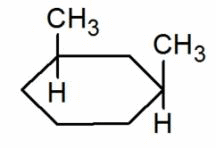
|
цис-1,3-диметициклолгексан |
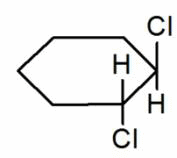
транс-1,2-дихлорциклогексан |
|
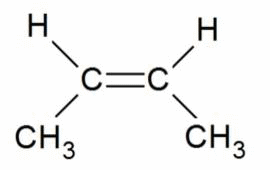
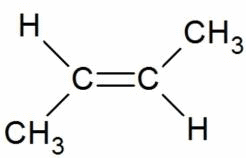
|
цис-бутен-2 |
транс-бутен-2 |
Оптическая изомерия возникает тогда, когда предмет – органическая молекула – несовместим со своим изображением в зеркале. Такое свойство обозначается термином «хиральность», а пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. В виде энантиомеров существует, например, молочная кислота `”CH”_3-“CH”(“OH”)-“COOH”`:
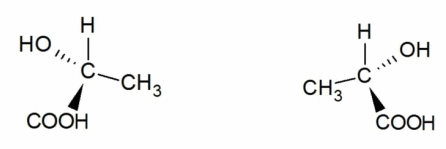
Энантиомеры имеют одинаковые температуры плавления и кипения, растворимость, показатель преломления и другие характеристики. Их отличия проявляются только при изучении вращения веществом плоскости поляризации света или при взаимодействии с другим хиральным соединением. Способность вращать плоскость поляризации света называется оптической активностью. Смесь равных количеств энантиомеров называется рацематом.