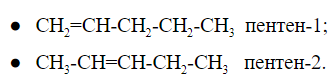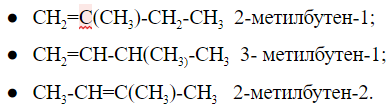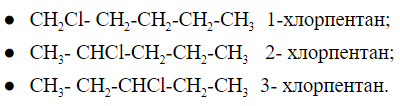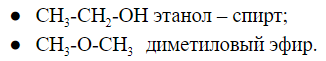Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
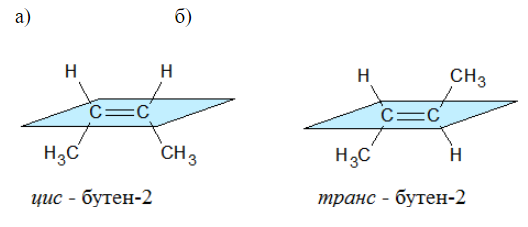
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан имеет три структурные формулы изомеров:
Изомерия положения кратной связи
При общей формуле пентен имеет два изомера, различающихся расположением двойной связи:
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу имеют два вещества:
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
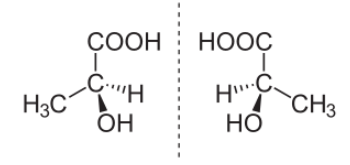
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.
Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
Теория химического строения органических соединений А. М. Бутлерова
Подобно тому, как для неорганической химии основой развития являются Периодический закон и Периодическая система химических элементов Д. И. Менделеева, для органической химии основополагающей стала теория строения органических соединений А. М. Бутлерова.
Основным постулатом теории Бутлерова является положение о химическом строении вещества, под которым понимается порядок, последовательность взаимного соединения атомов в молекулы, т.е. химическая связь.
Под химическим строением понимают порядок соединения атомов химических элементов в молекуле согласно их валентности.
Этот порядок может быть отображен при помощи структурных формул, в которых валентности атомов обозначаются черточками: одна черточка соответствует единице валентности атома химического элемента. Например, для органического вещества метана, имеющего молекулярную формулу $СН_4$, структурная формула выглядит так:
Основные положения теории А. М. Бутлерова
- Атомы в молекулах органических веществ связаны друг с другом согласно их валентности. Углерод в органических соединениях всегда четырехвалентен, а его атомы способны соединяться друг с другом, образуя различные цепи.
- Свойства веществ определяются не только их качественным и количественным составом, но и порядком соединения атомов в молекуле, т. е. химическим строением вещества.
- Свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в его молекуле, но и от взаимного влияния атомов и групп атомов друг на друга.
Теория строения органических соединений является динамичным и развивающимся учением. По мере развития знаний о природе химической связи, о влиянии электронного строения молекул органических веществ стали пользоваться, кроме эмпирических и структурных, электронными формулами. В таких формулах указывают направление смещения электронных пар в молекуле.
Квантовая химия и химия строения органических соединений подтвердили учение о пространственном направлении химических связей (цис- и трансизомерия), изучили энергетические характеристики взаимных переходов у изомеров, позволили судить о взаимном влиянии атомов в молекулах различных веществ, создали предпосылки для прогнозирования видов изомерии и направления и механизма протекания химических реакций.
Органические вещества имеют ряд особенностей:
- В состав всех органических веществ входят углерод и водород, поэтому при горении они образуют углекислый газ и воду.
- Органические вещества построены сложно и могут иметь огромную молекулярную массу (белки, жиры, углеводы).
- Органические вещества можно расположить в ряды сходных по составу, строению и свойствам гомологов.
- Для органических веществ характерной является изомерия.
Изомерия и гомология органических веществ
Свойства органических веществ зависят не только от их состава, но и от порядка соединения атомов в молекуле.
Изомерия — это явление существования разных веществ — изомеров с одинаковым качественным и количественным составом, т.е. с одинаковой молекулярной формулой.
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле; стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Структурная изомерия
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле $С_4Н_{10}$ соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода $С_5Н_{12}$ возможны три изомера: пентан, изопентан и неопентан:
$СН_3—СН_2—{СН_2}↙{пентан}—СН_2—СН_3$
С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода $С_{10}Н_{22}$ их уже $75$, а для углеводорода $С_{20}Н_{44}$ — $366 319$.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы:
$CH_2={CH-CH_2}↙{бутен-1}-CH_3$ $CH_3-{CH=CH}↙{бутен-2}-CH_3$
${CH_3-CH_2-CH_2-OH}↙{н-пропиловый спирт(пропанол-1)}$
Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих к разным классам. Так, молекулярной формуле $С_6Н_{12}$ соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан:
Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи бутадиен-1,3:
$CH≡C-{CH_2}↙{бутин-1}-CH_2$ $CH_2={CH-CH}↙{бутадиен-1,3}=CH_2$
Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу $С_4Н_{10}О$:
${CH_3CH_2OCH_2CH_3}↙{text””диэтиловый эфир””}$ ${CH_3CH_2CH_2CH_2OH}↙{text””н-бутиловый спирт (бутанол-1)””}$
Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле $С_2Н_5NO_2$:
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис- и транс- обычно относят к паре одинаковых заместителей:
Геометрические изомеры различаются по физическим и химическим свойствам.
Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале. Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом называют асимметрическим. Примером такой молекулы является молекула $α$-аминопропионовой кислоты ($α$-аланина) $СН_3СН(NH_2)COOH$.
Молекула $α$-аланина ни при каком перемещении не может совпасть со своим зеркальным отражением. Такие пространственные изомеры называются зеркальными, оптическими антиподами, или энантиомерами. Все физические и практически все химические свойства таких изомеров идентичны.
Изучение оптической изомерии необходимо при рассмотрении многих реакций, протекающих в организме. Большинство этих реакций идет под действием ферментов — биологических катализаторов. Молекулы этих веществ должны подходить к молекулам соединений, на которые они действуют, как ключ к замку, следовательно, пространственное строение, взаимное расположение участков молекул и другие пространственные факторы имеют для течения этих реакций большое значение. Такие реакции называются стереоселективными.
Большинство природных соединений являются индивидуальными энантиомерами, и их биологическое действие резко отличается от свойств их оптических антиподов, полученных в лаборатории. Подобное различие в биологической активности имеет огромное значение, так как лежит в основе важнейшего свойства всех живых организмов — обмена веществ.
Гомологическим рядом называется ряд веществ, расположенных в порядке возрастания их относительных молекулярных масс, сходных по строению и химическим свойствам, где каждый член отличается от предыдущего на гомологическую разность $CH_2$. Например: $CH_4$ — метан, $C_2H_6$ — этан, $C_3H_8$ — пропан, $C_4H_{10}$ — бутан и т. д.
Как составлять изомеры
Одним из важнейших понятий в органической химии является – изомерия. Ее смысл заключается в том, что существуют вещества, различающиеся пространственным расположение своих атом или атомных групп, при этом обладающих одинаковой молекулярной массой и составом. В этом и заключается главная причина того что в природе наблюдается огромное разнообразие органических веществ.

Вам понадобится
- Как составить изомер рассмотрим на примере алкана C6H14
Инструкция
Сначала нужно составить формулу углеводородного скелета в неразветвленном виде, исходя из данных его молекулярной формулы.
С – С – С – С – С – С
Пронумеровать все атомы углерода.
1 2 3 4 5 6
С – С – С – С – С – С
Зная о том, что углерод четырехвалентен, подставить атомы водорода углеродную цепь.
1 2 3 4 5 6
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Уменьшите углеродную цепочку на один атом, расположив его в виде бокового ответвления. Важно понимать, что боковые атомы цепочки углерода не могут стать боковыми ответвлениями.
С – С – С – С – С
С
Со стороны, к которой ближе боковое ответвление начните нумерацию цепочки, а затем расставьте атомы водорода, соблюдая правила валентности.
1 2 3 4 5
СН3 – СН – СН2 – СН2 – СН3
СН3
Если есть возможность чтобы расположить боковое ответвление у других атомов углеродной цепи, составьте все возможные изомеры.
1 2 3 4 5
СН3 – СН2 – СН – СН2 – СН3
СН3
Если для бокового ответвления больше нет возможностей, уменьшите изначальную цепочку углерода на один его атом, при этом расположив его как боковое ответвление. Не забывайте, что при одном атоме в углеродной цепочке находятся не больше двух ответвлений.
С
С – С – С – С
С
Пронумеруйте новую цепь атом с того же края, к которому ближе ответвление. Добавьте атомы водорода, помня о четырехвалентности атома углерода.
СН3
1 2 3 4
СН3 – С – СН2 – СН3
СН3
Проверяйте дальше можно ли расположить еще боковые ответвления к углеродной цепочке. Если можно составьте формулы изомеров. Если нельзя продолжайте уменьшать цепочку атомов углерода, постепенно на один атом, располагая его как боковое ответвление. Пронумеровав цепочку, продолжайте составлять формулы изомеров. Нумерация, в случае если боковые ответвления, находятся на одинаковом расстоянии от краев цепи, будет начинаться с края, у которого больше боковых ответвлений.
1 2 3 4
СН3 – СН – СН – СН3
СН3 СН3
Продолжайте последовательность всех действий, пока будет иметься возможность для расположения боковых ответвлений.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.