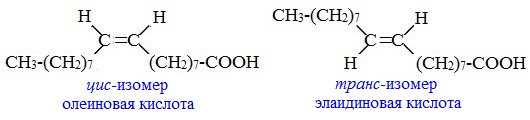Изомерия карбоновых кислот
Для карбоновых кислот характерна структурная и пространственная изомерия.
1. Структурная изомерия
а) Изомерия углеродного скелета (начиная с C4)
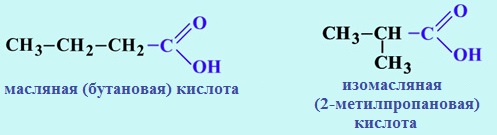
Изомерия углеродного скелета начинается с бутановой кислоты С3Н7СООН, которая существует в виде двух изомеров:
б) Межклассовая изомерия (начиная с C2)
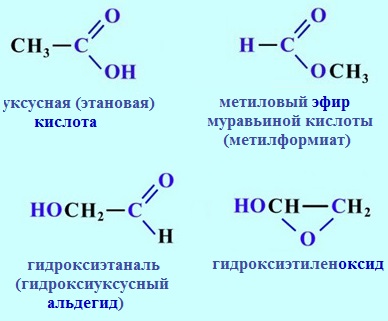
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
в) Изомерия положения кратной связи
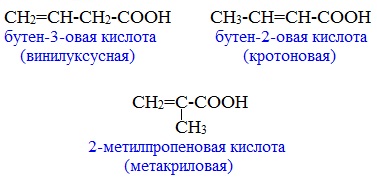
Этот вид изомерии характерен для непредельных карбоновых кислот. Например, кротоновая кислота имеет три изомера:
Изомеры валериановой кислоты
2. Пространственная изомерия
а) Оптическая
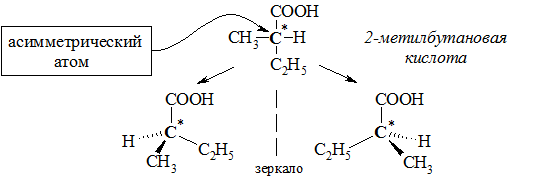
Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами.
Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН существует в виде двух оптических изомеров:
б) Цис- транс – изомерия (геометрическая изомерия)
Этот вид изомерии характерен для непредельных карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН существует два геометрических изомера:
Карбоновые кислоты
Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН.
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Строение, изомерия и гомологический ряд карбоновых кислот
Химические свойства карбоновых кислот
Способы получения карбоновых кислот
Классификация карбоновых кислот
По числу карбоксильных групп:
- одноосновные карбоновые кислоты — содержат одну карбоксильную группу -СООН. Общая формула CnH2n+1COOH или CnH2nO2.
Например, уксусная кислота
- многоосновные карбоновые кислоты — содержат две и более карбоксильные группы СООН. Например, общая формула двухосновных карбоновых кислот CnH2n(СОOH)2 или CnH2n-2O4.
Например, щавелевая кислота
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4).
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат | СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат |  |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат |  |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат |  |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |  |
Изомерия предельных карбоновых кислот
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и предельных одноосновных карбоновых кислот, и сложных эфиров — CnH2nО2.
Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
- кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- замещение атома водорода в алкильном радикале
- образование сложных эфиров — этерификация
1. Кислотные свойства
Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н.
В водном растворе карбоновые кислоты частично диссоциируют на ионы:
R–COOH ⇆ R-COO– + H+
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
Например, уксусная кислота растворяет осадок гидроксида меди (II)
Видеоопыт взаимодействия уксусной кислоты с гидроксидом натрия можно посмотреть здесь.
Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода.
Видеоопыт взаимодействия уксусной кислоты с магнием и цинком можно посмотреть здесь.
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды.
Например, уксусная кислота реагирует с оксидом меди (II)
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
Видеоопыт взаимодействия уксусной кислоты с оксидом меди (II) можно посмотреть здесь.
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
Например, уксусная кислота растворяет карбонат кальция
Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа
2. Реакции замещения группы ОН
Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов.
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
При нагревании карбоновые соли аммония разлагаются на амид и воду:
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты):
При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.
2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты
3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу.
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
Например, уксусная кислота реагирует с бромом в присутствии красного фосфора
4. Свойства муравьиной кислоты
Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов.
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Видеоопыт взаимодействия муравьиной кислоты с перманганатом калия можно посмотреть здесь.
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
Видеоопыт разложения муравьиной кислоты можно посмотреть здесь
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:
5.2. Реакции замещения в бензольном кольце
Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:
6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:
7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:
К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:
7.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Получение карбоновых кислот
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
Например, при окислении этанола в жестких условиях образуется уксусная кислота
2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота.
Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты
3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.
Образуется неустойчивое вещество, которое распадается с отщеплением воды:
Так как щелочь в избытке, то образуется не сама кислота, а её соль:
4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:
Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты:
5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:
Например, метилацетат гидролизуется в кислой среде:
6. Кислотный гидролиз жиров
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин
7. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:
8. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:
9. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
Например, при окислении толуола образуется бензойная кислота:
10. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.
Изомерия карбоновых кислот
Cтруктурная изомерия (на примере одноосновных кислот)
- Изомерия скелета в углеводородном радикале (начиная с C4).
Интерактивная анимация
- Межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
Интерактивная анимация
Пространственная изомерия
- цис-транс-Изомерия характерна для:
– непредельных карбоновых кислот, содержащих двойную связь с разными заместителями, например,
Изомеры бутен-2-овой кислоты Другой примерНенасыщенные жирные кислоты (входят в состав жиров)
- – замещённых алициклических кислот
Алициклические карбоновые кислоты — соединения, в молекулах которых группа СООН связана с замкнутым кольцом из частично или полностью насыщенных атомов углерода., например,
Изомеры 2-метилциклопропанкарбоновой кислоты
- Оптическую изомерию проявляют:
– кислоты, в молекулах которых присутствует асимметрический атомАсимметрический атом — тетраэдри-ческий sp3-атом, связанный с четырьмя различными заместителями. углерода
Оптическая изомерия карбоновых кислотЭтот вид стереоизомерии проявляется кислотами, в молекулах которых присутствует sp3-атом углерода, связанный с 4-мя различными заместителями (асимметрический атом углерода, обозн. С*). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами (или оптическими антиподами).
- Оптические изомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение (как левая и правая руки).
Например:- Молекулы оптических изомеров не имеют плоскости симметрии (через них нельзя провести зеркальную плоскость, разделяющую молекулу на две равные части). При одинаковом составе, но с различным относительным расположением атомов, две такие молекулы несовместимы в пространстве, т.е. являются стереоизомерами.
– транс-изомеры замещённых алициклических кислот, например,
Таким образом, 2-метилциклопропанкарбоновая кислота существует
в виде 3-х стереоизомеров (цис-изомер и 2 транс-изомера).
- Поворотная (конформационная) изомерия свойственна молекулам, содержащим σ-связи, по которым возможно внутримолекулярное вращение.
…
Изомерия карбоновых кислот
Для карбоновых кислот характерны структурная, геометрическая и оптическая виды изомерии.
А) Структурная изомерия
- Изомерия углеродного скелета (начиная с C4), например, валериановая и 2,2-диметилпропановая кислоты:
- Изомерия положения кратной связи (для ненасыщенных кислот), например, 2-бутеновая кислота и 2-метилпропеновая кислота:
- Изомерия положения заместителей или функциональных групп (для кислот, имеющих заместители и функциональные группы), например, молочная и гидракриловая кислоты (2- и 3- гидроксипропановые кислоты) и α- и β-аланин (α- и β-аминопропановые кислоты):
- Межклассовая изомерия со сложными эфирами карбоновых кислот (начиная с C2), например валериановая кислота и этиловый эфир пропановой кислоты:
Б) Пространственная изомерия
- Цис-, транс-изомерия характерна для непредельных кислот, например цис-2-бутеновая (изокротоновая) кислота и транс-2-бутеновая (кротоновая) кислота:
- Оптическая изомерия характерна для карбоновых кислот, имеющих асимметрический атом углерода, например D- и L- изомеры молочной кислоты:
Номенклатура карбоновых кислот
Карбоновым кислотам удобно давать названия, используя правила систематической номенклатуры ИЮПАК, также возможно использовать правила рациональной номенклатуры. Кроме этого некоторые кислоты имеют тривиальные названия. Тривиальные названия кислот приведены в разделе Изомерия и номенклатура органических соединений.
При составлении названий по рациональной номенклатуре изначально исходили из того, что все кислоты рассматривали, как производные уксусной кислоты, например, диметилуксусная кислота, диметилэтилуксусная кислота, фенилуксусная кислота. Позже было принято к названию углеводород радикала, прибавлть карбоновая кислота. Например, этанкарбоновая кислота, этиленкарбоновая кислота:
По систематической номенклатуре (ИЮПАК):
- Выбирать следует наиболее длинную цепь. За основу названия берут углеводород с тем же количеством атомов углерода, в конце прибавляют –овая кислота (для одноосновных кислот), диовая (для двухосновных кислот) и т.д.
- Нумерацию цепи начинают с карбоксильного углерода, если при этом используют арабские цифры. Если в названии используют латинские греческие буквы, то нумерацию начинают со следующего после карбоксильной группы атома углерода. Например, 2,3-диметилбутановая кислота и β-аминопропановая кислота:
- Если в молекуле имеются кратные связи, то выбирают цепь, включающую эти связи. При составлении названия указывают положение и число кратных связей, например, 2,3-диметил-3-пентеновая кислота:
- Если молекула кислоты включает функциональные группы, то выбирают цепь, содержащую все функциональные группы и в названии упоминают их в порядке старшинства. Например: β-окси-α-аминопроропионовая кислота:
План урока:
Строение карбоновых кислот
Виды карбоновых кислот
Номенклатура карбоновых кислот
Гомологический ряд карбоновых кислот
Изомерия карбоновых кислот
Способы получения карбоновых кислот
Физические свойства карбоновых кислот
Химические свойства карбоновых кислот
Применение карбоновых кислот
Строение карбоновых кислот
Общая формула: СnH2n+1COOH
Карбоксил, или карбоксильная группа, – сложная функциональная группа, содержащая карбонильную С=О и гидроксильную – ОН группы. Электронная плотность в молекуле стягивается на кислородный атом. Для карбонильного углерода характерно состояние sp2-гибридизации. Он образует три σ-связи и одну π-связь.
Виды карбоновых кислот
Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
- Нахождение главной цепи.
- Нумерация углеродных атомов, включая углеродный атом функциональной группы.
- Название радикала.
- Прибавление к названию суффикса «-овая» при наличии одной карбоксильной группы, суффикса «-диовая» при наличии двух функциональных групп. В любом случае добавляется слово «кислота».
Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.
Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия
Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.
Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.
Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
5С2Н5ОН + 4КМnO4 + 6H2SO4→ 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
2CH4 + 3O2 → 2HCOOH + 2H2O
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Из гомологов бензола получают бензойную кислоту.
Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.
Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.
Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-MgBr + CO2→ R-COO-MgBr
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.
Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.
Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.
Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
- Взаимодействие с основаниями
CH3COOH + NaOH→CH3COONa + H2O
- Взаимодействие с металлами
2СН2СООН + Са → (СН3СОО)2Са + Н2↑
- Реакция с основными оксидами
2СН3СООН + ВаО→ (СН3СОО)2Ва + Н2О
- Реакция с солями более слабых кислот
2СН3СООН + СаСО3→(СН3СОО)2Са + Н2О + СО2↑
Реакция замещения гидроксильной группы карбоновой кислоты
- Образование галогенангидридов
СН3СООН + PCl5→CH3COOCl + HCl + POCl3
- Взаимодействие с аммиаком
R-COOH + NH3→R-COONH4
- Образование сложных эфиров
Для проведения реакции необходима минеральная кислота.
R1-COOH + R2-OH →R1-COOR2 + H2O
- Образование ангидридов
Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.
Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.
Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.
Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.
Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.
Молекула щавелевой кислоты