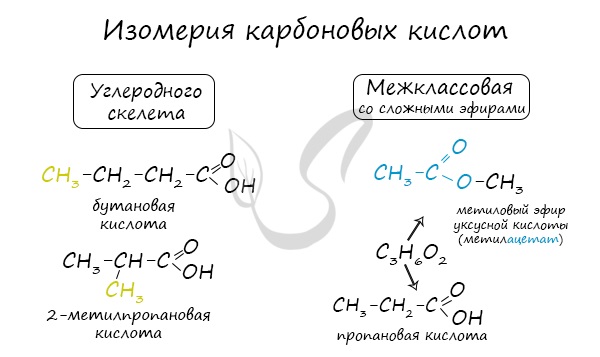
Изомерия карбоновых кислот
Для карбоновых кислот характерна структурная и пространственная изомерия.
1. Структурная изомерия
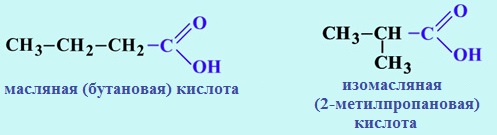
а) Изомерия углеродного скелета (начиная с C4)
Изомерия углеродного скелета начинается с бутановой кислоты С3Н7СООН, которая существует в виде двух изомеров:
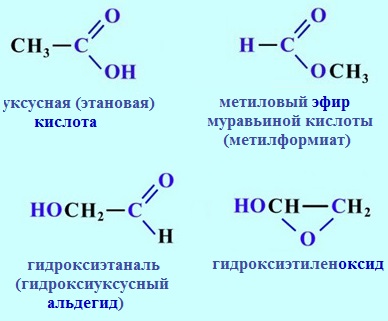
б) Межклассовая изомерия (начиная с C2)
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
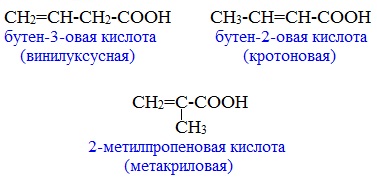
в) Изомерия положения кратной связи
Этот вид изомерии характерен для непредельных карбоновых кислот. Например, кротоновая кислота имеет три изомера:
Изомеры валериановой кислоты
2. Пространственная изомерия
а) Оптическая
Оптическую изомерию проявляют карбоновые кислоты, в молекулах которых присутствует асимметрический атом углерода (sp3-атом, связанный с 4-мя различными заместителями). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами.
Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН существует в виде двух оптических изомеров:

б) Цис- транс – изомерия (геометрическая изомерия)
Этот вид изомерии характерен для непредельных карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН существует два геометрических изомера:
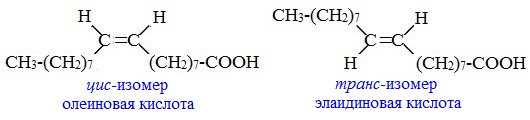
Карбоновые кислоты
Изомерия карбоновых кислот
Cтруктурная изомерия (на примере одноосновных кислот)
- Изомерия скелета в углеводородном радикале (начиная с C4).
Интерактивная анимация
- Межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 4 изомера, относящиеся к различным классам органических соединений:
Интерактивная анимация
Пространственная изомерия
- цис-транс-Изомерия характерна для:
– непредельных карбоновых кислот, содержащих двойную связь с разными заместителями, например,

Изомеры бутен-2-овой кислоты Другой примерНенасыщенные жирные кислоты (входят в состав жиров)

- – замещённых алициклических кислот
Алициклические карбоновые кислоты — соединения, в молекулах которых группа СООН связана с замкнутым кольцом из частично или полностью насыщенных атомов углерода., например,

Изомеры 2-метилциклопропанкарбоновой кислоты
- Оптическую изомерию проявляют:
– кислоты, в молекулах которых присутствует асимметрический атомАсимметрический атом — тетраэдри-ческий sp3-атом, связанный с четырьмя различными заместителями. углерода
Оптическая изомерия карбоновых кислотЭтот вид стереоизомерии проявляется кислотами, в молекулах которых присутствует sp3-атом углерода, связанный с 4-мя различными заместителями (асимметрический атом углерода, обозн. С*). Соединения, содержащие такой атом углерода, могут существовать в виде 2-х пространственных изомеров, которые называются оптическими изомерами (или оптическими антиподами).
- Оптические изомеры – пространственные изомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение (как левая и правая руки).
Например: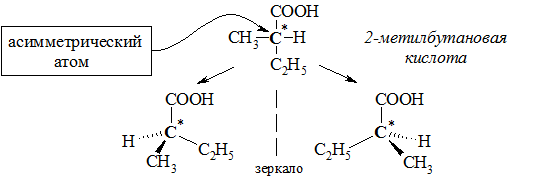

- Молекулы оптических изомеров не имеют плоскости симметрии (через них нельзя провести зеркальную плоскость, разделяющую молекулу на две равные части). При одинаковом составе, но с различным относительным расположением атомов, две такие молекулы несовместимы в пространстве, т.е. являются стереоизомерами.
– транс-изомеры замещённых алициклических кислот, например,

Таким образом, 2-метилциклопропанкарбоновая кислота существует
в виде 3-х стереоизомеров (цис-изомер и 2 транс-изомера).
- Поворотная (конформационная) изомерия свойственна молекулам, содержащим σ-связи, по которым возможно внутримолекулярное вращение.
…
Изомерия карбоновых кислот
Для карбоновых кислот характерны структурная, геометрическая и оптическая виды изомерии.
А) Структурная изомерия
- Изомерия углеродного скелета (начиная с C4), например, валериановая и 2,2-диметилпропановая кислоты:
![]()
- Изомерия положения кратной связи (для ненасыщенных кислот), например, 2-бутеновая кислота и 2-метилпропеновая кислота:
![]()
- Изомерия положения заместителей или функциональных групп (для кислот, имеющих заместители и функциональные группы), например, молочная и гидракриловая кислоты (2- и 3- гидроксипропановые кислоты) и α- и β-аланин (α- и β-аминопропановые кислоты):
![]()
- Межклассовая изомерия со сложными эфирами карбоновых кислот (начиная с C2), например валериановая кислота и этиловый эфир пропановой кислоты:
![]()
Б) Пространственная изомерия
- Цис-, транс-изомерия характерна для непредельных кислот, например цис-2-бутеновая (изокротоновая) кислота и транс-2-бутеновая (кротоновая) кислота:
![]()
- Оптическая изомерия характерна для карбоновых кислот, имеющих асимметрический атом углерода, например D- и L- изомеры молочной кислоты:
![]()
Номенклатура карбоновых кислот
Карбоновым кислотам удобно давать названия, используя правила систематической номенклатуры ИЮПАК, также возможно использовать правила рациональной номенклатуры. Кроме этого некоторые кислоты имеют тривиальные названия. Тривиальные названия кислот приведены в разделе Изомерия и номенклатура органических соединений.
При составлении названий по рациональной номенклатуре изначально исходили из того, что все кислоты рассматривали, как производные уксусной кислоты, например, диметилуксусная кислота, диметилэтилуксусная кислота, фенилуксусная кислота. Позже было принято к названию углеводород радикала, прибавлть карбоновая кислота. Например, этанкарбоновая кислота, этиленкарбоновая кислота:
![]()
По систематической номенклатуре (ИЮПАК):
- Выбирать следует наиболее длинную цепь. За основу названия берут углеводород с тем же количеством атомов углерода, в конце прибавляют –овая кислота (для одноосновных кислот), диовая (для двухосновных кислот) и т.д.
- Нумерацию цепи начинают с карбоксильного углерода, если при этом используют арабские цифры. Если в названии используют латинские греческие буквы, то нумерацию начинают со следующего после карбоксильной группы атома углерода. Например, 2,3-диметилбутановая кислота и β-аминопропановая кислота:
![]()
- Если в молекуле имеются кратные связи, то выбирают цепь, включающую эти связи. При составлении названия указывают положение и число кратных связей, например, 2,3-диметил-3-пентеновая кислота:
![]()
- Если молекула кислоты включает функциональные группы, то выбирают цепь, содержащую все функциональные группы и в названии упоминают их в порядке старшинства. Например: β-окси-α-аминопроропионовая кислота:
![]()
План урока:
Строение карбоновых кислот
Виды карбоновых кислот
Номенклатура карбоновых кислот
Гомологический ряд карбоновых кислот
Изомерия карбоновых кислот
Способы получения карбоновых кислот
Физические свойства карбоновых кислот
Химические свойства карбоновых кислот
Применение карбоновых кислот
Строение карбоновых кислот
Общая формула: СnH2n+1COOH
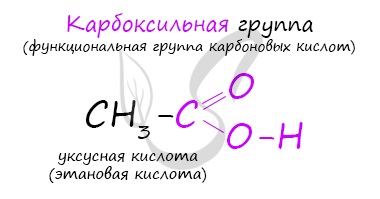
Карбоксил, или карбоксильная группа, – сложная функциональная группа, содержащая карбонильную С=О и гидроксильную – ОН группы. Электронная плотность в молекуле стягивается на кислородный атом. Для карбонильного углерода характерно состояние sp2-гибридизации. Он образует три σ-связи и одну π-связь.

Виды карбоновых кислот

Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
- Нахождение главной цепи.
- Нумерация углеродных атомов, включая углеродный атом функциональной группы.
- Название радикала.
- Прибавление к названию суффикса «-овая» при наличии одной карбоксильной группы, суффикса «-диовая» при наличии двух функциональных групп. В любом случае добавляется слово «кислота».

Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.

Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия

Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.

Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.

Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Реакции окисления
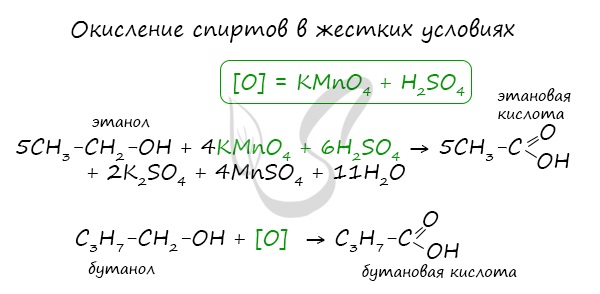
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
5С2Н5ОН + 4КМnO4 + 6H2SO4→ 5CH3COOH + 2K2SO4 + 4MnSO4 + 11H2O
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
2CH4 + 3O2 → 2HCOOH + 2H2O
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
2C4H10 + 5O2 → 4CH3COOH + 2H2O
Из гомологов бензола получают бензойную кислоту.

Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.

Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.

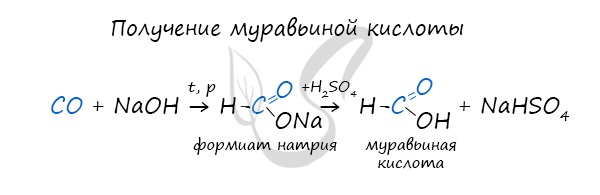
Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.

Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-MgBr + CO2→ R-COO-MgBr
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.

Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.

Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.

Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
- Взаимодействие с основаниями
CH3COOH + NaOH→CH3COONa + H2O
- Взаимодействие с металлами
2СН2СООН + Са → (СН3СОО)2Са + Н2↑
- Реакция с основными оксидами
2СН3СООН + ВаО→ (СН3СОО)2Ва + Н2О
- Реакция с солями более слабых кислот
2СН3СООН + СаСО3→(СН3СОО)2Са + Н2О + СО2↑
Реакция замещения гидроксильной группы карбоновой кислоты
- Образование галогенангидридов
СН3СООН + PCl5→CH3COOCl + HCl + POCl3
- Взаимодействие с аммиаком
R-COOH + NH3→R-COONH4
- Образование сложных эфиров
Для проведения реакции необходима минеральная кислота.
R1-COOH + R2-OH →R1-COOR2 + H2O
- Образование ангидридов

Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.

Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.

Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.

Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.

Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.

Молекула щавелевой кислоты
Карбоновые кислоты – класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп
COOH.
Имеют разнообразное промышленное применение и большое биологическое значение.
Общая формула одноосновных карбоновых кислот CnH2nO2 .
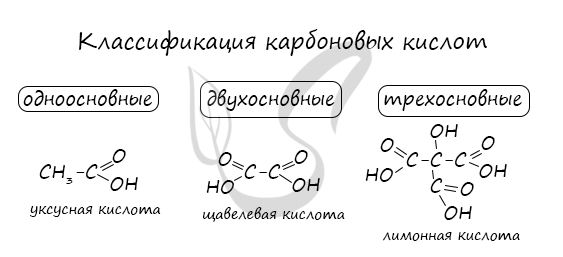
Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные – 1 карбоксильная группа
- Двухосновные – 2 карбоксильных группы
- Трехосновные – 3 карбоксильных группы
Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав
которых они входят.
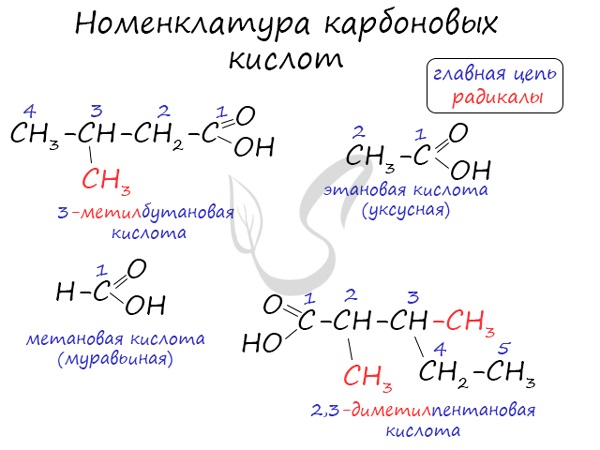
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса “овая” к названию алкана с соответствующим числом атомов углерода
и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая – HCOOH – муравьиная кислота
- Этановая – CH3-COOH – уксусная кислота
- Пропановая – C2H5-COOH – пропионовая кислота
- Бутановая – C3H7-COOH – масляная кислота
- Пентановая – C4H9-COOH – валериановая кислота
Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными
эфирами.
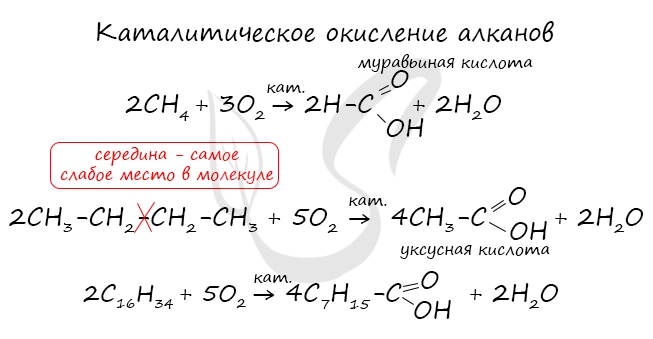
Получение карбоновых кислот
- Окисление алканов
- Окисление спиртов
- Окисление альдегидов
- Синтез муравьиной кислоты
- Синтез уксусной кислоты
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого
образуются кислоты.
При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются
до соответствующих кислот.
При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией
на альдегиды – реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом – свежеосажденным гидроксидом меди II.
В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С – образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.
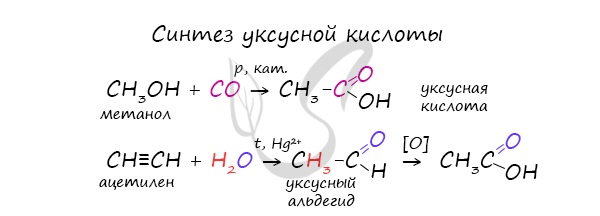
Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид.
Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.
Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем
спирты.
- Кислотные свойства
- Галогенирование
- Особые свойства муравьиной кислоты
- Разложение муравьиной кислоты
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений
металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко
замещается водород у третичного, чуть сложнее – у вторичного, и значительно сложнее – у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе.
Поэтому самая слабая из трех кислот – уксусная, чуть сильнее – хлоруксусная, за ней – дихлоруксусная и самая сильная –
трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это
перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот,
способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
HCOOH → (t, H2SO4) CO↑ + H2O
Сложные эфиры
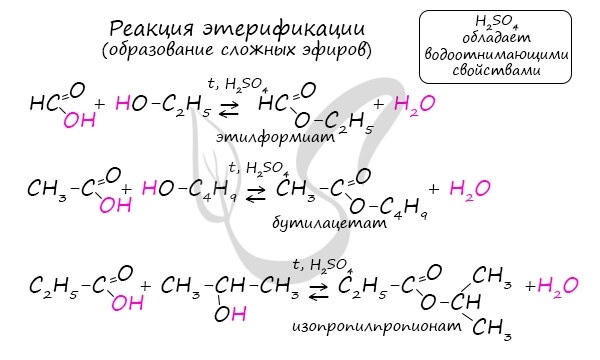
Получение сложных эфиров происходит в реакции этерификации (лат. aether – эфир), заключающейся во взаимодействии карбоновой кислоты
и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)
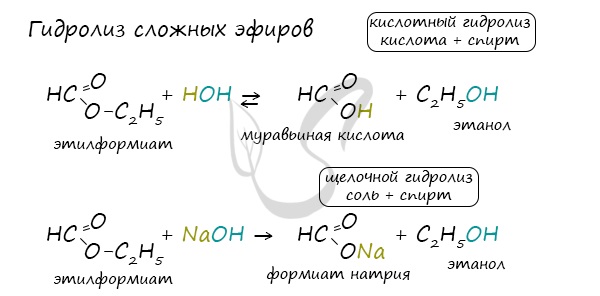
Для сложных эфиров характерной реакцией является гидролиз – их разложение. Возможен щелочной гидролиз, при котором образуется соль
кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной – необратимо.
Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.
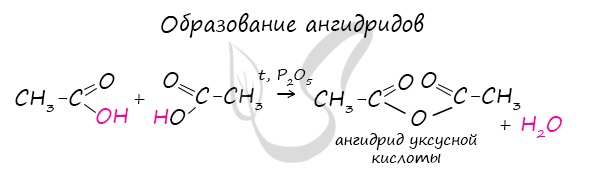
Ангидриды
Ангидриды – химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.
Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания.
Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.
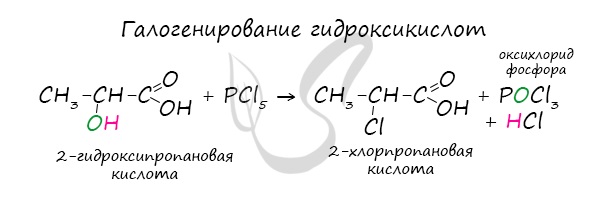
Непредельные карбоновые кислоты
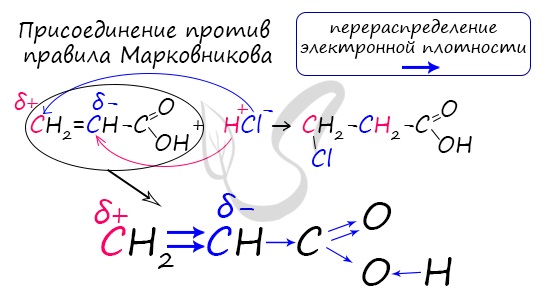
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит
в непредельной акриловой кислоте.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
