Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:

При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:

2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

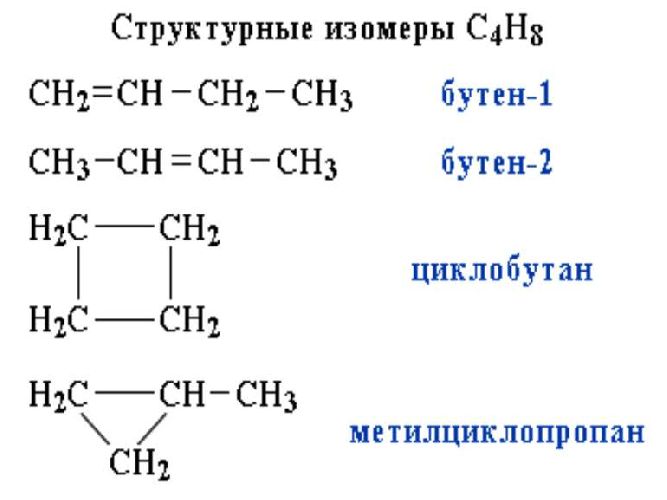
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров

1,2-Диметилпропан также образует цис-транс-изомеры:

Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.

2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.

Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:

Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан ![]() имеет три структурные формулы изомеров:
имеет три структурные формулы изомеров:

Изомерия положения кратной связи
При общей формуле ![]() пентен имеет два изомера, различающихся расположением двойной связи:
пентен имеет два изомера, различающихся расположением двойной связи:
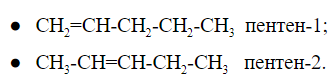
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
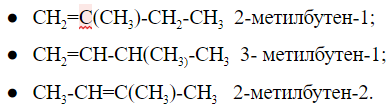
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
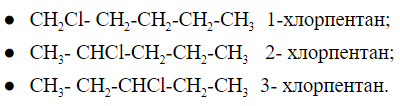
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
![]() бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:

Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу ![]() имеют два вещества:
имеют два вещества:
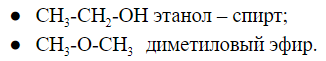
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-![]() :
:
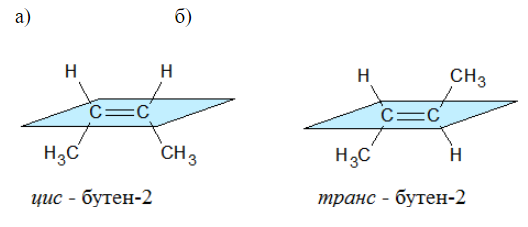
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
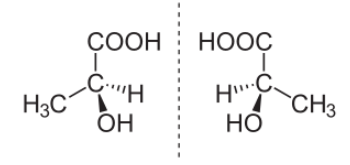
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.

Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Изомерия


4.6
Средняя оценка: 4.6
Всего получено оценок: 564.
4.6
Средняя оценка: 4.6
Всего получено оценок: 564.
Явление, при котором образуются соединения одинаковые по количеству атомов, но разные по структуре или пространственному расположению атомов, называется изомерией. Изомеры отличаются физическими и химическими свойствами. Изомерия свойственна всем органическим соединениям.
Классификация
Изомерия бывает двух типов:
- структурная – соединения отличаются строением молекул;
- пространственная – одинаковые по составу и строению вещества различаются пространственным расположением атомов.
Описание каждого типа представлено в таблице.
|
Изомерия |
Вид |
Определение |
|
Структурная |
Углеродного скелета |
Изомеры отличаются положением метильной группы -СН3 в углеродной цепи (может присоединяться к любому атому углерода) |
|
Положения |
Изомеры отличаются по положению:
|
|
|
Межклассовая |
Из-за расположения функциональной группы образуется вещество другого класса: CH3-CH2-OH (этанол) и CH3-O-CH3 (диметиловый эфир) |
|
|
Пространственная |
Оптическая или зеркальная |
Изомеры зеркально отражают друг друга |
|
Геометрическая |
Изомеры отличаются положением радикалов относительно плоскости. Характерна для классов веществ, содержащих двойные связи, а также для циклических соединений. Бывает двух типов:
|

Чем больше атомов углерода в молекуле, тем больше изомеров может образовывать соединение.
Номенклатура
Названия изомеров состоят из трёх частей:
- номер атома углерода, к которому присоединены дополнительные группы;
- название группы;
- название главной цепи.
За главную цепь принимается самая длинная цепочка атомов углерода. Например, если к цепи из пяти атомов углерода присоединена цепочка из двух атомов углерода, главной считается пятиуглеродная цепь.
Отсчёт атомов начинается с конца с разветвлением или большим количеством разветвлений. Структурная формула изомерии помогает наглядно определить, какой атом является первым.
Примеры изомеров с названиями:
- СН3-СН(СН3)-СН2-СН2-СН3 – 2-метилпентан (метильная группа находится у второго атома углерода);
- СН3-СН2-СН(СН3)-СН2-СН3 – 3-метилпентан;
- СН3-СН(СН3)-СОН – 2-метилпропаналь.
Изомеры имеют одинаковую молекулярную формулу, но разные структурные формулы.

Что мы узнали?
Из урока химии 10 класса узнали о явлении изомерии. Изомеры – соединения с одинаковым количеством атомов, но с разным строением или пространственным положением. При структурной изомерии меняется положение в углеродной цепи двойной связи, метильной группы или радикала. Пространственная изомерия бывает двух типов – оптическая (зеркальная) и геометрическая. Структурные названия изомеров обуславливаются положением функциональных групп и радикалов.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Тайсон Коняхин
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 564.
А какая ваша оценка?
План
1. Структурная
изомерия.
2. Конформационная
изомерия.
3. Геометрическая
изомерия.
4. Оптическая
изомерия.
Изомеры
– это вещества, имеющие одинаковый
состав и молекулярную массу, но разные
физические и химические свойства.
Различия в свойствах изомеров обусловлены
различиями в их химическом или
пространственном строении. В связи с
этим различают два вида изомерии.
изомерия
структурная
пространственная



Углеродного
скелета
Конфигурационная
Конформационная


Положение
функциональной
группы
Оптическая



Межклассовая
Геометрическая

1. Структурная изомерия
Структурные изомеры
отличаются химическим строением, т.е.
природой и последовательностью связей
между атомами в молекуле. Структурные
изомеры выделяют в чистом виде. Они
существуют как индивидуальные, устойчивые
вещества, для их взаимного превращения
необходима высокая энергия – порядка
350 – 400 кДж/моль. В динамическом равновесии
находятся только структурные изомеры
— таутомеры. Таутомерия – распространенное
явление в органической химии. Она
возможна при переносе подвижного атома
водорода в молекуле (карбонильные
соединения, амины, гетероциклы и т.д.),
внутримолекулярных взаимодействиях
(углеводы).
Все структурные
изомеры представляют в виде структурных
формул и называют по номенклатуре ИЮПАК.
Например,
составу С4Н8О
соответствуют структурные изомеры:
а)
с различным углеродным скелетом
неразветвленная
С-цепь – СН3-СН2-СН2-СН=О
(бутаналь, альдегид) и
разветвленная
С-цепь –
![]() (2-метилпропаналь,
(2-метилпропаналь,
альдегид) или
цикл – ![]()
(циклобутанол, циклический спирт);
б)
с различным положением функциональной
группы
![]() бутанон-2, кетон;
бутанон-2, кетон;
в)
с различным составом функциональной
группы
![]() 3-бутенол-2,
3-бутенол-2,
непредельный спирт;
г)
метамерии
Гетероатом
функциональной группы может быть включен
в углеродный скелет (цикл или цепь). Один
из возможных изомеров этого вида изомерии
–
СН3-О-СН2-СН=СН2
(3-метоксипропен-1, простой эфир);
д)
таутомерии (кето-енольной)
![]()
енольная форма
![]()
кетоформа
Таутомеры находятся
в динамическом равновесии, при этом в
смеси преобладает более устойчивая
форма – кетоформа.
Для
ароматических соединений структурную
изомерию рассматривают
только для боковой цепи.
2. Пространственная изомерия (стереоизомерия)
Пространственные
изомеры имеют одинаковое химическое
строение, различаются по пространственному
расположению атомов в молекуле. Это
различие и создает разницу в физических
и химических свойствах. Пространственные
изомеры изображают в виде различных
проекций или стереохимических формул.
Раздел химии, изучающий пространственное
строение и его влияние на физические и
химические свойства соединений,
на направление и скорость их реакций,
называется стереохимией.
а)
Конформационная
(поворотная) изомерия
Не
меняя ни валентных углов, ни длин связей,
можно представить себе множество
геометрических форм (конформаций)
молекулы, отличающихся друг от друга
взаимным поворотом углеродных тетраэдров
вокруг соединяющей их σ-С-С-связи. В
результате такого вращения возникают
поворотные изомеры (конформеры). Энергия
различных конформеров неодинакова, но
энергетический барьер, разделяющий
различные конформационные изомеры, для
большинства органических соединений
невелик. Поэтому при обычных условиях,
как правило, нельзя зафиксировать
молекулы в одной строго определенной
конформации. Обычно в равновесии
сосуществуют несколько легко переходящих
друг в друга конформационных изомеров.
Способы
изображения и номенклатуру изомеров
можно рассмотреть на примере молекулы
этана. Для нее можно предвидеть
существование двух, максимально
различающихся по энергии конформаций,
которые могут быть изображены в виде
перспективных
проекций
(1) («лесопильные
козлы»)
или
проекций
Ньюмена (2):

заторможенная
конформация заслоненная конформация
В
перспективной проекции (1) связь С-С надо
представить себе уходящей вдаль; стоящий
слева углеродный атом приближен к
наблюдателю, стоящий справа – удален от
него.
В
проекции Ньюмена (2) молекулу рассматривают
вдоль связи С-С. Три линии, расходящиеся
под углом 120о
из центра круга, обозначают связи
ближайшего к наблюдателю углеродного
атома; линии, «высовывающиеся»
из-за круга – связи удаленного углеродного
атома.
Изображенную
справа конформацию называют заслоненной.
Это название напоминает о том, что атомы
водорода обеих СН3-групп
находятся друг против друга. Заслоненная
конформация имеет повышенную внутреннюю
энергию и поэтому невыгодна. Конформацию,
изображенную слева, называют заторможенной,
подразумевая, что свободное вращение
вокруг связи С-С «тормозится»
в этом положении, т.е. молекула существует
преимущественно в этой конформации.
Минимум
энергии, необходимый для полного вращения
молекулы вокруг определенной связи,
называется барьером вращения для данной
связи. Барьер вращения в молекуле,
подобной этану, может быть выражен через
изменение потенциальной энергии молекулы
как функции изменения двугранного
(торсионного – τ ) угла системы.
Энергетический профиль вращения
вокруг связи С-С в этане показан на
рисунке 1. Барьер вращения, разделяющий
две формы этана, составляет около 3
ккал/моль (12,6 кДж/моль). Минимумы кривой
потенциальной энергии соответствуют
заторможенным конформациям, максимумы
– заслоненным. Поскольку при комнатной
температуре энергия некоторых столкновений
молекул может достигать 20 ккал/моль
(около 80 кДж/моль), то этот барьер в 12,6
кДж/моль легко преодолевается и вращение
в этане рассматривают как свободное.
В
смеси всех возможных конформаций
преобладают заторможенные конформации.
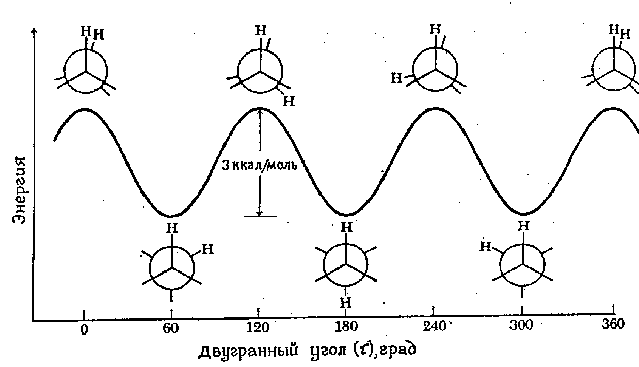
Рис.1.
Диаграмма потенциальной энергии
конформаций этана.
Для
более сложных молекул число возможных
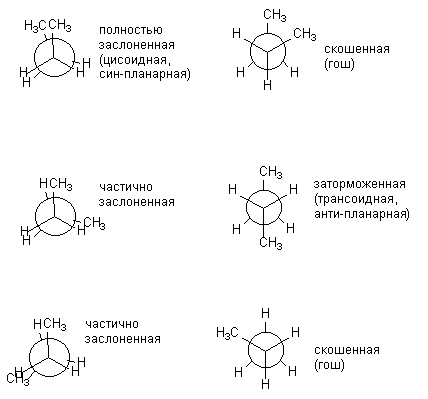
конформаций возрастает. Так, для н-бутана
можно изобразить уже шесть конформаций,
возникающих при повороте вокруг
центральной связи С2
– С3
и
отличающихся взаимным расположением
СН3-групп.
Различные заслоненные и заторможенные
конформации бутана отличаются по
энергии. Энергетически более выгодны
заторможенные конформации.
![]()
Энергетический
профиль вращения вокруг связи С2
-С3
в бутане показан на рисунке 2.
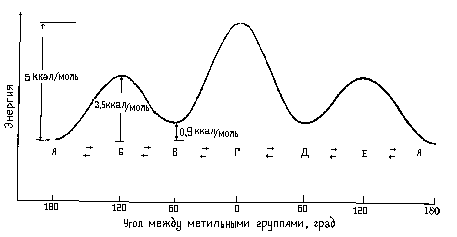
Рис.2.
Диаграмма потенциальной энергии
конформаций н-бутана.
Для молекулы с
длинной углеродной цепью число
конформационных форм возрастает.
Для молекулы
алициклических соединений характерны
различные конформационные формы цикла
(например, для циклогексана кресло,
ванна,
твист-формы).
Итак,
конформации – это различные пространственные
формы молекулы, имеющей определенную
конфигурацию. Конформерами являются
стереоизомерные структуры, соответствующие
энергетическим минимумам на диаграмме
потенциальной энергии, находящиеся в
подвижном равновесии и способные к
взаимопревращению путем вращения вокруг
простых σ-связей.
Если
барьер таких превращений становится
достаточно высоким, то можно разделить
стереоизомерные формы (пример – оптически
активные дифенилы). В таких случаях
говорят уже не о конформерах, а о реально
существующих стереоизомерах.
б)
Геометрическая изомерия
Геометрические
изомеры возникают в результате
отсутствия в молекуле:
1.
вращения атомов углерода относительно
друг друга – следствие жесткости двойной
связи С=С
или циклической структуры;
2.
двух одинаковых групп при одном атоме
углерода двойной связи или цикла.
Геометрические
изомеры, в отличие от конформеров, могут
быть выделены в чистом виде и существуют
как индивидуальные, устойчивые вещества.
Для их взаимного превращения необходима
более высокая энергия – порядка 125-170
кДж/моль (30-40 ккал/моль).
Различают
цис-транс-(Z,E) изомеры;
цис-формами
называют геометрические изомеры, у
которых одинаковые заместители лежат
по одну сторону от плоскости π-связи
или цикла, транс-формами
называют геометрические изомеры, у
которых одинаковые заместители лежат
по разные стороны от плоскости π-связи
или цикла.
Простейшим
примером могут служить изомеры бутена-2,
который существует
в виде цис- , транс-геометрических
изомеров:
![]()
![]()
цис-бутен-2
транс-бутен-2
температура
плавления
-138,90С
– 105,60С
температура
кипения
3,720С
1,000С
плотность
0,724
0,604
1,2 – дихлорциклопропан
существует в виде цис- , транс-изомеров:
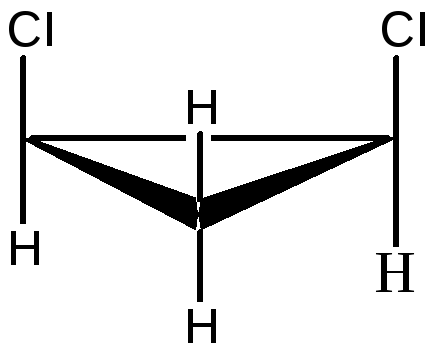
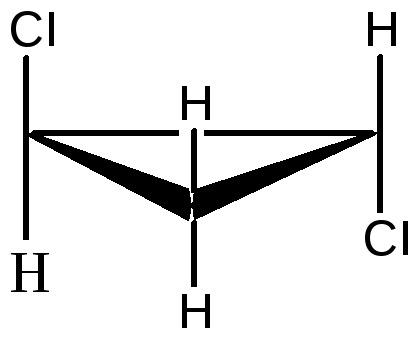
цис-1,2-дихлорциклопропан
транс-1,2-дихлорциклопропан
В
более сложных случаях применяется
Z,E-номенклатура
(номенклатура Канна, Ингольда, Прелога
– КИП, номенклатура старшинства
заместителей). В
соединении
1-бром
-2-метил-1-хлорбутене-1 (Br)(CI)С=С(СН3)
– СН2-СН3
все
заместители при атомах углерода с
двойной связью различные; поэтому данное
соединение существует в виде Z-,
E-
геометрических изомеров:
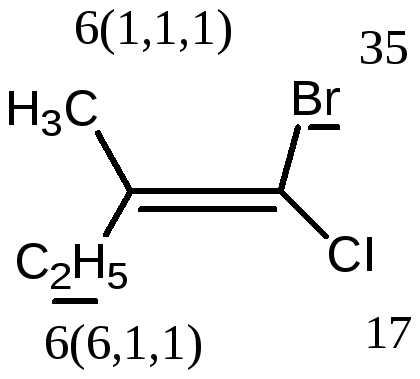
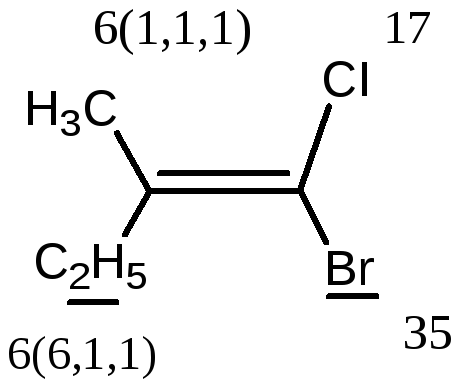
Е-1-бром-2-метил-1-хлорбутен-1
Z-1-бром-2-метил-1-хлорбутен-1.
Для обозначения
конфигурации изомера указывают
расположение
старших
заместителей
при двойной связи (или цикле) – Z-(от
немецкого Zusammen – вместе) или Е-(от немецкого
Entgegen – напротив).
В Z,E-системе старшими
считаются заместители с большим
порядковым (атомным) номером. Если атомы,
непосредственно связанные с ненасыщенными
атомами углерода, одинаковы, то переходят
ко “второму слою”, в случае
необходимости – к “третьему слою”
и т. д.
В
первой проекции старшие группы находятся
напротив друг друга относительно двойной
связи, поэтому это Е-изомер. Во второй
проекции старшие группы расположены
по одну сторону относительно двойной
связи (вместе), поэтому это Z-изомер.
Геометрические
изомеры широко распространены в природе.
Например, природные полимеры каучук
(цис-изомер) и гуттаперча (транс-изомер),
природная фумаровая (транс-бутендиовая
кислота) и синтетическая малеиновая
(цис-бутендиовая кислота) кислоты, в
составе жиров – цис-олеиновая, линолевая,
линоленовая кислоты.
в)
Оптическая изомерия
Молекулы
органических соединений могут быть
хиральными и ахиральными. Хиральность(от
греч. сheir
– рука) — несовместимость молекулы со
своим зеркальным отражением.
Хиральные
вещества способны вращать плоскость
поляризации света. Это явление называют
оптической активностью, а соответствующие
вещества – оптически
активными.
Оптически активные вещества встречаются
в виде пар оптических
антиподов
– изомеров, физические и химические
свойства которых в обычных условиях
одинаковы, за исключением одного – знака
вращения плоскости поляризации: один
из оптических антиподов отклоняет
плоскость поляризации в право (+,
правовращающий изомер), другой – влево
(-, левовращающий). Определить конфигурацию
оптических антиподов можно экспериментально
с помощью прибора – поляриметра.
Оптическая
изомерия появляется тогда, когда в
молекуле присутствует асимметрический
атом углерода (существуют
и другие причины хиральности молекулы).
Так называют
атом
углерода в sр3
–
гибридизации и связанный
с четырьмя различными заместителями.
Возможны два тетраэдрических расположения
заместителей вокруг асимметрического
атома. При
этом две
пространственные формы нельзя совместить
никаким вращением; одна из них является
зеркальным изображением другой :
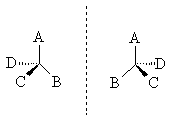
Обе
зеркальные формы составляют пару
оптических антиподов или энантиомеров.
Изображают
оптические изомеры в виде проекционных
формул Э. Фишера. Их получают в результате
проецирования молекулы с асимметрическим
атомом углерода. При этом сам асимметрический
атом углерода на плоскости обозначают
точкой, на горизонтальной линии указывают
символы заместителей, выступающих перед
плоскостью рисунка. На вертикальной
линии
(прерывистой
или сплошной) указывают заместители,
которые удалены за плоскость рисунка.
Ниже приведены различные способы записи
проекционной формулы, отвечающей левой
модели на предыдущем рисунке:
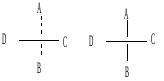
В
проекции главную углеродную цепь
изображают вертикально; главную функцию,
если она находится в конце цепи, указывают
в верхней части проекции. Например,
стереохимические и проекционные формулы
(+) и (-) аланина – СН3
–*СН(NН2)-СООН
представляют следующим образом:
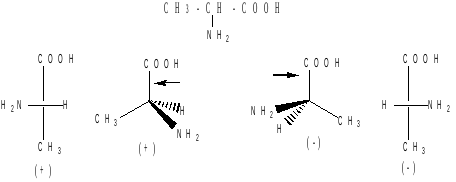
Смесь с одинаковым
содержанием энантиомеров называется
рацематом. Рацемат не обладает оптической
активностью и характеризуется отличными
от энантиомеров физическими свойствами.
Правила
преобразования проекционных формул.
1.
Формулы можно вращать в плоскости
чертежа на 180о,
не меняя их стереохимического смысла:
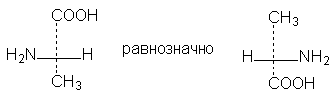
2.
Две (или любое четное число) перестановки
заместителей у одного асимметрического
атома не меняют стереохимического
смысла формулы:
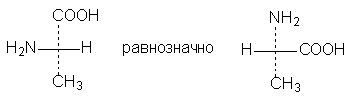
3. Одна
(или любое нечетное число) перестановка
заместителей у асимметрического центра
приводит к формуле оптического антипода:
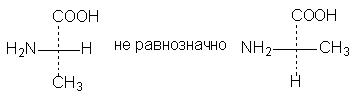
4.
Поворот в плоскости чертежа на 90о
превращает формулу в антипод.
5.
Вращение любых трех заместителей по
часовой стрелке или против не меняет
стереохимического смысла формулы:
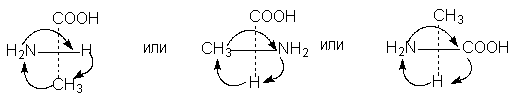
6.
Проекционные формулы нельзя выводить
из плоскости чертежа.
Оптической
активностью обладают органические
соединения, в молекулах которых хиральными
центрами являются и другие атомы,
например кремния, фосфора, азота, серы.
Соединения с
несколькими асимметрическими атомами
углерода существуют в виде диастереомеров,
т.е. пространственных изомеров, не
составляющих друг с другом оптических
антиподов.
Диастереомеры
отличаются друг от друга не только
оптическим вращением, но и всеми другими
физическими константами: у них разные
температуры плавления и кипения, разные
растворимости и др.
Число
пространственных изомеров определяют
по формуле Фишера N=2n,
где n – число асимметрических атомов
углерода. Число стереоизомеров может
уменьшаться из-за частичной симметрии,
появляющейся в некоторых структурах.
Оптически неактивные диастереомеры
называют
мезо-формами.
Номенклатура
оптических изомеров:
а)
D-
, L-
номенклатура
Для
определения D-
или L-ряда
изомера конфигурацию (положение ОН–группы
у асимметричного атома углерода)
сравнивают с конфигурациями энантиомеров
глицеринового альдегида (глицериновый
ключ):

L-глицериновый
альдегид D-глицериновый
альдегид
Применение
D-,
L-номенклатуры
в
настоящее время ограничено тремя
классами оптически активных веществ:
углеводами, аминокислотами и оксикислотами.
б)
R -, S-номенклатура (номенклатура Кана,
Ингольда и Прелога)
Для
определения R(правый)- или S(левый)-конфигурации
оптического изомера необходимо
расположить заместители в тетраэдре
(стереохимической формуле) вокруг
асимметрического углеродного атома
таким образом, чтобы самый младший
заместитель (обычно это водород) имел
направление «от
наблюдателя».
Если переход трех остальных заместителей
от старшего к среднему и младшему по
старшинству происходит по
часовой стрелке
–
это R-изомер
(падение старшинства совпадает с
движением руки при написании верхней
части буквы R). Если переход происходит
против часовой
стрелки
– это S–изомер
(падение старшинства совпадает с
движением руки при написании верхней
части буквы S).
Для определения
R- или S-конфигурации оптического изомера
по проекционной формуле необходимо
путем четного числа перестановок
расположить заместители так, чтобы
самый младший из них оказался внизу
проекции. Падение старшинства остальных
трех заместителей по часовой стрелке
соответствует R-конфигурации, против
часовой стрелки – S-конфигурации.
Получают
оптические изомеры следующими
методами:
а)
выделение из природных материалов,
содержащих оптически
активные соединения, например
белки и аминокислоты, углеводы, многие
оксикислоты (винная, яблочная, миндальная),
терпеновые углеводороды, терпеновые
спирты и кетоны, стероиды, алкалоиды и
др.
б)
расщепление рацематов;
в) асимметрический
синтез;
г)
биохимическое получение оптически
активных веществ.
ЗНАЕТЕ
ЛИ ВЫ, ЧТО
-Явление
изомерии (от греч.-
isos
—
разный и meros
–
доля, часть) открыто в 1823г. Ю. Либихом и
Ф. Вёлером на примере солей двух
неорганических кислот: циановой Н-О-С≡N
и гремучей Н-О-N=
С.
-В
1830 г. Ж.Дюма распространил представление
об изомерии на органические соединения.
-В
1831г. термин «изомер» для органических
соединений предложил Й. Берцелиус.
-Стереоизомеры
природных соединений характеризуются
разной биологической активностью
(аминокислоты, углеводы, алкалоиды,
гормоны, феромоны, лекарственные вещества
природного происхождения и т.д.).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
