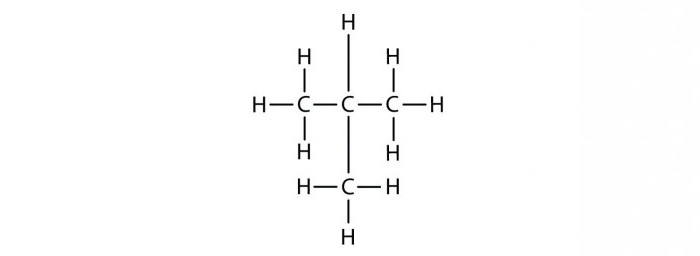
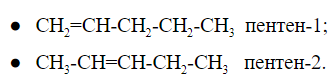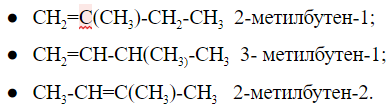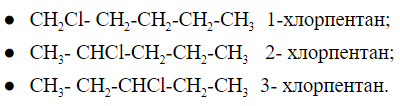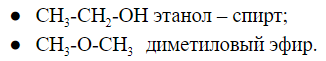Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
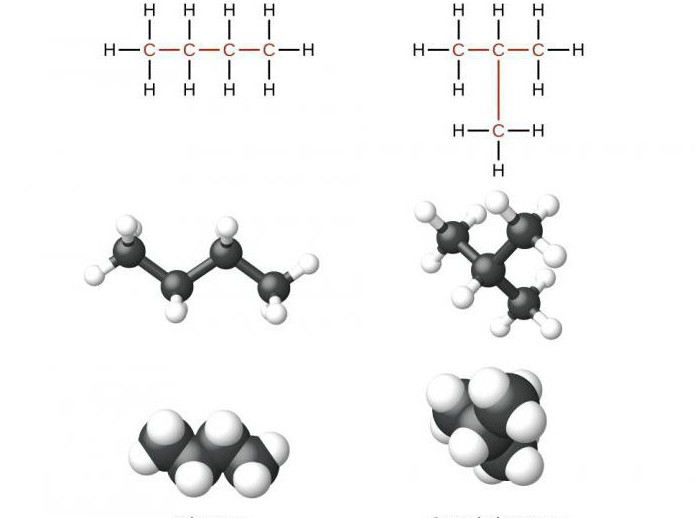
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
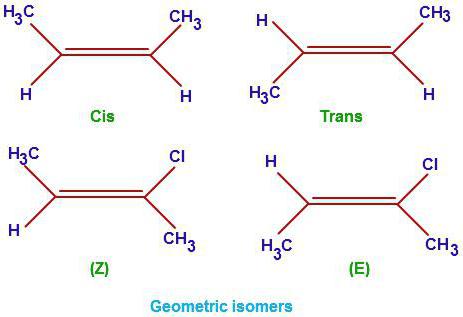
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
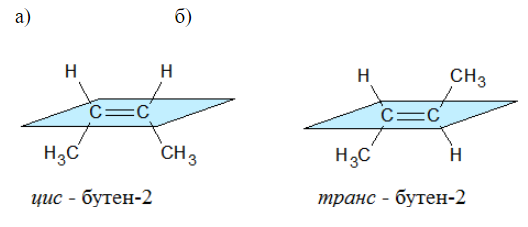
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Содержание
- 1 Определение
- 2 Структурная изомерия
- 2.1 Изомерия углеродного скелета
- 2.2 Изомерия положения кратной связи
- 2.3 Изомерия положения функциональной группы
- 2.4 Валентная изомерия
- 2.5 Межклассовая изомерия
- 3 Изомерия статическая и динамическая
- 4 Стереоизомерия
- 4.1 Цис-транс — изомерия (геометрическая)
- 4.2 Оптическая изомерия
- 5 Правила построения формул Фишера
- 6 Заключение
Органические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений.
Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле.
Определение
Изомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства.
Основные виды изомерии:
- структурные;
- пространственные.
Структурная изомерия
Структурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества.
Выделяют шесть видов структурной изомерии:
Изомерия углеродного скелета
Пентан имеет три структурные формулы изомеров:
Изомерия положения кратной связи
При общей формуле пентен имеет два изомера, различающихся расположением двойной связи:
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета.
Изомерия положения функциональной группы
К функциональным группам относятся фрагменты органических соединений, определяющие их свойства.
Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие.
Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи.
Валентная изомерия
Изомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом.
На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Пример:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут.
Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны.
Призман – самый нестабильный из изомеров бензола.
Межклассовая изомерия
Соединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений.
Общую формулу имеют два вещества:
Изомерия статическая и динамическая
Различают типы изомерии:
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная.
Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы.
Это интересно:
Изомеры гексана
Изомеры пентена
Гомологический ряд алкенов
Стереоизомерия
В пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному.
Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме.
Стереоизомерия делится на геометрическую (цис-транс) и оптическую.
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы.
Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл.
Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами.
Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-:
Оптическая изомерия
При исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ.
Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-).
Определить знак оптического изомера можно с помощью поляриметра.
Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями.
Хиральные молекулы невозможно совместить, так как они зеркально симметричны.
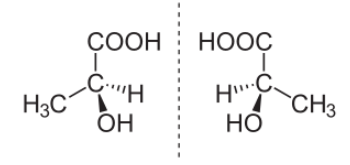
Пример пары стереоизомеров, представляющих зеркальные отражения:
(S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
Для изображения оптических изомеров используют проекционные формулы Э.Фишера.
Правила построения формул Фишера
Изображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.
Правила изображения проекции Фишера:
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила пользования проекциями Фишера имеют ограничения:
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S.
Заключение
Все виды изомерии органических соединений делят на две части – структурная изомерия и пространственная.
Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа.
Как составлять изомеры
Одним из важнейших понятий в органической химии является – изомерия. Ее смысл заключается в том, что существуют вещества, различающиеся пространственным расположение своих атом или атомных групп, при этом обладающих одинаковой молекулярной массой и составом. В этом и заключается главная причина того что в природе наблюдается огромное разнообразие органических веществ.

Вам понадобится
- Как составить изомер рассмотрим на примере алкана C6H14
Инструкция
Сначала нужно составить формулу углеводородного скелета в неразветвленном виде, исходя из данных его молекулярной формулы.
С – С – С – С – С – С
Пронумеровать все атомы углерода.
1 2 3 4 5 6
С – С – С – С – С – С
Зная о том, что углерод четырехвалентен, подставить атомы водорода углеродную цепь.
1 2 3 4 5 6
СН3 – СН2 – СН2 – СН2 – СН2 – СН3
Уменьшите углеродную цепочку на один атом, расположив его в виде бокового ответвления. Важно понимать, что боковые атомы цепочки углерода не могут стать боковыми ответвлениями.
С – С – С – С – С
С
Со стороны, к которой ближе боковое ответвление начните нумерацию цепочки, а затем расставьте атомы водорода, соблюдая правила валентности.
1 2 3 4 5
СН3 – СН – СН2 – СН2 – СН3
СН3
Если есть возможность чтобы расположить боковое ответвление у других атомов углеродной цепи, составьте все возможные изомеры.
1 2 3 4 5
СН3 – СН2 – СН – СН2 – СН3
СН3
Если для бокового ответвления больше нет возможностей, уменьшите изначальную цепочку углерода на один его атом, при этом расположив его как боковое ответвление. Не забывайте, что при одном атоме в углеродной цепочке находятся не больше двух ответвлений.
С
С – С – С – С
С
Пронумеруйте новую цепь атом с того же края, к которому ближе ответвление. Добавьте атомы водорода, помня о четырехвалентности атома углерода.
СН3
1 2 3 4
СН3 – С – СН2 – СН3
СН3
Проверяйте дальше можно ли расположить еще боковые ответвления к углеродной цепочке. Если можно составьте формулы изомеров. Если нельзя продолжайте уменьшать цепочку атомов углерода, постепенно на один атом, располагая его как боковое ответвление. Пронумеровав цепочку, продолжайте составлять формулы изомеров. Нумерация, в случае если боковые ответвления, находятся на одинаковом расстоянии от краев цепи, будет начинаться с края, у которого больше боковых ответвлений.
1 2 3 4
СН3 – СН – СН – СН3
СН3 СН3
Продолжайте последовательность всех действий, пока будет иметься возможность для расположения боковых ответвлений.
Видео по теме
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Постараемся выяснить, как составить изомеры органических веществ. Для примера возьмем углеводороды предельного и непредельного ряда.
Определение
Сначала выясним, что представляет собой явление изомерии. В зависимости от того, какое количество углеродных атомов находится в молекуле, возможно образование соединений, отличающихся по строению, физическим и химическим свойствам. Изомерия – это явление, которое объясняет многообразие органических веществ.
Изомерия насыщенных углеводородов
Как составить изомеры, назвать представителей данного класса органических соединений? Для того чтобы справиться с поставленной задачей, для начала выделим отличительные характеристики данного класса веществ. Предельные углеводороды имеют общую формулу СпН2п+2, в их молекулах присутствуют только простые (одинарные) связи. Изомерия для представителей ряда метана предполагает существование различных органических веществ, которые обладают одинаковым качественным и количественным составом, но отличаются последовательностью расположения атомов.
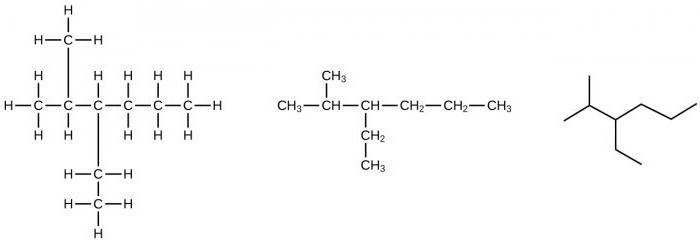
При наличии в составе предельных углеводородов от четырех и более атомов углерода для представителей данного класса наблюдается изомерия углеродного скелета. Например, можно составить формулу веществ изомеров состава С5Н12 в виде нормального пентана, 2-метилбутана, 2,2-диметилпропана.
Последовательность
Структурные изомеры, характерные для алканов, составляют, используя определенный алгоритм действий. Для того чтобы понять, как составить изомеры насыщенных углеводородов, остановимся на этом вопросе подробнее. Сначала рассматривается прямая углеродная цепочка, не имеющая дополнительных разветвлений. Например, при наличии в молекуле шести углеродных атомов, можно составить формулу гексана. Поскольку у алканов все связи одинарные, для них можно записать только структурные изомеры.
Структурные изомеры
Чтобы составить формулы возможных изомеров, углеродный скелет укорачивается на один атом С, он превращается в активную частицу – радикал. Метильная группа может располагаться у всех атомов в цепочке, исключая крайние атомы, образуя при этом различные органические производные алканов.
Например, можно составить формулу 2-метилпентана, 3-метилпентана. Затем количество атомов углерода в основной (главной) цепи уменьшается еще на один, в итоге появляется две активные метильные группы. Их можно располагать при одном или соседних углеродных атомах, получая различные изомерные соединения.
Например, можно составить формулы двух изомеров: 2,2-диметилбутана, 2,3-диметилбутана, отличающихся по физическим характеристикам. При последующем укорачивании основного углеродного скелета можно получить и другие структурные изомеры. Итак, для углеводородов предельного ряда явление изомерии объясняется наличием в их молекулах одинарных (простых) связей.
Особенности изомерии алкенов
Для того чтобы понять, как составить изомеры, необходимо отметить специфические особенности данного класса органических веществ. Мы имеем общую формулу СпН2п. В молекулах данных веществ, помимо одинарной связи, присутствует и двойная связь, которая оказывает влияние на количество изомерных соединений. Помимо структурной изомерии, характерной для алканов, для данного класса можно также выделить изомерию положения кратной связи, межклассовую изомерию.
Например, для углеводорода состава С4Н8 можно составить формулы двух веществ, которые будут отличаться по расположению двойной связи: бутена-1 и бутена-2.
Чтобы понять, как составить изомеры с общей формулой С4Н8, нужно иметь представление о том, что, помимо алкенов, такую же общую формулу имеют и циклические углеводороды. В качестве изомеров, принадлежащих к циклическим соединениям, можно представить циклобутан, а также метилциклопропан.
Кроме того, у непредельных соединений ряда этилена можно записать формулы геометрических изомеров: цис и транс форм. Для углеводородов, которые имеют двойную связь между углеродными атомами, характерно несколько видов изомерии: структурная, межклассовая, геометрическая.
Алкины
У соединений, которые принадлежат к данному классу углеводородов, общая формула – СпН2п-2. Среди отличительных характеристик этого класса можно упомянуть наличие тройной связи в молекуле. Одна из них является простой, образованной гибридными облаками. Две связи образуются при перекрывании негибридных облаков, они определяют особенности изомерии данного класса.
Например, для углеводорода состава С5Н8 можно составить формулы веществ, имеющих неразветвленную углеродную цепочку. Поскольку в исходном соединении есть кратная связь, она может располагаться по-разному, образуя пентин-1, пентин-2. Например, можно записать развернутую и сокращенную формулу соединения с заданным качественным и количественным составом, в котором углеродная цепочка будет сокращена на один атом, который будет представлен в соединении в виде радикала. Кроме того, для алкинов существуют и межклассовые изомеры, в качестве которых выступают диеновые углеводороды.
Для углеводородов, которые имеют тройную связь, можно составить изомеры углеродного скелета, написать формулы диенов, а также рассмотреть соединения с разным расположением кратной связи.
Заключение
При составлении структурных формул органических веществ можно по-разному располагать атомы кислорода, углерода, получая вещества, называемые изомерами. В зависимости от специфики класса органических соединений количество изомеров может быть различным. Например, для углеводородов предельного ряда, к которым относятся соединения ряда метана, характерна только структурная изомерия.
Для гомологов этилена, которые характеризуются наличием кратной (двойной) связи, помимо структурных изомеров, также можно рассмотреть изомерию положения кратной связи. Кроме того, такую же общую формулу имеют и другие соединения, которые относятся к классу циклоалканов, то есть возможна межклассовая изомерия.
Для кислородсодержащих веществ, например, для карбоновых кислот, также можно записать формулы оптических изомеров.
Прежде чем анализировать, как составлять изомеры предельных углеводородов, выявим особенности данного класса органических веществ.
Насыщенные углеводороды
В органической химии выделяется множество классов CxHy. У каждого есть своя общая формула, гомологический ряд, качественные реакции, применение. Для насыщенных углеводородов класса алканов характерны одинарные (сигма) связи. Общая формула данного класса органических веществ CnH2n+2. Этим объясняются основные химические свойства: замещение, горение, окисление. Для парафинов не характерны присоединение, так как связи в молекулах этих углеводородов одинарные.
Изомерия
Такое явление, как изомерия объясняет многообразие органических веществ. Под изомерией принято понимать явление, при котором существует несколько органических соединений, имеющих одинаковый количественный состав (число атомов в молекуле), но различное расположение их в молекуле. Получаемые вещества называют изомерами. Они могут быть представителями нескольких классов углеводородов, а потому отличаются химическими свойствами. Разное соединение в молекуле алканов атомов С приводит к возникновению структурной изомерии. Как составлять изомеры алканов? Существует определенный алгоритм, согласно которому можно изобразить структурные изомеры данного класса органических веществ. Появляется подобная возможность только с четырех углеродных атомов, то есть, с молекулы бутана С4Н10.
Разновидности изомерии
Для того чтобы понять, как составлять формулы изомеров, важно иметь представление о ее видах. При наличии внутри молекулы одинаковых атомов в равном количестве, располагающихся в пространстве в разном порядке, идет речь о пространственной изомерии. Иначе ее называют стереоизомерией. В подобной ситуации применения одних только структурных формул будет явно недостаточно, потребуется использование специальных проекционных или пространственных формул. Предельные углеводороды, начиная с H3C–СН3 (этана), имеют различные пространственные конфигурации. Это обусловлено вращением внутри молекулы по связи С–С. Именно простая σ-связь создает конформационную (поворотную) изомерию.
Структурная изомерия парафинов
Поговорим о том, как составлять изомеры алканов. Класс имеет структурную изомерию, то есть, атом углерода образует разные цепи. Иначе возможность изменения положения в цепи атомов углерода называют изомерией углеродного скелета.
Изомеры гептана
Итак, как оставлять изомеры для вещества, имеющего состав C7H16? Для начала можно расположить все атомы углерода в одну длинную цепочку, добавить для каждого определенное число атомов С. Сколько? Учитывая, что валентность углерода равна четырем, у крайних атомов будет по три атома водорода, а у внутренних – по два. Полученная молекула имеет линейное строение, такой углеводород называют н – гептаном. Буква «н» подразумевает прямой углеродный скелет в данном углеводороде.
Теперь меняем расположение углеродных атомов, «укорачивая» при этом прямую углеродную цепочку в C7H16. Составить изомеры можно в развернутом либо сокращенном структурном виде. Рассмотрим второй вариант. Сначала один атом С расположим в виде радикала метил в разных положениях.
Данный изомер гептана имеет следующее химическое название: 2-метилгексан. Теперь «передвигаем» радикал к следующему углеродному атому. Полученный предельный углеводород называется: 3-метилгексан.
Если мы будем далее передвигать радикал, нумерация будет начинаться с правой стороны (ближе к началу располагается углеводородный радикал), то есть, мы получим такой изомер, который у нас уже есть. Поэтому думая над тем, как составлять формулы изомеров для исходного вещества, попробуем сделать скелет еще «короче».
Оставшиеся два углерода можно представить в виде двух свободных радикалов – метил.
Расположим сначала их у разных углеродов, входящих в главную цепь. Назовем полученный изомер -2,3 диметилпентан.
Теперь оставим один радикал на том же месте, а второй перенесем к следующему углеродному атому главной цепи. Данное вещество называется 2,4 диметилпентан.
Теперь расположим углеводородные радикалы у одного углеродного атома. Сначала у второго, получим 2,2 диметилпентан. Затем у третьего, получив 3,3 диметилпентан.
Теперь оставляем в основной цепи четыре атома углерода, оставшиеся три используем в качестве радикалов метил. Располагаем их следующим образом: два у второго атома С, один – у третьего углерода. Называем полученный изомер: 2,2, 3 триметилбутан.
На примере гептана мы разобрали, как правильно составлять изомеры для предельных углеводородов. На фото представлены примеры структурных изомеров для бутена6 его хлорпроизводных.
Алкены
Данный класс органических веществ имеет общую формулу CnH2n. Помимо насыщенных связей С-С в данном классе есть также двойная связь. Именно она определяет основные свойства данного ряда. Поговорим о том, как оставлять изомеры алкенов. Попробуем выявить их отличия от предельных углеводородов. Помимо изомерии главной цепи (структурные формулы) для представителей данного класса органических углеводородов также характерны еще три разновидности изомеров: геометрические (цис- и трансформы), положения кратной связи, а также межклассовая изомерия (с циклоалканами).
Изомеры C6H12
Попробуем выяснить, как составить изомеры c6h12, учитывая тот факт, что вещество с данной формулой может принадлежать сразу к двум классам органических веществ: алкенам, циклоалканам.
Для начала подумаем, как составлять изомеры алкенов, если есть двойная связь в молекуле. Ставим прямую углеродную цепочку, поставим кратную связь после первого углеродного атома. Попробуем не только составить изомеры с6н12, но и назвать вещества. Данное вещество – гексен – 1. Цифрой указывается положение в молекуле двойной связи. При ее передвижении по углеродной цепочке, получаем гексен -2, а также гексен – 3
Теперь порассуждаем, как составлять изомеры для данной формулы, меняя количество атомов в главной цепи.
Для начала укоротим углеродный скелет на один углеродный атом, его будет рассматривать в качестве радикала метил. Двойную связь оставим после первого атома С. Полученный изомер по систематической номенклатуре будет иметь следующее название: 2 метилпентен – 1. Теперь передвигаем углеводородный радикал по главной цепи, оставив положение двойной связи неизменным. Данный непредельный углеводород разветвленного строения называют 3 метилпентен -1.
Возможен без изменения основной цепи и положения двойной связи еще один изомер: 4 метилпентен -1.
Для состава C6H12 можно попробовать переместить двойную связь из первого во второе положение, не преобразуя саму главную цепочку. Радикал при этом будет передвигать по углеродному скелету, начиная со второго атома С. Данный изомер имеет название 2 метилпентен-2. Кроме того, можно поместить радикал CH3 третьего атома углерода получив при этом 3 метилпентен-2
Если поместить радикал у четвертого углерода атома в данной цепи, образуется еще одно новое вещество непредельный углеводород с извилистым углеродным скелетом – 4 метилпентен-2.
При дальнейшем сокращении числа С в главной цепи, можно получить еще один изомер.
Двойную связь оставим после первого углеродного атома, а два радикала поставим к третьему атому С основной цепи, получаем 3,3 диметилутен-1.
Теперь поставим радикалы у соседних углеродных атомов, не меняя положения двойной связи, получим 2,3 диметилбутен-1. Попробуем, не меняя размер главной цепи, передвинуть двойную связь во второе положение. Радикалы при этом мы может поставить только у 2 и 3 атомов С, получив 2,3 диметилбутен-2.
Других структурных изомеров для данного алкена нет, любые попытки их придумать приведут к нарушению теории строения органических веществ А. М. Бутлерова.
Пространственные изомеры C6H12
Теперь выясним, как составлять изомеры и гомологи с точки зрения пространственной изомерии. Важно понимать, что цис- и трансформы алкенов возможны только для положения двойной связи 2 и 3.
При нахождении в одной плоскости углеводородных радикалов, образуется цис – измер гексена -2, а при расположении радикалов в разных плоскостях, транс-форма гексена – 2.
Межклассовые изомеры C6H12
Рассуждая над тем, как составлять изомеры и гомологи, нельзя забывать и о таком варианте, как межклассовая изомерия. Для непредельных углеводородов ряда этилена, имеющих общую формулу CnH2n, такими изомерами являются циклоалканы. Особенностью данного класса углеводородов является наличие циклической (замкнутой) структуры при насыщенных одинарных связях между атомами углерода. Можно составить формулы циклогексана, метилциклопентана, диметилциклобутана, триметилциклопропана.
Заключение
Органическая химия многогранна, загадочна. Количество органических веществ превышает в сотни раз число неорганических соединений. Данный факт легко объясняется существованием такого уникального явления, как изомерия. Если в одном гомологическом ряду располагаются сходные по свойствам и строению вещества, то при изменении положения атомов углерода в цепи, появляются новые соединения, названные изомерами. Только после появления теории химического строения органических веществ удалось классифицировать все углеводороды, понять специфику каждого класса. Одно из положений данной теории, непосредственно касается явления изомерии. Великий русский химик сумел понять, объяснить, доказать, что именно от расположения углеродных атомов зависят химические свойства вещества, его реакционаня активность, практическое применение. Если сравнивать количество изомеров, образуемых предельными алканами и непредельными алкенами, лидируют, безусловно, алкены. Объясняется это тем, что в их молекулах есть двойная связь. Именно она позволяет этому классу органических веществ образовывать не только алкены разного вида и строения, но и вести речь о меклассовой изомерии с циклоалканами.