Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июня 2017 года; проверки требуют 2 правки.
Изотопы магния — разновидности атомов (и ядер) химического элемента магния, имеющие разное содержание нейтронов в ядре.
Природный магний состоит из смеси 3 стабильных изотопов 24Mg, 25Mg и 26Mg с молярной концентрацией в смеси 78,6 %, 10,1 % и 11,3 % соответственно.
Все остальные 19 изотопов нестабильны, самый долгоживущий из них 28Mg с периодом полураспада 20,915 часов.
Таблица изотопов магния[править | править код]
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[1] (а. е. м.) |
Период полураспада[2] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[2] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 18Mg[3] | 12 | 6 | 2p | 16Ne | 0+ | ||||
| 19Mg | 12 | 7 | 19,03417(5) | 5(3) пс | 2p | 17Ne | 1/2−# | ||
| 20Mg | 12 | 8 | 20,0187631(2) | 93(5) мс | β+ (69,7%) | 20Na | 0+ | ||
| β+, p (30,3%) | 19Ne | ||||||||
| 21Mg | 12 | 9 | 21,0117058(8) | 118,6(5) мс | β+ (66,9%) | 21Na | 5/2+ | ||
| β+, p (32,6%) | 20Ne | ||||||||
| β+, α (0,5%) | 17F | ||||||||
| 22Mg | 12 | 10 | 21,9995707(3) | 3,8755(12) с | β+ | 22Na | 0+ | ||
| 23Mg | 12 | 11 | 22,99412394(17) | 11,317(11) с | β+ | 23Na | 3/2+ | ||
| 24Mg | 12 | 12 | 23,985041697(14) | стабилен | 0+ | 0,7899(4) | 0,78958–0,79017 | ||
| 25Mg | 12 | 13 | 24,98583696(5) | стабилен | 5/2+ | 0,1000(1) | 0,09996–0,10012 | ||
| 26Mg | 12 | 14 | 25,98259297(3) | стабилен | 0+ | 0,1101(3) | 0,10987–0,11030 | ||
| 27Mg | 12 | 15 | 26,98434063(5) | 9,435(27) мин | β− | 27Al | 1/2+ | ||
| 28Mg | 12 | 16 | 27,9838766(21) | 20,915(9) ч | β− | 28Al | 0+ | ||
| 29Mg | 12 | 17 | 28,988617(12) | 1,30(12) с | β− | 29Al | 3/2+ | ||
| 30Mg | 12 | 18 | 29,990463(4) | 313(4) мс | β− (99,94%) | 30Al | 0+ | ||
| β−, n (0,06%) | 29Al | ||||||||
| 31Mg | 12 | 19 | 30,996648(3) | 236(20) мс | β− (93,8%) | 31Al | 1/2(+) | ||
| β−, n (6,2%) | 30Al | ||||||||
| 32Mg | 12 | 20 | 31,999110(4) | 86(5) мс | β− (94,5%) | 32Al | 0+ | ||
| β−, n (5,5%) | 31Al | ||||||||
| 33Mg | 12 | 21 | 33,005327(3) | 90,5(16) мс | β− (86%) | 33Al | 3/2− | ||
| β−, n (14%) | 32Al | ||||||||
| 34Mg | 12 | 22 | 34,00894(3) | 20(10) мс | β− (70%) | 34Al | 0+ | ||
| β−, n (30%) | 33Al | ||||||||
| 35Mg | 12 | 23 | 35,01679(29) | 70(40) мс | β−, n (52%) | 34Al | 7/2−# | ||
| β− (48%) | 35Al | ||||||||
| 36Mg | 12 | 24 | 36,02188(74) | 3,9(13) мс | β− | 36Al | 0+ | ||
| 37Mg | 12 | 25 | 37,03029(75) | 8(4) мс | β− | 37Al | (3/2−) | ||
| β−, n | 36Al | ||||||||
| 38Mg | 12 | 26 | 38,03658(54)# | 1# мс [>260 нс] | 0+ | ||||
| 40Mg | 12 | 28 | 40,05191(54)# | 1# мс | β−, n | 39Al | 0+ | ||
| β− | 40Al |
Пояснения к таблице[править | править код]
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами ‘m’, ‘n’, ‘p’ (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом, обозначены стабильные продукты распада.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Примечания[править | править код]
- ↑ Данные приведены по Wang M., Audi G., Kondev F. G., Huang W. J., Naimi S., Xu X. The Ame2016 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Chinese Physics C. — 2016. — Vol. 41, iss. 3. — P. 030003-1—030003-442. — doi:10.1088/1674-1137/41/3/030003.
- ↑ 1 2 Данные приведены по Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.
- ↑ Jin, Y.; et al. (2021). “First observation of the four-proton unbound nucleus 18Mg”. Physical Review Letters. 127 (262502). DOI:10.1103/PhysRevLett.127.262502.
Из раздела химии
Валерия Баженова
Ученик
(245),
закрыт
3 месяца назад
Известны три стабильных изотопа магния с массовыми числами 24,25,26.определите число протов, нейтронов в ядре каждого изотопа. И объясните что такое изотоп, где его можно посмотреть?
NiNa Martushova
Искусственный Интеллект
(153334)
10 лет назад
Изотоп – это разновидность химического элемента, у которого одинаковый заряд ядра, но разное массовое число. Изотоп магния 24 имеет в ядре 12 протонов и 12 нейтронов; в изотопе 25,- 12 протонов, 13 нейтронов; в изотопе 26,- 12 протонов и 13 нейтронов.
В уроке 2 «Изотопы элементов» из курса «Химия для чайников» рассмотрим что такое изотопы элементов и как правильно их обозначают; кроме того мы научимся определять массовое число, дефект массы и энергию связи ядра. Данный урок полностью опирается на основы химии, изложенные в первом уроке, в котором мы рассмотрели строение атома и атомного ядра, поэтому настоятельно вам рекомендую его изучить от корки до корки.
Что такое изотоп?
Хотя все атомы одного элемента имеют одинаковое число протонов, эти атомы могут отличаться числом имеющихся у них нейтронов. Такие различные атомы одного и того же элемента называются изотопами. Количество протонов, а также количество электронов у изотопа и исходного элемента совпадает. По этой причине в природе существует гораздо больше химических элементов, чем указано в таблице Менделеева, которая систематизирует элементы по числу протонов (порядковый номер).
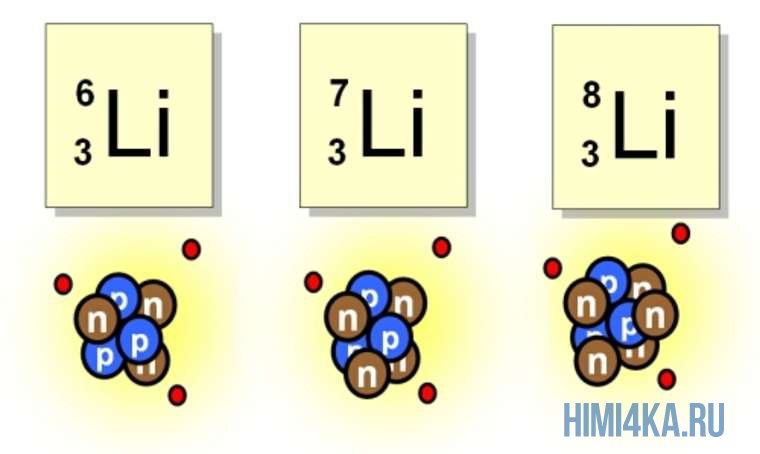
Например, все атомы Li имеют 3 протона, но в природе существуют изотопы, содержащие от 3 до 5 нейтронов. Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента. Нижний индекс, обозначающий порядковый номер элемента, указывать не обязательно, так как все атомы лития имеют в своем ядре по 3 протона. Также, обсуждая эти изотопы, можно пользоваться записью «литий-6» и «литий-8».
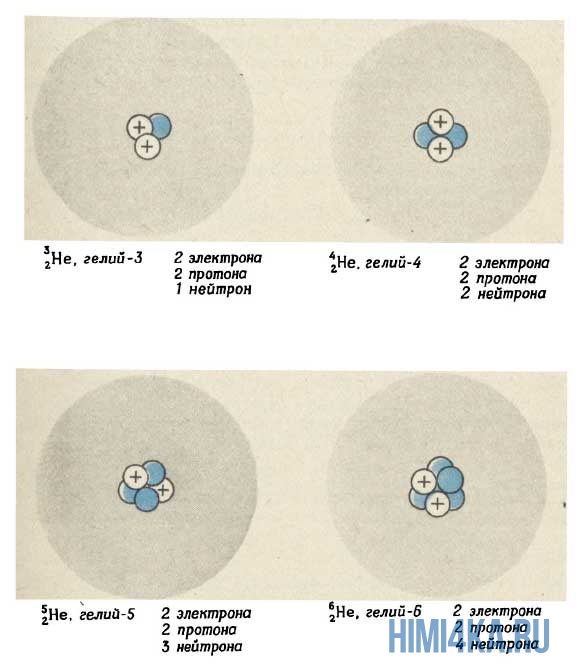
На рисунке выше изображен состав четырех изотопов гелия (Не). Все атомы гелия содержат два протона (и, следовательно, два электрона), но число нейтронов у них может быть разным. В природе большинство атомов гелия имеет два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 , гелий-6 и гелий-8 (не показанный на рисунке) — неустойчивы и обнаруживаются лишь на очень непродолжительное время в ядерных реакциях (подробнее об этом будем говорить еще не скоро). Размеры ядер на рисунке очень сильно увеличены. Если бы они были такими, как это показано на рисунке, диаметр атома должен был достигать примерно 0,5 км.
Пример 1. Сколько протонов, нейтронов и электронов содержится в атоме урана-238? Запишите символ этого изотопа.
Решение: Порядковый номер урана (см. таблицу Менделеева) равен 92, а массовое число изотопа равно 238 (по условию). Следовательно, он содержит 92 протона, 92 электрона и 238 — 92 = 146 нейтронов. Его символ 238U.
Дефект массы и энергия связи ядра
Затронув тему изотопов, нельзя пройти мимо феномена дефект массы ядра. Когда из отдельных нуклонов образуется атомное ядро, часть их массы превращается в энергию. Другими словами, вот взяли вы щепотку протонов и нейтронов, хорошенько их смяли вместе, и получили ядро, но его масса будет меньше массы исходных компонентов. Это и есть дефект масс. Формула для расчета дефекта массы ядра:
- ∆m=(Zmp+Nmn)-Mя
где Mя – масса ядра, Z – число протонов в ядре, N – число нейтронов в ядре, mp – масса протона, mn – масса нейтрона.
Если к атому подвести энергию (которая эквивалентна дефекту масс), то можно разделить его ядро обратно на нуклоны. Эта энергия носит название энергия связи ядра. Формула для расчета энергии связи ядра:
- ∆Eсв=∆mc2
где с — скорость света, ∆m — дефект массы ядра
Проверьте себя, как вы усвоили понятия дефект массы и энергия связи ядра, самостоятельно решив задачу пользуясь формулами выше.
Пример 2. Если образовать атом углерода-12 из субатомных частиц, какое значение будет иметь дефект масс?
Показать
Ответ: 0,0990 а.е.м.
[свернуть]
Теперь нам известно, что каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Поскольку дефект массы при образовании атома очень мал, массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. (Например, атомная масса хлора-37 равна 36,966, что после округления дает 37.) Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная атомная масса) равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется соответственно относительному содержанию изотопов в природе. Хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а.е.м.) и 24,47% хлора-37 (36,97 а.е.м.), поэтому средневзвешенное значение масс этих изотопов равно
- (0,7553·34,97 а.е.м.) + (0,2447·36,97 а.е.м.) = 35,46 а.е.м.
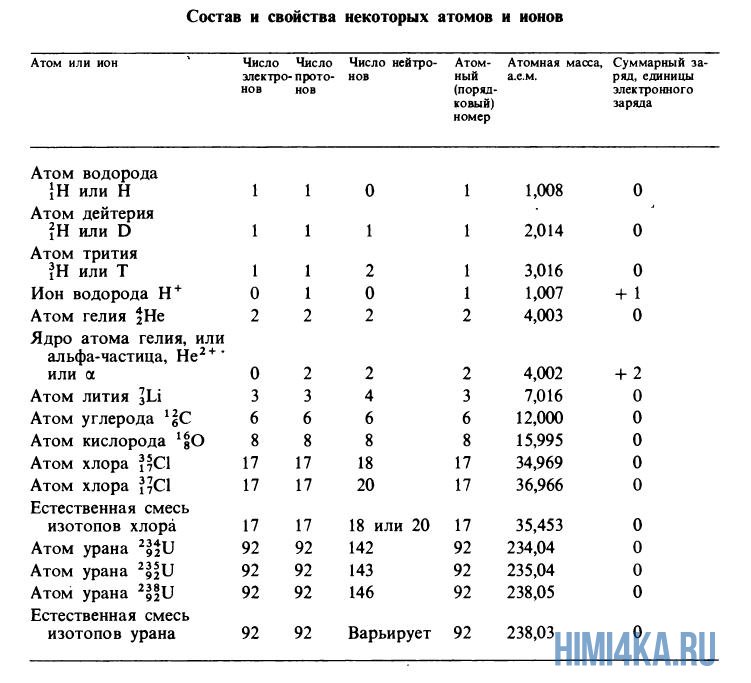
Атомные массы, указанные в таблице Менделеева представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет обсуждаться какой-нибудь конкретный изотоп. Все изотопы одного элемента в химическом отношении ведут себя практически одинаково. На рисунке ниже изображены состав и свойства некоторые атомов, ионов и изотопов элементов.
Пример 3. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% всех атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Чему равно средневзвешенное значение их атомных масс?
Решение: Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 — 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом:
- (0,7870·23,985 а.е.м.) + (0,1013·24,986 а.е.м.) + (0,1117·25,983 а.е.м.) = 24,31 а.е.м.
Надеюсь урок 2 «Изотопы элементов» помог вам понять что из себя представляют изотопы. Если у вас возникли вопросы, пишите их в комментарии.
Изотопы магния
- Изотопы магния
-
Изотопы магния — разновидности атомов (и ядер) химического элемента магния, имеющие разное содержание нейтронов в ядре.
Таблица изотопов магния
Символ
нуклидаZ(p) N(n) Масса изотопа[1]
(а. е. м.)Период
полураспада[2]
(T1/2)Спин и чётность
ядра[2]Энергия возбуждения 19Mg 12 7 19,03547 1/2- 20Mg 12 8 20,018863 90,8 мс 0+ 21Mg 12 9 21,011713 122 мс 5/2+ 22Mg 12 10 21,9995738 3,8755 s 0+ 23Mg 12 11 22,9941237 11,317 с 3/2+ 24Mg 12 12 23,985041700 стабилен 0+ 25Mg 12 13 24,98583692 стабилен 5/2+ 26Mg 12 14 25,982592929 стабилен 0+ 27Mg 12 15 26,98434059 9,458 мин 1/2+ 28Mg 12 16 27,9838768 20,915 ч 0+ 29Mg 12 17 28,988600 1,30 с 3/2+ 30Mg 12 18 29,990434 335 мс 0+ 31Mg 12 19 30,996546 230 мс 3/2+ 32Mg 12 20 31,998975 86 мс 0+ 33Mg 12 21 33,005254 90,5 мс 7/2- 34Mg 12 22 34,00946 20 мс 0+ 35Mg 12 23 35,01734 70 мс 7/2- 36Mg 12 24 36,02300 3,9 мс 0+ 37Mg 12 25 37,03140 40 мс 7/2- 38Mg 12 26 38,03757 1 мс 0+ 39Mg 12 27 39,04677 260 нс 7/2- 40Mg 12 28 40,05393 1 мс 0+ Примечания
- ↑ Данные приведены по G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 1 2 Данные приведены по G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
Изотопы натрия • Периодическая таблица по изотопам элементов • Изотопы алюминия
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое “Изотопы магния” в других словарях:
-
Изотопы алюминия — разновидности атомов (и ядер) химического элемента алюминия, имеющие разное содержание нейтронов в ядре. Таблица изотопов алюминия Символ нуклида Z(p) N(n) Масса изотопа[1] (а. е. м.) П … Википедия
-
Изотопы натрия — разновидности атомов (и ядер) химического элемента натрия, имеющие разное содержание нейтронов в ядре. Таблица изотопов натрия Символ нуклида Z(p) N(n) Масса изотопа[1] (а. е. м.) … Википедия
-
Изотопы неона — разновидности атомов (и ядер) химического элемента неона, имеющие разное содержание нейтронов в ядре. Существует три стабильных нуклида неона: 20Ne (изотопная распространённость 90,48 %), 21Ne (0,27 %) и 22Ne (9,25 %)[1].… … Википедия
-
Цезий — 55 Ксенон ← Цезий → Барий … Википедия
-
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
-
Актиноиды — Общие сведения Состав группы торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий … Википедия
-
МАГНИЙ — Mg (magnesium), химический элемент IIA подгруппы периодической системы элементов семейства щелочноземельных металлов (Be, Mg, Ca, Sr, Ba, Ra). Открыт английским химиком Х.Дэви в 1808. Магний один из наиболее легких металлов; недостаток его… … Энциклопедия Кольера
-
Уран (элемент) — У этого термина существуют и другие значения, см. Уран. 92 Протактиний ← Уран → Нептуний … Википедия
-
Аргон — 18 Хлор ← Аргон → Калий … Википедия
-
Иттрий — 39 Стронций ← Иттрий → Цирконий … Википедия
|
||||||||||||||||
| Стандартный атомный вес Аr, стандарт(Мг) |
|
|||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Магний (12Mg) в природе встречается в трех стабильных изотопах, 24Mg, 25Mg и 26Mg. Было обнаружено 18 радиоизотопов, начиная от 19Мг к 40Mg. Самый долгоживущий радиоизотоп – это 28Mg с периодом полураспада 20,915 часов. Более легкие изотопы в основном распадаются на изотопы натрий в то время как более тяжелые изотопы распадаются на изотопы алюминий. Самый недолговечный – это 19Mg с периодом полураспада 5 пикосекунд.
Обилие природных изотопов магния.
Список изотопов
| Нуклид[2] | Z | N | Изотопная масса (Да )[3] [n 1] |
Период полураспада [n 2] |
Разлагаться Режим [n 3] |
Дочь изотоп [n 4] |
Вращение и паритет [n 5][n 2] |
Природное изобилие (мольная доля) | |
|---|---|---|---|---|---|---|---|---|---|
| Нормальная пропорция | Диапазон вариации | ||||||||
| 19Mg | 12 | 7 | 19.03417(5) | 5 (3) л.с. | 2p | 17Ne | 1/2−# | ||
| 20Mg | 12 | 8 | 20.0187631(2) | 93 (5) мс | β+ (69.7%) | 20Na | 0+ | ||
| β+, п (30.3%) | 19Ne | ||||||||
| 21Mg | 12 | 9 | 21.0117058(8) | 118,6 (5) мс | β+ (66.9%) | 21Na | 5/2+ | ||
| β+, п (32,6%) | 20Ne | ||||||||
| β+, α (0.5%) | 17F | ||||||||
| 22Mg | 12 | 10 | 21.9995707(3) | 3.8755 (12) с | β+ | 22Na | 0+ | ||
| 23Mg | 12 | 11 | 22.99412394(17) | 11,317 (11) с | β+ | 23Na | 3/2+ | ||
| 24Mg | 12 | 12 | 23.985041697(14) | Стабильный | 0+ | 0.7899(4) | 0.78958–0.79017 | ||
| 25Mg | 12 | 13 | 24.98583696(5) | Стабильный | 5/2+ | 0.1000(1) | 0.09996–0.10012 | ||
| 26Mg[n 6] | 12 | 14 | 25.98259297(3) | Стабильный | 0+ | 0.1101(3) | 0.10987–0.11030 | ||
| 27Mg | 12 | 15 | 26.98434063(5) | 9,435 (27) мин | β− | 27Al | 1/2+ | ||
| 28Mg | 12 | 16 | 27.9838766(21) | 20.915 (9) ч | β− | 28Al | 0+ | ||
| 29Mg | 12 | 17 | 28.988617(12) | 1,30 (12) с | β− | 29Al | 3/2+ | ||
| 30Mg | 12 | 18 | 29.990463(4) | 313 (4) мс | β− (99.94%) | 30Al | 0+ | ||
| β−, п (0.06%) | 29Al | ||||||||
| 31Mg | 12 | 19 | 30.996648(3) | 236 (20) мс | β− (93.8%) | 31Al | 1/2(+) | ||
| β−, п (6,2%) | 30Al | ||||||||
| 32Mg | 12 | 20 | 31.999110(4) | 86 (5) мс | β− (94.5%) | 32Al | 0+ | ||
| β−, п (5,5%) | 31Al | ||||||||
| 33Mg | 12 | 21 | 33.005327(3) | 90,5 (16) мс | β− (86%) | 33Al | 3/2− | ||
| β−, п (14%) | 32Al | ||||||||
| 34Mg | 12 | 22 | 34.00894(3) | 20 (10) мс | β− (70%) | 34Al | 0+ | ||
| β−, п (30%) | 33Al | ||||||||
| 35Mg | 12 | 23 | 35.01679(29) | 70 (40) мс | β−, п (52%) | 34Al | 7/2−# | ||
| β− (48%) | 35Al | ||||||||
| 36Mg | 12 | 24 | 36.02188(74) | 3,9 (13) мс | β− | 36Al | 0+ | ||
| 37Mg | 12 | 25 | 37.03029(75) | 8 (4) мс | β− | 37Al | (3/2−) | ||
| β−, п | 36Al | ||||||||
| 38Mg | 12 | 26 | 38.03658(54)# | 1 # мс [> 260 нс] | 0+ | ||||
| 40Mg | 12 | 28 | 40.05191(54)# | 1 # мс | β−, п | 39Al | 0+ | ||
| β− | 40Al |
- ^ () – Неопределенность (1σ) дается в сжатой форме в скобках после соответствующих последних цифр.
- ^ а б # – Значения, отмеченные #, получены не только из экспериментальных данных, но, по крайней мере, частично из трендов соседних нуклидов (TNN ).
- ^ Режимы распада:
- ^ Жирный символ как дочка – Дочерний продукт стабильный.
- ^ () значение вращения – указывает вращение со слабыми аргументами присваивания.
- ^ Используется в сияющий события в начале истории Солнечной системы
внешняя ссылка
- Данные по изотопам магния из Проект изотопов Лаборатории Беркли
Рекомендации
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ Период полураспада, мода распада, ядерный спин и изотопный состав происходят из:
Audi, G .; Кондев, Ф. Г .; Wang, M .; Huang, W. J .; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF). Китайская физика C. 41 (3): 030001. Bibcode:2017ЧФК..41с0001А. Дои:10.1088/1674-1137/41/3/030001. - ^ Wang, M .; Audi, G .; Кондев, Ф. Г .; Huang, W. J .; Naimi, S .; Сюй, X. (2017). «Оценка атомной массы AME2016 (II). Таблицы, графики и ссылки» (PDF). Китайская физика C. 41 (3): 030003-1–030003-442. Дои:10.1088/1674-1137/41/3/030003.