Изотопы калия — разновидности химического элемента калия с разным количеством нейтронов в атомном ядре. Известны изотопы калия с массовыми числами от 33 до 59 (количество протонов 19, нейтронов от 14 до 40) и 5 ядерных изомеров.
Природный калий представляет собой смесь трех изотопов. Двух стабильных:
- 39K (изотопная распространённость 93,258 %)
- 41K (изотопная распространённость 6,730 %)
И одного нестабильного, но с большим периодом полураспада:
- 40K (изотопная распространённость 0,012 %), период полураспада 1,25⋅109 лет.
Благодаря радиоактивности 40K природный калий обладает удельной активностью около 31 кБк/кг. Самым долгоживущим из остальных радиоизотопов является 43K с периодом полураспада 22,3 часа.
Калий-40[править | править код]
40K распадается по одной из трех схем:
- Бета-распад: вероятность 89,28 %, дочерний изотоп стабильный 40Ca.
- Электронный захват: вероятность 10,72 %, дочерний изотоп стабильный 40Ar.
- Позитронный распад: вероятность 0,001 %, дочерний изотоп стабильный 40Ar.
Значимость калия-40 определяется его определяющим вкладом в собственную радиоактивность биологических тканей, содержащих природный калий. Ввиду наличия калия-40 в теле человека природная радиоактивность человеческого организма составляет 4—5 кБк. Это примерно 80—85 % собственной радиоактивности организма. Оставшаяся часть обусловлена в основном изотопом 14С. Среднегодовая эффективная эквивалентная доза, получаемая человеком в результате распада калия-40 в тканях организма, составляет 0,18 мЗв.
Соотношение калия-40 и аргона-40 используется в калий-аргоновом способе датирования (англ.) (рус. абсолютного возраста минералов в геохронологии.
Таблица изотопов калия[править | править код]
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[1] (а. е. м.) |
Период полураспада[2] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[2] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 31K[3][4] | 19 | 12 | <10-11 с | 3p | 28S | ||||
| 32K | 19 | 13 | 32,02265(43)# | p | 31Ar | 1+# | |||
| 32mK | 950(100)# кэВ | 4+# | |||||||
| 33K | 19 | 14 | 33,00756(21)# | <25 нс | p | 32Ar | 3/2+# | ||
| 34K | 19 | 15 | 33,99869(21)# | <40 нс | p | 33Ar | 1+# | ||
| 35K | 19 | 16 | 34,9880054(6) | 178(8) мс | β+ (99,63%) | 35Ar | 3/2+ | ||
| β+, p (0,37%) | 34Cl | ||||||||
| 36K | 19 | 17 | 35,9813020(4) | 341(3) мс | β+ (99,95%) | 36Ar | 2+ | ||
| β+, p (0,048%) | 35Cl | ||||||||
| β+, α (0,0034%) | 32S | ||||||||
| 37K | 19 | 18 | 36,97337589(10) | 1,2365(9) с | β+ | 37Ar | 3/2+ | ||
| 38K | 19 | 19 | 37,96908112(21) | 7,636(18) мин | β+ | 38Ar | 3+ | ||
| 38m1K | 130,50(28) кэВ | 924,46(14) мс | β+ | 38Ar | 0+ | ||||
| 38m2K | 3458,0(2) кэВ | 21,95(11) мкс | ИП | 38K | (7+) | ||||
| 39K | 19 | 20 | 38,963706487(5) | стабилен | 3/2+ | 0,932581(44) | |||
| 40K | 19 | 21 | 39,96399817(6) | 1,248(3)⋅109 лет | β− (89,28%) | 40Ca | 4− | 1,17(1)⋅10−4 | |
| ЭЗ (10,72%) | 40Ar | ||||||||
| β+ (0,001%)[5] | |||||||||
| 40mK | 1643,639(11) кэВ | 336(12) нс | ИП | 40K | 0+ | ||||
| 41K | 19 | 22 | 40,961825258(4) | стабилен | 3/2+ | 0,067302(44) | |||
| 42K | 19 | 23 | 41,96240231(11) | 12,355(7) ч | β− | 42Ca | 2− | ||
| 43K | 19 | 24 | 42,9607347(4) | 22,3(1) ч | β− | 43Ca | 3/2+ | ||
| 43mK | 738,30(6) кэВ | 200(5) нс | ИП | 43K | 7/2− | ||||
| 44K | 19 | 25 | 43,9615870(5) | 22,13(19) мин | β− | 44Ca | 2− | ||
| 45K | 19 | 26 | 44,9606915(6) | 17,8(6) мин | β− | 45Ca | 3/2+ | ||
| 46K | 19 | 27 | 45,9619816(8) | 105(10) с | β− | 46Ca | 2− | ||
| 47K | 19 | 28 | 46,9616616(15) | 17,50(24) с | β− | 47Ca | 1/2+ | ||
| 48K | 19 | 29 | 47,9653412(8) | 6,8(2) с | β− (98,86%) | 48Ca | 1− | ||
| β−, n (1,14%) | 47Ca | ||||||||
| 49K | 19 | 30 | 48,9682108(9) | 1,26(5) с | β−, n (86%) | 48Ca | (3/2+) | ||
| β− (14%) | 49Ca | ||||||||
| 50K | 19 | 31 | 49,972380(8) | 472(4) мс | β− (71%) | 50Ca | 0− | ||
| β−, n (29%) | 49Ca | ||||||||
| 50mK | 171,4(4) кэВ | 125(40) нс | ИП | 50K | (2−) | ||||
| 51K | 19 | 32 | 50,975828(14) | 365(5) мс | β−, n (65%) | 50Ca | 3/2+ | ||
| β− (35%) | 51Ca | ||||||||
| 52K | 19 | 33 | 51,98160(4) | 110(4) мс | β−, n (74%) | 51Ca | 2−# | ||
| β− (23,7%) | 52Ca | ||||||||
| β−, 2n (2,3%) | 50Ca | ||||||||
| 53K | 19 | 34 | 52,98680(12) | 30(5) мс | β−, n (64%) | 52Ca | (3/2+) | ||
| β− (26%) | 53Ca | ||||||||
| β−, 2n (10%) | 51Ca | ||||||||
| 54K | 19 | 35 | 53,99463(64)# | 10(5) мс | β− (>99,9%) | 54Ca | 2−# | ||
| β−, n (<.1%) | 53Ca | ||||||||
| 55K | 19 | 36 | 55,00076(75)# | 3# мс | β− | 55Ca | 3/2+# | ||
| β−, n | 54Ca | ||||||||
| 56K | 19 | 37 | 56,00851(86)# | 1# мс | β− | 56Ca | 2−# | ||
| β−, n | 55Ca | ||||||||
| 57K[6][7] | 19 | 38 | β− | 57Ca | |||||
| 59K[7][прим. 1] | 19 | 40 | β− | 59Ca |
- ↑ Открытие этого изотопа не подтверждено.
Пояснения к таблице[править | править код]
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами ‘m’, ‘n’, ‘p’ (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом, обозначены стабильные продукты распада. Символами, выделенными жирным курсивом, обозначены радиоактивные продукты распада, имеющие периоды полураспада, сравнимые с возрастом Земли или превосходящие его и вследствие этого присутствующие в природной смеси.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Примечания[править | править код]
- ↑ Данные приведены по Wang M., Audi G., Kondev F. G., Huang W. J., Naimi S., Xu X. The Ame2016 atomic mass evaluation (I). Evaluation of input data; and adjustment procedures (англ.) // Chinese Physics C. — 2016. — Vol. 41, iss. 3. — P. 030002-1—030002-344. — doi:10.1088/1674-1137/41/3/030002.
- ↑ 1 2 Данные приведены по Audi G., Kondev F. G., Wang M., Huang W. J., Naimi S. The Nubase2016 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2017. — Vol. 41, iss. 3. — P. 030001-1—030001-138. — doi:10.1088/1674-1137/41/3/030001. — Bibcode: 2017ChPhC..41c0001A.

- ↑ “A peculiar atom shakes up assumptions of nuclear structure”. Nature. 573 (7773): 167. 6 September 2019. Bibcode:2019Natur.573T.167.. DOI:10.1038/d41586-019-02655-9. PMID 31506620.
- ↑ Kostyleva, D.; et al. (2019). “Towards the Limits of Existence of Nuclear Structure: Observation and First Spectroscopy of the Isotope 31K by Measuring Its Three-Proton Decay”. Physical Review Letters. 123 (9): 092502. arXiv:1905.08154. Bibcode:2019PhRvL.123i2502K. DOI:10.1103/PhysRevLett.123.092502. PMID 31524489.
- ↑ Engelkemeir, D. W.; Flynn, K. F.; Glendenin, L. E. (1962). “Positron Emission in the Decay of K40”. Physical Review. 126 (5): 1818. Bibcode:1962PhRv..126.1818E. DOI:10.1103/PhysRev.126,1818.
- ↑ Neufcourt, L.; Cao, Y.; Nazarewicz, W.; Olsen, E.; Viens, F. (2019). “Neutron drip line in the Ca region from Bayesian model averaging”. Physical Review Letters. 122 (6): 062502–1–062502–6. arXiv:1901.07632. Bibcode:2019PhRvL.122f2502N. DOI:10.1103/PhysRevLett.122.062502. PMID 30822058.
- ↑ 1 2 Tarasov, O.B. Production of very neutron rich isotopes: What should we know? (2017). Дата обращения: 2 февраля 2022. Архивировано 2 февраля 2022 года.
Содержание
- – Как узнать количество изотопов?
- – Как определить заряд ядра калия?
- – Сколько электронов в Изотопе калия?
- – Как найти массовое число изотопа?
- – Сколько всего изотопов?
- – Сколько изотопов у кислорода?
- – Как определять заряд ядра атома?
- – Как определить заряд атомного ядра?
- – Какой заряд у калия?
- – Сколько электронов в калии?
- – Сколько изотопов у калия?
- – Сколько протонов в атоме калия?
- – Как найти массовое число нуклидов?
- – Как найти атомное число?
- – Как определить массу атома изотопа?
Порядковый номер – это число протонов в ядре, а массовое число – это сумма протонов и нейтронов в ядре. Таким образом, в ядре самого распространенного изотопа калия 19 протонов и 39-19=20 нейтронов.
Как узнать количество изотопов?
Для обозначения изотопа, слева от символа элемента подписывают нижним индексом его порядковый номер, а верхним — массовое число. Массовое число — это суммарное число нуклонов (протонов и нейтронов) в атомном ядре, численно близкое к атомной массе элемента.
Как определить заряд ядра калия?
Зная порядковый номер элемента, можно определить строение его атома. Например, порядковый номер элемента калия 19; следовательно, заряд ядра его атома +19. Вокруг ядра нейтрального атома калия размещаются 19 элек- тронов с общим отрицательным зарядом –19. Можно также рассчитать и число нейтронов.
Сколько электронов в Изотопе калия?
Книги, звери и еда – это хобби навсегда. Порядковый номер калия в таблице Менделеева 19, поэтому атом калия содержит 19 электронов и 19 протонов. Наиболее часто встречающийся в природе изотоп калия имеем массу 39, он содержит в ядре 39-19=20 нейтронов.
Как найти массовое число изотопа?
Если число протонов в ядре обозначить буквой Z, а число нейтронов – буквой N, то массовое число (или число нуклонов) А = Z + N. Термин “массовое число” связан с тем, что именно количество нуклонов (протонов и нейтронов) в ядре практически полностью (с точностью обычно не хуже 1%) определяет массу атомного ядра и атома.
Сколько всего изотопов?
На 2017 год было известно 3437 изотопов всех элементов, из них 252 изотопа стабильны.
Сколько изотопов у кислорода?
Известно 16 изотопов кислорода с массовыми числами от 11 до 26 (количество протонов 8, нейтронов от 3 до 18). Ядерные изомеры неизвестны. Природный кислород состоит из смеси 3 стабильных изотопов: O (изотопная распространенность 99,76 %)
Как определять заряд ядра атома?
Установлено, что число протонов в ядре равно порядковому номеру элемента в Периодической таблице. Заряд ядра определяется числом протонов в нём. Значит, заряд ядра тоже равен порядковому номеру элемента. Атом — электронейтральная частица, поэтому число электронов в нём равно числу протонов.
Как определить заряд атомного ядра?
Заряд ядра химического элемента равен количеству протонов в ядре, умноженному на заряд протона. Количество протонов в ядре совпадает с порядковым номером элемента в периодической таблице Менделеева.
Какой заряд у калия?
Степень окисления калия
Атомы калия в соединениях имеют степени окисления 1, -1.
Сколько электронов в калии?
Образец: Это калий. Порядковый номер калия 19. Заряд ядра +19. В атоме калия 19 электронов и 4 энергетических уровня.
Сколько изотопов у калия?
Известны изотопы калия с массовыми числами от 33 до 59 (количество протонов 19, нейтронов от 14 до 40) и 5 ядерных изомеров. Природный калий представляет собой смесь трех изотопов. Двух стабильных: K (изотопная распространённость 93,258 %)
Сколько протонов в атоме калия?
19
Как найти массовое число нуклидов?
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число.
Как найти атомное число?
Так как атомный номер = количество протонов, а массовое число = количество протонов + количество нейтронов, то число нейтронов = массовое число – атомный номер.
Как определить массу атома изотопа?
Массу ядра можно найти следующим образом: mяд = N·mn + Z·mp. Так как mn ≈ mp ≈ 1.66·10−27 кг, а Z + N = A, получим: mяд = 1.66·10−27·A кг.
Интересные материалы:
Как зовут родителей принцессы Каденс?
Как зовут родителей Снегурочки?
Как зовут рождественских оленей?
Как зовут шимпанзе из Мадагаскара?
Как зовут сына Обломова?
Как зовут Трилл Пилла?
Как зовут всю семью барбоскиных?
Как зовут зеленого монстра из мультика?
Как зовут зелёную Фиксика?
Как зовут желтого робота из Звездных Войн?
Калий является химическим элементом, которому в периодической таблице Д. И. Менделеева соответствует символ “K” (с лат. Kalium) и номер 19. С арабского языка название этого элемента переводится как “зола растений”. Металл обладает яркими щелочными свойствами, имеет бело-серебристый цвет и распространен в природе в соленой воде и минералах. Химическая активность металла достаточно высокая, он легко окисляется на воздухе. Существует большое число изотопов калия, которые используются в различных областях деятельности человека.

Что такое атомные изотопы?
Перед рассмотрением вопроса об изотопах калия объясним термин “изотоп”. Под изотопами атома конкретного химического элемента понимается набор атомов, которые имеют один и тот же номер в периодической системе Менделеева, но отличаются друг от друга массой ядер. При этом число протонов во всех ядрах изотопов данного элемента является одинаковым. Отличается лишь число нейтронов.
Сам термин “изотоп” ведет свое происхождение с греческого языка и состоит из двух слов: isos – равный и topos – место. Впервые этот термин начал использоваться в начале XX века английским ученым Фредериком Содди, который вошел в историю химии, как исследователь радиоактивности атомов и природы изотопов различных элементов. За свои заслуги Содди получил Нобелевскую премию в 1921 году по химии.
Отметим, что большинство химических элементов имеют более одного изотопа. Всего 8 элементов периодической таблицы обладают одним изотопом, например, натрий или бериллий. Элементом, который имеет больше всего стабильных изотопов, является олово, у него их 10.
Стабильность изотопов
Чтобы ядро атома конкретного химического элемента было стабильным, необходимо соблюдение определенного соотношения нейтронов и протонов в этом ядре. Если это соотношение нарушается, изотоп становится нестабильным и в результате процессов радиоактивности распадается на более стабильные изотопы. Понятие стабильности является относительным, поскольку многие изотопы, будучи нестабильными, имеют большой период полураспада и могут считаться относительно стабильными.
Нестабильные или радиоактивные изотопы преобразуются в более стабильные атомы. В результате этого процесса происходит испускание бета-, альфа- или гамма-излучения.
Искусственно полученные радиоактивные изотопы используются для различных техник исследования в медицине. Применение же природных радиоактивных изотопов находит себя в области геологии для определения возраста пород и живых организмов, а также при производстве атомной энергии.
Изотопы калия
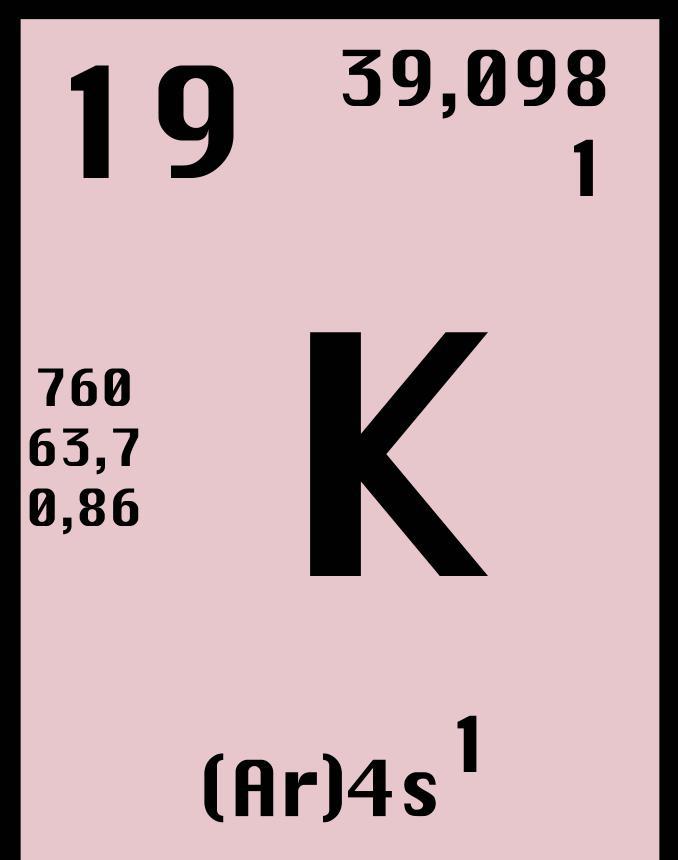
Калий имеет 24 различных изотопа. Эти изотопы обладают массой от 32 до 56 в атомных единицах массы (АЕМ). Учитывая, что калий занимает 19 порядковый номер в таблице Менделеева, значит, ядро изотопа калия содержит 19 протонов и от 13 до 37 нейтронов. Из всех этих изотопов всего три обладают большим временем жизни. Говоря более точно, отметим, что два изотопа, 39K и 41K, являются стабильными, в то время как третий изотоп, 40K, имеет большой период полураспада (1,25 миллиарда лет).
Содержание в природе калия и его изотопов
Содержание в природе изотопов калия составляет 2,4 % от массы всей земной коры, что ставит его на 7-е место в списке самых распространенных элементов на нашей планете. Из-за его высокой химической активности очень тяжело получить чистый калий. Кроме того, растворимость калия очень велика, поэтому во многих минералах он содержится в небольших концентрациях. Тем не менее на дне древних озер находятся большие количества этого элемента в виде следующих минералов:
- карналлит;
- лангбейнит;
- полигалит;
- сильвин.

Из этих минералов добыча калия является экономически целесообразной. Но калий существует в этих минералах не в виде одного изотопа. Как было выше сказано про стабильные изотопы, калий имеет три изотопа, содержание в природе которых составляет 93,3 % 39K, 6,7 % 41K и 0,012 % 40K.
Относительно стабильный изотоп K40
Радиоактивный изотоп калия 40K распадается либо за счет захвата электрона, либо за счет испускания позитрона. При этом образуется изотоп аргона 40Ar. Большой период полураспада 40K (1,248*109 лет) объясняется спин-запрещенным переходом этого изотопа в другой стабильный элемент.
В любом калийсодержащем минерале этот радиоактивный изотоп находится в достаточных количествах для демонстрации в школьных экспериментах явления радиоактивности. У людей и животных этот изотоп является главным источником их радиоактивности. Так, у человека весом 70 кг в организме находится около 4400 ядер 40K, которые распадаются каждую секунду.

Радиоактивный распад 40K на 40Ar используется в качестве одного из самых надежных методов определения возраста горных пород. Суть метода калия-аргона заключается в том, что при преобразовании гор в них не содержался аргон. В процессе времени атомы 40K распадались с образованием аргона, который задерживался в толще горных пород. Определение количества этого благородного газа, а также процентное содержание изотопов калия дает информацию о геологическом возрасте пород.
Другие радиоактивные изотопы

За исключением отмеченного изотопа 40K, все остальные изотопы этого химического элемента имеют периоды полураспада меньше 1 дня, большая же часть изотопов распадается быстрее, чем проходит минута. Почему изотопы калия, имеющие массы отличные от 39-41 АЕМ, распадаются так быстро? Дело в том, что в ядре атома калия содержится 19 протонов, а законы стабильности атомного ядра говорят, что количество нейтронов должно быть приблизительно такое же, чтобы атом мог существовать большое количество времени, не испытывая радиоактивный распад. Иными словами, чем ближе число нейтронов в ядре калия к 19, тем стабильнее будет такой изотоп.
Например, изотопы 42K и 43K (число нейтронов 23 и 24) имеют периоды полураспада 12,3 часа и 22,3 часа, соответственно. В то же время изотопы 33K и 34K (число нейтронов 14 и 15) распадаются за несколько наносекунд.
From Wikipedia, the free encyclopedia
|
||||||||||||||||||||||
| Standard atomic weight Ar°(K) | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||||||||||
|
Potassium (
19K) has 26 known isotopes from 31
K to 57
K, with the exception of still-unknown 32
K, as well as an unconfirmed report of 59
K.[3] Three of those isotopes occur naturally: the two stable forms 39
K (93.3%) and 41
K (6.7%), and a very long-lived radioisotope 40
K (0.012%)
Naturally occurring radioactive 40
K decays with a half-life of 1.248×109 years. 89% of those decays are to stable 40
Ca by beta decay, whilst 11% are to 40
Ar by either electron capture or positron emission. 40
K has the longest known half-life for any positron-emitter nuclide. The long half-life of this primordial radioisotope is caused by a highly spin-forbidden transition: 40
K has a nuclear spin of 4, while both of its decay daughters are even–even isotopes with spins of 0.
40
K occurs in natural potassium in sufficient quantity that large bags of potassium chloride commercial salt substitutes can be used as a radioactive source for classroom demonstrations.[citation needed] 40
K is the largest source of natural radioactivity in healthy animals and humans, greater even than 14
C. In a human body of 70 kg mass, about 4,400 nuclei of 40
K decay per second.[4]
The decay of 40
K to 40
Ar is used in potassium-argon dating of rocks. Minerals are dated by measurement of the concentration of potassium and the amount of radiogenic 40
Ar that has accumulated. Typically, the method assumes that the rocks contained no argon at the time of formation and all subsequent radiogenic argon (i.e., 40
Ar) was retained.[citation needed] 40
K has also been extensively used as a radioactive tracer in studies of weathering.[citation needed]
All other potassium isotopes have half-lives under a day, most under a minute. The least stable is 31
K, a three-proton emitter discovered in 2019; its half-life was measured to be shorter than 10 picoseconds.[5][6]
Various potassium isotopes have been used for nutrient cycling studies because potassium is a macronutrient required for life.[citation needed]
List of isotopes[edit]
| Nuclide[7] [n 1] |
Z | N | Isotopic mass (Da)[8] [n 2][n 3] |
Half-life [n 4] |
Decay mode |
Daughter isotope [n 5] |
Spin and parity [n 6][n 4] |
Natural abundance (mole fraction) | |
|---|---|---|---|---|---|---|---|---|---|
| Excitation energy[n 4] | Normal proportion | Range of variation | |||||||
| 31 K[5][6] |
19 | 12 | <10 ps | 3p | 28S | ||||
| 33K | 19 | 14 | 33.00756(21)# | <25 ns | p | 32Ar | 3/2+# | ||
| 34K | 19 | 15 | 33.99869(21)# | <40 ns | p | 33Ar | 1+# | ||
| 35K | 19 | 16 | 34.9880054(6) | 178(8) ms | β+ (99.63%) | 35Ar | 3/2+ | ||
| β+, p (.37%) | 34Cl | ||||||||
| 36K | 19 | 17 | 35.9813020(4) | 341(3) ms | β+ (99.95%) | 36Ar | 2+ | ||
| β+, p (.048%) | 35Cl | ||||||||
| β+, α (.0034%) | 32S | ||||||||
| 37K | 19 | 18 | 36.97337589(10) | 1.2365(9) s | β+ | 37Ar | 3/2+ | ||
| 38K | 19 | 19 | 37.96908112(21) | 7.636(18) min | β+ | 38Ar | 3+ | ||
| 38m1K | 130.50(28) keV | 924.46(14) ms | β+ | 38Ar | 0+ | ||||
| 38m2K | 3458.0(2) keV | 21.95(11) μs | IT | 38K | (7+) | ||||
| 39K | 19 | 20 | 38.963706487(5) | Stable | 3/2+ | 0.932581(44) | |||
| 40K[n 7][n 8] | 19 | 21 | 39.96399817(6) | 1.248(3)×109 y | β− (89.28%) | 40Ca | 4− | 1.17(1)×10−4 | |
| EC (10.72%) | 40Ar | ||||||||
| β+ (0.001%)[9] | |||||||||
| 40mK | 1643.639(11) keV | 336(12) ns | IT | 40K | 0+ | ||||
| 41K | 19 | 22 | 40.961825258(4) | Stable | 3/2+ | 0.067302(44) | |||
| 42K | 19 | 23 | 41.96240231(11) | 12.355(7) h | β− | 42Ca | 2− | ||
| 43K | 19 | 24 | 42.9607347(4) | 22.3(1) h | β− | 43Ca | 3/2+ | ||
| 43mK | 738.30(6) keV | 200(5) ns | IT | 43K | 7/2− | ||||
| 44K | 19 | 25 | 43.9615870(5) | 22.13(19) min | β− | 44Ca | 2− | ||
| 45K | 19 | 26 | 44.9606915(6) | 17.8(6) min | β− | 45Ca | 3/2+ | ||
| 46K | 19 | 27 | 45.9619816(8) | 105(10) s | β− | 46Ca | 2− | ||
| 47K | 19 | 28 | 46.9616616(15) | 17.50(24) s | β− | 47Ca | 1/2+ | ||
| 48K | 19 | 29 | 47.9653412(8) | 6.8(2) s | β− (98.86%) | 48Ca | 1− | ||
| β−, n (1.14%) | 47Ca | ||||||||
| 49K | 19 | 30 | 48.9682108(9) | 1.26(5) s | β−, n (86%) | 48Ca | (3/2+) | ||
| β− (14%) | 49Ca | ||||||||
| 50K | 19 | 31 | 49.972380(8) | 472(4) ms | β− (71%) | 50Ca | 0− | ||
| β−, n (29%) | 49Ca | ||||||||
| 50mK | 171.4(4) keV | 125(40) ns | IT | 50K | (2−) | ||||
| 51K | 19 | 32 | 50.975828(14) | 365(5) ms | β−, n (65%) | 50Ca | 3/2+ | ||
| β− (35%) | 51Ca | ||||||||
| 52K | 19 | 33 | 51.98160(4) | 110(4) ms | β−, n (74%) | 51Ca | 2−# | ||
| β− (23.7%) | 52Ca | ||||||||
| β−, 2n (2.3%) | 50Ca | ||||||||
| 53K | 19 | 34 | 52.98680(12) | 30(5) ms | β−, n (64%) | 52Ca | (3/2+) | ||
| β− (26%) | 53Ca | ||||||||
| β−, 2n (10%) | 51Ca | ||||||||
| 54K | 19 | 35 | 53.99463(64)# | 10(5) ms | β− (>99.9%) | 54Ca | 2−# | ||
| β−, n (<.1%) | 53Ca | ||||||||
| 55K | 19 | 36 | 55.00076(75)# | 3# ms | β− | 55Ca | 3/2+# | ||
| β−, n | 54Ca | ||||||||
| 56K | 19 | 37 | 56.00851(86)# | 1# ms | β− | 56Ca | 2−# | ||
| β−, n | 55Ca | ||||||||
| 57K[10][3] | 19 | 38 | β− | 57Ca | |||||
| 59K[3][n 9] | 19 | 40 | β− | 59Ca | |||||
This table header & footer:
|
- ^ mK – Excited nuclear isomer.
- ^ ( ) – Uncertainty (1σ) is given in concise form in parentheses after the corresponding last digits.
- ^ # – Atomic mass marked #: value and uncertainty derived not from purely experimental data, but at least partly from trends from the Mass Surface (TMS).
- ^ a b c # – Values marked # are not purely derived from experimental data, but at least partly from trends of neighboring nuclides (TNN).
- ^ Bold symbol as daughter – Daughter product is stable.
- ^ ( ) spin value – Indicates spin with weak assignment arguments.
- ^ Used in potassium-argon dating
- ^ Primordial radionuclide
- ^ Discovery of this isotope is unconfirmed
See also[edit]
- Banana equivalent dose
References[edit]
- ^ “Standard Atomic Weights: Potassium”. CIAAW. 1979.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). “Standard atomic weights of the elements 2021 (IUPAC Technical Report)”. Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ a b c Tarasov, O.B. (2017). “Production of very neutron rich isotopes: What should we know?”.
- ^ “Radioactive Human Body”. Retrieved 2011-05-18.
- ^ a b “A peculiar atom shakes up assumptions of nuclear structure”. Nature. 573 (7773): 167. 6 September 2019. Bibcode:2019Natur.573T.167.. doi:10.1038/d41586-019-02655-9. PMID 31506620.
- ^ a b Kostyleva, D.; et al. (2019). “Towards the Limits of Existence of Nuclear Structure: Observation and First Spectroscopy of the Isotope 31K by Measuring Its Three-Proton Decay”. Physical Review Letters. 123 (9): 092502. arXiv:1905.08154. Bibcode:2019PhRvL.123i2502K. doi:10.1103/PhysRevLett.123.092502. PMID 31524489. S2CID 159041565.
- ^ Half-life, decay mode, nuclear spin, and isotopic composition is sourced in:
Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). “The NUBASE2016 evaluation of nuclear properties” (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001. - ^ Wang, M.; Audi, G.; Kondev, F. G.; Huang, W. J.; Naimi, S.; Xu, X. (2017). “The AME2016 atomic mass evaluation (II). Tables, graphs, and references” (PDF). Chinese Physics C. 41 (3): 030003-1–030003-442. doi:10.1088/1674-1137/41/3/030003.
- ^ Engelkemeir, D. W.; Flynn, K. F.; Glendenin, L. E. (1962). “Positron Emission in the Decay of K40”. Physical Review. 126 (5): 1818. Bibcode:1962PhRv..126.1818E. doi:10.1103/PhysRev.126.1818.
- ^ Neufcourt, L.; Cao, Y.; Nazarewicz, W.; Olsen, E.; Viens, F. (2019). “Neutron drip line in the Ca region from Bayesian model averaging”. Physical Review Letters. 122 (6): 062502–1–062502–6. arXiv:1901.07632. Bibcode:2019PhRvL.122f2502N. doi:10.1103/PhysRevLett.122.062502. PMID 30822058. S2CID 73508148.
Изотопы калия
Изотопы калия — разновидности атомов (и ядер) химического элемента калия, имеющие разное содержание нейтронов в ядре.
Таблица изотопов калия
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[1] (а. е. м.) |
Период полураспада[2] (T1/2) |
Спин и чётность ядра[2] |
|---|---|---|---|---|---|
| Энергия возбуждения | |||||
| 32K | 19 | 13 | 32,02192 | 1+ | |
| 32mK | 950 кэВ | ? | 4+ | ||
| 33K | 19 | 14 | 33,00726 | 25 нс | 3/2+ |
| 34K | 19 | 15 | 33,99841 | 40 нс | 1+ |
| 35K | 19 | 16 | 34,988010 | 178 мс | 3/2+ |
| 36K | 19 | 17 | 35,981292 | 342 мс | 2+ |
| 37K | 19 | 18 | 36,97337589 | 1,23651 с[3] | 3/2+ |
| 38K | 19 | 19 | 37,9690812 | 7,636 мин | 3+ |
| 38m1K | 130,50 кэВ | 924,2 мс | 0+ | ||
| 38m2K | 3,4580 МэВ | 21,98 мкс | 7+ | ||
| 39K | 19 | 20 | 38,96370668 | стабилен | 3/2+ |
| 40K | 19 | 21 | 39,96399848 | 1,248·109 лет | 4- |
| 40mK | 1,643639 МэВ | 336 нс | 0+ | ||
| 41K | 19 | 22 | 40,96182576 | стабилен | 3/2+ |
| 42K | 19 | 23 | 41,96240281 | 12,360 ч | 2- |
| 43K | 19 | 24 | 42,960716 | 22,3 ч | 3/2+ |
| 44K | 19 | 25 | 43,96156 | 22,13 мин | 2- |
| 45K | 19 | 26 | 44,960699 | 17,3 мин | 3/2+ |
| 46K | 19 | 27 | 45,961977 | 105 с | 2- |
| 47K | 19 | 28 | 46,961678 | 17,50 с | 1/2+ |
| 48K | 19 | 29 | 47,965514 | 6,8 с | 2- |
| 49K | 19 | 30 | 48,96745 | 1,26 с | 3/2+ |
| 50K | 19 | 31 | 49,97278 | 472 мс | 1- |
| 51K | 19 | 32 | 50,97638 | 365 мс | 3/2+ |
| 52K | 19 | 33 | 51,98261 | 105 мс | 2- |
| 53K | 19 | 34 | 52,98712 | 30 мс | 3/2+ |
| 54K | 19 | 35 | 53,99420 | 10 мс | 2- |
| 55K | 19 | 36 | 54,99971 | 3 мс | 3/2+ |
| 56K | 19 | 37 | > 620 нс |
Примечания
- ↑ Данные приведены по Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 Данные приведены по Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ P. D. Shidling et al. Precision half-life measurement of the β+ decay of 37K (англ.) // Physical Review C. — 2014. — Vol. 90. — P. 032501. — DOI:10.1103/PhysRevC.90.032501. — arXiv:1407.1742.
