Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 октября 2020 года; проверки требуют 4 правки.
Изото́пы бо́ра — разновидности атомов (и ядер) химического элемента бора, имеющие разное содержание нейтронов в ядре.
Природный бор состоит из двух стабильных изотопов, — бора-10 с концентрацией около 20 ат.% и остальное — бора-11. Соотношение этих двух изотопов варьируется в различных природных источниках в результате естественных природных процессов обогащения тем или иным изотопом. Усреднённые по разным природным источникам бора концентрации бора−10 и бора-11 составляют 19,97 ат.% и 80,17 ат.% соответственно с вариацией в пределах 18,929—20,386 и 79,614—81,071 ат.% соответственно.
Все остальные изотопы бора радиоактивны, самый долгоживущий из них — бор-8 с периодом полураспада 770 мс.
Таблица изотопов бора[править | править код]
| Символ нуклида |
Z(p) | N(n) | Масса изотопа[1] (а. е. м.) |
Период полураспада[2] (T1/2) |
Канал распада | Продукт распада | Спин и чётность ядра[2] |
Распространённость изотопа в природе |
Диапазон изменения изотопной распространённости в природе |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | |||||||||
| 7 B |
5 | 2 | 7,029 712 ± (27) | (570 ± (14))⋅10-24 с [801 ± (20) кэВ] |
p | 6 Be |
(3/2−) | ||
| 8 B |
5 | 3 | 8,0 246 073 ± (11) | 771,9 ± (9) мс | β+, α | 4 He |
2+ | ||
| 8m B |
10 624 ± (8) кэВ | 0+ | |||||||
| 9 B |
5 | 4 | 9,0 133 296 ± (10) | (800 ± (300))⋅10-21 с | p | 8 Be |
3/2− | ||
| 10 B |
5 | 5 | 10,012 936 862 ± (16) | стабилен | 3+ | [0,189, 0,204][3] | |||
| 11 B |
5 | 6 | 11,009 305 167 ± (13) | стабилен | 3/2− | [0,796, 0,811][3] | |||
| 11m B |
12 560 ± (9) кэВ | 1/2+, (3/2+) | |||||||
| 12 B |
5 | 7 | 12,0 143 526 ± (14) | 20,20 ± (2) мс | β− (99,40 ± (2)%) | 12 C |
1+ | ||
| β−, α (0,60 ± (2)%) | 8 Be |
||||||||
| 13 B |
5 | 8 | 13,0 177 800 ± (11) | 17,16 ± (18) мс | β− (99,734 ± (36)%) | 13 C |
3/2− | ||
| β−, n (0,266 ± (36)%) | 12 C |
||||||||
| 14 B |
5 | 9 | 14,025 404 ± (23) | 12,36 ± (29) мс | β− (93,96 ± (23)%) | 14 C |
2− | ||
| β−, n (6,04 ± (23)%) | 13 C |
||||||||
| 14m B |
17 065 ± (29) кэВ | (4,15 ± (1,90))⋅10-21 с | 0+ | ||||||
| 15 B |
5 | 10 | 15,031 087 ± (23) | 10,18 ± (35) мс | β−, n (> 98,7 ± (1,0)%) | 14 C |
3/2− | ||
| β− (< 1,3%) | 15 C |
||||||||
| β−, 2n (< 1,5%) | 13 C |
||||||||
| 16 B |
5 | 11 | 16,039 841 ± (26) | > 4,6⋅10-21 с | n | 15 B |
0− | ||
| 17 B |
5 | 12 | 17,04 693 ± (22) | 5,08 ± (5) мс | β−, n (63 ± (1)%) | 16 C |
(3/2−) | ||
| β− (21,1 ± (2,4)%) | 17 C |
||||||||
| β−, 2n (12 ± (2)%) | 15 C |
||||||||
| β−, 3n (3,5 ± (7)%) | 14 C |
||||||||
| β−, 4n (0,4 ± (3)%) | 13 C |
||||||||
| 18 B |
5 | 13 | 18,05 560 ± (22) | < 26 нс | n | 17 B |
(2−) | ||
| 19 B |
5 | 14 | 19,06 417 ± (56) | 2,92 ± (13) мс | β−, n (71 ± (9)%) | 18 C |
(3/2−) | ||
| β−, 2n (17 ± (5)%) | 17 C |
||||||||
| β−, 3n (< 9,1%) | 16 C |
||||||||
| β− (> 2,9%) | 19 C |
||||||||
| 20 B[4] |
5 | 15 | 20,07 451 ± (59) | > 912,4⋅10-24 с | n | 19 B |
(1−, 2−) | ||
| 21 B[4] |
5 | 16 | 21,08 415 ± (60) | > 760⋅10-24 с | 2n | 19 B |
(3/2−) |
Пояснения к таблице[править | править код]
- Распространённость изотопов приведена для большинства природных образцов. Для других источников значения могут сильно отличаться.
- Индексами ‘m’, ‘n’, ‘p’ (рядом с символом) обозначены возбужденные изомерные состояния нуклида.
- Символами, выделенными жирным шрифтом, обозначены стабильные продукты распада. Символами, выделенными жирным курсивом, обозначены радиоактивные продукты распада, имеющие периоды полураспада, сравнимые с возрастом Земли или превосходящие его и вследствие этого присутствующие в природной смеси.
- Значения, помеченные решёткой (#), получены не из одних лишь экспериментальных данных, а (хотя бы частично) оценены из систематических трендов у соседних нуклидов (с такими же соотношениями Z и N). Неуверенно определённые значения спина и/или чётности заключены в скобки.
- Погрешность приводится в виде числа в скобках, выраженного в единицах последней значащей цифры, означает одно стандартное отклонение (за исключением распространённости и стандартной атомной массы изотопа по данным ИЮПАК, для которых используется более сложное определение погрешности). Примеры: 29770,6(5) означает 29770,6 ± 0,5; 21,48(15) означает 21,48 ± 0,15; −2200,2(18) означает −2200,2 ± 1,8.
Применение[править | править код]

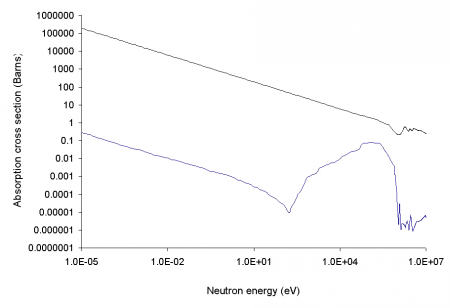
Сечения захвата нейтрона, барн, у изотопов 10В (красная линия) и 11В (синяя линия) в зависимости от энергии нейтрона, эВ
Бор-10 имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства изотопов других элементов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуется возбуждённое ядро бора-11 (11B*) сразу распадающееся на два стабильных ядра (альфа-частицу и ядро лития-7), эти ядра очень быстро тормозятся в среде, а проникающая радиация (гамма-излучение и нейтроны) при этом отсутствуют, в отличие от аналогичных реакций захвата нейтронов другими изотопами:
+ 2,31 МэВ.
Поэтому 10В в составе раствора борной кислоты и других химических соединений, например, карбида бора применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты персонала от тепловых нейтронов. Для повышения эффективности поглощения нейтронов бор, применяемый в реакторах, иногда специально обогащают изотопом бор-10.
Кроме того, соединения бора применяются в нейтрон-захватной терапии некоторых видов рака мозга, пробег ионизирующих быстрых ядер гелия-4 и лития-7 в тканях организма очень мал и поэтому при этом не поражаются ионизирующим излучением здоровые ткани.
Газообразное химическое соединение бора BF3 используется в качестве рабочей среды в ионизационных камерах детекторов тепловых нейтронов.
В 2015 году в опубликованной в журнале Science статье[5] было предложено применить измерение соотношения изотопов бора в древних осадочных породах позднего пермского периода и начала триасового периодов для определения изменения кислотности воды (pH) палеоокеанов в те эпохи, для объяснения возможных причин массового пермского вымирания в основном водных организмов, вызванное, вероятно, глобальным усилением вулканической деятельности, сопровождающейся выбросом углекислого газа в атмосферу. Этот метод определения кислотности древних океанов, по-видимому, более точен, чем ранее применявшийся метод определения кислотности по соотношению изотопов кальция[6] и изотопов углерода.
Примечания[править | править код]
- ↑ Данные приведены по Meng Wang, Huang W. J., Kondev F. G., Audi G., Naimi S. The Ame2020 atomic mass evaluation (II). Tables, graphs and references (англ.) // Chinese Physics C. — 2021. — Vol. 43, iss. 3. — P. 030003-1—030003-512. — doi:10.1088/1674-1137/abddaf.
- ↑ 1 2 Данные приведены по Kondev F. G., Wang M., Huang W. J., Naimi S., Audi G. The Nubase2020 evaluation of nuclear properties (англ.) // Chinese Physics C. — 2021. — Vol. 45, iss. 3. — P. 030001-1—030001-180. — doi:10.1088/1674-1137/abddae.

- ↑ 1 2 Atomic Weight of Boron. CIAAW. Дата обращения: 13 февраля 2022. Архивировано 20 марта 2022 года.
- ↑ 1 2 Leblond, S.; et al. (2018). “First observation of 20B and 21B”. Physical Review Letters. 121 (26): 262502–1–262502–6. arXiv:1901.00455. DOI:10.1103/PhysRevLett.121.262502. PMID 30636115.
- ↑ Clarkson, M. O. et al. (2015) Science 348, 229—232.
- ↑ Witze, Alexandra (2015) Acidic oceans linked to greatest extinction ever; Rocks from 252 million years ago suggest that carbon dioxide from volcanoes made sea water lethal. Journal Nature; News publiée le 09 avril 2015
From Wikipedia, the free encyclopedia
|
|||||||||||||
| Standard atomic weight Ar°(B) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||
|
Boron (5B) naturally occurs as isotopes 10
B
and 11
B
, the latter of which makes up about 80% of natural boron. There are 13 radioisotopes that have been discovered, with mass numbers from 7 to 21, all with short half-lives, the longest being that of 8
B
, with a half-life of only 771.9(9) ms and 12
B
with a half-life of 20.20(2) ms. All other isotopes have half-lives shorter than 17.35 ms. Those isotopes with mass below 10 decay into helium (via short-lived isotopes of beryllium for 7
B
and 9
B
) while those with mass above 11 mostly become carbon.
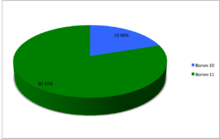
A chart showing the abundances of the naturally occurring isotopes of boron.
List of isotopes[edit]
| Nuclide[3] [n 1] |
Z | N | Isotopic mass (Da)[4] [n 2][n 3] |
Half-life
[resonance width] |
Decay mode [n 4] |
Daughter isotope [n 5] |
Spin and parity [n 6][n 7] |
Natural abundance (mole fraction) | |
|---|---|---|---|---|---|---|---|---|---|
| Excitation energy | Normal proportion | Range of variation | |||||||
| 6 B ?[n 8] |
5 | 1 | 6.050800(2150) | p-unstable | 2p? | 6 Li ? |
2−# | ||
| 7 B |
5 | 2 | 7.029712(27) | 570(14) ys [801(20) keV] |
p | 6 Be [n 9] |
(3/2−) | ||
| 8 B [n 10] |
5 | 3 | 8.0246073(11) | 771.9(9) ms | β+α | 4 He |
2+ | ||
| 8m B |
10624(8) keV | 0+ | |||||||
| 9 B |
5 | 4 | 9.0133296(10) | 800(300) zs | p | 8 Be [n 11] |
3/2− | ||
| 10 B [n 12] |
5 | 5 | 10.012936862(16) | Stable | 3+ | [0.189, 0.204][5] | |||
| 11 B |
5 | 6 | 11.009305167(13) | Stable | 3/2− | [0.796, 0.811][5] | |||
| 11m B |
12560(9) keV | 1/2+, (3/2+) | |||||||
| 12 B |
5 | 7 | 12.0143526(14) | 20.20(2) ms | β− (99.40(2)%) | 12 C |
1+ | ||
| β−α (0.60(2)%) | 8 Be [n 13] |
||||||||
| 13 B |
5 | 8 | 13.0177800(11) | 17.16(18) ms | β− (99.734(36)%) | 13 C |
3/2− | ||
| β−n (0.266(36)%) | 12 C |
||||||||
| 14 B |
5 | 9 | 14.025404(23) | 12.36(29) ms | β− (93.96(23)%) | 14 C |
2− | ||
| β−n (6.04(23)%) | 13 C |
||||||||
| β−2n ?[n 14] | 12 C ? |
||||||||
| 14m B |
17065(29) keV | 4.15(1.90) zs | IT ?[n 14] | 0+ | |||||
| 15 B |
5 | 10 | 15.031087(23) | 10.18(35) ms | β−n (98.7(1.0)%) | 14 C |
3/2− | ||
| β− (< 1.3%) | 15 C |
||||||||
| β−2n (< 1.5%) | 13 C |
||||||||
| 16 B |
5 | 11 | 16.039841(26) | > 4.6 zs | n ?[n 14] | 15 B ? |
0− | ||
| 17 B [n 15] |
5 | 12 | 17.04693(22) | 5.08(5) ms | β−n (63(1)%) | 16 C |
(3/2−) | ||
| β− (21.1(2.4)%) | 17 C |
||||||||
| β−2n (12(2)%) | 15 C |
||||||||
| β−3n (3.5(7)%) | 14 C |
||||||||
| β−4n (0.4(3)%) | 13 C |
||||||||
| 18 B |
5 | 13 | 18.05560(22) | < 26 ns | n | 17 B |
(2−) | ||
| 19 B [n 15] |
5 | 14 | 19.06417(56) | 2.92(13) ms | β−n (71(9)%) | 18 C |
(3/2−) | ||
| β−2n (17(5)%) | 17 C |
||||||||
| β−3n (< 9.1%) | 16 C |
||||||||
| β− (> 2.9%) | 19 C |
||||||||
| 20 B [6] |
5 | 15 | 20.07451(59) | > 912.4 ys | n | 19 B |
(1−, 2−) | ||
| 21 B [6] |
5 | 16 | 21.08415(60) | > 760 ys | 2n | 19 B |
(3/2−) | ||
This table header & footer:
|
- ^ mB – Excited nuclear isomer.
- ^ ( ) – Uncertainty (1σ) is given in concise form in parentheses after the corresponding last digits.
- ^ # – Atomic mass marked #: value and uncertainty derived not from purely experimental data, but at least partly from trends from the Mass Surface (TMS).
- ^
Modes of decay:
- ^ Bold symbol as daughter – Daughter product is stable.
- ^ ( ) spin value – Indicates spin with weak assignment arguments.
- ^ # – Values marked # are not purely derived from experimental data, but at least partly from trends of neighboring nuclides (TNN).
- ^ This isotope has not yet been observed; given data is inferred or estimated from periodic trends.
- ^ Subsequently decays by double proton emission to 4
He
for a net reaction of 7
B
→ 4
He
+ 3 1
H
- ^ Has 1 halo proton
- ^ Immediately decays into two α particles, for a net reaction of 9
B
→ 2 4
He
+ 1
H
- ^ One of the few stable odd-odd nuclei
- ^ Immediately decays into two α particles, for a net reaction of 12
B
→ 3 4
He
+ e− - ^ a b c Decay mode shown is energetically allowed, but has not been experimentally observed to occur in this nuclide.
- ^ a b Has 2 halo neutrons
- Neutrinos from boron-8 beta decays within the Sun are an important background to dark matter direct detection experiments.[7] They are the first component of the neutrino floor that dark matter direct detection experiments are expected to eventually encounter.
Applications[edit]
Boron-10[edit]
Boron-10 is used in boron neutron capture therapy as an experimental treatment of some brain cancers.
References[edit]
- ^ “Standard Atomic Weights: Boron”. CIAAW. 2009.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; et al. (2022-05-04). “Standard atomic weights of the elements 2021 (IUPAC Technical Report)”. Pure and Applied Chemistry. doi:10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ Half-life, decay mode, nuclear spin, and isotopic composition is sourced in:
Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). “The NUBASE2020 evaluation of nuclear properties” (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae. - ^ Wang, Meng; Huang, W.J.; Kondev, F.G.; Audi, G.; Naimi, S. (2021). “The AME 2020 atomic mass evaluation (II). Tables, graphs and references*”. Chinese Physics C. 45 (3): 030003. doi:10.1088/1674-1137/abddaf.
- ^ a b “Atomic Weight of Boron”. CIAAW.
{{cite web}}: CS1 maint: url-status (link) - ^ a b Leblond, S.; et al. (2018). “First observation of 20B and 21B”. Physical Review Letters. 121 (26): 262502–1–262502–6. arXiv:1901.00455. doi:10.1103/PhysRevLett.121.262502. PMID 30636115. S2CID 58602601.
- ^ Cerdeno, David G.; Fairbairn, Malcolm; Jubb, Thomas; Machado, Pedro; Vincent, Aaron C.; Boehm, Celine (2016). “Physics from solar neutrinos in dark matter direct detection experiments”. JHEP. 2016 (5): 118. arXiv:1604.01025. Bibcode:2016JHEP…05..118C. doi:10.1007/JHEP05(2016)118. S2CID 55112052.
| Бор | |
|---|---|
| Тёмно-коричневое или чёрное вещество | |

Элементарный бор |
|
| Название, символ, номер | Бор / Borum (B), 5 |
| Атомная масса (молярная масса) |
[10,806; 10,821]а. е. м. (г/моль) |
| Электронная конфигурация | [He] 2s2 2p1 |
| Радиус атома | 98 пм |
| Ковалентный радиус | 82 пм |
| Радиус иона | 23 (+3e) пм |
| Электроотрицательность | 2,04 (шкала Полинга) |
| Степени окисления | -3;0;+3 |
| Энергия ионизации (первый электрон) |
800,2(8,29) кДж/моль (эВ) |
| Плотность (при н. у.) | 2,34 г/см³ |
| Температура плавления | 2 348 K (2075 °C) |
| Температура кипения | 4 138 K (3865 °C) |
| Уд. теплота плавления | 23,60 кДж/моль |
| Уд. теплота испарения | 504,5 кДж/моль |
| Молярная теплоёмкость | 11,09 Дж/(K·моль) |
| Молярный объём | 4,6 см³/моль |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | a=10,17; α=65,18 Å |
| Отношение c/a | 0,576 |
| Температура Дебая | 1250 K |
| Теплопроводность | (300 K) 27,4 Вт/(м·К) |
| Номер CAS | 7440-42-8 |
Бор (B, лат. borum) — химический элемент 13-й группы, второго периода периодической системы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе III группы, или к группе IIIA) с атомным номером 5. Бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 4.1 Изотопы бора
- 5 Происхождение
- 6 Химические свойства
- 7 Применение
- 7.1 Элементарный бор
- 7.2 Соединения бора
- 7.3 Бороводороды и борорганические соединения
- 7.4 Боразон и его гексагидрид
- 8 Биологическая роль

История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Хэмфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бурак (араб. بورق) или персидского бурах (перс. بوره), которые использовались для обозначения буры.
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; в «чужих» минералах он почти не встречается. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л), в водах соляных озёр, горячих источников и грязевых вулканов.
Основные минеральные формы бора:
- Боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8
- Бораты: бура Na2B4O7·10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B6O11·6H2O, иниоит Ca2B6O11·13H2O, калиборит KMg2B11O19·9H2O.
Также различают несколько типов месторождений бора:

Образец датолита. Дальнегорское боросиликатное месторождение
- Месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды.
- Месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- Месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- Вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды.
- Галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Крупнейшее месторождение России находится в Дальнегорске (Приморье). Оно относится к боросиликатному типу. В этом одном компактном месторождении сосредоточено не менее 3 % всех мировых запасов бора. На действующем при месторождении горно-химическом предприятии выпускается боросодержащая продукция, которая удовлетворяет потребности отечественной промышленности. При этом 75 % продукции идёт на экспорт в Корею, Японию и Китай.
Получение
- Наиболее чистый бор получают пиролизом бороводородов. Такой бор используется для производства полупроводниковых материалов и тонких химических синтезов.
-
- B2H6 → t 2B + 3H2
- Метод металлотермии (чаще восстановление магнием или натрием):
-
- B2O3 + 3Mg ⟶ 3MgO + 2B
-
- KBF4 + 3Na ⟶ 3NaF + KF + B
- Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
-
- 2BBr3 + 3H2 →W 2B + 6HBr
Физические свойства
Сечения захвата нейтронов изотопами 10B (верхняя кривая) и 11B (нижняя кривая).
Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). Обладает хрупкостью и полупроводниковыми свойствами (широкозонный полупроводник).
У бора — самый высокий предел прочности на разрыв 5,7 ГПа.
Изотопы бора
Основная статья: Изотопы бора
В природе бор находится в виде двух изотопов 10B (19,8 %) и 11B (80,2 %).
10B имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
- 10B + n → 11B* → α + 7Li + 2,31 МэВ.
Поэтому 10B в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8B с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжелых ядер космическими лучами, или при взрывах сверхновых.
Химические свойства

Ионы бора окрашивают пламя в зелёный цвет
По многим физическим и химическим свойствам неметалл бор напоминает кремний.
Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
-
- 2B + 3F2 ⟶ 2BF3↑
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
-
- 4B + 3O2 ⟶ 2B2O3
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
-
- Mg3B2 + 6HCl ⟶ B2H6↑ + 3MgCl2
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
-
- 3SiO2 + 4B ⟶ 3Si + 2B2O3
-
- 3P2O5 + 10B ⟶ 5B2O3 + 6P
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. Растворяется в расплаве смеси гидроксида и нитрата калия:
-
- 2B + 2KOH + 3KNO3 →ot 2KBO2 + 3KNO2 + H2O
В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты H3BO3.
Оксид бора B2O3 — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
-
- B2O3 + 3H2O ⟶ 2H3BO3
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
-
- 4H3BO3 + 2NaOH ⟶ Na2B4O7 + 7H2O
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице.
Применение
Элементарный бор
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей).
Соединения бора
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2−) [B4O12H8]−) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент, рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике.
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °C. Изготовление люминофоров из нитрида бора, состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Бороводороды и борорганические соединения
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Боразон и его гексагидрид
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см3, содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили.
Биологическая роль
Основная статья: Биологическая роль бора
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л. Ежедневно с пищей человек получает 1—3 мг бора. Токсичная доза — 4 г. ЛД₅₀ ≈ 6 г/кг массы тела.
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора.
Изотопы бора
- Изотопы бора
-
Изотопы бора — разновидности атомов (и ядер) химического элемента бора, имеющие разное содержание нейтронов в ядре.
Таблица изотопов бора
Символ
нуклидаZ(p) N(n) Масса изотопа[1]
(а. е. м.)Период
полураспада[2]
(T1/2)Спин и чётность
ядра[2]Энергия возбуждения 6B 5 1 6,04681 7B 5 2 7,02992 350 ис 3/2- 8B 5 3 8,0246072 770 мс 2+ 9B 5 4 9,0133288 800 зс 3/2- 10B 5 5 10,0129370 стабилен 3+ 11B 5 6 11,0093054 стабилен 3/2- 12B 5 7 12,0143521 20,20 мс 1+ 13B 5 8 13,0177802 17,33 мс 3/2- 14B 5 9 14,025404 12,5 мс 2- 15B 5 10 15,031103 9,87 мс 3/2- 16B 5 11 16,03981 190 пс 0- 17B 5 12 17,04699 5,08 мс 3/2- 18B 5 13 18,05617 26 нс 4- 19B 5 14 19,06373 2,92 мс 3/2- Примечания
- ↑ Данные приведены по G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 1 2 Данные приведены по G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
Изотопы бериллия • Периодическая таблица по изотопам элементов • Изотопы углерода
Wikimedia Foundation.
2010.
Полезное
Смотреть что такое “Изотопы бора” в других словарях:
-
ИЗОТОПЫ БОРА В ГЕОЛОГИИ — природный бор имеет два стабильных изотопа: В10 и В11, соотношение масс которых (В11/В10) в п. литосферы в среднем равно 4,05. Большая относительная разница в массах изотопов бора в сочетании с его высокой миграционной способностью обусловливает… … Геологическая энциклопедия
-
Изотопы углерода — разновидности атомов (и ядер) химического элемента углерода, имеющие разное содержание нейтронов в ядре. Углерод имеет два стабильных изотопа 12C и 13C. Содержание этих изотопов в природном углероде равно соответственно 98,93 % и 1,07 % … Википедия
-
Изотопы бериллия — разновидности атомов (и ядер) химического элемента бериллия, имеющие разное содержание нейтронов в ядре. На данный момент известны 12 изотопов бериллия. Таблица изотопов бериллия Символ нуклида Z(p) N(n) Масса изотопа[1] (а … Википедия
-
Подгруппа бора — Группа → 13 ↓ Период 2 5 Бор … Википедия
-
Актиноиды — Общие сведения Состав группы торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий … Википедия
-
Второй период периодической системы — Ко второму периоду периодической системы относятся элементы второй строки (или второго периода) периодической системы химических элементов. Строение периодической таблицы основано на строках для иллюстрации повторяющихся (периодических) трендов в … Википедия
-
Важнейшие открытия в физике — История технологий По периодам и регионам: Неолитическая революция Древние технологии Египта Наука и технологии древней Индии Наука и технологии древнего Китая Технологии Древней Греции Технологии Древнего Рима Технологии исламского мира… … Википедия
-
АТОМНОГО ЯДРА СТРОЕНИЕ — Ядро представляет собой центральную часть атома (см. также АТОМА СТРОЕНИЕ). В нем сосредоточены положительный электрический заряд и основная часть массы атома; по сравнению с радиусом электронных орбит размеры ядра чрезвычайно малы: 10 15 10 14 м … Энциклопедия Кольера
-
ВВЭР-1000 — Монтаж корпуса реактора ВВЭР 1000 на Балаковской АЭС Тип реактора водо водяной … Википедия
-
Полоний — У этого термина существуют и другие значения, см. Полоний (значения). 84 Висмут ← Полоний → Астат … Википедия
|
|
Эта статья нужны дополнительные цитаты для проверка. Пожалуйста помоги улучшить эту статью к добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален. |
10Содержание B может составлять от 19,1% до 20,3% в природных образцах. 11B – остаток в таких случаях.[2] |
|||||||||||||
| Стандартный атомный вес Аr, стандарт(В) |
|
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Бор (5Б) естественно встречается как изотопы 10Группа 11B, последний из которых составляет около 80% природного бора. Всего 13 радиоизотопы которые были обнаружены, с массовыми числами от 7 до 21, все с короткими период полураспада, самый длинный из которых 8B, с периодом полураспада всего 770 миллисекунды (мс) и 12B с периодом полураспада 20,2 мс. Все остальные изотопы имеют период полураспада менее 17,35 мс. Изотопы с массой менее 10 распадаются на гелий (через недолговечный изотопы бериллия за 7Группа 9Б) в то время как те, у кого масса больше 11, в основном становятся углерод.

Диаграмма, показывающая распространенность встречающихся в природе изотопов бора.
Список изотопов
| Нуклид[4] [n 1] |
Z | N | Изотопная масса (Да )[5] [n 2][n 3] |
Период полураспада
[ширина резонанса ] |
Разлагаться Режим [n 4] |
Дочь изотоп [n 5] |
Вращение и паритет [n 6][n 7] |
Природное изобилие (мольная доля) | |
|---|---|---|---|---|---|---|---|---|---|
| Энергия возбуждения | Нормальная пропорция | Диапазон вариации | |||||||
| 7B | 5 | 2 | 7.029712(27) | 570(14) × 10−24 s [801 (20) кэВ] |
п | 6 Быть [n 8] |
(3/2−) | ||
| 8B[n 9] | 5 | 3 | 8.0246073(11) | 770 (3) мс | β+, α | 2 4 Он |
2+ | ||
| 9B | 5 | 4 | 9.0133296(10) | 800(300) × 10−21 s [0,54 (21) кэВ] |
п, α | 2 4 Он |
3/2− | ||
| 10B[n 10] | 5 | 5 | 10.012936862(16) | Стабильный | 3+ | 0.199(7) | 18.929–20.386 | ||
| 11B | 5 | 6 | 11.009305167(13) | Стабильный | 3/2− | 0.801(7) | 79.614–81.071 | ||
| 12B | 5 | 7 | 12.0143526(14) | 20.20 (2) мс | β− (98.4%) | 12 C |
1+ | ||
| β−, α (1.6%) | 8 Быть [n 11] |
||||||||
| 13B | 5 | 8 | 13.0177800(11) | 17,33 (17) мс | β− (99.72%) | 13 C |
3/2− | ||
| β−, п (0,28%) | 12 C |
||||||||
| 14B | 5 | 9 | 14.025404(23) | 12,5 (5) мс | β− (93.96%) | 14 C |
2− | ||
| β−, п (6,04%) | 13 C |
||||||||
| 15B | 5 | 10 | 15.031088(23) | 9,93 (7) мс | β−, п (93,6%) | 14 C |
3/2− | ||
| β− (6.0%) | 15 C |
||||||||
| β−, 2n (0,4%) | 13 C |
||||||||
| 16B | 5 | 11 | 16.039842(26) | > 4.6 × 10−21 s | п | 15 B |
0− | ||
| 17B[n 12] | 5 | 12 | 17.04693(22) | 5,08 (5) мс | β−, п (63,0%) | 16 C |
(3/2−) | ||
| β− (22.1%) | 17 C |
||||||||
| β−, 2n (11.0%) | 15 C |
||||||||
| β−, 3н (3,5%) | 14 C |
||||||||
| β−, 4n (0,4%) | 13 C |
||||||||
| 18B | 5 | 13 | 18.05560(22) | <26 нс | п | 17 B |
(2−) | ||
| 19B[n 12] | 5 | 14 | 19.06417(56) | 2,92 (13) мс | β−, п (71%) | 18 C |
3/2−# | ||
| β−, 2н (17%) | 17 C |
||||||||
| β− (12%) | 19 C |
||||||||
| 20B[6] | 5 | 15 | 20.07348(86)# | [2.50(9) МэВ ] | п | 19 B |
(1−, 2−) | ||
| 21B[6] | 5 | 16 | 21.08302(97)# | <260 нс [2,47 (19) МэВ] |
2n | 19 B |
(3/2−)# |
- ^ мB – Возбужден ядерный изомер.
- ^ () – Неопределенность (1σ) дается в сжатой форме в скобках после соответствующих последних цифр.
- ^ # – Атомная масса, отмеченная #: значение и погрешность, полученные не из чисто экспериментальных данных, а, по крайней мере, частично из трендов от массовой поверхности (ТМС ).
- ^ Режимы распада:
- ^ Жирный символ как дочка – Дочерний продукт стабильный.
- ^ () значение вращения – указывает вращение со слабыми аргументами присваивания.
- ^ # – Значения, отмеченные #, получены не только из экспериментальных данных, но, по крайней мере, частично из трендов соседних нуклидов (TNN ).
- ^ Впоследствии распадается путем двойного испускания протона до 4Он для чистой реакции 7B → 4Он + 3 1ЧАС
- ^ Имеет 1 гало протон
- ^ Один из немногих стабильных нечетно-нечетные ядра
- ^ Немедленно распадается на две α-частицы, в результате чего возникает чистая реакция 12В → 34Он + е−
- ^ а б Имеет 2 нейтрона гало
- Нейтрино бета-распады бора-8 на Солнце являются важным фоном для темной материи прямое обнаружение эксперименты.[7] Они являются первым компонентом нейтринного дна, с которым, как ожидается, в конечном итоге столкнутся эксперименты по прямому обнаружению темной материи.
Приложения
Бор-10
Бор-10 используется в борная нейтронозахватная терапия (BNCT) в качестве экспериментального лечения некоторых видов рака мозга.
Рекомендации
- ^ а б «Атомный вес и изотопный состав для всех элементов». Национальный институт стандартов и технологий. Получено 2008-09-21.
- ^ Szegedi, S .; Варади, М .; Buczkó, Cs. М .; Варнаги, М .; Sztaricskai, T. (1990). «Определение бора в стекле методом нейтронного пропускания». Журнал радиоаналитической и ядерной химии Letters. 146 (3): 177. Дои:10.1007 / BF02165219.
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ Период полураспада, мода распада, ядерный спин и изотопный состав происходят из:
Audi, G .; Кондев, Ф. Г .; Wang, M .; Huang, W. J .; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF). Китайская физика C. 41 (3): 030001. Bibcode:2017ЧФК..41с0001А. Дои:10.1088/1674-1137/41/3/030001. - ^ Wang, M .; Audi, G .; Кондев, Ф. Г .; Huang, W. J .; Naimi, S .; Сюй, X. (2017). «Оценка атомной массы AME2016 (II). Таблицы, графики и ссылки» (PDF). Китайская физика C. 41 (3): 030003-1–030003-442. Дои:10.1088/1674-1137/41/3/030003.
- ^ а б Leblond, S .; и другие. (2018). “Первое наблюдение 20Группа 21B “. Письма с физическими проверками. 121 (26): 262502–1–262502–6. arXiv:1901.00455. Дои:10.1103 / PhysRevLett.121.262502. PMID 30636115.
- ^ Cerdeno, David G .; Fairbairn, Малькольм; Джубб, Томас; Мачадо, Педро; Винсент, Аарон С .; Бем, Селин (2016). «Физика солнечных нейтрино в экспериментах по прямому обнаружению темной материи». JHEP. 2016 (5): 118. arXiv:1604.01025. Bibcode:2016JHEP … 05..118C. Дои:10.1007 / JHEP05 (2016) 118.
