Каким образом определить какая кислота соответствует определенному оксиду?
Профи
(627),
закрыт
11 лет назад
Тугеус Владимир
Искусственный Интеллект
(174748)
11 лет назад
Ваш вопрос включает в себя целый параграф химии!
Кислотный оксид + вода = кислота, например, Р2О5 + 3Н2О = 2Н3РО4,
но у фосфора бывает кислота НРО3 – метафосфорная кислота. В этих кислотах степень окисления фосфора равна +5. Проверь сам обе формулы по степеням окисления, если степени окислений у кислорода -2 и у водорода +1 (сумма должна дать 0!).
Даниил Журавлев
Профи
(546)
5 лет назад
в середине кислоты находится элемент-вот его степень окисления вычисли и построй оксид. Например, в вашем случае : Н3Р04-степень окисления фосфора: +5, теперь получм в уме оксид (степень окисления кислорода равна -2!) Получаем Р2О5. Есть разные кислотные оксиды с разными степенями окислений, но каждому из них соответствует кислотв с такой же степенью окисления неметалла, как и в оксиде. Получение кислоты: оксид+вода (Р2О5+3Н2О=2Н3Р04)

Свойства кислотных оксидов
Материал по химии
К кислотным оксидам относят оксиды неметаллов (кроме CO, SiO, NO и N2O), а также оксиды металлов в степени окисления «+5», «+6», «+7».
Кислотные оксиды реагируют с водой, основными и амфотерными оксидами, основаниями, с солями.
- При взаимодействии с водой все кислотные оксиды (за редким исключением, например, SiO2) образуют кислоты.
- При взаимодействии с основными оксидами образуется средняя соль.
- При взаимодействии с основаниями образуется средняя соль и вода, либо кислая соль и вода не выделяется.
- При взаимодействии с растворами солей образуются кислые соли. Оксид, соответствующий более сильной кислоте, может вытеснить из соли оксид, соответствующий менее сильной кислоте.
- Кислотные оксиды не реагируют с кислотами, исключение: P2O5 с кислородсодержащими кислотами (кислотными гидроксидами).
- Кислотный оксид + вода = кислота
CO2 + H2O = H2CO3
SO2 + H2O = H2SO3
Как определить, какая кислота образуется из кислотного оксида?
Способ первый. Выучить оксиды, соответствующие кислотам:
- Оксиду SO2 соответствует кислота H2SO3 (сернистая)
SO2 + H2O = H2SO3
- Оксиду SO3 соответствует кислота H2SO4 (серная)
SO3 + H2O = H2SO4
- Оксиду CO2 соответствует кислота H2CO3 (угольная)
CO2 + H2O = H2CO3
- Оксиду P2O5 соответствуют кислоты H3PO4, H4P2O7, HPO3 (ортофосфорная, пирофосфорная и метафосфорная соответственно)
Кислота зависит от соотношения воды и оксида фосфора:
P2O5 + H2O = 2HPO3 (метафосфорная)
P2O5 + 2H2O = H4P2O7 (пирофосфорная)
P2O5 + 3H2O = 2H3PO4 (ортофосфорная)
- Оксиду N2O3 соответствует кислота HNO2 (азотистая)
N2O3 + H2O = 2HNO2
- Оксиду N2O5 соответствует кислота HNO3 (азотная)
N2O5 + H2O = 2HNO3
- Оксиду NO2 также соответствует кислота HNO3, однако, при определенных условиях из этого оксида можно получить смесь азотной и азотистой кислот:
NO2 + H2O + O2 = HNO3
NO2 + H2O = HNO2 + HNO3
- Оксиду SiO2 соответствует кислота H2SiO3 (кремниевая), но напрямую из этого оксида кислоту получить нельзя, так как диоксид кремния нерастворим в воде.
- Оксиду CrO3 соответствуют кислоты H2CrO4 и H2Cr2O7 (хромовая и дихромовая):
CrO3 + H2O = H2CrO4
2CrO3 + H2O = H2Cr2O7
- Оксиду Mn2O7 соответствует кислота HMnO4 (марганцовая)
Mn2O7 + H2O = HMnO4
- Оксидам Cl2O, Br2O, I2O соответствуют кислоты HClO, HBrO, HIO (хлорноватистая, бромноватистая, йодноватистая)
Cl2O + H2O = 2HClO
Br2O + H2O = 2HBrO
I2O + H2O = 2HIO
- Оксидам Cl2O3, Br2O3, I2O3 соответствуют кислоты HClO2, HBrO2, HIO2 (хлористая, бромистая, йодистая)
Cl2O3 + H2O = 2HClO2
Br2O3 + H2O = 2HBrO2
I2O3 + H2O = 2HIO2
- Оксидам Cl2O5, Br2O5, I2O5 соответствуют кислота HClO3, HBrO3, HIO3 (хлорноватая, бромноватая, йодноватая)
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
Cl2O5 + H2O = 2HClO3
- Оксидам Cl2O7, Br2O7, I2O7 соответствуют HClO4, HBrO4, HIO4 (хлорная, бромная, йодная).
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Cl2O7 + H2O = 2HClO4
Способ второй. Считать степени окисления (или валентность). В оксиде и образующейся из неё кислоте у основного элемента должна быть одинаковая степень окисления. Таким образом оксиду SO3 соответствует только H2SO4, потому что степень окисления в обоих веществах «+6» (или валентность VI), а из всего разнообразия хлорсодержащих кислот, оксиду Cl2O3 будет соответствовать HClO2, так как и в оксиде, и в кислоте степень окисления хлора равна «+3» (или валентность III).
Свойства кислотных оксидов
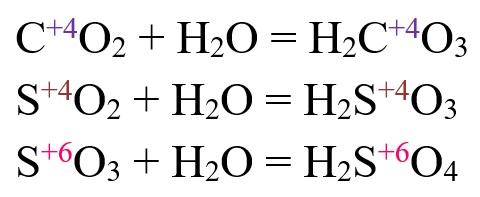
Какие оксиды соответствуют кислотам?
Способ третий. Составим кислоту самостоятельно, пользуясь алгоритмом (это особенно удобно, когда дан оксид, соответствующую кислоту которого мы не знаем):
- Пишем исходные вещества, определим степень окисления оксидообразующего элемента:
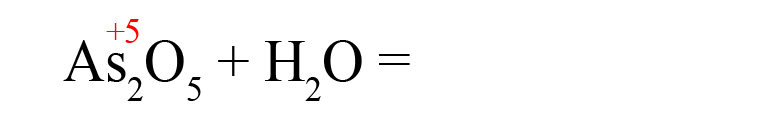
- В продуктах запишем «скелет» молекулы (последовательность всегда будет следующей водород → элемент → кислород):
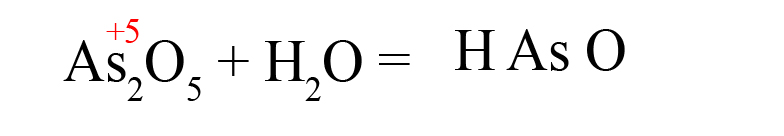
- Расставим степени окисления в продукте (они равны исходным степеням окисления в оксидах):
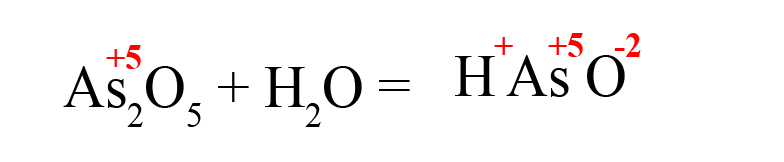
- Складываем положительные заряды:
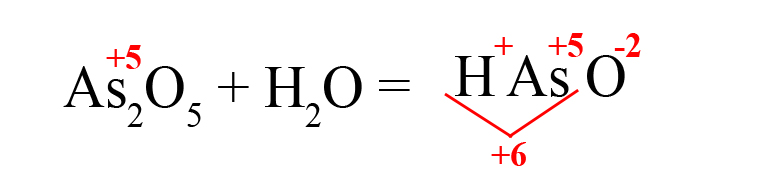
- Ставим после кислорода такой индекс, чтобы умножение его на -2 дало значение равное количеству положительных зарядов, посчитанных ранее (в нашем примере индекс «3»):
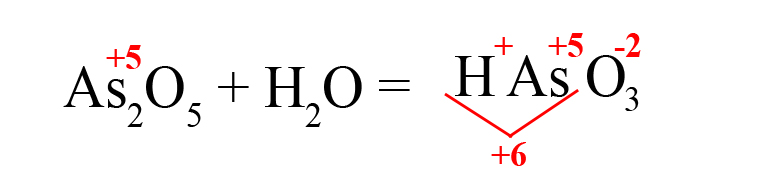
В результате реакции оксида мышьяка образовалась мышьяковая кислота.
Рассмотрим еще один пример – получения теллуристой кислоты.
- Пишем исходные оксиды, определяем степень окисления теллура:
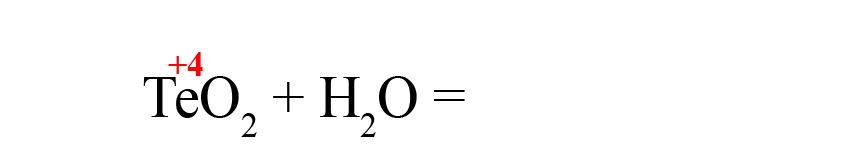
- Формируем основу кислоты в порядке: водород → теллур → кислород.
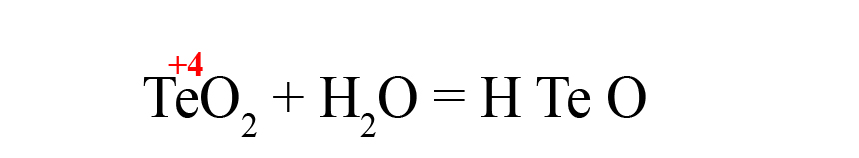
- Переносим степени окисления из левой части уравнения (у водорода и кислорода в кислотах и оксидах типичные для них степени окисления, поэтому они не указаны в первой части уравнения), считаем сумму положительных зарядов:
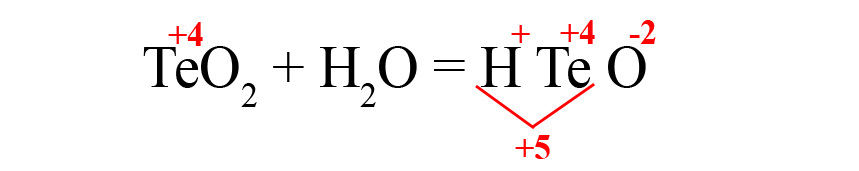
- В данном случае общий положительный заряд равен нечётному числу, чтобы молекула стала электронейтральной, после кислорода пришлось бы ставить индекс 2,5, что недопустимо. Поэтому сначала помножаем элемент, дающий нечётную степень окисления (у нас это водород) на 2, поставив индекс после него:
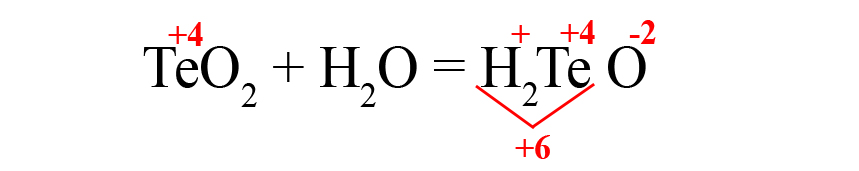
Это влияет на общий положительный заряд, который теперь становится чётным.
- Осталось умножить кислород на «3», чтобы общий отрицательный заряд стал равен шести:
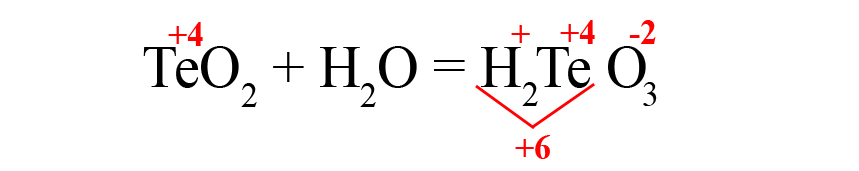
- Кислотный оксид + основный оксид = средняя соль.
Например: CaO + N2O5 = Ca(NO3)2
Как определить, какая соль образуется из кислотного оксида?
Способ первый. Соль состоит из катиона металла и кислотного остатка. Кислотный остаток соответствует оксиду с такой же степенью окисления, как в нём. Как определить степень окисления элемента в ионе? Прежде всего, необходимо помнить, что ион отличается от молекулы наличием заряда (молекулы элетронейтральны). Этот заряд складывается из положительных и отрицательных зарядов частиц, образующих ион:

Степень окисления кислорода в большинстве веществ равна ‒2, ион содержит три кислорода, они суммарно вносят в заряд этого иона ‒6, азот вносит х. Из этого получим уравнение: x ‒ 6 = ‒ 1 (где «‒1» – общий заряд иона), откуда х = 5.
Таким образом, нитрат-ион соответствует оксиду азота V, потому что в них одинаковая степень окисления азота.
В таблице приведены готовые группы соответствующих веществ и ионов:
Таблица «Взаимосвязь оксидов, кислот и их остатков»
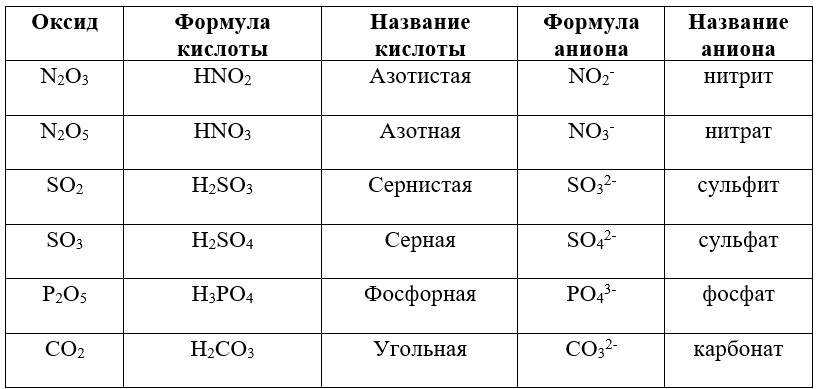
Не забывайте об индексах! После того как Вы подобрали нужный анион, нужно убедиться, что количество положительных и отрицательных зарядов в молекуле равны.
Рассмотрим, несколько примеров расстановки индексов в солях.
Пример 1. Взаимодействие оксида серы IV и оксида натрия:
- Подберем нужные ионы продуктах. Оксид серы IV соответствует сульфит-иону:
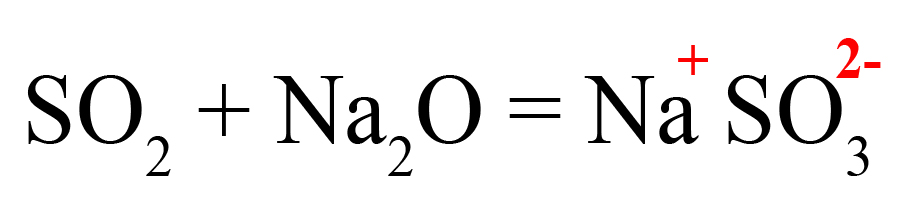
- Проверяем количество положительных и отрицательных ионов. В полученном веществе на один положительный заряд приходится два отрицательных. Количество положительных и отрицательных зарядов должно быть одинаковым, поэтому добавляем индекс «2» после натрия:
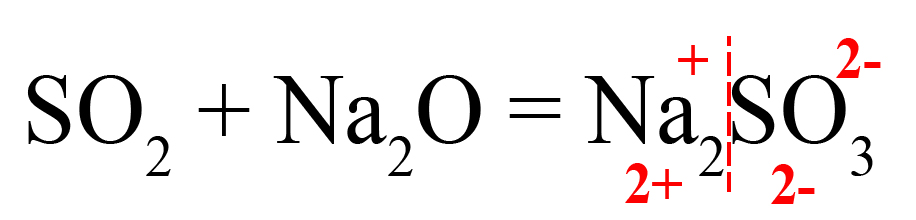
Индекс «2» говорит о том, что в сульфите натрия содержится два катиона натрия, каждый из которых несет заряд «+», таким образом, два натрия имеют общий заряд «2+».
Пример 2. Взаимодействие оксида серы VI с оксидом алюминия (с кислотными оксидами ведет себя как основный).
- Подбираем ионы в продуктах. Оксиду серы VI соответствует сульфат-ион:
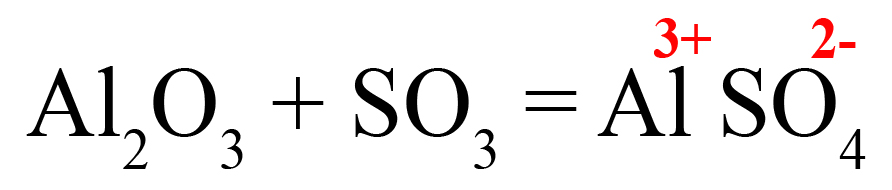
- В случаях, когда придется ставить коэффициенты после обоих ионов, находим наименьшее общее кратное:
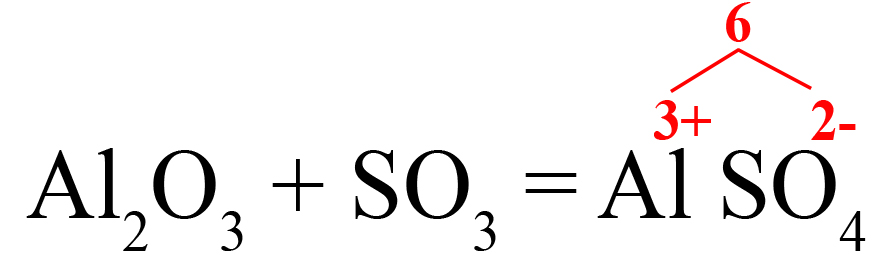
- Делим наименьшее общее кратное на 3 (заряд алюминия), получаем индекс «2» после алюминия. Делением общего кратного на 2 (заряд сульфат-иона), получаем индекс «3» после SO42-. Сульфат-ион заключаем в скобки, так как индекс после скобок действует на весь ион, без скобок он будет действовать только на тот элемент, после которого стоит.
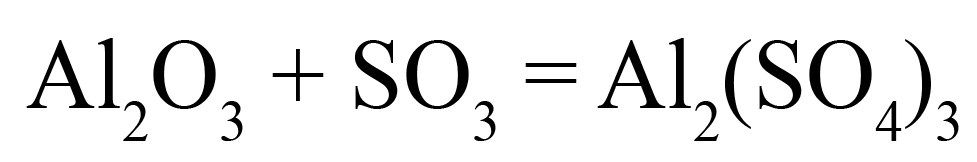
Способ второй.
Этот способ уже рассматривался выше, он основан на степенях окисления элементов в исходных оксидах.
Пример 1. Образование нитрита калия.
- В продукте образуется соль, на первом месте должен стоять металл, на втором – элемент из кислотного оксида, на третьем – кислород. Определим степени окисления элементов в исходных оксидах, перенесем эти степени в правую часть уравнения:
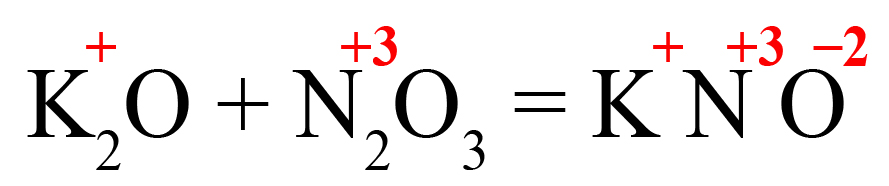
- Посчитаем общее количество положительных зарядов:
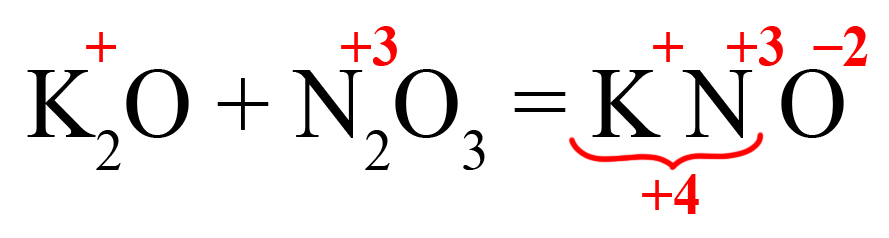
- Поделим это количество на степень окисления кислорода, получим индекс «2»:
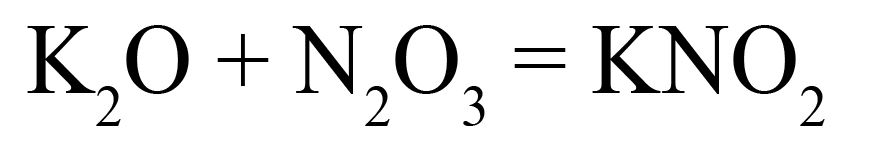
Пример 2. Образование нитрата бария.
- В правой части реакции образуем соль. На первое место ставим металл, на второе – элемент из кислотного оксида, на третье – кислород. Определяем степень окисления элементов в исходных веществах, переносим вправо:
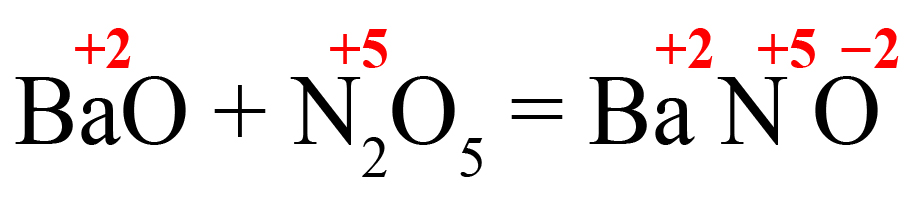
- Определяем количество положительных зарядов:
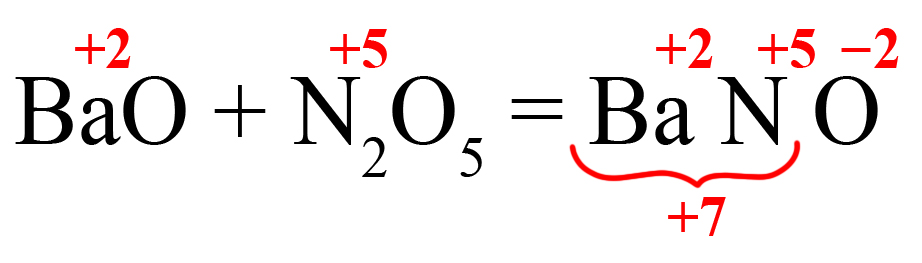
Получаем нечетное значение. Если оставить всё так, то индекс после кислорода должен стать равным 3,5. Чтобы избежать этого поставим удваивающий индекс после того элемента, который даёт нечетный заряд (азот):
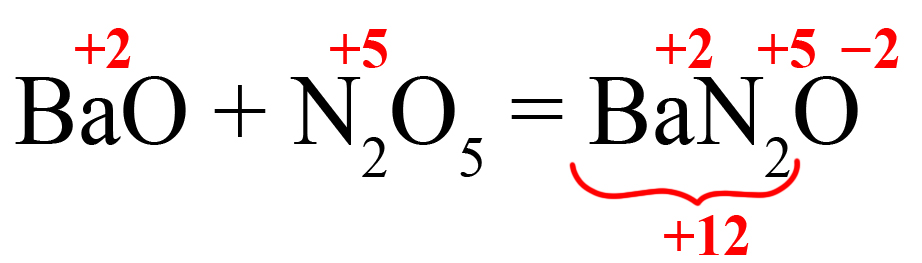
Теперь общее количество положительных зарядов равно двенадцати.
- Делим 12 на степень окисления кислорода, получаем индекс «6»:
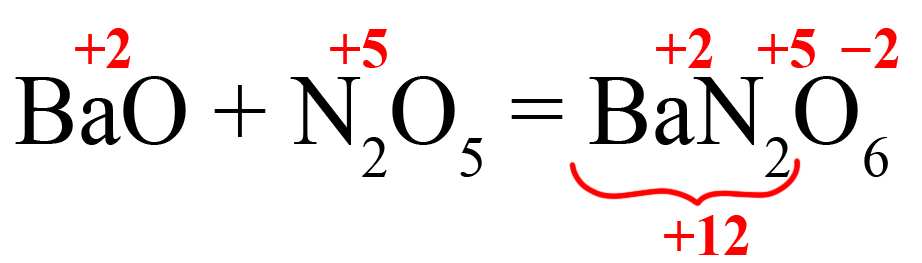
- Выносим индекс «2» за скобку, получаем формулу нитрата бария:
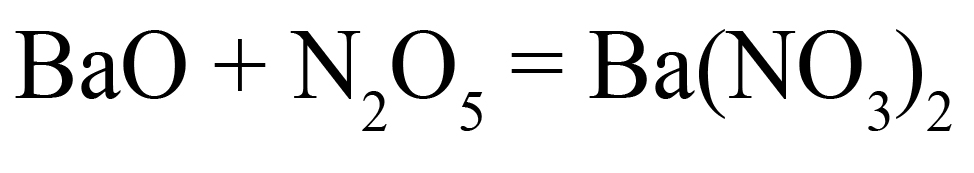
- Кислотный оксид + основание = соль + вода
Кислотный оксид + основание = кислая соль.
При образовании средней и кислой соли можно руководствоваться теми же способами, которые использовались в реакциях кислотных оксидов с основными.
От чего зависит, будет ли образованная соль кислой или средней? Рассмотрим два примера образования разных солей из одинаковых реагентов:
KOH + SO2 = KHSO3 (кислая соль, гидросульфит калия)
2KOH + SO2 = K2SO3 + H2O(средняя соль, сульфит калия)
Разница заключается лишь в количестве взятых реагентов. При образовании средней соли гидроксида калия в два раза больше оксида серы (об этом говорят коэффициенты перед веществами: «2» KOH и «1» перед SO2. Перед оксидом серы IV коэффициента нет, в таком случае подразумевается единица). При образовании кислой соли KOH взяли в два раза меньше относительно реакции, в которой образовалась средняя соль. В таких случаях говорят о том, что гидроксид калия был взят в недостатке или оксид серы – в избытке.
Рассмотрим другие пары реакций со схожим результатом:
Ca(OH)2 + CO2 = CaCO3 + H2O (образуется мутный раствор из-за образования нерастворимого карбоната кальция).
Ca(OH)2 + 2CO2 = Ca(HCO3)2 (образуется прозрачный раствор, так как гидрокарбонат растворим).
При образовании кислой соли был взят избыток углекислого газа (или недостаток гидроксида кальция).
Оксиды, соответствующие трехосновным кислотам (см.Классификация кислот)
, могут образовывать не одну кислую соль, а несколько:
6NaOH + P2O5 = 2Na3PO4 + 3H2O (образуется фосфат натрия, средняя соль).
4NaOH + P2O5 = 2Na2HPO4 + H2O (образуется гидрофосфат натрия, кислая соль).
2NaOH + P2O5 + H2O = 2NaH2PO4 (образуется дигидрофосфат натрия, кислая соль)
Из этих трех реакций можно сделать вывод: чем меньше взято щелочи, тем кислее будет соль.
Если оксид соответствует одноосновной кислоте, то при его реакции с основаниями будут образовываться только средние соли:
2KOH + Cl2O = 2KClO + H2O (Cl2O соответствует кислоте HClO)
NaOH + Mn2O7 = NaMnO4 + H2O (Mn2O7 соответствует кислоте HMnO4)
- Соль + кислотный оксид = кислая соль.
Оксид должен соответствовать двухосновной или многоосновной кислоте, оксид должен совпадать с кислотным остатком, уже имеющимся в соли, реакция идет в растворах или при наличии воды в окружающей среде.
Примеры:
CaCO3 + CO2 + H2O = Ca(HCO3)2 (мутный раствор становится прозрачным).
Na2SO3 + SO2 + H2O = 2NaHSO3
Одни кислотные оксиды могут вытеснять другие кислотные оксиды из солей:
Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3
Nакая реакция происходит, когда засыхает силикатный клей. В тюбике с клеем содержится раствор силиката натрия, при выдыхании человек выделяет углекислый газ, который взаимодействует с силикатом натрия с образованием кремниевой кислоты, которая при высыхании полимеризуется, склеивая бумагу.
Na2CO3 + SiO2 = Na2SiO3 + CO2 (такая реакция происходит при нагревании).
Оксиды, соответствующие более сильным кислотам, вытесняют из соединений оксиды, соответствующие менее сильным кислотам:
Na2CO3 + SO3 = Na2SO4 + CO2
Оксид серы VI (SO3) соответствует сильной серной кислоте, а углекислый газ (CO2) – слабой угольной кислоте, поэтому оксид серы вытесняет оксид углерода.
- Оксид фосфора отнимает у кислородсодержащих кислот воду, при этом образуется фосфорная кислота и оксид, соответствующий исходной кислоте (основной элемент оксида имеет такую же степень окисления, как в исходной кислоте):
2HNO3 + P2O5 = 2HPO3 + N2O5
HClO4 + P2O5 = HPO3 + Cl2O7
Кислоты бывают:
-
бескислородные: хлороводородная (соляная) HCl, сероводородная H2S
-
кислородосодержащие: азотная HNO3, серная H2SO4 и т.д.
• По числу атомов водорода: одноосновные (HNO3), двухосновные (H2SO4) трехосновные (H3PO4).
• По растворимости: растворимые, нерстворимые (см. таблицу растворимости)
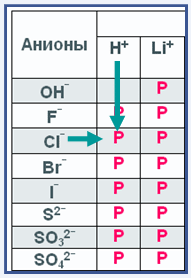
На рисунке слева представлена небольшая часть уже знакомой тебе таблицы растворимости. Под общим названием анионы расположены различные отрицательно заряженные ионы, кроме гидроксид иона ОН– все остальные – это ионы кислотных остатков.
При пересечении, например столбца иона водорода Н+ с ионом хлора Cl– мы видим ячейку в которой находится буква Р (растворяется). Это значит, что соляная кислота HCl растворяется в воде. Так определяют растворимость кислот.
![]() Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
Запомни: Оксид, которому соответствует кислота называется кислотный оксид: S > SO3 > H2SO4 . Кслотный оксид SO3, ему соотвествует серная кислота.
![]()
Вопрос: Как составить формулу оксида соответствующего данной кислоте?
Пример: Для серной кислоты составим соответствующий оксид. Для этого:
1. Определим степень окисления элементов в кислоте.
H2SO4 – формула серной кислоты
Степени окисления водорода и кислорода нам известны: водорода +1, кислорода -2. Неизвестна только степень окисления у серы. Обозначим её х. Подставим все степени окисления в формулу серной кислоты.
H2+1SхO4-2 т.к. для химического соединения в сумме все степени окисления равны 0, можно составить уравнение:
+1 • 2 + х + (-2) • 4 = 0
решим его:
2 + х – 8 = 0
Х = +6
все степени окисления известны: H2+1S+6O4-2
2. Степень окисления серы в серной кислоте +6. Составим оксид соответствующий серной кислоте: S+6O3-2 или SO3.
Таблица кислот и оксидов
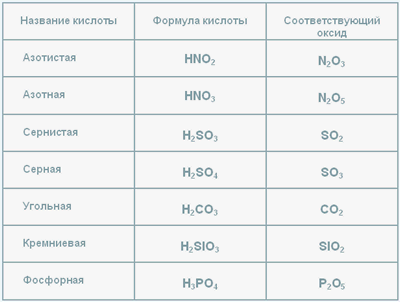
Табл.1
В таблице представленны формулы кислот, их названия и оксиды, соответствующие данной кислоте.
* * *
.
Кислотные оксиды


4.5
Средняя оценка: 4.5
Всего получено оценок: 1553.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1553.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
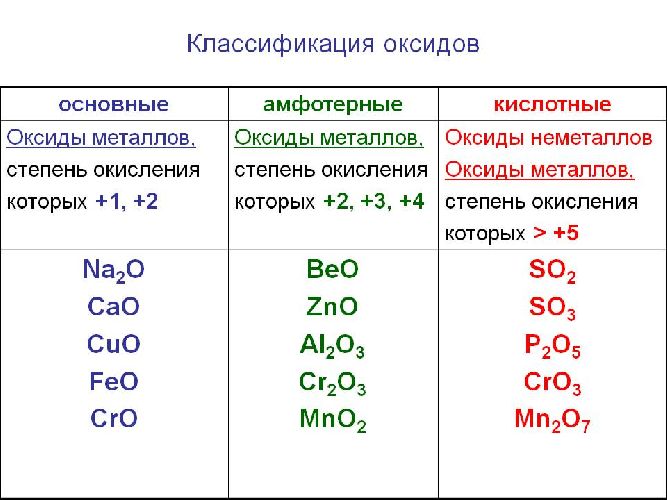
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
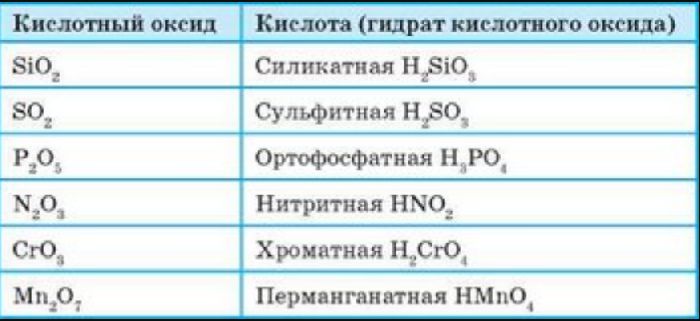
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |


Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Владимир Мартынов
7/10
-

Polina Malchikova
9/10
-

Дима Кулагин
10/10
-

Сергей Ефремов
9/10
-

Артём Макушенко
10/10
-

Наталия Григорьева
10/10
-

Данила Волков
9/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1553.
А какая ваша оценка?
Методические
рекомендации для учащихся первого курса
по теме: «Основные классы неорганических
соединений»
1. ОКСИДЫ
– сложные вещества, состоящие из двух
элементов, одним из которых является
кислород в степени окисления -2.
Элементом
может быть как металл, так и неметалл.
2. КИСЛОТЫ
– сложные вещества, состоящие из атомов
водорода, способных
замещаться атомами металла,
и кислотных остатков. Водород в формулах
кислот всегда пишется на первом месте.
Кислоты – это
гидроксиды неметаллов.
3. ОСНОВАНИЯ
– сложные вещества, состоящие из атомов
металла и одной или нескольких
гидроксогрупп ОН.
Основания – это
гидроксиды металлов.
4. СОЛИ
– сложные вещества, состоящие из атомов
металла и кислотных остатков.
II Классификация оксидов
Все оксиды делят
на две группы: солеобразующие
и несолеобразующие.
Несолеобразующие
– это оксиды, которые не образуют солей
ни с кислотами, ни
с основаниями. К
ним относятся оксиды: CO,
NO,
N2O,
SiO.
Все эти оксиды –
оксиды неметаллов.
Солеобразующие
оксиды –
это оксиды, которые образуют соли
либо с кислота-
ми,
либо с основаниями.
Солеобразующие
оксиды делят
на три группы: кислотные,
основные и амфо-
терные.
КИСЛОТНЫЕ
ОКСИДЫ – это
оксиды, которым соответствуют кислоты.
К
ним относятся все
оксиды неметаллов
(за исключением несолеобразующих) и
оксиды металлов
с валентностью 4 и больше.
Например:
SO3
– H2SO4
SO2
– H2SO3
CO2
– H2CO3
SiO2
– H2SiO3
P2O5
– H3PO4
и
HPO3
N2O5
– HNO3
CrO3
– H2CrO4
SeO2
– H2SeO3
(Оксиды S,
C,
Si,
P,
N
– это оксиды неметаллов, а оксиды Cr
(VI)
и Se
(IV)
– это
оксиды металлов.
Однако и те и другие – это кислотные
оксиды).
Таким образом,
надо иметь в виду, что оксиды неметаллов
– это всегда кислотные
оксиды, а оксиды
металлов могут быть как основными, так
и кислотными.
ОБРАТИТЕ ВНИМАНИЕ!
Валентность (и степень окисления)
элемента в оксиде
и кислоте должны
быть ОДИНАКОВЫМИ.
Формулу кислоты
легко записать по формуле оксида Для
этого надо мысленно
(или на черновике)
прибавить
воду Н2О
к оксиду и
(если в этом есть необходи-
мость) сократить.
Например:
формула оксида N2O3.
Прибавляем к N2O3
воду Н2О.Получаем
–
Н2
N2O4;
сокращаем на 2 – получаем Н
NO2.
Второй пример:
формула оксида V2O5.
Прибавляем к V2O5
воду Н2О.
Получаем – Н2
V2O6;
сокращаем на 2 – получаем Н
VO3.
Третий пример:
формула оксида Cl2O7.
Прибавляем к Cl2O7
воду Н2О.
Получаем – Н2
Cl2O8;
сокращаем на 2 – получаем Н
ClO4.
Четвертый пример:
формула оксида МоO3.
Прибавляем к МоO3
воду Н2О.
Получаем – Н2
МоO4;
естественно, сокращать в этом случае
просто нечего.
ОСНОВНЫЕ
ОКСИДЫ – это
оксиды, которым соответствуют основания.
К
ним относятся
только оксиды
металлов
(за исключением тех, которые относятся
к кислотным, то-есть
с валентностью металла 4 и больше.
НАПРИМЕР: К2О
– КОН Na2O
– NaOH
BaO
– Ba(OH)2
FeO –
Fe(OH)2
Fe2O3
– Fe(OH)3
CrO – Cr(OH)2
Ag2O
– AgOH
ПОМНИТЕ!
Валентность гидроксогруппы
ОН равна 1.
Валентность металла
может быть не
только постоянной, но и переменной.
АМФОТЕРНЫЕ
ОКСИДЫ – это
оксиды, которые проявляют свойства как
основных, так и
кислотных оксидов. К ним относятся
только
некоторые оксиды
металлов –
Al2O3,
ZnO,
BeO,
Cr2O3
(эти оксиды надо запомнить) и ряд других.
Если амфотерный
оксид реагирует с кислотой, то он
реагирует как обычный
основный оксид.
Если же амфотерный оксид реагирует со
щелочью, то в этом
случае он реагирует
как кислотный оксид и ему соответствует
кислота, формулу
которой находим
так же, как и с любым кислотным оксидом,
то-есть прибавляя
Н2О.
НАПРИМЕР:
Al2O3
– Н2Al2O4;
сокращаем на 2, получаем НАlО2.
Если же Al2O3
реагирует с
кислотой, то, естественно, ему соответствует
гидроксид Аl(ОН)3.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
