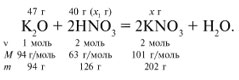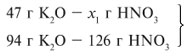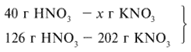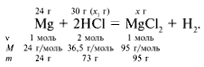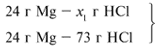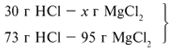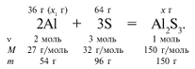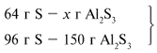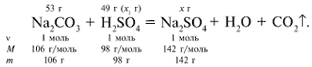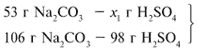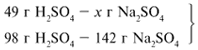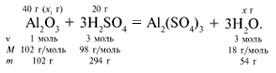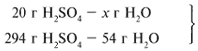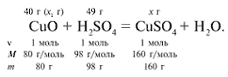“Я не сдам ЕГЭ, потому что у меня нет таланта! У Кати талант есть, у Паши – тоже есть, а у меня нет!” Сколько раз каждый из вас так думал? Много? Ха-Ха и еще раз Ха-Ха! Марк Твен говорил: «Существует тысяча причин для того, чтобы себя оправдать, но ни одной реальной». Секрет таланта и успеха на ЕГЭ я раскрою в конце статьи, а пока продолжаем изучать Стехиометрию. Сегодня разберемся с деликатной темой: избыток-недостаток в расчетах по уравнениям реакций.
В ряде задач представлены данные для обоих реагентов. Как в таких случаях выполнять расчеты по уравнения реакций? Что брать в качестве точки расчета? Давайте разбираться. Вначале определимся с понятиями.
Эквимолярное соотношение – равные количества веществ
Стехиометрическое соотношение – количества веществ в соответствии с коэффициентами в уравнении реакции
Для того, чтобы понять, в каких соотношениях представлены количества веществ-реагентов в конкретной задаче, необходимо начать анализ задачи по уже известным Четырем Заповедям. После выполнения Предварительных Расчетов (Третья Заповедь), следует выписать количества веществ над формулами реагентов в уравнении реакции и произвести пересчет количества одного вещества через количество другого. После определения избытка-недостатка дальнейшие расчеты в задаче производим по недостатку.
ПОМНИ!!!
Расчеты по уравнению реакции производятся по НЕДОСТАТКУ!
Как определить избыток-недостаток и провести дальнейшие расчеты, лучше разобрать на конкретной задаче. Читайте внимательно и попробуйте записать решение задачи на отдельном листе бумаги.
Задача 1
На 47 г оксида калия подействовали раствором, содержащим 40 г азотной кислоты. Найдите массу образовавшегося нитрата калия.
1) Первая Заповедь. Выписать данные задачи в разделе “Дано”.
2) Вторая Заповедь. Написать уравнение реакции.
Немного теории химии. Оксиды щелочных металлов проявляют ярко выраженные основные свойства. Они легко реагируют с кислотами с образованием солей.
3. Третья Заповедь. Сделать предварительные расчеты по данным условия задачи
В условии задачи представлены данные по обоим реагентам – оксиду калия и азотной кислоте, поэтому определяем количество вещества каждого участника процесса.
На этой стадии необходимо определить, кто из реагентов в избытке, а кто в недостатке. Для этого следует провести пересчет количества одного вещества через количество другого. Покажу два способа пересчета и анализа. Можете пользоваться любым, какой понятней.
1) Считаем количество вещества азотной кислоты по количеству вещества оксида калия (обычный расчет по уравнению реакции). Читайте внимательно! Я мысленно произношу: “Пусть весь оксид калия вступил в реакцию. Сколько тогда прореагирует азотной кислоты?” И делаю расчет по уравнению реакции. Азотной кислоты, по расчетам, требуется больше, чем дано, значит, азотная кислота – в недостатке.
2) Считаем количество вещества оксида калия по количеству вещества азотной кислоты (обычный расчет по уравнению реакции). Я мысленно произношу: “Пусть вся азотная кислота вступила в реакцию. Сколько тогда прореагирует оксида калия?” Оксида калия, по расчетам, требуется меньше, чем дано, значит, оксид калия в избытке.
4. Четвертая заповедь. Составить алгоритм решения задачи.
Формулизируем вопрос задачи “Найдите массу образовавшегося нитрата калия”, т.е. записываем формулу расчета массы, которая для нас, как для химиков, должна быть представлена произведением количества вещества на молярную массу. Анализируем компоненты формулы: молярную массу нитрата калия определяем по таблице Менделеева, количество вещества нитрата калия рассчитываем по уравнению реакции исключительно по недостатку!
Задача 2
Смешали 7,3 г хлороводорода и 4 г аммиака. Какая масса соли при этом образуется?
Немного теории. При смешивании хлороводорода и аммиака образуется густой белый дым (“дым без огня”) – кристаллики соли хлорида аммония.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты.
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
Задача 3
На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося сульфида алюминия.
При поджигании смеси порошкообразных алюминия и серы между ними начинается интенсивная экзотермическая реакция с образованием сульфида алюминия, который полностью гидролизуется водой, поэтому не может быть получен обменными реакциями в водных растворах.
Последовательность действия, выполняемых при решении задачи:
1) Выписать данные в разделе “Дано”
2) Написать уравнение реакции
3) Сделать предварительные расчеты.
4) Определить избыток-недостаток
5) Сделать расчет по уравнению реакции (по недостатку!)
6) Составить алгоритм решения
7) Сделать окончательный расчет
Секрет таланта и успеха на ЕГЭ
Талант не дается от природы, он создается самим человеком. Это определенные способности, которые раскрываются с приобретением навыков и опыта. Успех на ЕГЭ зависит от ежедневного упорного труда и достижения мастерства в выбранном деле. Думаю, вывод не трудно сделать. Хотите добиться успеха – принимайтесь за работу!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение решать химические задачи –
важная составляющая знаний по предмету. Согласно
государственному стандарту образования по химии
учащиеся, оканчивающие школу, должны уметь
решать более десятка типов стандартных задач.
Среди них и задачи на «избыток–недостаток».
Предлагаю свой вариант подачи материала по
решению таких задач в курсе химии 9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в
зависимости от уровня способностей учеников
класса. Ознакомление с алгоритмом решения задач
данного типа происходит в рамках изучения темы
«Теория электролитической диссоциации». Однако
если класс сильный, то в рамках эксперимента этот
тип задач иногда изучаем и в конце 8-го класса в
главе «Галогены», а высвободившееся время можно
потратить на изучение органической химии в курсе
9-го класса.
На первом уроке разбираю два типа задач на
«избыток–недостаток»:
одно из двух
вступивших в реакцию веществ дано в избытке;
оба вступивших в
реакцию вещества расходуются на взаимодействие
друг с другом без остатка, т. е. даны в
стехиометрических количествах.
В качестве домашнего задания обязательно
предлагаются две-три задачи, подобные изученным
на уроке.
На втором уроке закрепляю и углубляю изученный
материал, ввожу понятия «процентная
концентрация растворов веществ», вступивших в
реакцию, «плотность растворов». Кроме того,
усложняю задачи, вводя «процентное содержание
примесей в исходном веществе» и т. д. Такой прием
позволяет повторить элементы уже изученного
материала, сэкономить время. В конце второго
урока изучения темы или в начале третьего
провожу небольшую самостоятельную работу на
закрепление изученного материала, включающую
одну-две задачи, причем самостоятельная работа
предлагается в трех уровнях сложности, в
зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
Цели.
- научить алгоритму решения
задач нового типа; - закрепить навыки устного
счета; - повторить правила расчета
относительных молекулярных масс веществ; - закрепить правила грамотного
оформления условия задачи; - формировать навыки
химического мышления, логики, а также
способствовать воспитанию гармоничной,
всесторонне развитой личности.
ХОД УРОКА
Рассмотрим вариант,
когда одно из вступивших в реакцию веществ дано в
избытке, другое – в недостатке.
Решая химические задачи, следует не забывать о
правилах их грамотного оформления по схеме: дано,
найти, решение, ответ.
ЗАДАЧА 1. На 47 г оксида калия
подействовали раствором, содержащим 40 г азотной
кислоты. Найдите массу образовавшегося нитрата
калия.
Дано:
m(K2O) = 47 г,
m(HNO3) = 40 г.Найти:
m(КNO3).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(K2O) = 2Ar(K) + 1Ar(O)
= 2•39 + 1•16 = 94,
Mr(HNO3) = 1Ar(H) + 1Ar(N)
+ 3Ar(O) = 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) = 1Ar(K) + 1Ar(N)
+ 3Ar(O) = 1•39 + 1•14 + 3•16 = 101.
Для удобства расчета за х1 примем
массу НNО3 и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в
недостатке.
47/94 = х1/126, х1 = 63 г.
Следовательно, азотная кислота дана в
недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126 = х/202, х = 64 г.
Ответ. m(КNO3) = 64 г.
ЗАДАЧА 2. На 24 г металлического магния
подействовали 100 г 30%-го раствора соляной кислоты.
Найдите массу образовавшегося хлорида магния.
Дано:
m(Mg) = 24 г,
m(р-р HCl) = 100 г,
(HCl) = 30%.
Найти:
m(MgCl2).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(HCl) = 1Ar(H) + 1Ar(Cl)
= 1 + 35,5 = 36,5,
Mr(MgCl2) = 1Ar(Mg) +
2Ar(Cl) = 24 + 2•35,5 = 95.
Для удобства расчета за х1 примем
массу соляной кислоты и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в
недостатке.
24/24 = х1/73, х1 = 73 г.
Из расчета видно, что соляная кислота дана в
недостатке, т. к. по условию задачи ее дано 30 г, а
для реакции требуется 73 г. Следовательно, расчет
ведем по соляной кислоте:
30/73 = х/95, х = 39 г.
Ответ. m(MgCl2) = 39 г.
Рассмотрим вариант,
когда оба вступивших в реакцию вещества даны в
стехиометрических количествах, т. е. реагируют
друг с другом без остатка.
ЗАДАЧА 1. На 36 г алюминия подействовали
64 г серы. Найдите массу образовавшегося сульфида
алюминия.
Дано:
m(Al) = 36 г,
m(S) = 64 г.Найти:
m(Al2S3).
Решение
Примем массу Al за х1 и найдем, какое
из веществ, вступивших в реакцию, дано в избытке,
какое – в недостатке.
х1/54 = 64/96, х1 = 36 г.
В данном случае вещества, вступившие в реакцию,
взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
64/96 = х/150, х = 100 г.
Ответ. m(Al2S3) = 100 г.
ЗАДАЧА 2. На раствор, содержащий 53 г
карбоната натрия, подействовали раствором,
содержащим 49 г серной кислоты. Найдите массу
образовавшейся соли.
Дано:
m(Na2CO3) = 53 г,
m(H2SO4) = 49 г.Найти:
m(Na2SO4).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(Na2CO3) = 2Ar(Na)
+ 1Ar(C) + 3Ar(O) = 2•23 + 1•12 + 3•16 =
106.
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98.
Mr(Na2SO4) = 2Ar(Na)
+ 1Ar(S) + 4Ar(O) = 2•23 + 1•32 + 4•16 =
142.
Примем за х1 массу cерной кислоты,
чтобы узнать, какое вещество дано в избытке,
какое – в недостатке.
53/106 = х1/98, х1 = 49 г.
В данном случае оба вещества взяты в
стехиометрических количествах, поэтому расчет
можно вести по любому из них:
49/98 = х/142, х = 71 г.
Ответ. m(Na2SO4) = 71 г.
Однако учитель, подбирая задачи для решения в
классе, должен помнить, что в некоторых случаях
(например, если кислота или кислотный оксид дан в
избытке) решение задачи не ограничивается
расчетом двух пропорций, т. к. реакция будет
протекать дальше с образованием кислой соли. Это
повысит сложность материала. На первых уроках
при решении задач данного типа я не включаю в
материал задачи на прохождение реакций с
образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА 1. На 200 г 10%-го раствора серной
кислоты подействовали 40 г оксида алюминия.
Найдите массу образовавшейся воды.
Дано:
M(р-р H2SO4) = 200 г,
(H2SO4) =
10%,
m(Al2O3) = 40 г.Найти:
m(Н2O).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(Al2O3) = 2Ar(Al)
+ 3Ar(O) = 2•27 + 3•16 = 102,
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98,
Mr(H2O) = 2Ar(H) + 1Ar(O)
= 2•1 + 1•16 = 18.
m(H2SO4) = 200•10/100 = 20 г.
Найдем, какое из вступивших в реакцию веществ
дано в избытке, а какое – в недостатке.
х1/102 = 20/294, х1 = 6,94 г.
Из расчета видно, что Al2O3 дан в
избытке, следовательно, расчет ведем по кислоте:
20/294 = х/54, х = 3,67 г.
Ответ. m(Н2O) = 3,67 г.
ЗАДАЧА 2. На 40 г оксида меди(II)
подействовали раствором серной кислоты,
содержащим 49 г безводного вещества. Найдите
массу образовавшейся соли.
Дано:
m(CuO) = 40 г,
m(H2SO4) = 49 г.Найти:
M(СuSO4).
Решение
Найдем, какое из веществ, вступивших в реакцию,
дано в избытке, а какое – в недостатке.
х1/80 = 49/98, х1 = 40 г.
Cогласно уравнению данной реакции вещества
взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
40/80 = х/160, х = 80 г.
Ответ. m(CuSO4) = 80 г.
В.А.ДЕМИДОВ,
учитель химии Синегорской
средней школы
(Нагорский р-н,
Кировская обл.)
Задачи на избыток и недостаток
22-Фев-2014 | комментариев 16 | Лолита Окольнова
Задачи такого типа (точнее, это может быть даже не самой задачей, а частью задачи) есть в части С ГИА, они входят в часть С ЕГЭ, теперь они появились и в части B.
Задачи на избыток и недостаток
Классический пример задачи на избыток и недостаток.
Этапы решения задачи:
1. Записываем уравнение реакции и уравниваем его:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(Cu) = mAr =3.2 г 63.5 гмоль = 0,05 моль
m(Hg(NO3)2) = mMr = 20 324 = 0,06 моль
3. Сравниваем количество моль веществ и определяем недостаток:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
0,05 моль 0,06 моль
по уравнению реакции меди и нитрат ртути реагируют 1:1, значит, их количество моль тоже должно быть одинаковым
0,05 моль < 0,06 моль — медь в недостатке
Задачи на избыток и недостаток всегда решаются ПО НЕДОСТАТКУ
Почему по недостатку? Это аналогично вопросу — «сколько целых яблок можно сложить из 5 половинок? «
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
Cu + Hg(NO3)2 → Hg + Cu(NO3)2
0,05 моль ——> 0,05 моль
m(Hg)= n*Ar = 0,05 моль * 200 гмоль = 10 г
______________________________________________________________________________________
Пример задачи на избыток и недостаток,
где вещества в другом соотношении:
те же самые этапы решения:
1. Записываем уравнение реакции и уравниваем его:
2N2 + 5O2 = 2N2O5
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(N2 ) = mMr = 1428=0.5 моль
n(O2) = mMr =1632=0.5 моль
3. Сравниваем количество моль веществ и определяем недостаток:
2N2 + 5O2 = 2N2O5
0.5 моль 0.5 моль
в этом уравнении все не так очевидно, как в предыдущем, поэтому нужно просто прикинуть:
- если считать по азоту (0.5 моль), то по соотношению коэффициентов (2:5) кислорода должно быть в 2.5 раза больше, т.е. (0.5*2.5) 1,25 моль, а у нас только 0.5, значит, O2 в недостатке;
- если бы количество моль азота оказалось бы меньше, значит, считали бы по азоту
4. Вычисляем массу продукта по количеству моль, соответствующему недостатку:
m(N2O5) = n*Mr = 2* 0.55 моль * 108 гмоль = 21 г
______________________________________________________________________________________
Есть задачи, очень похожие на задачи избыток-недостаток,
но это задачи на кислые и основные соли:
1. Записываем уравнение реакции и уравниваем его:
здесь у нас возможно 2 варианта — образование средней и кислой соли:
CO2 + 2NaOH → Na2CO3 + H2O
CO2 + NaOH → NaHCO3
2. Находим количество моль тех веществ, массы которых нам даны в условии:
n(CO2 ) = V22.4 лмоль = 24.9 22.4 = 1,11 моль
n(NaOH)= mMr = 44.440 = 1,11 моль
т.к. количество моль веществ одинаково, то делаем вывод, что реакция протекает по схеме образования кислой соли:
CO2 + NaOH → NaHCO3
4. Вычисляем массу продукта по количеству моль:
m ( NaHCO3) = n*Mr = 1,11 * 84 = 93,24 г
______________________________________________________________________________________
Задачи на избыток и недостаток не трудные, зачастую они являются частью более сложных задач, поэтому все, что нужно сделать, это натренироваться — порешать как можно больше таких примеров, внимательно уравнивая и работая с коэффициентами.
Обсуждение: “Задачи на избыток и недостаток”
(Правила комментирования)
Методика решения задач
на «избыток–недостаток»
в курсе основной
общеобразовательной школы
Умение
решать химические задачи – важная составляющая знаний по предмету. Согласно
государственному стандарту образования по химии учащиеся, оканчивающие школу,
должны уметь решать более десятка типов стандартных задач. Среди них и задачи
на «избыток–недостаток».
Предлагаю свой вариант подачи материала по решению таких задач в курсе химии
9-го класса.
На изучение этой темы отвожу 2–2,5 урока, в зависимости от уровня способностей
учеников класса. Ознакомление с алгоритмом решения задач данного типа
происходит в рамках изучения темы «Теория электролитической диссоциации».
Однако если класс сильный, то в рамках эксперимента этот тип задач иногда
изучаем и в конце 8-го класса в главе «Галогены», а высвободившееся время можно
потратить на изучение органической химии в курсе 9-го класса.
На первом уроке разбираю два типа задач на «избыток–недостаток»:
одно
из двух вступивших в реакцию веществ дано в избытке;
оба
вступивших в реакцию вещества расходуются на взаимодействие друг с другом без
остатка, т. е. даны в стехиометрических количествах.
В качестве домашнего задания обязательно предлагаются две-три задачи, подобные
изученным на уроке.
На втором уроке закрепляю и углубляю изученный материал, ввожу понятия
«процентная концентрация растворов веществ», вступивших в реакцию, «плотность
растворов». Кроме того, усложняю задачи, вводя «процентное содержание примесей
в исходном веществе» и т. д. Такой прием позволяет повторить элементы уже
изученного материала, сэкономить время. В конце второго урока изучения темы или
в начале третьего провожу небольшую самостоятельную работу на закрепление
изученного материала, включающую одну-две задачи, причем самостоятельная работа
предлагается в трех уровнях сложности, в зависимости от способностей ученика.
Урок 1
Решение задач на «избыток–недостаток»
Цели.
- научить
алгоритму решения задач нового типа; - закрепить
навыки устного счета; - повторить
правила расчета относительных молекулярных масс веществ; - закрепить
правила грамотного оформления условия задачи; - формировать
навыки химического мышления, логики, а также способствовать воспитанию
гармоничной, всесторонне развитой личности.
ХОД УРОКА
Рассмотрим
вариант, когда одно из вступивших в реакцию веществ дано в избытке, другое – в
недостатке.
Решая химические задачи, следует не забывать о правилах их грамотного
оформления по схеме: дано, найти, решение, ответ.
ЗАДАЧА
1. На 47 г оксида калия подействовали раствором, содержащим 40
г азотной кислоты. Найдите массу образовавшегося нитрата калия.
Дано:
m(K2O)
= 47 г,
m(HNO3) = 40 г.
Найти:
m(КNO3).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(K2O) = 2Ar(K)
+ 1Ar(O) = 2•39 + 1•16 = 94,
Mr(HNO3) = 1Ar(H)
+ 1Ar(N) + 3Ar(O) = 1•1 + 1•14 + 3•16 = 63,
Mr(KNO3) = 1Ar(K)
+ 1Ar(N) + 3Ar(O) = 1•39 + 1•14 + 3•16 =
101.
Для
удобства расчета за х1 примем массу НNО3 и
найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в
недостатке.
47/94 = х1/126, х1 =
63 г.
Следовательно,
азотная кислота дана в недостатке, т. к. по условию ее 40 г, а по расчету
необходимо 63 г, поэтому расчет ведем по HNO3:
40/126 = х/202, х = 64 г.
Ответ. m(КNO3)
= 64 г.
ЗАДАЧА
2. На 24 г металлического магния подействовали 100 г 30%-го
раствора соляной кислоты. Найдите массу образовавшегося хлорида магния.
Дано:
m(Mg)
= 24 г,
m(р-р HCl) = 100 г,
(HCl) = 30%.
Найти:
m(MgCl2).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(HCl) = 1Ar(H) + 1Ar(Cl)
= 1 + 35,5 = 36,5,
Mr(MgCl2) = 1Ar(Mg)
+ 2Ar(Cl) = 24 + 2•35,5 = 95.
Для
удобства расчета за х1 примем массу соляной кислоты
и найдем, какое из веществ, вступивших в реакцию, дано в избытке, какое – в
недостатке.
24/24 = х1/73, х1 =
73 г.
Из
расчета видно, что соляная кислота дана в недостатке, т. к. по условию задачи
ее дано 30 г, а для реакции требуется 73 г. Следовательно, расчет ведем по
соляной кислоте:
30/73 = х/95, х = 39 г.
Ответ. m(MgCl2)
= 39 г.
Рассмотрим
вариант, когда оба вступивших в реакцию вещества даны в стехиометрических
количествах, т. е. реагируют друг с другом без остатка.
ЗАДАЧА
1. На 36 г алюминия подействовали 64 г серы. Найдите массу образовавшегося
сульфида алюминия.
Дано:
m(Al)
= 36 г,
m(S) = 64 г.
Найти:
m(Al2S3).
Решение
Примем
массу Al за х1 и найдем, какое из веществ,
вступивших в реакцию, дано в избытке, какое – в недостатке.
х1/54 = 64/96, х1 =
36 г.
В
данном случае вещества, вступившие в реакцию, взяты в стехиометрических
количествах, поэтому расчет можно вести по любому из них:
64/96 = х/150, х = 100 г.
Ответ. m(Al2S3)
= 100 г.
ЗАДАЧА
2. На раствор, содержащий 53 г карбоната натрия, подействовали
раствором, содержащим 49 г серной кислоты. Найдите массу образовавшейся соли.
Дано:
m(Na2CO3)
= 53 г,
m(H2SO4) = 49 г.
Найти:
m(Na2SO4).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(Na2CO3) = 2Ar(Na)
+ 1Ar(C) + 3Ar(O) = 2•23 + 1•12 + 3•16 =
106.
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98.
Mr(Na2SO4) = 2Ar(Na)
+ 1Ar(S) + 4Ar(O) = 2•23 + 1•32 + 4•16 =
142.
Примем
за х1 массу cерной кислоты, чтобы узнать, какое
вещество дано в избытке, какое – в недостатке.
53/106 = х1/98, х1 =
49 г.
В
данном случае оба вещества взяты в стехиометрических количествах, поэтому
расчет можно вести по любому из них:
49/98 = х/142, х = 71 г.
Ответ. m(Na2SO4)
= 71 г.
Однако
учитель, подбирая задачи для решения в классе, должен помнить, что в некоторых
случаях (например, если кислота или кислотный оксид дан в избытке) решение
задачи не ограничивается расчетом двух пропорций, т. к. реакция будет протекать
дальше с образованием кислой соли. Это повысит сложность материала. На первых
уроках при решении задач данного типа я не включаю в материал задачи на
прохождение реакций с образованием кислых или основных солей.
Домашнее задание
ЗАДАЧА
1. На 200 г 10%-го раствора серной кислоты подействовали 40 г
оксида алюминия. Найдите массу образовавшейся воды.
Дано:
M(р–р H2SO4)
= 200 г,
(H2SO4)
= 10%,
m(Al2O3) = 40 г.
Найти:
m(Н2O).
Решение
Рассчитаем
относительные молекулярные массы интересующих нас веществ:
Mr(Al2O3) = 2Ar(Al)
+ 3Ar(O) = 2•27 + 3•16 = 102,
Mr(H2SO4) = 2Ar(H)
+ 1Ar(S) + 4Ar(O) = 2•1 + 1•32 + 4•16 = 98,
Mr(H2O) = 2Ar(H)
+ 1Ar(O) = 2•1 + 1•16 = 18.
m(H2SO4) = 200•10/100
= 20 г.
Найдем,
какое из вступивших в реакцию веществ дано в избытке, а какое – в недостатке.
х1/102 = 20/294, х1 =
6,94 г.
Из
расчета видно, что Al2O3 дан в избытке,
следовательно, расчет ведем по кислоте:
20/294 = х/54, х = 3,67 г.
Ответ. m(Н2O)
= 3,67 г.
ЗАДАЧА
2. На 40 г оксида меди(II) подействовали раствором серной кислоты,
содержащим 49 г безводного вещества. Найдите массу образовавшейся соли.
Дано:
m(CuO)
= 40 г,
m(H2SO4) = 49 г.
Найти:
M(СuSO4).
Решение
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/80 = 49/98, х1 =
40 г.
Cогласно
уравнению данной реакции вещества взяты в стехиометрических количествах,
поэтому расчет можно вести по любому из них:
40/80 = х/160, х = 80 г.
Ответ. m(CuSO4)
= 80 г.
Урок 2
Закрепление алгоритма решения задач
на «избыток – недостаток»
Продолжение. Начало см. в № 44/2003
Цели.
- повторить
способы решения задач; - закрепить
навыки решения; - повторить
правила расчета молекулярной массы; - закрепить
правила грамотного оформления задачи; - формировать
навыки химического мышления, логики; - повторить
материал о процентной концентрации, плотности растворов, переводе объемов
растворов в граммы.
ХОД УРОКА
ЗАДАЧА
1. На 300 г 20%-го раствора хлорида натрия подействовали 100 г
10%-го раствора нитрата серебра. Найдите массу осадка хлорида серебра.
Дано:
m(р-р
NaCl) = 300 г,
(NaCl) = 20%,
m(р-р AgNO3) = 100 г,
(AgNO3) = 10%.
Найти:
m(AgCl).
Решение
m(NaCl)
= 300•20/100 = 60 г,
m(AgNO3)
= 100•10/100 = 10 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, какое – в недостатке.
х1/58,5
= 10/170, х1 = 3,44 г.
Из
расчета видно, что NaCl дан в избытке. Следовательно, дальнейший расчет ведем
по AgNO3:
10/170
= х/143,5, х = 8,44 г.
Ответ. m(AgCl)
= 8,44 г.
ЗАДАЧА
2. На 40 г алюминия, содержащего 10% примесей, подействовали
100 г 10%-й соляной кислоты. Найдите массу образовавшегося хлорида алюминия.
Дано:
m(Al
с прим.) = 40 г,
(прим.) = 10%,
m(р-р HCl) = 100 г,
(HCl) = 10%.
Найти:
m(AlCl3).
Решение
m(прим.)
= 40•10/100 = 4 г,
m(Al)
= 40 – 4 = 36 г,
m(HCl)
= 100•10/100 = 10 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
36/54
= х1/219, х1 = 146 г.
Соляная
кислота дана в недостатке, следовательно, расчет ведем по ней:
10/219
= х/267, х = 12,2 г.
Ответ. m(AlCl3)
= 12,2 г.
ЗАДАЧА
3. На сплав массой 20 г, содержащий 30% алюминия и 70% магния,
подействовали раствором, содержащим 100 г серной кислоты. Найдите массы
образовавшихся солей.
Дано:
m(сплав)
= 20 г,
(Al) = 30%,
(Mg) = 70%,
m(H2SO4) = 100 г.
Найти:
m(Al2(SO4)3),
m(MgSO4).
Решение
m(Al)
= 30•20/100 = 6 г,
m(Mg)
= 20 – 6 = 14 г,
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
6/54
= х1/294, х1 = 33 г.
Кислота
взята в избытке, поэтому расчет ведем по Al:
6/54
= х/342, х = 38 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
14/24
= y1/98, y1 = 57 г.
m‘(H2SO4)
= 100 – 33 = 67 г.
67 г
кислоты достаточно для полного взаимодействия с 14 г Mg, cледовательно, кислота
дана в избытке и расчет ведем по Mg:
14/24
= х/120, х = 70 г.
Ответ. m(Al2(SO4)3)
= 38 г, m(MgSO4) = 70 г.
ЗАДАЧА
4. К 100 мл 10%-го раствора гидроксида калия
плотностью 1,11 г/мл прибавили 200 мл 28%-го раствора азотной кислоты
плотностью 1,21 г/мл. Найдите массу образовавшейся соли.
Дано:
V(р-р
KOH) = 100 мл,
(KOH) = 10%,
(р-р KOH) = 1,11 г/мл,
V(р-р HNO3) = 200 мл,
(HNO3) = 28%,
(р-р HNO3) = 1,21 г/мл.
Найти:
m(KNO3).
Решение
m(р-р
KOH) = •V =
1,11•100 = 111 г,
m(KOH)
= 111•10/100 = 11,1 г,
m(р-р
HNO3) = •V =
1,21•200 = 242 г,
m(HNO3)
= 242•28/100 = 68 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/56
= 68/63, х1 = 60,4 г.
KOH дан
в недостатке, следовательно, расчет ведем по нему:
11,1/56
= х/101, х = 20 г.
Ответ. m(KNO3)
= 20 г.
ЗАДАЧА
5. На 500 мл 10%-го раствора гидроксида калия плотностью
1,11 г/мл подействовали раствором, содержащим 20 г соляной кислоты. Найдите
массу образовавшейся воды.
Дано:
V(р-р
KOH ) = 500 мл,
(KOH) = 10%,
(р-р KOH) = 1,11 г/мл,
m(HCl) = 20 г
Найти:
m(Н2О).
Решение
m(р-р
KOH) = •V =
1,11•500 = 555 г,
m(KOH)
= 555•10/100 = 55,5 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
х1/56
= 20/36,5, х1 = 30,7 г.
KOH дан
в избытке, следовательно, расчет ведем по HCl:
20/36,5
= х/18, х = 9,86 г.
Ответ. m(H2O)
= 9,86 г.
Домашнее задание
ЗАДАЧА
1. К 400 мл 20%-го раствора карбоната натрия с плотностью 1,18
г/мл прибавили раствор, содержащий 40 г соляной кислоты. Найдите массу хлорида
натрия.
Дано:
V(р–р Na2CO3)
= 400 мл,
(Na2CO3)
= 20%,
(р–р Na2CO3)
= 1,18 г/мл,
m(HCl) = 40 г.
Найти:
m(NaCl).
Решение
m(р-р
Na2CO3) = •V = 1,18•400 = 472 г,
m(Na2CO3)
= 20•472/100 = 94,4
Найдем,
какое из вступивших в реакцию веществ дано в избытке, какое – в недостатке.
х1/106
= 40/73, х1 = 58,1 г.
Na2CO3 дан
в избытке, следовательно, расчет ведем по HCl:
40/73
= х/117, х = 64 г.
Ответ. m(NaCl)
= 64 г.
ЗАДАЧА
2. На 40 г оксида цинка, содержащего 20% примесей,
подействовали 100 г 20%-го раствора азотной кислоты. Найдите массу нитрата
цинка.
Дано:
m(ZnO
с прим.) = 40 г,
(прим.) = 20%,
m(р-р HNO3) = 100 г,
(HNO3) = 20%.
Найти:
m(Zn(NO3)2).
Решение
m(прим.)
= 40•20/100 = 8 г,
m(ZnO)
= 40 – 8 = 32 г,
m(безводн.
HNO3) = 100•20/100 = 20 г.
Найдем,
какое из веществ, вступивших в реакцию, дано в избытке, а какое – в недостатке.
32/81
= х1/126, х1 = 50 г.
Азотная
кислота дана в недостатке, расчет ведем по ней:
20/126
= х/189, х = 30 г.
Ответ. m(Zn(NO3)2)
= 30 г.
Урок 3
Самостоятельная
работа
Цель.
Проверить усвоение алгоритма решения типовых задач на «избыток – недостаток».
Вариант на оценку три балла
ЗАДАЧА. На 40 г
оксида магния подействовали 200 г 10%-го раствора азотной кислоты. Найдите
массу нитрата магния.
Дано:
m(MgO) =
40 г,
m(р-р HNO3) = 200 г,
(HNO3) = 10%.
Найти:
m(Mg(NO3)2).
Решение
m(HNO3 безводн.) = 200•10/100 = 20 г.
Найдем, какое из веществ, вступивших в
реакцию, дано в избытке, а какое – в недостатке.
40/40 = х1/126, х1 = 126 г.
HNO3 дана в недостатке, расчет ведем по
ней:
20/126 = х/148, х = 23,5 г.
Ответ. m(Mg(NO3)2)
= 23,5 г.
Вариант на оценку четыре
балла
ЗАДАЧА 1. На
40 г алюминия, содержащего 20% примесей, подействовали 100 г 20%-го раствора
соляной кислоты. Найдите массу хлорида алюминия.
Дано:
m(Al с
прим.) = 40 г,
(прим.) = 20%,
m(р-р HCl) = 100 г,
(HCl) = 20%.
Найти:
m(AlCl3).
Решение
m(прим.)
= 40•20/100 = 8 г,
m(Al) = 40 – 8 = 32 г,
m(HCl) =
100•20/100 = 20 г.
Найдем, какое из веществ, вступивших в
реакцию, дано в избытке, а какое – в недостатке.
32/54 = х1/219, х1 = 129,8 г.
HCl дана в недостатке, расчет ведем по ней:
20/219 = х/267, х = 24,4 г.
Ответ. m(AlCl3)
= 24,4 г.
ЗАДАЧА 2. К 300 г
10%-го раствора гидроксида калия прибавили раствор, содержащий 20 г азотной
кислоты. Найдите массу нитрата калия.
Дано:
m(р-р
KOH) = 300 г,
(KOH) = 10%,
m(HNO3) = 20 г.
Найти:
m(KNO3).
Решение
Для расчета по уравнению реакции найдем
относительные молекулярные массы интересующих нас веществ:
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ 1Ar(H) = 39 + 16 + 1 = 56,
Mr(HNO3) = 1Ar(H)
+ 1Ar(N) + 3Ar(O) = 1 + 14 + 48 = 63,
Mr(KNO3) = 1Ar(K)
+ 1Ar(N) + 3Ar(O) = 39 + 14 + 48 = 101.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/56
= 20/63, х1 = 18 г.
Гидроксид калия дан в избытке,
следовательно, расчет ведем по азотной кислоте:
20/63 = х/101, х = 32 г.
Ответ. m(KNO3)
= 32 г.
Вариант на оценку пять баллов
ЗАДАЧА 1. На 40 г
сплава, содержащего 50% натрия и 50% калия, подействовали 200 г воды. Сколько
образовалось граммов гидроксида натрия и гидроксида калия?
Дано:
m(сплав)
= 40 г,
(К) =
(Na) = 50%,
m(H2O)
= 200 г.
Найти:
m(NaOH),
m(KOH).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(H2О) = 2Ar(Н) + 1Ar(O)
= 2•1 + 1•16 = 18,
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ 1Ar(H) = 39 + 16 + 1 = 56,
Mr(NaOH) = 1Ar(Na) + 1Ar(O)
+ 1Ar(H) = 23 + 16 + 1 = 40.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/78
= 200/36, х1 = 433 г.
Калий дан в недостатке, расчет ведем по
нему:
20/78 = х/112, х = 29 г.
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
y1/46
= 200/36, y1 = 256 г.
Натрий дан в недостатке, расчет ведем по
нему:
20/46 = y/80, y =
35 г.
Ответ. m(KOH)
= 29 г, m(NaOH) = 35 г.
ЗАДАЧА 2. К 500
мл 10%-го раствора гидроксида калия плотностью 1,11 г/мл прибавили раствор,
содержащий 10 г серной кислоты. Найдите массу образовавшегося сульфата калия.
Дано:
V(р-р
КОН) = 500 мл,
(КОН) = 1,11 г/мл,
(КОН) = 10%,
m(H2SO4) = 10 г.
Найти:
m(K2SO4).
Решение
Рассчитаем относительные молекулярные массы
интересующих нас веществ:
Mr(KOH) = 1Ar(K) + 1Ar(O)
+ Ar(H) = 39 +
16 + 1 = 56,
Mr(Н2SO4)
= 2Ar(H) + 1Ar(S) + 4Ar(O)
= 2•1 + 1•32 + 4•16 = 98,
Mr(K2SO4) = 2Ar(K)
+ 1Ar(S) + 4Ar(O) = 2•39 + 1•32 + 4•16 =
174.
m(р-р
KOH) = •V = 1,11•500 = 555 г,
m(KOH)
=555 • 10/100 = 55,5
Найдем, какое из вступивших в реакцию
веществ дано в избытке, а какое – в недостатке.
х1/112
= 10/98, х1 = 11,4 г.
Гидроксид калия дан в избытке,
следовательно, расчет ведем по cерной кислоте:
10/98 = х/174, х = 17,7 г.
Ответ. m(K2SO4)
= 17,7 г.
Как узнать в любой задаче по химии, что в избытке? плиз подскажите
Ученик
(103),
закрыт
9 лет назад
dredan
Знаток
(266)
10 лет назад
Для начала необходимо рассчитать химическое количество каждого вещества. Затем посмотреть, какое значение меньше. Но необходимо учитывать стехиометреческие коэффициенты в реакции. Например:
А + 2Б = В
Вещества А – 3 моль, а вещества Б – 4 моль. Но на каждый моль А нужно 2 моля Б. Поэтому в недостатке вещество Б.
Вот простой не химический пример. У нас есть 7 ручек и 5 колпачков к ним. Сколько мы можем сделать ручек с колпачками? Только 5.