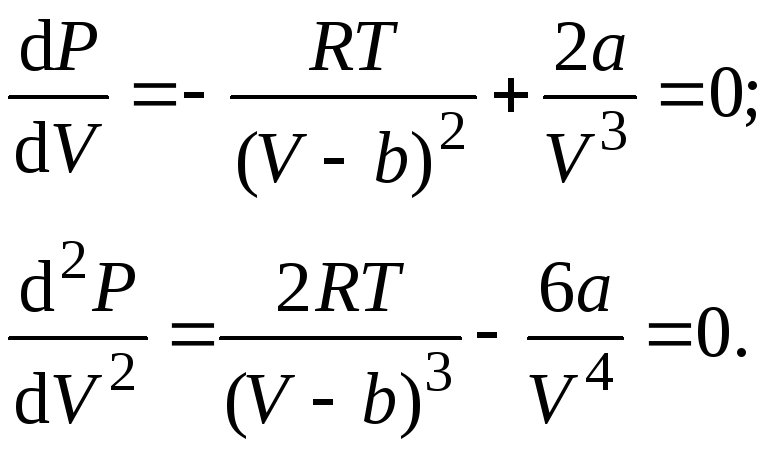Как распознавать газы
Как известно, вещества могут находиться в различных агрегатных состояниях, таких как: твердое, жидкое и газообразное. Но если твердые и жидкие вещества могут иметь окраску, которая является основным признаком для визуального определения химических соединений, то газы в большинстве случаев окраской не обладают. Тогда напрашивается вопрос, как же распознавать газы? Оказывается, не все так сложно и с помощью нехитрых приемов,а также по некоторым свойствам, можно вполне определить газообразные вещества.
Вам понадобится
- Стакан для сбора газа, спички, лучина.
Инструкция
Кислород. Собирают его методом вытеснения воздуха или воды. Так как он тяжелее воздуха, то емкость можно не переворачивать, а просто в нее собирать газ. Чтобы определить, что получено именно это газообразное вещество, необходимо внести в сосуд с кислородом тлеющую лучинку, которая вспыхнет ярким пламенем. Так как газ поддерживает горение, следовательно, в данной емкости находится именно кислород.
Водород. Это газ без цвета и запаха, легче воздуха. Поэтому его собирают методом вытеснения воды или воздуха, но емкость при этом держат дном вверх. После собирания сосуд сразу закрывают. Для того, чтобы распознать вещество открывают емкость с водородом и сразу подносят к отверстию зажженную спичку. Слышен хлопок «пах». Именно этот хлопок свидетельствует о наличии водорода в сосуде.
Углекислый газ. Это вещество тяжелее воздуха, а потому его можно собирать прямо в стакан методом вытеснения воздуха. Для того чтобы определить, что собран углекислый газ, нужно внести в емкость с ним тлеющую лучину. То, что огонь сразу погаснет и является признаком наличия углекислого газа, так как он не поддерживает процесс горения.
Аммиак. Это газообразное вещество и его можно сразу определить по резкому удушливому запаху. Такой же «аромат» имеет нашатырный спирт, который используется при потере сознания.
Оксид азота (IV). Это газ, определяемый даже визуально, так как иное его название «лисий хвост», которое появилось из-за бурой окраски. Бурый газ очень ядовит и категорически противопоказан в незащищенной ситуации (только под тягой).
Метан. Сам по себе это газ без цвета и запаха, однако, в целях безопасности в него добавляют специальные «пахучие» вещества, которые помогают распознавать метан и предотвращать аварийные ситуации.
Озон. Это газообразное вещество, которое каждый чувствует после грозовых разрядов. Ощущение свежести после дождя с грозой дает именно озон. Таким образом, на вопрос: «Как распознавать газы» имеется один ответ – использовать простейшие навыки и приемы, полученные на уроках химии.
Обратите внимание
Обратите внимание на выполнение правил техники безопасности, так как водород с примесями взрывоопасен, а бурый газ нельзя получать без соблюдения мер предосторожности (тяги)
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Вот скажи,смысл обращаться сюда? Берёшь учебник и читаешь внимательно
А вообще можно объяснить так. Просто надо знать какие газы чаще всего выделяются в реакциях – H₂ CO₂ CO – этот газ всё же реже выделяется
Пример:
Zn + 2HNO₂ = Zn(NO₂)₂ + H₂↑ вот тебе и газ
Или же вот
Mg + 2HCl = MgCl₂ + H₂↑
Вот такая реакция
Au + HNO₃ ≠ Не пойдёт реакция,так как Au стоит в ряду активности(напряжений) металлов после водорода и не может заместить его.
Вот с углекислым газом
2HCl + CaCO₃ = CaCl₂ + H₂CO₃
Вообще надо сразу так писать 2HCl + CaCO₃ = CaCl₂ + H₂O + CO₂↑(Но для удобности можно записать и угольную кислоту)
Я записал вместо угольной кислоты воду и углекислый газ. Почему же? Да потому что угольная кислота слабая и сразу же распадается на воду и углекислый газ.
Оцени ответ
Химия. Объясните, пожалуйста, как понять, где газ?
Ученик
(99),
закрыт
10 лет назад
Дополнен 10 лет назад
Хорошо. В таком случае, что нужно тут сделать? Нужно здесь найти либо газ, либо осадок, либо слабый электролит (воду) . Но здесь нет ничего из этого. Как решить тогда? Или я ошибаюсь?
Уже уравняла
К2СО3 + 2НNO3 = 2KNO3 + H2CO3
Вячек
Высший разум
(391245)
10 лет назад
На самом деле газов не так уж много, стоит их запомнить:
Из простых веществ их всего пять (H2, N2, O2, F2, Cl2), да ещё 6 инертных (от гелия до радона) , но они не участвуют в реакциях.
Из сложных веществ – все водородные соединения неметаллов (кроме Н2О) да несколько оксидов – углерода (СО, СО2), азота (N2O,NO, NO2) и серы (SO2, SO3),
Есть и другие, но их мало, и они реже встречаются
check;
Мастер
(1295)
10 лет назад
Нужно знать вещества, их названия и свойства. Газами обычно являются или простые (O2 – кислород, Н2 – водород, N2) или оксиды (СО2 – углекислый, СО – угарный, SO2, NO и NO2). Наиболее часто встречаемые я привел в качестве примеров.
ferrrrera
Знаток
(289)
4 года назад
Что я хочу добавить, вещество H2CO3 очень так сказать не стойкое, и обычно после получения его в реакции обмена, с ним происходит реакция разложения: H2CO3 = H2O + CO2. Это я своими словами.
16.1. Уравнение Ван-дер-Ваальса
Уравнение
Ван-дер-Ваальса – это
уравнение состояния реального газа.
Оно не является единственным уравнением,
характеризующим состояние газа. Таких
уравнений предложено более семидесяти.
Уравнение Ван-дер-Ваальса является
наиболее удачным из всех этих уравнений.
Оно, в общем, правильно передает
зависимость давления от объема для
реального газа. В него входят всего три
константы, одна из которых является
универсальной газовой постояннойR.
В дальнейшем (для упрощения вычислений)
будем рассматривать только один моль
газа. Для одного моля идеального газа
уравнение Менделеева – Клапейрона,
т.е. уравнение состояния идеального
газа, записывалось так:
,(16.1)
где
P – давление
газа;V0 –
объем одного моля газа;Т–
абсолютная температура газа. В это
уравнение надо внести поправки,
учитывающие свойства реального газа.
Первая
поправка – это учет собственного объема
молекул газа. Хотя собственный объем
одной молекулы может показаться ничтожно
малой величиной, учитывая огромное
число молекул, находящихся в данном
объеме газа, нельзя пренебрегать
собственным объемом всех молекул.
Собственный объем молекул сказывается
в том, что молекулы движутся в данном
объеме менее свободно, чем, если бы они
были точечными. Если рассматривается
объем V0
одного моля газа, то свободное
пространство, в котором движутся
молекулы, будет меньше чемV0.С учетом собственного
объема молекулы уравнение (16.1) запишется
так:
, (16.2)
где
b – поправка на
собственный объем молекул, рассчитанная
на 1 моль газа. Теоретические расчеты
показывают, что,
гдеV–
собственный объем одной молекулы газа,NA– число
Авогадро, т.е. число молекул в одном
моле. Поправку «b»
определены экспериментально.
Вторая
поправка – это учет сил взаимодействия
между молекулами реального газа. Молекулы
реального газа, находясь на некотором
расстоянии друг от друга, взаимно
притягиваются. Эти силы притяжения лишь
при очень малых расстояниях между
молекулами (в момент столкновения)
сменяются силами отталкивания. В
результате сил притяжения между
молекулами газ как бы «сжимается» так,
как если бы газ находился под бόльшим
давлением P,
чем то внешнее давлениеP,
которое на него оказывают стенки сосуда.
С учетом сил притяжения в выражении
(16.1) давлениеPнадо
заменить наP = P + Pi.
Величина
называется внутренним давлением
газа. Теоретические расчеты показывают,
что,
гдеV0–
объем одного моля газа,а–
константа, которая также определена
экспериментально. С учетом обеих
поправок, уравнение состояния реального
газа запишется так:
.(16.3)
Это
уравнение Ван-дер-Ваальса для одного
моля реального газа.R –универсальная газовая постоянная, «а»
и «b» –
константы, различные для разных газов,
они определены экспериментально.
16.2. Изотермы реального газа. Критическое состояние
Уравнение
состояния реального газа – это уравнение
Ван-дер-Ваальса. Построим график
зависимости давления газа Ван-дер-Ваальса
от его объёма при постоянной температуре
(рис. 16.1), выразив давление P
через объём
V из уравнения
:
.Кривые, построенные согласно этому
уравнению, имеют вид, показанный на
рисунке, и называютсяизотермами
Ван-дер-Ваальса, т.к. каждая кривая
соответствует определенной температуреТ. При высоких температурах изотермы
Ван-дер-Ваальса напоминают изотермы
идеального газа; при более низких
температурах изотермы Ван-дер-Ваальса
имеют в определенной области давлений
и объемов минимум и максимум.
Уравнение
Ван-дер-Ваальса было получено теоретически,
и с точки зрения математики построение
кривых согласно уравнению (16.3) сомнений
не вызывает. Но для того, чтобы выяснить
смысл этой, на первый взгляд странной
зависимости, надо обратиться к опыту.
Если
взять какой-нибудь реальный газ, поместить
его под поршень в цилиндр и
экспериментально найти зависимость
при различных температурах, то кривые
будут иметь вид, показанный нарис. 16.2.
При высоких температурах изотермы
реального газа, рассчитанные теоретически,
совпадают с изотермами, найденными
экспериментально. Кроме того, изотермы
реального газа при высоких температурах
очень близки к изотермам идеального
газа, которые подчиняются закону Бойля
– Мариотта. При более низких температурах
в той области, где теоретические изотермы
Ван-дер-Ваальса имеют минимум и максимум,
экспериментальные изотермы имеют
прямолинейные участки.
Чертим
отдельно одну теоретическую изотерму
и при той же самой температуре
экспериментальную изотерму. Если эти
рисунки наложить друг на друга, то они
совместятся друг с другом за исключением
участка ВС.
|
|
|
Начнем
сжимать газ, поддерживая его температуру
постоянной, с какой-нибудь точки А.
Ветвь изотермыАВ(на обоих рисунках)
соответствует сжатию газа при низких
давлениях. Свойства газа на участкеАВочень близки к свойствам идеального
газа. При достижении некоторого давленияР0поведение газа резко меняется.
Газ
продолжаем сжимать, его объем уменьшается,
а давление остается одним и тем же (рис.
16.3), равным Р0.
УчастокВСнаэкспериментальной
изотермесоответствует процессу
сжижения газа, т.е. на участкеВСгаз
превращается в жидкость (ВС –линия
конденсации пара). В этой области вещество
существует одновременно в двух фазах:
жидкость – одна фаза, и вторая фаза –
газ, который в данном случае является
насыщенным паром по отношению к жидкости.
Давление насыщенного пара зависит
только от температуры, но не зависит от
объема. Поэтому давлениеР0не меняется до тех пор, пока весь пар
при данной температуре, не перейдет в
жидкость. ДавлениеP0называетсяупругостью насыщенных
паров при данной температуреТ.
В точкеВвсе вещество еще было в
газообразном состоянии, в точке С все
вещество находится уже в жидком состоянии.
Ветвь
изотермы СД (на обеих изотермах)
характеризует процесс сжатия жидкости.
Жидкости обладают малой сжимаемостью,
поэтому криваяСДкруто идет вверх.
Участок
ВЕтеоретической изотермы
Ван-дер-Ваальса можно получить на
опыте. УчастокВЕхарактеризуетпересыщенный пар, т.е. пар, плотность
которого больше плотности насыщенного
пара при данной температуре. Состояние
пересыщенного пара – малоустойчивое
состояние. Пар легко конденсируется,
частично переходит в жидкость, а
оставшийся пар тогда будет уже насыщенным
паром.
Участок
СFтеоретической
изотермыВан-дер-Ваальса также можно
получить экспериментально. Он характеризует
малоустойчивое состояниерастянутой
жидкости, т.е. жидкости с меньшей
плотностью, чем ей положено иметь при
данной температуре. Такая жидкость
получается, если её особенно тщательно
очистить от всяких примесей.
Участок
FЕтеоретической
изотермыВан-дер-Ваальса экспериментально
получить нельзя.
Каждая
экспериментальная изотерма соответствует
одной какой-либо температуре Т = const.
С повышением температурыТпрямолинейные участки соответствующих
изотерм становятся все уже и при какой-то
температуреТкточкиВиС, ограничивающие
прямолинейный участок, сольются в одну
точкуК. Изотерма, на которой линия
конденсации изображается в виде точки,
является критической изотермой.
Температура, соответствующая критической
изотерме – критическая температураTк.
Изотерма, соответствующая критической
температуреТк,
имеет только точку перегибаК.
Касательная к точкеКпараллельна
оси абсцисс. Изотермы при температурах
вышеТкне имеют ни максимумов, ни минимумов,
ни прямолинейных участков и близки к
изотермам идеального газа.
Точка
Кназывается критической точкой.Тк,
соответствующие ейPкиVкназываются критическими температурой,
давлением и объемом соответственно.Критической температурой Тк
называется температура, при которой
исчезает различие между жидким и
газообразным состоянием вещества.Для разных веществ критическая температураТкразлична. Состояние вещества при
критической температуре называется
критическим состоянием вещества. В этом
состоянии вещество приобретает особые
свойства, например, исчезают силы
сцепления между молекулами, вещество
не имеет поверхностного натяжения и
т.п.
При
температурах ниже критической вещество
может существовать в зависимости от
давления либо в жидком, либо в газообразном
состоянии, либо в двухфазном состоянии
(жидкость и ее пар одновременно).
При
температурах выше критической температуры
вещество может существовать только в
газообразном состоянии и никаким сжатием
не может быть переведено в жидкое
состояние. Газ сначала надо охладить
до Т Тк,
и только потом сжимать.
Критическому
состоянию вещества соответствует
единственная точка критической изотермы
– точка, в которую превратилась линия
конденсации. Эта точка называется
критической. Параметры вещества
в критической точке называют
критическими параметрами. Для их
определения необходимо установить
положение критической точки на
координатной плоскости P,V.
Любая
изотерма Ван-дер-Ваальса, в том числе и
критическая, описывается уравнением
.
Так как критическая точка является
точкой перегиба изотермы Ван-дер-Ваальса,
в ней равны нулю первая и вторая
производные по объёму функцииприT = const:
Решая
уравнения совместно, найдем значения
критических параметров:
(16.4)
где а,b–
константы из уравнения Ван-дер-Ваальса,
описывающего состояние данного реального
газа,R– универсальная
газовая постоянная. На рисунке областьI(заштрихована) – это
область двухфазного состояния вещества,
областьII(двойная
штриховка) – это область жидкого
состояния, областьIII(не
заштриховано) – это область газообразного
состояния.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Реальные газы это газ, который при всех стандартных условиях давления и температуры не подчиняется газовым законам.
Он отклоняется от своего идеального поведения, поскольку газ становится огромным и объемным. Истинные газы имеют скорость, массу и объем.
Они разжижаются при охлаждении до температуры кипения. Пространство, заполненное газом, не мало по сравнению с общим объемом газа.
Примеры реальных газов: водяной пар, оксид серы, оксид азота и так далее.
Что такое реальные газы закон реального газа
Явно включив эффекты молекулярного размера и межмолекулярных сил, голландский физик Йоханнес ван дер Ваальс изменил закон идеального газа, чтобы объяснить поведение реальных газов.
Уравнение Ван-дер-Вааля для реального газа: Уравнение закона реального газа, = (P + an2)/v2 = (V — nb)nRT
Где a и b представляют эмпирическую константу, которая уникальна для каждого газа.
n2/V2 представляет собой концентрацию газа.
P представляет давление, R представляет собой универсальную газовую постоянную, а T — температуру
Сравнение идеальных и реальных газов
Приведенная ниже разница показывает свойства реального газа и идеального газа, а также поведение идеального и реального газа.
| Идеальный газ | Реалный газ |
| Нет определенного объема | Определенный объем |
| Упругое столкновение частиц | Сила межмолекулярного притяжения |
| На самом деле не существует в окружающей среде и является гипотетическим газом | Он действительно существует в окружающей среде |
| Высокое давление | Давление меньше по сравнению с идеальным газом |
| Независимый | Взаимодействует с другими |
| Подчиняется PV = NRT | Подчиняется P + ((n2a)/V2)(V−nb) = nRT |
Идеальный газ определяется как газ, который подчиняется законам газа при любых условиях давления и температуры.
Идеальные газы обладают как скоростью, так и массой. У них нет объема. Объем, занимаемый газом, невелик по сравнению с общим объемом газа. Он не конденсируется, и тройной точки не существует.
Закон идеального газа это уравнение состояния гипотетического идеального газа, также называемое общим газовым уравнением.
Во многих условиях это разумное приближение поведения нескольких газов, но оно имеет много ограничений.
Уравнение идеального и реального газа
В 1834 году Бенуа Поль Эмиль Клапейрон впервые описал его как вариацию эмпирического закона Бойля, закона Шарля, закона Авогадро и закона Гей-Люссака.
В эмпирической форме закон идеального газа также записан:
pV=nRT
Графики реальных газов
Поскольку все молекулы имеют определенный объем и взаимодействуют друг с другом, то реальные газообразные вещества подчиняются законам идеальных газов только в области малых давлений и высоких температур.
С повышением давления и понижением температуры начинают проявляться индивидуальные свойства каждого газа, обусловленные электронным строением его молекул (рис.).
Рис. Различие свойств идеального и реальных газов.
Поведение реальных газов достаточно хорошо описывается уравнением Ван-дер-Ваальса
(p +(a/V2))(V — b) = RT

Постоянная b представляет собой суммарный объем молекул. Обе эти величины находят экспериментально для каждого газа в отдельности.
Отклонение поведения реальных газов от законов идеального газа следует учитывать при определении молекулярных масс газообразных веществ с помощью уравнения М = m (RT/pV).
Рис. 2. Определение молекулярной массы газообразного вещества с помощью уравнения объединенного газового состояния
Чтобы определить правильное значение молекулярной массы, необходимо измерить объем, занимаемый газом при различных давлениях (температура во всех опытах должна оставаться постоянной).
Затем нужно построить график функции М = f (р) и найти точку пересечения этого графика с осью у (р = 0). Ордината точки пересечения равна численному значению молекулярной массы М (рис. 2).
Интересные факты о реальном газе?
Коэффициент, известный как коэффициент сжимаемости Z, определяется отклонением реального газа от идеального газа и определяется как отношение фактического объема к объему, предсказанному законом об идеальном газе, при той же температуре и давлении Z = Фактический объем/объем,
предсказанный идеальным газом = v/RT/P
Но идеальная скорость газа, V идеальный, составляет RT/P. Поэтому коэффициент сжимаемости также может быть определен как отношение удельного реального объема газа к удельному объему идеального газа, т. е.
Коэффициент сжимаемости Z = (Vреальный)/(Vидеальный)
Как мы все знаем, при очень низких давлениях и высоких температурах все газы действуют как идеальные газы. Поэтому, когда давление снижается, поскольку газ ведет себя как идеальный, значение Z стремится к единице.
Следует помнить, что в зависимости от давления и температуры значение Z может быть меньше единицы или больше единицы. На диаграмме коэффициента сжимаемости показаны значения Z, соответствующие давлению.
Сжижение газов
Кинетическая молекулярная теория газов не предсказывает и не объясняет сжижение газов. Согласно как теории, так и закону идеального газа, газы, раздавленные до чрезвычайно высоких давлений и охлажденные до чрезвычайно низких температур, все равно должны вести себя как газы, хотя и холодные, плотные.
Когда газы сжимаются и охлаждаются, они неизменно конденсируются, превращаясь в жидкости, хотя для сжижения легких элементов, таких как гелий, требуются чрезвычайно низкие температуры (например, 4,2 К при давлении 1 атм).
Сжижение можно рассматривать как крайнее отклонение от поведения идеального газа. Когда молекулы в газе охлаждаются до такой степени, что их кинетической энергии больше не хватает, чтобы противостоять силам межмолекулярного притяжения, происходит это явление.
Точная комбинация температуры и давления, необходимая для сжижения газа, сильно зависит от его молярной массы и структуры, при этом более тяжелые и сложные молекулы разжижаются при более высоких температурах.
Поскольку большие коэффициенты предполагают относительно сильные межмолекулярные притягательные взаимодействия, вещества с большими коэффициентами ван-дер-Ваальса, как правило, легко разжижаются.
С другой стороны, небольшие молекулы, содержащие только легкие компоненты, имеют низкие коэффициенты, что указывает на слабые межмолекулярные взаимодействия и затрудняет их разжижение.
В больших масштабах сжижение газа используется для разделения O2, N2, Ar, Ne, Kr и Xe. После сжижения пробы воздуха смесь нагревают, и газы разделяют в соответствии с их свойствами.
Часто задоваемые вопросы ответы о реальном газе?
Каков пример реального газа?
Любой существующий газ это настоящий газ. Кислород, водород, углекислый газ, гелий, монооксид углерода и т.д.
Реальные газы между частицами обладают малыми силами притяжения и отталкивания, а идеальные газы-нет. Существует объем частиц истинного газа, а частиц идеального газа нет.
Каковы предположения об идеальном газе?
Закон идеального газа предполагает, что газы ведут себя идеально, что означает, что они соответствуют следующим характеристикам: (1) столкновения между молекулами являются упругими/
А их движение без трения, что означает, что молекулы не теряют энергию; (2) меньшая величина-это общий объем отдельных молекул.
Что такое Газовый закон Шарля?
Физическая концепция, известная как закон Шарля, гласит, что, как определено по шкале Кельвина, объем газа равен постоянному значению, умноженному на его температуру (нулю Кельвина соответствует -273,15 градуса Цельсия).
Что такое настоящий газ?
Газ, который не действует как идеальный газ, называется «реальным газом». Взаимодействия между молекулами газа помогают объяснить их поведение.
Из-за этих межмолекулярных взаимодействий между частицами газа реальные газы не подчиняются закону идеального газа.
Следовательно, реальные газы-это неидеальные газы, молекулы которых занимают определенное пространство и могут взаимодействовать друг с другом.
Что такое идеальный газ?
Идеальный газ-это тот, который подчиняется законам газа при любых условиях температуры и давления. Для этого газ должен следовать кинетико-молекулярной теории.
Частицы газа не должны иметь объема и не должны проявлять сил притяжения друг к другу. Не может быть такой вещи, как идеальный газ, поскольку ни одно из этих требований не может быть выполнено.
В действительности идеального газа не существует. Это гипотетический газ, который был предложен для упрощения вычислений.
Каковы многочисленные факторы, которые необходимо учитывать при работе с реальными газами?
Чтобы понять, как ведут себя реальные газы, необходимо учитывать несколько факторов. Ниже перечислены многие соображения, которые необходимо учитывать при работе с реальными газами.
- Влияние сжимаемости на реальный газ.
- Различные реальные газы обладают различной удельной теплоемкостью.
- Силы Ван-дер-Ваальса оказывают влияние на взаимодействия между молекулами в реальном газе.
- Потенциал системы для неравновесных термодинамических эффектов.
- Разнообразный состав газа и изменения его состава в результате молекулярной диссоциации, а также любые элементарные процессы, которые могут происходить.
Что такое уравнение идеального газа?
Нам нужен стандартный газ для изучения свойств газов, но какой газ мы должны использовать? Существуют тысячи различных газов, которые мы могли бы исследовать, включая водород, кислород, гелий, азот и углекислый газ, и это лишь некоторые из них.
Исследователи обнаружили, что независимо от того, какой газ вы анализируете, если вы берете образец с одним молем и помещаете его в тот же контейнер при той же температуре, давление почти одинаковое, а при более низкой плотности даже эти незначительные расхождения в показаниях исчезают.
В результате при чрезвычайно низких плотностях все реальные газы, как правило, подчиняются единому универсальному закону, известному как закон идеального газа.
Уравнение, известное как уравнение идеального газа, описывает этот закон:
PV = nRT
Статья на тему Реальные газы