Определение и формула
Это неорганическое химическое соединение, относящееся к классу солей. Название по другой номенклатуре – хлористый кальций.
Химическая формула
CaCl2
Cтруктурная схема
Получение химического соединения
Хлорид кальция в свободном виде в природе не встречается. Его синтезируют химическими путями.
Естественные источники получения
В природе хлористый кальций встречается исключительно в виде кристаллогидрата с химической формулой СаСl2 · 6Н2O. Под воздействием высоких температур при нагревании свыше 29,8°C кристаллогидрат теряет молекулы воды.
Искусственные источники получения
В лабораторных условиях хлористый кальций синтезируют при взаимодействии гидроксида кальция с хлоридом аммония.
2NH4Cl + Ca(OH)2 → 2NH3↑ + CaCl2 + 2H2O
Рассмотренная химическая реакция лежит в основе промышленного производства соды. Второй продукт взаимодействия – аммиак, в качестве побочного продукта выделяется вода.
Альтернативный способ – обработка кальцийсодержащего сырья (кристаллического карбоната кальция) соляной кислотой.
СаСО3 + 2HCl → CaCl2 + СО2↑ + Н2О
Свойства хлористого кальция
Физические свойства
Хлористый кальций – это твердое вещество белого цвета. Кристаллы, имеющие кубическую форму, обладают высокой гигроскопичностью и быстро поглощают влагу из окружающего воздуха. Хорошо растворим в низших спиртах и органических растворителях (ацетоне).
Прочие физические свойства:
| плотность | 2,15 г/см³ |
| молярная масса | 111,08 г/моль |
| температура кипения | 1935 °C |
| температура плавления | 772 °C |
| растворимость в воде | 74,5 г/100 мл |
Химические свойства
Хлорид кальция проявляет все типичные свойства солей.
| Свойство | Уравнение |
|---|---|
| Подергается обратимому гидролизу. Диссоциирует на катиона кальция и хлорид-анионы. | CaCl2↔Ca2+ + 2Cl– |
| Взаимодействует с водными растворами щелочей. | CaCl2 + 2NaOH(conc) →Ca(OH)2↓ + 2NaCl |
| Вступают в химическое взаимодействие с сильными кислотами. | CaCl2 + H2SO4(conc) → CaSO4↓ + 2HCl↑ |
| Вступает в химические реакции с другими солями при условии, что один из продуктов выпадает в осадок или улетучивается. В противоположном случае реакция будет обратимой. | CaCl2+ Na2CO3 → CaCO3↓ + 2NaCl |
| Вступает во взаимодействие с водородом при нагревании до 600-700°C и в присутствии катализаторов – Pt, Ni, Fe. | CaCl2 + H2↔ CaH2 + 2HCl |
Применение хлористого кальция

Хлористый кальций активно применяется в медицине, промышленности, пищевом производстве. Вещество используют:
• как сырье для получения кальция;
• как наполнитель для осушающих конструкций в форме трубок (при изоляции водяных паров и осушении газообразных веществ);
• на газораспределительных станциях;
• для быстрого схватывания цемента;
• как средство от гололеда;
• для регулирования жесткости воды при производстве напитков;
• в качестве консерванта;
• в качестве отвердителя в пищевых продуктах (безопасная для здоровья добавка E509);
• для смягчения мяса;
• в качестве лекарственного средства для восполнения дефицита кальция в организме;
• в медицине для лечения проявлений аллергии, при токсических отравлениях, гепатите, для укрепления стенок сосудов, улучшения работы сердца.
Тест по теме «Хлорид кальция»
Физические свойства
Хлорид кальция CaCl2 — соль щелочноземельного металла кальция и хлороводородной кислоты. Белый, плавится без разложения. Хорошо растворяется в воде (гидролиза нет).
Относительная молекулярная масса Mr = 110,98; относительная плотность для тв. и ж. состояния d = 2,51; tпл = 782º C; tкип = 1960º C;
Способ получения
1. Хлорид кальция можно получить путем взаимодействия кальция и хлора:
Ca + Cl2 = CaCl2
2. В результате взаимодействия карбоната кальция и соляной кислоты образуется хлорид кальция, углекислый газ и вода:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Качественная реакция
Качественная реакция на хлорид кальция — взаимодействие его с нитратом серебра, в результате реакции происходит образование белого творожного осадка:
1. При взаимодействии с нитратом серебра, хлорид кальция образует нитрат кальция и осадок хлорид серебра:
CaCl2 + 2AgNO3 = Ca(NO3)2 + 2AgCl↓
Химические свойства
1. Хлорид кальция реагирует с простыми веществами:
1.1. В результате реакции между хлоридом кальция и водородом при 600 — 700º С и катализаторах Pt, Fe, Ni образуется гидрид кальция и соляная кислота:
CaCl2 + H2 = CaH2 + 2HCl
1.2. Хлорид кальция взаимодействует с алюминием при 600 — 700º С и образует на выходе кальций и хлорид алюминия:
3CaCl2 + 2Al = 3Ca + 2AlCl3
2. Хлорид кальция вступает в реакцию со многими сложными веществами:
2.1. Хлорид кальция вступает в реакции с основаниями:
2.1.1. Хлорид кальция взаимодействует с концентрированным раствором гидроксида натрия. При этом образуются гидроксид кальция и хлорид натрия:
CaCl2 + 2NaOH = Ca(OH)2↓ + 2NaCl
2.2. Хлорид кальция реагирует с кислотами:
2.2.1. Твердый хлорид кальция реагирует с концентрированной серной кислотой при кипении, образуя сульфат кальция и газ хлороводород:
CaCl2 + H2SO4 = CaSO4↓ + 2HCl↑
2.3. Хлорид кальция вступает в взаимодействие с солями:
2.3.1. В результате реакции между хлоридом кальция и карбонатом натрия образуется карбонат кальция и хлорид натрия:
CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl
2.3.2. Хлорид кальция реагирует с фторидом аммония и образует фторид кальция и хлорид аммония:
CaCl2 + 2NH4F = CaF2↓ + 2NH4Cl
2.3.3. Хлорид кальция может реагировать с сульфатом калия при 800º С с образованием сульфата кальция и хлорида калия:
CaCl2 + K2SO4 = CaSO4 + 2KCl
| Хлорид кальция | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
Хлорид кальция |
| Традиционные названия | Хлорид кальция, хлористый кальций |
| Хим. формула | CaCl2 |
| Рац. формула | CaCl2 |
| Физические свойства | |
| Молярная масса | 111,08 г/моль |
| Плотность | 2,15 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 772 °C |
| • кипения | 1935 °C |
| Химические свойства | |
Константа диссоциации кислоты  |
8—9 |
| Растворимость | |
| • в воде | 74,5 г/100 мл |
| Структура | |
| Координационная геометрия | Октаэдральная |
| Классификация | |
| Рег. номер CAS | 10043-52-4 |
| PubChem | 5284359 |
| Рег. номер EINECS | 233-140-8 |
| SMILES |
[Cl-].[Cl-].[Ca+2] |
| InChI |
InChI=1S/Ca.2ClH/h;2*1H/q+2;;/p-2 UXVMQQNJUSDDNG-UHFFFAOYSA-L |
| Кодекс Алиментариус | E509 |
| RTECS | EV9800000 |
| ChEBI | 3312 |
| ChemSpider | 23237 |
| Безопасность | |
| ЛД50 | 1,5-3,6 г/кг (крысы, перорально) |
| Токсичность | ПДК 2 мг/м³ |
| Фразы риска (R) | R36 |
| Фразы безопасности (S) | S22, S24 |
| Краткие характер. опасности (H) |
H319 |
| Меры предостор. (P) |
P280, P264, P305+P351+P338, P337+P313 |
| Пиктограммы СГС |
|
| NFPA 704 |
0 2 1 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлори́д ка́льция, CaCl2 — химическое неорганическое вещество; кальциевая соль соляной кислоты. Неядовит, зарегистрирован в качестве пищевой добавки E509.
Белые кристаллы плотностью 2,15 г/см³, температура плавления — 772 °C. Обладает высокими гигроскопическими свойствами. Растворимость (г на 100 г H2O): 74 (20 °C) и 159 (100 °C). Водные растворы хлорида кальция замерзают при низких температурах (20%-й — при -18,57 °C, 30%-й — при -48 °C).
CaCl2 образует гидрат CaCl2·6H2O, устойчивый до 29,8 °C; при более высоких температурах из насыщенного раствора выпадают кристаллогидраты с 4, 2 и 1 молекулами H2O. При смешении CaCl2*6H2O (58,8 %) со снегом или льдом (41,2 %) температура понижается до —55 °C (криогидратная точка).
Производство[править | править код]

Структура полимерного гексагидрата хлорида кальция [Ca(H2O)6]2+.
Природный минерал гексагидрата хлорида кальция, ставший известным как антарктицит[en], был впервые обнаружен на дне солёного озера Дон-Жуан на Земле Виктории в Антарктиде.
Получают как побочный продукт в производстве соды (в процессе рекуперации аммиака):
.
Во многих частях света хлорид кальция получается как побочный продукт из известняка по методу Сольве со следующей реакцией:[2]
- 2 NaCl + CaCO3 → Na2CO3 + CaCl2
Потребление в Северной Америке в 2002 году составляло 1529000 тонн.[3]
Как и в других солях, в хлориде кальция могут встречаться следовые количества других катионов щелочных и редкоземельных металлов групп 1 и 2, а также анионов других галогенов 17 группы таблицы химических элементов.
Применение[править | править код]
В химической лаборатории хлорид кальция применяется в качестве наполнителя для осушающих трубок[en], также называемых хлоркальциевыми, предназначенных для изоляции веществ в сосуде от водяных паров атмосферы и для осушки газов. В первом случае такая трубка прямая или согнута под углом 90 градусов и имеет один шарообразный участок, во втором она согнута в виде буквы U и имеет два шарообразных участка[4].
Хлорид кальция также применяют для получения металлического кальция, для осушки и понижения точки росы технологического и импульсного газа:
- на газораспределительных станциях, компрессорных станциях магистральных газопроводов;
- на автогазонаполнительных компрессорных станциях;
- на объектах газодобычи при подготовке газа к транспортировке.
Кроме того, он применяется в следующих областях:
- в смягчении говядины и баранины (снижение затрат на заморозку, хранение и погрузку);
- в консервировании овощей и фруктов (хранение яблок с пропиткой 8 % раствором)[5]
- как ускоритель схватывания цемента;
- как противогололёдное средство;
- как отвердитель в продуктах питания (загуститель для получения низкокалорийных желе);
- в молочной промышленности при производстве ферментированных молочных продуктов, и играет большую роль в формировании сгустка. Добавление хлористого кальция ведёт к увеличению выхода конечного продукта, а также улучшает его свойства;
- в медицине;
- в регулировании жёсткости воды при производстве слабоалкогольных и безалкогольных напитков;
- в изготовлении хлеба (консервант);
- при транспортировке замороженных грузов морем — для избежания замерзания воды в дренажной системе;
- для приготовления жидкости глушения при проведении ремонта на нефтяных и газовых скважинах.
- замораживание грунтов хлористым кальцием [6]
Обеспыливание грунтовых дорог[править | править код]

Разбрызгивание раствора хлорида кальция препятствует испарению влаги и образованию пыли.
Второе по массовости применение хлорида кальция использует гигроскопичность (стремление захватывать влагу) этого соединения, в результате чего образуется липкий гидрат. Концентрированный раствор делает поверхность грунтовой дороги немного влажной и предотвращает образование пыли. Удержанные в гидрате мелкие частички образуют липкий слой. Если бы этого не происходило, частички бы разлетались, приводя к смещению более крупных частиц и постепенному разрушению дороги. Использование хлорида кальция снижает необходимость в разравнивании дороги на 50% и на 80% снижает образование ям, которые необходимо заделывать.[7]
Возможная опасность[править | править код]
В малых количествах и при этом насыщенный влагой хлорид кальция не является токсичным материалом. Однако сухой хлорид кальция крайне гигроскопичен, что может являться источником опасности, поскольку при попадании на кожу интенсивно сушит и раздражает её. При растворении твёрдого хлорида кальция выделяется энергия, поэтому при употреблении внутрь этот экзотермический процесс может приводить к ожогам полости рта и внутренних органов. Употребление внутрь концентрированного раствора приводит к нарушению пищеварения и поражению внутренних органов.[8]
Употребление хлорида кальция может привести к гиперкальциемии.[9]
Примечания[править | править код]
- ↑ (unspecified title)
- ↑ Robert Kemp, Suzanne E. Keegan “Calcium Chloride” in Ullmann’s Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_547
- ↑ Calcium Chloride SIDS Initial Assessment Profile, UNEP Publications, SIAM 15, Boston, 22–25 October 2002, страница 11.
- ↑ И. Э. Нифантьев, П. В. Ивченко «Практикум по органической химии» — см. с. 14—15.
- ↑ Химлайн : Пищевая добавка Е509 (Е-509) хлорид кальция : П : Реализация промышленной химии : Продукция и услуги. Дата обращения: 2 июня 2013. Архивировано из оригинала 16 ноября 2013 года.
- ↑ Замораживание грунтов
- ↑ Dust: Don’t Eat It! Control It! Road Management & Engineering Journal. US Roads (TranSafety Inc.) (1 июня 1998). Дата обращения: 9 августа 2006. Архивировано 29 октября 2007 года.
- ↑ Product Safety Assessment (PSA): Calcium Chloride. Dow Chemical Company (2 мая 2006). Дата обращения: 22 июля 2008. Архивировано 17 сентября 2009 года.
- ↑ Calcium Chloride Possible Side Affects.
Кальция хлорид (Calcium chloride)
💊 Состав препарата Кальция хлорид
✅ Применение препарата Кальция хлорид
Описание активных компонентов препарата
Кальция хлорид
(Calcium chloride)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.11.10
Владелец регистрационного удостоверения:
Код ATX:
B05XA07
(Кальция хлорид)
Лекарственная форма
| Кальция хлорид |
Р-р д/в/в введения 1 г/10 мл: амп. 10 шт. рег. №: ЛС-000366 |
Форма выпуска, упаковка и состав
препарата Кальция хлорид
10 мл – ампулы (10) – пачки картонные.
Фармакологическое действие
Кальций – макроэлемент, участвующий в формировании костной ткани, процессе свертывания крови, необходим для поддержания стабильной сердечной деятельности, процессов передачи нервных импульсов. Улучшает сокращение мышц при мышечной дистрофии, миастении, уменьшает проницаемость сосудов, оказывает противоаллергическое действие. При в/в введении кальций вызывает возбуждение симпатической нервной системы и усиление выделения надпочечниками адреналина; оказывает умеренное диуретическое действие.
При взаимодействии раствора кальция хлорида с солями магния, щавелевой и фтористой кислотами образуются нерастворимые соединения, что позволяет применять раствор кальция хлорида в качестве антидота.
Фармакокинетика
В крови кальций находится в ионизированном и в связанном состоянии. В плазме около 45% кальция находится в комплексе с белками. Физиологической активностью обладает ионизированный кальций. Депонируется в костной ткани. Около 20% выводится почками, остальное количество (80%) – кишечником. 95% кальция, выводящегося путем гломерулярной фильтрации, подвергается резорбции в восходящем сегменте петли Генле, а также в проксимальных и дистальных почечных канальцах.
Показания активных веществ препарата
Кальция хлорид
Аллергические заболевания (крапивница, ангионевротический отек, аллергодерматозы, сывороточная болезнь), гипокальциемия (в т.ч. гипокальциемическая тетания, при гипопаратиреозе), свинцовая колика, гиперкалиемия, передозировка солями магния (в составе комплексной терапии).
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Применяют внутрь, в/в струйно или капельно. Дозу, способ и схему применения, длительность терапии определяют индивидуально, в зависимости от показаний, клинической ситуации и возраста пациента.
Дозу для детей устанавливают из расчета на массу тела.
Побочное действие
Возможно: ощущение жара сначала в полости рта, а затем по всему телу, привкус мела во рту, периферическая вазодилатация, снижение АД, аритмия (в т.ч. брадикардия), тошнота, обморок. При попадании в подкожную клетчатку и в мышцу вызывает сильное раздражение и некроз окружающих тканей. При быстром в/в введении возможны фибрилляция желудочков сердца, сердечно-сосудистая недостаточность, вплоть до остановки сердца.
Местные реакции: раздражение по ходу вены; гиперемия кожи, боль, сыпь, кальцификация могут свидетельствовать об экстравазации, которая может приводить к некрозу окружающих тканей.
Противопоказания к применению
Повышенная чувствительность к кальция хлориду, гиперкальциемия, тяжелая хроническая почечная недостаточность, фибрилляция желудочков, мочекаменная болезнь, саркоидоз, выраженный атеросклероз, склонность к тромбообразованию, одновременный прием с сердечными гликозидами; беременность; период грудного вскармливания.
С осторожностью: хроническая почечная недостаточность легкой и средней степени тяжести, дегидратация, нарушение электролитного баланса (риск гиперкальциемии), заболевания сердца (риск аритмии), заболевания почек, «легочное» сердце, респираторный ацидоз, дыхательная недостаточность (риск токсических реакций вследствие окисления кальция), детский возраст.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период лактации (грудного вскармливания). При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания.
Применение при нарушениях функции почек
Противопоказано применение при тяжелой хронической почечной недостаточности. С осторожностью применять при хронической почечной недостаточности легкой и средней степени тяжести, заболеваниях почек.
Применение у детей
Кальция хлорид следует с осторожностью применять у детей.
Особые указания
Не вводить п/к и в/м. При попадании кальция хлорида под кожу или в мышечные ткани развивается сильное раздражение с образованием очагов некроза.
При возникновении боли или гиперемии в месте введения следует прекратить введение и исключить экстравазацию средства.
Лечение проводят под контролем концентрации кальция в крови.
При аллергических заболеваниях рекомендуется совместное применение кальция хлорида и антигистаминных препаратов.
Влияние на способность к управлению транспортными средствами и механизмами
В период лечения в связи с возможным развитием побочных эффектов необходимо соблюдать осторожность при вождении автотранспорта и занятиях другой деятельностью, требующей высокой концентрации внимания и скорости психомоторных реакций.
Лекарственное взаимодействие
При одновременном применении уменьшает действие блокаторов “медленных” кальциевых каналов; с другими кальций- и магнийсодержащими препаратами повышается риск гиперкальциемии или гипермагниемии соответственно, особенно у пациентов с хронической почечной недостаточностью; с хинидином – возможно замедление внутрижелудочковой проводимости и повышение токсичности хинидина.
Снижает эффективность недеполяризующих миорелаксантов. Может увеличивать продолжительность действия тубокурарина хлорида.
Фармацевтически несовместим с тетрациклинами, магния сульфатом, лекарственными препаратами, содержащими фосфаты, карбонаты или тартраты.
Кальция хлорид несовместим с солями свинца, серебра, одновалентной ртути вследствие образования нерастворимых хлоридов тяжелых металлов и с барбиталом натрия, т.к. при этом образуется малорастворимая кальциевая соль барбитала.
Во время лечения сердечными гликозидами парентеральное применение кальция хлорида не рекомендуется в связи с усилением кардиотоксического действия.
Если вы хотите разместить ссылку на описание этого препарата – используйте данный код
Общее понятие о хлористом кальции
Хлористый кальций (хлорид кальция, кальция хлорид или СаCl2) 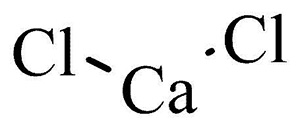 – кальциевая соль соляной кислоты в виде гигроскопических кристаллов, с горько-соленым вкусом, без цвета и запаха. Хорошо растворяется в воде (4:1), охлаждая раствор, и в спирте. Температура плавления +34 °C, замерзания от -18 до -48 °C (в зависимости от концентрации). Кальция хлорид содержит до 27 % чистого кальция. Данный химический реактив несовместим с кислотами, солями тяжелых металлов, йодидами. Кальций хлорид получают при производстве аммиачной соды (побочный продукт), а также при нагревании хлорной извести (хлорки).
– кальциевая соль соляной кислоты в виде гигроскопических кристаллов, с горько-соленым вкусом, без цвета и запаха. Хорошо растворяется в воде (4:1), охлаждая раствор, и в спирте. Температура плавления +34 °C, замерзания от -18 до -48 °C (в зависимости от концентрации). Кальция хлорид содержит до 27 % чистого кальция. Данный химический реактив несовместим с кислотами, солями тяжелых металлов, йодидами. Кальций хлорид получают при производстве аммиачной соды (побочный продукт), а также при нагревании хлорной извести (хлорки).
Хлористый кальций в жидком виде (водный или технический кальций) представляет собой прозрачный (возможно слегка мутный, зеленого или желто-серого цвета) раствор.
Области применения
Благодаря своим полезным свойствам в настоящее время  хлористый кальций нашел свое применение почти во всех отраслях промышленности:
хлористый кальций нашел свое применение почти во всех отраслях промышленности:
– сельское хозяйство (для мелиорации почв, улучшения качества кормов, удобрений);
– строительство (ускоритель для загустения цемента, бетона);
– пищевая (безвредная пищевая добавка E509). В настоящее время входит в состав многих продуктов питания. Классифицируется как эмульгатор и используется как отвердитель. Применяется при изготовлении кисло-молочных продуктов (творога, кефира, сыра, брынзы, сметаны, масла, сухого молока), так как ионы калия связывают белки, он служит прекрасным загустителем продуктов. С этой целью его добавляют в мармелад, джем, желе, шоколад, консервированные фрукты и овощи, в хлебобулочные изделия);
– химическая (при производстве каучука, латекса, резинотехнических изделий);
– противогололедное средство;
– нефтяная (для увеличения нефтеотдачи, очиститель газа);
– целлюлозно-бумажная (для улучшения качества продукции);
– деревообрабатывающая (пропитка древесины для огнестойкости);
– горная (предотвращает самовозгорание угля);
– машиностроительная (антифриз).
Хлористый кальций – как лекарственный препарат
Немаловажную роль в жизнедеятельности организма играет макро и микроэлементы, среди них – хлористый кальций. В организме он находится в виде неионизированных соединений в скелетной ткани, в ионизированных – в тканевой жидкости и крови.
Хлористый кальций – синтетический лекарственный препарат, восполняющий недостаток кальция в организме. Он является «строительным материалом» для формирования внутренних органов и костной ткани, необходим для передачи нервных импульсов, сокращения мышц, свертывания крови и т.д. Его недостаток может привести к серьезным нарушениям, к рахиту, а у беременных женщин – к выкидышу.
 Хлорид кальция используется при лечении вегетососудистых заболеваний, так как он укрепляет стенки кровеносных сосудов и клеток (препятствует развитию отеков), повышает иммунитет (устойчивость организма к инфекционным заболеваниям), участвует в выработке многих ферментов, а также в процессе превращения протромбина в тромбин.
Хлорид кальция используется при лечении вегетососудистых заболеваний, так как он укрепляет стенки кровеносных сосудов и клеток (препятствует развитию отеков), повышает иммунитет (устойчивость организма к инфекционным заболеваниям), участвует в выработке многих ферментов, а также в процессе превращения протромбина в тромбин.
Кальция хлорид оказывает противовоспалительное, противоаллергическое и кровоостанавливающее действие, поэтому его применяют при лечении:
– аллергических заболеваний (крапивницы, ангионевротических отеков, бронхиальной астмы, сенной лихорадки) и аллергических реакций на лекарства;
– кожных заболеваний (псориаз, экзема);
– пневмонии;
– катаракты;
– при токсическом поражении печени;
– наружных и внутренних кровотечениях (легочных, маточных, носовых, желудочно-кишечных).
Хлорид кальция принимают внутрь или вводят внутривенно (струйно или капельно). При быстром введении данного препарата могут возникнуть побочные действия: сначала жар во рту, позже – во всем теле. Запрещается вводить его внутримышечно и подкожно, так как он может вызвать сильное раздражение и даже некроз (омертвление) тканей. Первая помощь при попадании под кожу – отсосать шприцом. Противопоказан больным, склонным к тромбозам и с повышенным содержанием кальция в крови. Применять данный лекарственный препарат нужно только по назначению врача.
Кальций хлористый купить
«Прайм Кеммикалс Групп» – это магазин химических реактивов, который предлагает широкий ассортимент лабораторного оборудования и приборов, лабораторной посуды, фильтровальной бумаги, весов электронных лабораторных для научных и производственных целей.
Цена на хлористый кальций невелика, купить его можно и под заказ.

