| Карбид кремния | |
|---|---|
 |
|
| Общие | |
| Хим. формула | SiC |
| Физические свойства | |
| Состояние | кристаллы, друзы или кристаллические порошки от прозрачного белого, жёлтого, зелёного или тёмно-синего до чёрного цветов, в зависимости от чистоты, дисперсности, аллотропных и политипных модификаций. |
| Молярная масса | 40,0962 г/моль |
| Плотность | [1] |
| Твёрдость | 9,5 |
| Энергия ионизации | 9,3 ± 0,1 эВ[2] |
| Термические свойства | |
| Температура | |
| • плавления | (с разл.) 2730 °C |
| • сублимации | 4892 ± 1 ℉[2] |
| Давление пара | 0 ± 1 мм рт.ст.[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| • в кислотах | нерастворим |
| Оптические свойства | |
| Показатель преломления | [3] |
| Классификация | |
| Рег. номер CAS | 409-21-2 |
| PubChem | 9863 |
| Рег. номер EINECS | 206-991-8 |
| SMILES |
[C-]#[Si+] |
| InChI |
InChI=1S/CSi/c1-2 HBMJWWWQQXIZIP-UHFFFAOYSA-N |
| RTECS | VW0450000 |
| ChEBI | 29390 |
| ChemSpider | 9479 |
| Безопасность | |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, в микроэлектронике (в силовых установках электроавтомобилей), для имитирующих алмаз вставок в ювелирные украшения.
Открытие и начало производства[править | править код]

Повторение эксперимента Г. Д. Раунда
О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (фр. César Despretz; 1849), Марсден (англ. Robert Sydney Marsden; 1880) и Колсон (англ. Robert Sydney Marsden; 1882 год)[4]. Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893 году. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893 года[5]. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива[6].
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах.
В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках[7].
В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году[8].
Формы нахождения в природе[править | править код]

Монокристалл муассанита (~1 мм в размере)
Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в виде небольших шестиугольных пластинчатых включений в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был назван минерал в 1905 году[9]. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество)[10].
Хоть карбид кремния и является редким веществом на Земле, он широко распространён в космосе. Это вещество встречается в пылевых облаках вокруг богатых углеродом звёзд, также его много в первозданных, не подвергшихся изменениям, метеоритах (почти исключительно в форме бета-полиморфа). Анализ зёрен карбида кремния, найденных в углеродистом хондритовом метеорите Мёрчисон, показал аномальное изотопное соотношение углерода и кремния, что указывает на происхождение данного вещества за пределами Солнечной системы: 99 % зёрен SiC образовалось около богатых углеродом звёзд, принадлежащих к асимптотической ветви гигантов[11]. Карбид кремния можно часто обнаружить вокруг таких звёзд по их ИК-спектрам[12].
Производство[править | править код]
Из-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
Синтетические кристаллы SiC ~3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору.
На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей.
Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала[13].

Чистый карбид кремния можно получить с помощью так называемого процесса Лели[en][14], в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2 см × 2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре[15]. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров[13][16].
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах.
Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику[17][18][19][20].
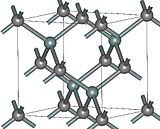
Структура и свойства[править | править код]
- Структуры основных политипов SiC
-

(β)3C-SiC
-
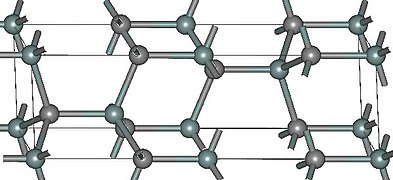
4H-SiC
-
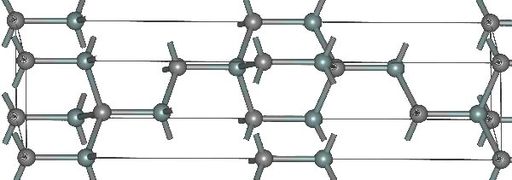
(α)6H-SiC
Известно примерно 250 кристаллических форм карбида кремния[21].
Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами.
Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем.
Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности[22].
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом.
Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C[23].
До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается. Нагревание бета-формы до температур свыше 1700 °C способно приводить к постепенному переходу кубической бета-формы в гексагональную (2Н, 4Н, 6Н, 8Н) и ромбичеcкую (15R).[24] При повышении температуры и времени процесса все образующиеся формы переходят в конечном итоге в гексагональный альфа-политип 6Н.[25]
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристаллическая структура | Кубичкская | Гексагональная | Гексагональная |
| Пространственная группа |  |
 |

|
| Символ Пирсона | cF8 | hP8 | hP12 |
| Постоянные решётки (Å) | 4,3596 | 3,0730; 10,053 | 3,0810; 15,12 |
| Плотность (г/см3) | 3,21 | 3,21 | 3,21 |
| Ширина запрещённой зоны (эВ) | 2,36 | 3,23 | 3,05 |
| МОС (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт/(см·К)) | 3,6 | 3,7 | 4,9 |
Чистый карбид кремния бесцветен. Его оттенки от коричневого до чёрного цвета связаны с примесями железа.
Радужный блеск кристаллов обусловливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя.
Карбид кремния является весьма инертным химическим веществом: практически не взаимодействует с большинством кислот, кроме концентрированных фтористоводородной (плавиковой), азотной и ортофосфорной кислот. Способен выдерживать нагревание на открытом воздухе до температур порядка 1500 °C.
Карбид кремния не плавится при любом известном давлении, но способен сублимировать при температурах свыше 1700 °C.
Высокая термическая устойчивость карбида кремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей.
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где высокая теплопроводность, высокое электрическое напряжение пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств[28], в том числе при создании сверхмощных светодиодов.
Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0⋅10−6 K−1) и в достаточно широком температурном диапазоне эксплуатации не испытывает фазовых переходов (в том числе фазовых переходов второго рода), из-за которых может произойти разрушение монокристаллов[13].
Электропроводность[править | править код]
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей.
Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия[3].
Металлическая проводимость была достигнута за счёт сильного легирования бором, алюминием и азотом.
Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К[29].
Физические свойства[править | править код]
Карбид кремния является твёрдым, тугоплавким веществом. Кристаллическая решётка аналогична решётке алмаза. Является полупроводником.[30]
- Стандартная энтальпия образования (298 К): −66,1 кДж/моль[31].
- Стандартная энергия Гиббса образования (298 К): −63,7 кДж/моль[31].
- Стандартная энтропия образования (298 К): 16,61 Дж/(моль·K)[31].
- Стандартная мольная теплоемкость (298 К): 26,86 Дж/(моль·K)[31].
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/(г·форм[прояснить])[32].
Химические свойства[править | править код]
По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленной некоторым различием в электроотрицательностях атомов Si и C, не превышает 10—12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твёрдостью. В инертной атмосфере карбид кремния разлагается только при очень высокой температуре:
.
Сильно перегретый пар разлагает карбид кремния:
.
Концентрированные кислоты и их смеси растворяют карбид кремния:
.
В присутствии кислорода щёлочи растворяют карбид кремния:
.
При нагревании реагирует с кислородом:
с галогенами:
с азотом, образуя нитрид кремния:
с активными металлами:
и их пероксидами:
.
Применение[править | править код]
Абразивные и режущие инструменты[править | править код]

Режущие диски из карбида кремния
В современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости.
В обрабатывающей промышленности из-за его высокой твёрдости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки[33].
Суспензии мелкодисперсных порошков карбида кремния в масле, глицерине или этиленгликоле используются в процессе проволочной резки полупроводниковых монокристаллов на пластины.
В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей[34].
Конструкционные материалы[править | править код]

Карбид кремния используется в качестве лицевого слоя композитной секции противопулевого бронежилета
Карбид кремния наряду с карбидом вольфрама и другими износостойкими материалами применяется для создания торцевых механических уплотнений.
В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе.
Планировалось, что разработанные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов.
Тем не менее, ни один из этих проектов не привёл к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния[35].
Подобно другим высокотвёрдым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Шкура дракона», созданном компанией Pinnacle Armor, используются диски из карбида кремния[36].
Автомотодетали[править | править код]

Углерод-керамические (карбид кремния) дисковые тормоза Porsche Carrera GT
Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод», становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе Porsche Carrera GT, Bugatti Veyron, Chevrolet Corvette ZR1, Bentley, Ferrari, Lamborghini[37]. Карбид кремния используется также в спечённых формах в дизельных фильтрах для очистки от твёрдых частиц[38][уточнить].
Электроника и электротехника[править | править код]
Первыми электрическими устройствами из SiC были нелинейные элементы варисторы и вентильные разрядники (см. также: тирит, вилит, лэтин, силит) для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита — смеси SiC и связующего. Варистор обладает высоким сопротивлением до тех пор, пока напряжение на нём не достигнет определённого порогового значения VT, после чего его сопротивление падает до более низкого уровня и поддерживает это значение, пока приложенное напряжение не упадёт ниже VT[39].
- Электронные приборы

Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, n-МОП транзисторах и в высокотемпературных тиристорах[40]. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества:
- в несколько раз большая ширина запрещённой зоны;
- в 10 раз большая электрическая прочность;
- высокие допустимые рабочие температуры (до 600 °C);
- теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия;
- устойчивость к воздействию радиации;
- стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени.
Из почти 250 модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC.
Проблемы с сопряжением элементов, основанных на диоксиде кремния, препятствуют развитию n-МОП транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро[прояснить][41].
История светодиодов из SiC весьма примечательна: впервые свечение в SiC было обнаружено Х. Роундом в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Жёлтые светодиоды из 3C-SiC были изготовлены в СССР в 1970-х годах[42], а синие (из 6H-SiC) по всему миру — в 1980-х годах[43]. Производство вскоре остановилось, потому что нитрид галлия показал в 10—100 раз более яркую эмиссию.
Эта разница в эффективности связана с неблагоприятной непрямой запрещённой зоной SiC, в то время как нитрид галлия имеет прямую запрещённую зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по-прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах[43].
Астрономия и точная оптика[править | править код]
Жесткость, высокая теплопроводность и низкий коэффициент теплового расширения делают карбид кремния термостабильным материалом в широком диапазоне рабочих температур. Это обуславливает широкое применение карбидкремниевых матриц для изготовления зеркальных элементов в различных оптических системах, например, в астрономических телескопах или в системах передачи энергии с использованием лазерного излучения. Развитие технологий (химическое осаждение паров) позволяет создавать диски из поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркал могут формироваться различными методами, включая прессование чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов (например, Gaia) уже оснащены оптикой из карбида кремния, покрытого адюминием[44][45].
Пирометрия[править | править код]

Изображения теста пирометрии. Высота пламени 7 см
Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K[46][47].
Нагревательные элементы[править | править код]
Первые упоминания об использовании карбида кремния для изготовления нагревательных элементов относятся к началу 20 века, когда они были изготовлены The Carborundum Company в США и EKL в Берлине[источник не указан 3310 дней].
В настоящее время карбид кремния является одним из типичных материалов для изготовления нагревательных элементов, способных работать при температурах до 1400 °C на воздухе и до 2000 °C в нейтральной или восстановительной среде[источник не указан 3310 дней], что заметно выше, чем доступно для многих металлических нагревателей[источник не указан 3310 дней].
Нагревательные элементы из карбида кремния используются при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т. д.[48]
Ядерная энергетика[править | править код]
Благодаря высокой устойчивости к воздействию внешних неблагоприятных факторов, включая природные, высокой прочности и твёрдости, низкому коэффициенту теплового расширения и низкому коэффициенту диффузии примесей и продуктов деления реакционноспечённый карбид кремния нашёл применение в ядерной энергетике[49].
Карбид кремния, наряду с другими материалами, используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных реакторах, в том числе в газоохлаждаемых реакторах[источник не указан 123 дня].
Из карбида кремния изготавливаются пеналы для длительного хранения и захоронения ядерных отходов[источник не указан 123 дня].
Ювелирные изделия[править | править код]
Как ювелирный камень карбид кремния используется в ювелирном деле под названием «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и твёрд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза).
Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление.
Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях.
По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления.
Муассанит имеет более низкую плотность 3,21 г/см3 (против 3,53 г/см3 для алмаза) и гораздо более устойчив к теплу.
В результате получается камень с большим блеском минерала, с чёткими гранями и хорошей устойчивостью к внешним воздействиям.
В отличие от алмаза, который горит при температуре 800 °C, муассанит остаётся неповреждённым вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота).
Муассанит стал популярен как заменитель алмаза и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зелёной или жёлтой флуоресценции в ультрафиолетовом свете[50].
Производство стали[править | править код]
Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище, чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом[51].
Катализатор[править | править код]
Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид[52][53].
Производство графена[править | править код]
Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений[54][55]. Высокая температура (2830 °C, как выше указано в реакции) приводит к разложению карбида кремния. Кремний как более летучий элемент уходит из приповерхностных слоёв, оставляя одно- или многослойный графен, нижние из которых сильно связаны с объёмным кристалом. В качестве исходного материала используют монокристаллы 6H-SiC(0001), на поверхности которых формировались террасы графена в результате термообработки с размерами около 1 мкм, разделённые областями с несколькими слоями[56].
Применение в строительстве[править | править код]
Может использоваться в качестве фибры в фибробетоне (аналогично базальтовому волокну)[57].
См. также[править | править код]
- Победит
- Муассанит
- Абразив
- Нитрид галлия
Примечания[править | править код]
- ↑ Patnaik, P. Handbook of Inorganic Chemicals (англ.). — McGraw-Hill Education, 2002. — ISBN 0070494398.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0555.html
- ↑ 1 2 Properties of Silicon Carbide (SiC) (англ.). Ioffe Institute. Архивировано 24 апреля 2012 года.
- ↑ Weimer, A. W. Carbide, nitride, and boride materials synthesis and processing (англ.). — Springer, 1997. — P. 115. — ISBN 0412540606.
- ↑ Acheson, G. (1893) U.S. Patent 492 767 «Production of artificial crystalline carbonaceous material» (англ.).
- ↑ The Manufacture of Carborundum — a New Industry (англ.) (4 July 1894). Архивировано 23 января 2009 года.
- ↑ Dunwoody, Henry H. C. (1906) U.S. Patent 837 616 «Wireless telegraph system» (silicon carbide detector) (англ.).
- ↑ Hart, Jeffrey A.; Stefanie Ann Lenway, Thomas Murtha.: A History of Electroluminescent Displays (англ.). Архивировано 24 апреля 2012 года.
- ↑ Moissan, Henri. Nouvelles recherches sur la météorité de Cañon Diablo (фр.) // Comptes rendus (англ.) (рус. : magazine. — 1904. — Vol. 139. — P. 773—786. Архивировано 2 декабря 2019 года.
- ↑ Di Pierro S. et al. Rock-forming moissanite (natural α-silicon carbide) (итал.) // American Mineralogist (англ.) (рус. : diario. — 2003. — V. 88. — P. 1817—1821. Архивировано 24 сентября 2015 года.
- ↑ Alexander C. M. O’D. In situ measurement of interstellar silicon carbide in two CM chondrite meteorites (англ.) // Nature : journal. — 1990. — Vol. 348. — P. 715—717. — doi:10.1038/348715a0.
- ↑ Jim Kelly. The Astrophysical Nature of Silicon Carbide. Архивировано 4 мая 2017 года.
- ↑ 1 2 3 Harris, Gary Lynn. Properties of silicon carbide (англ.). — United Kingdom: IEE, 1995. — 282 с. — P. 19; 170—180. — ISBN 0852968701.
- ↑ Lely, Jan Anthony. Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen (нем.) // Berichte der Deutschen Keramischen Gesellschaft : Журнал. — 1955. — H. 32. — S. 229—236.
- ↑ N. Ohtani, T. Fujimoto, T. Aigo, M. Katsuno, H. Tsuge, H. Yashiro. Large high-quality silicon carbide substrates (англ.) // Nippon Steel Technical Report. — 2001. — No. 84. Архивировано 4 марта 2012 года.
- ↑ Byrappa, K.; Ohachi, T. Crystal growth technology (англ.). — Springer, 2003. — P. 180—200. — ISBN 3540003673.
- ↑ Pitcher, M. W.; Joray, S. J.; Bianconi, P. A. Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne) (англ.) // журнал Advanced Materials. — 2004. — P. 706. — doi:10.1002/adma.200306467.
- ↑ Park, Yoon-Soo. SiC materials and devices (англ.). — Academic Press, 1998. — P. 20—60. — ISBN 0127521607.
- ↑ Bunsell, A. R.; Piant, A. A review of the development of three generations of small diameter silicon carbide fibres (англ.) // Journal of Materials Science. — 2006. — P. 823. — doi:10.1007/s10853-006-6566-z.
- ↑ Laine, Richard M. Preceramic polymer routes to silicon carbide (англ.). — Babonneau, Florence: Chemistry of Materials, 1993. — P. 260. — doi:10.1021/cm00027a007.
- ↑ Cheung, Rebecca. Silicon carbide microelectromechanical systems for harsh environments (англ.). — Imperial College Press, 2006. — P. 3. — ISBN 1860946240.
- ↑ Morkoç, H.; Strite, S.; Gao, G. B.; Lin, M. E.; Sverdlov, B.; Burns, M. Large-band-gap SiC, III-V nitride, and II-VI ZnSe-based semiconductor device technologies (англ.). — Journal of Applied Physics, 1994. — P. 1363. — doi:10.1063/1.358463.
- ↑ Muranaka, T. Superconductivity in carrier-doped silicon carbide (англ.). — Sci. Technol. Adv. Mater., 2008. — doi:10.1088/1468-6996/9/4/044204.
- ↑ Карбид кремния / под ред. Г. Хенита и Р. Рол, пер. с англ. — М.: Мир, 1972. — 349 с., с ил. — С. 119—128.
- ↑ Г. Г. Гнесин. Карбидокремниевые материалы. — М.: Металлургия, 1977. — 216 с., с ил.
- ↑ Properties of Silicon Carbide (SiC) (англ.). Ioffe Institute. Дата обращения: 6 июня 2009. Архивировано 24 апреля 2012 года.
- ↑ Yoon-Soo Park, Willardson, Eicke R. Weber. SiC materials and devices (англ.). — Academic Press, 1998. — P. 1—18. — ISBN 0127521607.
- ↑ Bhatnagar, M.; Baliga, B. J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices (англ.). — IEEE Transactions on Electron Devices, 1993. — Iss. 3. — P. 645—655. — doi:10.1109/16.199372. Архивировано 1 сентября 2010 года.
- ↑ Kriener, M. Superconductivity in heavily boron-doped silicon carbide (англ.) // Sci. Technol. Adv. Mater. : журнал. — 2008. — Iss. 9. — P. 044205. — doi:10.1088/1468-6996/9/4/044205.
- ↑ Важнейшие соединения кремния. Дата обращения: 24 мая 2010. Архивировано из оригинала 13 октября 2007 года.
- ↑ 1 2 3 4 Рабинович, В. А. Кремния карбид // Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. — Л. : Химия, 1977. — С. 74.
- ↑ А. М. Голуб. Общая и неорганическая химия = Загальна та неорганична хімія. — Вища школа, 1971. — С. 227. — 443 с. — 6700 экз.
- ↑ Fuster, Marco A. (1997) «Skateboard grip tape», U.S. Patent 5 622 759 (англ.).
- ↑ Bansal, Narottam P. Handbook of ceramic composites (англ.). — Springer, 2005. — P. 312. — ISBN 1402081332.
- ↑ Ceramics for turbine engines (англ.). Архивировано 6 апреля 2009 года.
- ↑ Dragon Skin – Most Protective Body Armor – Lightweight (англ.). Future Firepower. Архивировано 24 апреля 2012 года.
- ↑ Top 10 Fast Cars (англ.). Архивировано из оригинала 26 августа 2009 года.
- ↑ O’Sullivan, D.; Pomeroy, M. J.; Hampshire, S.; Murtagh, M. J. Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits (англ.) // MRS proceedings. — 2004. — Iss. 19. — P. 2913—2921. — doi:10.1557/JMR.2004.0373.
- ↑ Whitaker, Jerry C. The electronics handbook (англ.). — CRC Press, 2005. — P. 1108. — ISBN 0849318890.
- ↑ Bhatnagar, M.; Baliga, B. J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices (англ.) // IEEE Transactions on Electron Devices. — 1993. — Iss. 3. — P. 645—655. — doi:10.1109/16.199372. Архивировано 1 сентября 2010 года.
- ↑ Madar, Roland. Materials science: Silicon carbide in contention (англ.) // Nature : Журнал. — 2004-08-26. — Iss. 430. — P. 974—975. — doi:10.1038/430974a.
- ↑ Yellow SiC LED (англ.). Архивировано 24 апреля 2012 года.
- ↑ 1 2 Stringfellow, Gerald B. High brightness light emitting diodes (англ.). — Academic Press, 1997. — P. 48, 57, 425. — ISBN 0127521569.
- ↑ The largest telescope mirror ever put into space (англ.), European Space Agency. Архивировано 19 октября 2012 года. Дата обращения: 3 мая 2010.
- ↑ Petrovsky, G. T. 2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope (англ.) // Journal Proc. SPIE. — P. 263. Архивировано 1 октября 2017 года.
- ↑ Thin-Filament Pyrometry Developed for Measuring Temperatures in Flames (англ.), NASA. Архивировано 15 марта 2012 года. Дата обращения: 3 мая 2010.
- ↑ Maun, Jignesh D.; Sunderland, P. B.; Urban, D. L. Thin-filament pyrometry with a digital still camera (англ.) // Applied Optics. — 2007. — Iss. 4. — P. 483. — doi:10.1364/AO.46.000483. — PMID 17230239.
- ↑ Yeshvant V. Deshmukh. Industrial heating: principles, techniques, materials, applications, and design. — CRC Press, 2005. — С. 383—393. — ISBN 0849334055.
- ↑ López-Honorato, E. TRISO coated fuel particles with enhanced SiC properties (англ.) // Journal of Nuclear Materials : журнал. — 2009. — P. 219. — doi:10.1016/j.jnucmat.2009.03.013.
- ↑ O’Donoghue, M. Gems (англ.). — Elsevier. — 2006. — P. 89. — ISBN 0-75-065856-8.
- ↑ Silicon carbide (steel industry) (англ.). Архивировано 24 апреля 2012 года.
- ↑ Rase, Howard F. Handbook of commercial catalysts : heterogeneous catalysts : [англ.]. — CRC Press, 2000. — P. 258. — ISBN 0849394171.
- ↑ Singh, S. K. High surface area silicon carbide from rice husk : A support material for catalysts : [англ.] / S. K. Singh, K. M. Parida, B. C. Mohanty … [] // Reaction Kinetics and Catalysis Letters. — 1995. — Vol. 54. — P. 29–34. — doi:10.1007/BF02071177.
- ↑ de Heer, Walt A. Handbook of Nanophysics (англ.). — Epitaxial graphene: Taylor and Francis, 2010. — ISBN 1420075381. (недоступная ссылка)
- ↑ de Heer, Walt A. Epitaxial graphene (англ.) // Solid State Communications. — 2007. — P. 92. — doi:10.1016/j.ssc.2007.04.023. Архивировано 9 декабря 2008 года.
- ↑ Елецкий А. В., Искандарова И. М., Книжник А. А., Красиков Д. Н. Графен: методы получения и теплофизические свойства // Успехи физических наук. — Российская академия наук, 2011. — Т. 181. — С. 227—258. — doi:10.3367/UFNr.0181.201103a.0233. Архивировано 14 декабря 2012 года.
- ↑ 212. К. А. Сарайкина, В. А. Шаманов Дисперсное армирование бетонов // Вестник ПГТУ. Урбанистика. 2011. № 2.
Ссылки[править | править код]
- Kelly, Jim. A brief history of SiC : [арх. 19.01.2008] // Jim Kelly’s filing cabinet. — Department of Chemistry, University College London, 2005. — 15 мая. — Дата обращения: 23.06.2020.
- Карбид кремния: технология, свойства, применение / Под ред. Беляева А. Е., Конаковой Р. В. — Харьков: ИСМА, 2010. — 532 с. — ISBN 978-966-02-5445-9
- Дигонский С. В. Газофазные процессы синтеза и спекания тугоплавких веществ. — М.: ГЕОС, 2013. — 462 с.
| Карбид кремния | |
|---|---|
 |
|
| Хим. формула | SiC |
| Состояние | кристаллы, друзы или кристаллические порошки от прозрачного белого, жёлтого, зелёного или тёмно-синего до чёрного цветов, в зависимости от чистоты, дисперсности, аллотропных и политипных модификаций. |
| Молярная масса | 40.0962 г/моль |
| Плотность | |
| Твёрдость | 9.5 |
| Энергия ионизации | 9,3 ± 0,1 эВ |
| Т. плав. | (с разл.) 2730 °C |
| Т. субл. | 4892 ± 1 °F |
| Давление пара | 0 ± 1 мм рт.ст. |
| Растворимость в воде | нерастворим |
| Растворимость в кислотах | нерастворим |
| Показатель преломления | |
| ГОСТ | ГОСТ 3647-80 ГОСТ 52381-2005 ГОСТ 26327-84 |
| Рег. номер CAS | 409-21-2 |
| PubChem | 9863 |
| Рег. номер EINECS | 206-991-8 |
| SMILES |
[C-]#[Si+] |
| InChI |
1S/CSi/c1-2 HBMJWWWQQXIZIP-UHFFFAOYSA-N |
| RTECS | VW0450000 |
| ChEBI | 29390 |
| ChemSpider | 9479 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Карбид кремния (карборунд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, для имитирующих алмаз вставок в ювелирные украшения.
Содержание
- 1 Открытие и начало производства
- 2 Формы нахождения в природе
- 3 Производство
- 4 Структура и свойства
- 4.1 Электропроводность
- 4.2 Физические свойства
- 4.3 Химические свойства
- 5 Применение
- 5.1 Абразивные и режущие инструменты
- 5.2 Конструкционные материалы
- 5.3 Автомотодетали
- 5.4 Электроника и электротехника
- 5.5 Астрономия и точная оптика
- 5.6 Пирометрия
- 5.7 Нагревательные элементы
- 5.8 Ядерная энергетика
- 5.9 Ювелирные изделия
- 5.10 Производство стали
- 5.11 Катализатор
- 5.12 Производство графена
- 5.13 Применение в строительстве

Открытие и начало производства

Повторение эксперимента Г. Д. Раунда
О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год). Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива.
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году.
Формы нахождения в природе

Монокристалл муассанита (~1 мм в размере)
Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в виде небольших шестиугольных пластинчатых включений в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был назван минерал в 1905 году. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество).
Хоть карбид кремния и является редким веществом на Земле, он широко распространён в космосе. Это вещество встречается в пылевых облаках вокруг богатых углеродом звёзд, также его много в первозданных, не подвергшихся изменениям, метеоритах (почти исключительно в форме бета-полиморфа). Анализ зёрен карбида кремния, найденных в углеродистом хондритовом метеорите Мёрчисон, показал аномальное изотопное соотношение углерода и кремния, что указывает на происхождение данного вещества за пределами Солнечной системы: 99 % зёрен SiC образовалось около богатых углеродом звёзд, принадлежащих к асимптотической ветви гигантов. Карбид кремния можно часто обнаружить вокруг таких звёзд по их ИК-спектрам.
Производство
Из-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
- SiO2 + 3C →1600−2500oC SiC + 2CO

Синтетические кристаллы SiC ~ 3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе.
Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала.

Кристаллы карбида кремния, полученные благодаря процессу Лели
Чистый карбид кремния можно получить с помощью так называемого процесса Лели, в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров.
Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику.
Структура и свойства
- Структуры основных политипов SiC
Известно примерно 250 кристаллических форм карбида кремния. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности.
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C. До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается. Нагревание бета-формы до температур свыше 1700 °C способно приводить к постепенному переходу кубической бета-формы в гексагональную (2Н, 4Н, 6Н, 8Н) и ромбичекую (15R). При повышении температуры и времени процесса все образующиеся формы переходят в конечном итоге в гексагональный альфа-политип 6Н.
Карбид кремния является весьма инертным химическим веществом: практически не взаимодействует с большинством кислот, кроме концентрированных фтористоводородной (плавиковой), азотной и ортофосфорной кислот. Способен выдерживать нагревание на открытом воздухе до температур порядка 1500 °C. Карбид кремния не плавится при любом известном давлении, но способен сублимировать при температурах свыше 1700 °C. Высокая термическая устойчивость карбида кремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей.Чистый карбид кремния бесцветен. Его оттенки от коричневого до чёрного цвета связаны с примесями железа. Радужный блеск кристаллов обусловливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя.
Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где высокая теплопроводность, высокое электрическое напряжение пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств, в том числе при создании сверхмощных светодиодов. Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0⋅10−6K) и в достаточно широком температурном диапазоне эксплуатации он не испытывает фазовых переходов (в том числе фазовых переходов второго рода), из-за которых может произойти разрушение монокристаллов.
Электропроводность
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей. Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия. Металлическая проводимость была достигнута за счёт сильного легирования бором, алюминием и азотом.
Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К.
Физические свойства
Карбид кремния является твердым, тугоплавким веществом. Кристаллическая решётка аналогична решётке алмаза. Является полупроводником.
- Стандартная энтальпия образования (298 К, кДж/моль): −66,1
- Стандартная энергия Гиббса образования (298 К, кДж/моль): −63,7
- Стандартная энтропия образования (298 К, Дж/моль·K): 16,61
- Стандартная мольная теплоемкость (298 К, Дж/моль·K): 26,86
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/г·форм
Химические свойства
Карбид кремния является единственным бинарным соединением, образуемым элементами IV группы Периодической таблицы элементов Д. И. Менделеева. По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленной некоторым различием в электроотрицательностях атомов Si и C, не превышает 10—12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твердостью. В инертной атмосфере карбид кремния разлагается только при очень высокой температуре:
- SiC →2830∘C Si + C
Сильно перегретый пар разлагает карбид кремния:
- SiC + 2H2O →1300∘C SiO2 + CH4
Концентрированные окисляющие кислоты и их смеси растворяют карбид кремния:
- 3SiC + 8HNO3 ⟶ 3SiO2 + 3CO2 + 8NO + 4H2O
- 3SiC + 18HF + 8HNO3 ⟶ 3H2[SiF6] + 3CO2 + 8NO + 10H2O
В присутствии кислорода щёлочи растворяют карбид кремния:
- SiC + 4NaOH + O2 ⟶ Na4SiO4 + C + 2H2O
- SiC + 4NaOH + 2O2 →350oC Na2SiO3 + Na2CO3 + 2H2O
При нагревании реагирует с кислородом:
- 2SiC + 3O2 →950−1700∘C 2SiO2 + 2CO
-
- с галогенами:
- SiC + 2Cl2 →600−1200∘C SiCl4 + C
-
- с азотом, образуя нитрид кремния:
- 6SiC + 7N2 →1000−1400∘C 2Si3N4 + 3C2N2
-
- с активными металлами:
- 2SiC + 5Mg →700∘C 2Mg2Si + MgC2
-
- и их пероксидами:
- SiC + 4Na2O2 →700−800∘C Na2SiO3 + Na2CO3 + 2Na2O
Применение
Абразивные и режущие инструменты

Режущие диски из карбида кремния
В современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости. В обрабатывающей промышленности из-за его высокой твердости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки.
Суспензии мелкодисперсных порошков карбида кремния в масле, глицерине или этиленгликоле используются в процессе проволочной резки полупроводниковых монокристаллов на пластины.
В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей.
Конструкционные материалы

Карбид кремния используется в качестве лицевого слоя композитной секции противопулевого бронежилета
Карбид кремния наряду с карбидом вольфрама и другими износостойкими материалами применяется для создания торцевых механических уплотнений.
В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе. Планировалось, что разработанные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов. Тем не менее, ни один из этих проектов не привёл к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния.
Подобно другим высокотвердым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Кожа дракона», созданном компанией Pinnacle Armor, используются диски из карбида кремния.
Автомотодетали

Углерод-керамические (карбид кремния) дисковые тормоза Porsche Carrera GT
Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод», становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе Porsche Carrera GT, Bugatti Veyron, Chevrolet Corvette ZR1, Bentley, Ferrari, Lamborghini. Карбид кремния используется также в спечённых формах в дизельных фильтрах для очистки от твердых частиц.
Электроника и электротехника
Первыми электрическими устройствами из SiC были нелинейные элементы варисторы и вентильные разрядники (см. также: тирит, вилит, лэтин, силит) для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита — смеси SiC и связующего. Варисторы должны были обладать высоким сопротивлением до тех пор, пока напряжение на них не достигнет определённого порогового значения VT, после чего их сопротивление должно упасть до более низкого уровня и поддерживать этот уровень, пока приложенное напряжение падает ниже VT.
- Электронные приборы

Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, n-МОП транзисторах и в высокотемпературных тиристорах. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества:
- в несколько раз большая ширина запрещённой зоны;
- в 10 раз большая электрическая прочность;
- высокие допустимые рабочие температуры (до 600 °C);
- теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия;
- устойчивость к воздействию радиации;
- стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени.
Из почти двухсот пятидесяти модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC.
Проблемы с интерфейсом элементов, основанных на диоксиде кремния, препятствуют развитию n-МОП транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро.
История светодиодов из SiC весьма примечательна: впервые свечение в SiC было обнаружено Х. Роундом в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Жёлтые светодиоды из 3C-SiC были изготовлены в СССР в 1970-х годах, а синие (из 6H-SiC), по всему миру — в 1980-х. Производство вскоре остановилось, потому что нитрид галлия показал в 10—100 раз более яркую эмиссию. Эта разница в эффективности связана с неблагоприятной непрямой запрещённой зоной SiC, в то время как нитрид галлия имеет прямую запрещённую зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по-прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах.
Астрономия и точная оптика
Жесткость, высокая теплопроводность и низкий коэффициент теплового расширения делают карбид кремния термостабильным материалом в широком диапазоне рабочих температур. Это обуславливает широкое применение карбидкремниевых матриц для изготовления зеркальных элементов в различных оптических системах, например в астрономических телескопах или в системах передачи энергии с использованием лазерного излучения. Развитие технологий (химическое осаждение паров) позволяет создавать диски из поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркал могут формироваться различными методами, включая прессование чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов, например Gaia, уже оснащены оптикой из карбида кремния, покрытого серебром.
Пирометрия

Изображения теста пирометрии. Высота пламени 7 см
Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K.
Нагревательные элементы
Первые упоминания об использовании карбида кремния для изготовления нагревательных элементов относятся к началу 20 века, когда они были изготовлены The Carborundum Company в США и EKL в Берлине.
В настоящее время карбид кремния является одним из типичных материалов для изготовления нагревательных элементов, способных работать при температурах до 1400°C на воздухе и до 2000°C в нейтральной или восстановительной среде, что заметно выше, чем доступно для многих металлических нагревателей.
Нагревательные элементы из карбида кремния используются при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т. д.
Ядерная энергетика
Благодаря высокой устойчивости к воздействию внешних неблагоприятных факторов, включая природные, высокой прочности и твердости, низкому коэффициенту термического расширения и низкому коэффициенту диффузии примесей и продуктов деления реакционноспечённый карбид кремния нашёл применение в ядерной энергетике.
Карбид кремния, наряду с другими материалами, используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных реакторах, в том числе в газоохлаждаемых реакторах.
Из карбида кремния изготавливаются пеналы для длительного хранения и захоронения ядерных отходов.
Ювелирные изделия

Кольцо с синтетическим муассанитом
Как ювелирный камень карбид кремния используется в ювелирном деле: называется «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и тверд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза).
Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление. Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях. По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления. Муассанит имеет более низкую плотность 3,21 г/см³ (против 3,53 г/см³ для алмаза) и гораздо более устойчив к теплу. В результате получается камень с большим блеском минерала, с четкими гранями и хорошей устойчивостью к внешним воздействиям. В отличие от алмаза, который горит при температуре 800 °C, муассанит остаётся неповреждённым вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота). Муассанит стал популярен как заменитель алмаза, и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зелёной или жёлтой флуоресценции в ультрафиолетовом свете.
Производство стали
Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище, чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом.
Катализатор
Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид.
Производство графена
Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений. Высокая температура (1500—2000 °C) приводит к разложению карбида кремния. Кремний как более летучий элемент уходит из приповерхностных слоёв, оставляя монослойный или многослойный графен, нижние из которых сильно связаны с объёмным кристалом. В качестве исходного материала используют монокристаллы 6H-SiC(0001), на поверхности которых формировались террасы графена в результате термообработки с размерами около 1 микрона, разделённые областями с несколькими слоями.
Применение в строительстве
Может использоваться в качестве фибры в фибробетоне (аналогично базальтовому волокну).
| Карбид кремния | |
 |
|
| Общие | |
|---|---|
| Химическая формула | SiC |
| Физические свойства | |
| Состояние (ст. усл.) | от прозрачного до черного, в зависимости от чистоты |
| Молярная масса | 40.0962 г/моль |
| Плотность | 3.21[1] г/см³ |
| Термические свойства | |
| Температура плавления | (с разл.) 2730 °C |
| Химические свойства | |
| Растворимость в воде | нерастворим г/100 мл |
| Растворимость в кислотах | нерастворим г/100 мл |
| Оптические свойства | |
| Показатель преломления | 2.55[2] |
| Классификация | |
| Рег. номер CAS | 409-21-2 |
| RTECS | VW0450000 |
| Безопасность | |
| Токсичность |
0 1 0 |
Карби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, искусственные драгоценные камни.
Содержание
- 1 Открытие и начало производства
- 2 Формы нахождения в природе
- 3 Производство
- 4 Структура и свойства
- 4.1 Электропроводность
- 4.2 Физические свойства
- 4.3 Химические свойства
- 5 Применение
- 5.1 Абразивные и режущие инструменты
- 5.2 Конструкционные материалы
- 5.3 Автомобильные запчасти
- 5.4 Электроника и электротехника
- 5.5 Электронные приборы
- 5.6 Астрономия
- 5.7 Пирометрия
- 5.8 Элементы нагревания
- 5.9 Элементы ядерного топлива
- 5.10 Ювелирные изделия
- 5.11 Производство стали
- 5.12 Катализатор
- 5.13 Производство графена
- 6 См. также
- 7 Примечания
- 8 Ссылки
Открытие и начало производства

![]()
Повторение эксперимента Г. Д. Раунда
О ранних, несистематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год)[3]. Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893[4]. Ачесон также разработал электрическую печь в которой карбид кремния создается до сих пор. Он основал компанию The Carborundum Company для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива [5].
Исторически первым способом использования карбидокремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках [6]. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за желтым, зеленым и оранжевым излучением на катоде. Эти эксперименты были позже повторены О. В. Лосевым в СССР в 1923 году [7].
Формы нахождения в природе

![]()
Монокристалл муассанита (~1 мм в размере)
Природный карбид кремния — муассанит можно найти только в ничтожно малых количествах в некоторых типах метеоритов и в месторождениях корунда и кимберлита. Практически любой карбид кремния, продаваемый в мире, в том числе и в виде муассанитового украшения, является синтетическим. Природный муассанит был впервые обнаружен в 1893 году в качестве небольшого включения в метеорите Каньон Диабло в Аризоне Фердинандом Анри Муассаном, в честь которого и был назван минерал в 1905 году[8]. Исследование Муассана о естественном происхождении карбида кремния было изначально спорным, потому что его образец мог быть загрязнён крошкой карбида кремния от пилы (в то время пилы уже содержали данное вещество)[9].
Хоть карбид кремния и является редким веществом на Земле, однако, он широко распространен в космосе. Это вещество распространено в пылевых облаках вокруг богатых углеродом звезд, также его много в первозданных, не подверженных изменениям, метеоритах, почти исключительно, в форме бета-полиморфа. Анализ зёрен карбида кремния, найденных в Мерчисонском углеродистом хондритовом метеорите, выявил аномальное изотопное соотношение углерода и кремния, что указывает на происхождение данного вещества за пределами Солнечной системы: 99 % зёрен SiC образовалось около богатых углеродом звёзд принадлежащих к асимптотической ветви гигантов [10]. Карбид кремния можно часто обнаружить вокруг таких звезд по их ИК-спектрам [11].
Производство
Из-за редкости нахождения в природе муассанита, карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезема с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:
![]()
Синтетические кристаллы SiC ~ 3 мм в диаметре
Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе. Кристаллы высокой чистоты бесцветного, бледно-желтого и зеленого цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или черный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала [12].

![]()
Кристаллы карбида кремния, полученные благодаря процессу Лели
Чистый карбид кремния можно получить с помощью так называемого процесса Лели[13], в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см². Этот процесс дает высококачественные монокристаллы, в основном состоящие из 6H-SiC фазы (это связано с высокой температурой роста). Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях дает еще большие монокристаллы до 10 см в диаметре[14]. Кубический SiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров [12][15]. Чистый карбид кремния также может быть получен путем термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику [16][17][18][19].
Структура и свойства
- Структуры основных политипов SiC
-
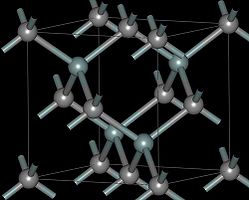
(β)3C-SiC
-
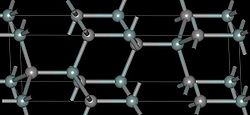
4H-SiC
-

(α)6H-SiC
Существует примерно 250 кристаллических форм карбида кремния[20]. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определенной последовательности [21].
Альфа карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита.
Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C [22]. До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако, в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается.
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристаллическая структура | Цинковая обманка (кубич.) | Гексагональная | Гексагональная |
| Пространственная группа |  |
 |
 |
| Символ Пирсона |  |
 |
 |
| Постоянные решётки (Å) |  |
 |
 |
| Плотность (г/см³) | 3.21 | 3.21 | 3.21 |
| Ширина запрещенной зоны (еВ) | 2.36 | 3.23 | 3.05 |
| МОС (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт/(см·К)) | 3.6 | 3.7 | 4.9 |
Чистый карбид кремния бесцветен. Его оттенки от коричневого до черного цвета связаны с примесями железа. Радужный блеск кристаллов обуславливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя.
Высокая температура сублимации карбидокремния (около 2700 °C) делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей. Карбид кремния не плавится при любом известном давлении. Кроме того, является весьма инертным химическим веществом.
В настоящее время существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где его высокая теплопроводность, высокое электрическое поле пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств [25]. Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0·10−6K) и он не испытывает фазовые переходы из-за которых может произойти разрушение монокристаллов[12].
Электропроводность
Карбид кремния является полупроводником, тип проводимости которого зависит от примесей. Проводимость n-типа получается при легировании азотом или фосфором, а p-тип — с помощью алюминия, бора, галлия или бериллия [2]. Металлическая проводимость была достигнута за счет сильного легирования бором, алюминием и азотом. Сверхпроводимость была обнаружена в политипах 3C-SiC:Al, 3C-SiC:B и 6H-SiC:B при одинаковой температуре — 1,5 К [26].
Физические свойства
Является твердым, тугоплавким веществом. Кристаллическая решетка аналогична решетке алмаза. Является полупроводником.[27]
- Стандартная энтальпия образования (298 К, кДж/моль): −66,1[28]
- Стандартная энергия Гиббса образования (298 К, кДж/моль): −63,7[28]
- Стандартная энтропия образования (298 К, Дж/моль·K): 16,61[28]
- Стандартная мольная теплоемкость (298 К, Дж/моль·K): 26,86[28]
- Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/г·форм[29]
Химические свойства
Карбид кремния очень устойчивое вещество и в инертной атмосфере разлагается только при очень высокой температуре:
Сильно перегретый пар разлагает карбид кремния:
Концентрированные окисляющие кислоты и их смеси растворяют карбид кремния:
В присутствии кислорода щёлочи растворяют карбид кремния:
При нагревании реагирует с кислородом:
-
- с галогенами:

-
- с азотом, образуя нитрид кремния:

-
- с активными металлами:

-
- и их пероксидами:

Применение
Абразивные и режущие инструменты

![]()
Режущие диски из карбида кремния
В современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости. В обрабатывающей промышленности из-за его высокой твердости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки[30].
В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей [31].
Конструкционные материалы

![]()
Карбид кремния используется в качестве лицевого слоя композитной секции противопулевого бронежилета
В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе. Планировалось, что разработаные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов. Тем не менее, ни один из этих проектов не привел к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния [32].
Подобно другим высокотвердым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Кожа дракона», созданном компанией Pinnacle Armor, используются диски из карбида кремния [33].
Автомобильные запчасти

![]()
Углерод-керамические (карбид кремния) дисковые тормоза Porsche Carrera GT
Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод» становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе Porsche Carrera GT, Bugatti Veyron, Chevrolet Corvette ZR1, Bentley, Ferrari, Lamborghini[34]. Карбид кремния используется также в спеченных формах в дизельных фильтрах для очистки от твердых частиц[35].
Электроника и электротехника
Первыми электрическими устройствами из SiC были нелинейные элементы вентильных разрядников для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита – смеси SiC и связующего. Также на основе карбида кремния делают варисторы.Эти элементы должны были обладать высоким сопротивлением до тех пор пока напряжение на них не достигнет определенного порогового значения VT, после чего их сопротивление должно упасть до более низкого уровня и поддерживать этот уровень, пока приложенное напряжение падает ниже VT[36].
Электронные приборы

Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, N-МОП-транзисторах и в высокотемпературных тиристорах[37]. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества:
- в несколько раз большая ширина запрещённой зоны;
- в 10 раз большая электрическая прочность;
- высокие допустимые рабочие температуры (до 600 °C);
- теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия;
- устойчивость к воздействию радиации;
- стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени.
Из почти двухсот пятидесяти модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC.
Проблемы с интерфейсом элементов основанных на диоксиде кремния препятствуют развитию N-МОП-транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро [38].
История светодиодов из SiC весьма примечательна: первые светодиоды с использованием SiC были продемонстрированы в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Желтые светодиоды из 3C-SiC были изготовлены в Советском Союзе в 1970-х годах[39], а синие (из 6H-SiC) по всему миру в 1980-х [40]. Производство вскоре остановилось, потому что нитрид галлия показал в 10-100 раз более яркую эмиссию. Эта разница в эффективности связана с неблагоприятной непрямой запрещенной зоной SiC, в то время как нитрид галлия имеет прямую запрещенную зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах[40].
Астрономия
Низкий коэффициент теплового расширения, высокая прочность, жесткость и теплопроводность делает карбид кремния нужным материалом для зеркал в астрономических телескопах. Развитие технологий (химическое осаждение паров) позволило создавать диски поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркала формируются из чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов уже оснащены оптикой из карбида кремния[41][42].
Пирометрия

![]()
Изображения теста пирометрии. Высота пламени 7 см
Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K[43][44].
Элементы нагревания
Ссылки на то, что карбид кремния использовался в нагревательных элементах существуют с начала 20-го века, когда они были изготовлены The Carborundum Company в США и EKL в Берлине. Карбид кремния помог увеличить рабочую температуру по сравнению с металлическими нагревателями. Элементы из карбида кремния используются сегодня при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т. д.[45]
Элементы ядерного топлива
Карбид кремния часто используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных газовых реакторах или в очень высокотемпературных реакторах. Карбид кремния обеспечивает механическую устойчивость к топливу и является основным барьером для диффузии продуктов деления[46].
Ювелирные изделия
![]()
Кольцо с муассанитом
Чаще всего он использовался в качестве абразива, но в последнее время можно найти применение данного вещества и в качестве полупроводника или как имитатор алмаза ювелирного качества
Как ювелирный камень карбид кремния используется в ювелирном деле: называется «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и тверд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза). Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление. Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях. По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления. Муассанит имеет более низкую плотность 3,21 г/см³ (против 3,53 г/см³ для алмаза) и гораздо более устойчив к теплу. В результате получается камень с большим блеском минерала, с четкими гранями и хорошей устойчивостью к внешним воздействиям. В отличие от алмаза, который горит при температуре 800 °C, муассанит остается неповрежденным вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота). Муассанит стал популярен как заменитель алмаза, и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зеленой или желтой флуоресценции в ультрафиолетовом свете [47].
Производство стали
Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом[48].
Катализатор
Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид[49][50].
Производство графена
Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений[51][52].
См. также
- Муассанит
- Абразив
- Нитрид галлия
Примечания
- ↑ Patnaik, P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2002. — ISBN 0070494398
- ↑ 1 2 Properties of Silicon Carbide (SiC). Ioffe Institute. Архивировано из первоисточника 24 апреля 2012.
- ↑ Weimer, A. W. Carbide, nitride, and boride materials synthesis and processing. — Springer, 1997. — P. 115. — ISBN 0412540606
- ↑ Acheson, G. (1893) U.S. Patent 492 767 «Production of artificial crystalline carbonaceous material»
- ↑ The Manufacture of Carborundum — a New Industry (4/7/1894).
- ↑ Dunwoody, Henry H.C. (1906) U.S. Patent 837 616 «Wireless telegraph system» (silicon carbide detector)
- ↑ Hart, Jeffrey A.; Stefanie Ann Lenway, Thomas Murtha A History of Electroluminescent Displays. Архивировано из первоисточника 24 апреля 2012.
- ↑ Moissan, Henri (1904). «Nouvelles recherches sur la météorité de Cañon Diablo». Comptes rendus 139: 773–86.
- ↑ Di Pierro S., Gnos E., Grobety B.H., Armbruster T., Bernasconi S.M., and Ulmer P. (2003). «Rock-forming moissanite (natural α-silicon carbide)». American Mineralogist 88: 1817–21.
- ↑ Alexander, C. M. O’D. (1990). «In situ measurement of interstellar silicon carbide in two CM chondrite meteorites». Nature 348: 715–17. DOI:10.1038/348715a0.
- ↑ «The Astrophysical Nature of Silicon Carbide».
- ↑ 1 2 3 Harris, Gary Lynn Свойства карбида кремния = Properties of silicon carbide. — United Kingdom: IEE, 1995. — 282 с. — P. 19; 170–180. — ISBN 0852968701
- ↑ Lely, Jan Anthony Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen (нем.) // Журнал Berichte der Deutschen Keramischen Gesellschaft. — 1955. — В. 32. — С. 229—236.
- ↑ N.Ohtani, T.Fujimoto, T.Aigo, M.Katsuno, H.Tsuge, H.Yashiro Large high-quality silicon carbide substrates (англ.) // Nippon Steel Technical Report no. 84. — 2001.
- ↑ Byrappa, K.; Ohachi, T. Crystal growth technology. — Springer, 2003. — С. 180-200. — ISBN 3540003673
- ↑ Pitcher, M. W.; Joray, S. J.; Bianconi, P. A. Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne) // журнал Advanced Materials. — 2004. — С. 706. — DOI:10.1002/adma.200306467
- ↑ Park, Yoon-Soo SiC materials and devices. — Academic Press, 1998. — С. 20–60. — ISBN 0127521607
- ↑ Bunsell, A. R.; Piant, A. A review of the development of three generations of small diameter silicon carbide fibres // Journal of Materials Science. — 2006. — С. 823. — DOI:10.1007/s10853-006-6566-z
- ↑ Laine, Richard M. Preceramic polymer routes to silicon carbide. — Babonneau, Florence: Chemistry of Materials, 1993. — С. 260. — DOI:10.1021/cm00027a007
- ↑ Cheung, Rebecca Silicon carbide microelectromechanical systems for harsh environments. — Imperial College Press, 2006. — С. 3. — ISBN 1860946240
- ↑ Morkoç, H.; Strite, S.; Gao, G. B.; Lin, M. E.; Sverdlov, B.; Burns, M. Large-band-gap SiC, III-V nitride, and II-VI ZnSe-based semiconductor device technologies. — Journal of Applied Physics, 1994. — С. 1363. — DOI:10.1063/1.358463
- ↑ Muranaka, T. Superconductivity in carrier-doped silicon carbide : free download. — Sci. Technol. Adv. Mater., 2008. — DOI:10.1088/1468-6996/9/4/044204
- ↑ Properties of Silicon Carbide (SiC). Ioffe Institute. Архивировано из первоисточника 24 апреля 2012. Проверено 6 июня 2009.
- ↑ Yoon-Soo Park, Willardson, Eicke R Weber SiC materials and devices. — Academic Press, 1998. — P. 1–18. — ISBN 0127521607
- ↑ Bhatnagar, M.; Baliga, B.J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices. — IEEE Transactions on Electron Devices, Март 1993. — В. 3. — С. 645–655. — DOI:10.1109/16.199372
- ↑ Kriener, M. Superconductivity in heavily boron-doped silicon carbide (английский) // Sci. Technol. Adv. Mater. : журнал. — 2008. — В. 9. — С. 044205. — DOI:10.1088/1468-6996/9/4/044205
- ↑ Важнейшие соединения кремния (рус.).(недоступная ссылка — история) Проверено 24 мая 2010.
- ↑ 1 2 3 4 Кремния карбид (рус.). Архивировано из первоисточника 24 апреля 2012. Проверено 24 мая 2010.
- ↑ А. М. Голуб Общая и неорганическая химия = Загальна та неорганична хімія. — Вища школа, 1971. — С. 227. — 443 с. — 6700 экз.
- ↑ Fuster, Marco A. (1997) «Skateboard grip tape», U.S. Patent 5 622 759
- ↑ Bansal, Narottam P. Handbook of ceramic composites. — Springer, 2005. — С. 312. — ISBN 1402081332
- ↑ Ceramics for turbine engines.
- ↑ Dragon Skin – Most Protective Body Armor – Lightweight. Future Firepower. Архивировано из первоисточника 24 апреля 2012.
- ↑ Top 10 Fast Cars.
- ↑ O’Sullivan, D.; Pomeroy, M.J.; Hampshire, S.; Murtagh, M.J. Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits // MRS proceedings. — 2004. — В. 19. — С. 2913–2921. — DOI:10.1557/JMR.2004.0373
- ↑ Whitaker, Jerry C. The electronics handbook. — CRC Press, 2005. — С. 1108. — ISBN 0849318890
- ↑ Bhatnagar, M.; Baliga, B.J. Comparison of 6H-SiC, 3C-SiC, and Si for power devices // IEEE Transactions on Electron Devices. — март, 1993. — В. 3. — С. 645–655. — DOI:10.1109/16.199372
- ↑ Madar, Roland Materials science: Silicon carbide in contention : Журнал Nature. — 2004-08-26. — В. 430. — С. 974–975. — DOI:10.1038/430974a
- ↑ Yellow SiC LED. Архивировано из первоисточника 24 апреля 2012.
- ↑ 1 2 Stringfellow, Gerald B. High brightness light emitting diodes. — Academic Press, 1997. — С. 48, 57, 425. — ISBN 0127521569
- ↑ The largest telescope mirror ever put into space, European Space Agency.
- ↑ Petrovsky, G. T. 2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope. — Журнал Proc. SPIE. — С. 263.
- ↑ Thin-Filament Pyrometry Developed for Measuring Temperatures in Flames (английский), NASA.
- ↑ Maun, Jignesh D.; Sunderland, PB; Urban, DL Thin-filament pyrometry with a digital still camera : Applied Optics. — 2007. — В. 4. — С. 483. — DOI:10.1364/AO.46.000483 — PMID 17230239.
- ↑ Yeshvant V. Deshmukh Industrial heating: principles, techniques, materials, applications, and design. — CRC Press, 2005. — С. 383–393. — ISBN 0849334055
- ↑ López-Honorato, E. TRISO coated fuel particles with enhanced SiC properties : Journal of Nuclear Materials. — 2009. — С. 219. — DOI:10.1016/j.jnucmat.2009.03.013
- ↑ O’Donoghue, M. Gems. — Elsevier. — 2006. — С. 89. — ISBN 0-75-065856-8
- ↑ Silicon carbide (steel industry) (английский). Архивировано из первоисточника 24 апреля 2012.
- ↑ Rase, Howard F. Handbook of commercial catalysts: heterogeneous catalysts. — CRC Press, 2000. — С. 258. — ISBN 0849394171
- ↑ Singh, S. K.; Parida, K. M.; Mohanty, B. C.; Rao, S. B. High surface area silicon carbide from rice husk: A support material for catalysts : Reaction Kinetics and Catalysis Letters. — 1995. — С. 29. — DOI:10.1007/BF02071177
- ↑ de Heer, Walt A. Handbook of Nanophysics. — Epitaxial graphene: Taylor and Francis, 2010. — ISBN 1420075381
- ↑ de Heer, Walt A. Epitaxial graphene : Solid State Communications. — 2007. — С. 92. — DOI:10.1016/j.ssc.2007.04.023
Ссылки
- Короткая история изучения SiC (англ.)
- Карбид кремния: технология, свойства, применение/Под ред. Беляева А.Е., Конаковой Р.В. – Харьков. “ИСМА”. 2010. – 532 с. (8,9 Mb) ISBN 978-966-02-5445-9 (рус.)
“Carborundum” redirects here. Not to be confused with Corundum.

A laboratory-grown synthetic SiC monocrystal |
|
| Names | |
|---|---|
| Preferred IUPAC name
Silicon carbide |
|
| Other names
Carborundum |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.006.357 |
| EC Number |
|
|
Gmelin Reference |
13642 |
| MeSH | Silicon+carbide |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
CSi |
| Molar mass | 40.096 g·mol−1 |
| Appearance | Yellow to green to bluish-black, iridescent crystals[1] |
| Density | 3.16 g⋅cm−3 (hex.)[2] |
| Melting point | 2,830 °C (5,130 °F; 3,100 K)[2] (decomposes) |
| Solubility | Insoluble in water, soluble in molten alkalis and molten iron[3] |
| Electron mobility | ~900 cm2/(V⋅s) (all polytypes) |
|
Magnetic susceptibility (χ) |
−12.8 × 10−6 cm3/mol[4] |
|
Refractive index (nD) |
2.55 (infrared; all polytypes)[5] |
| Hazards | |
| GHS labelling:fibres[6] | |
|
Pictograms |

|
|
Signal word |
Danger |
|
Hazard statements |
H350i |
|
Precautionary statements |
P201, P202, P260, P261, P264, P270, P271, P280, P281, P302+P352, P304+P340, P305+P351+P338, P308+P313, P312, P314, P321, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
1 0 0 |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 15 mg/m3 (total) TWA 5 mg/m3 (resp)[1] |
|
REL (Recommended) |
TWA 10 mg/m3 (total) TWA 5 mg/m3 (resp)[1] |
|
IDLH (Immediate danger) |
N.D.[1] |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Silicon carbide (SiC), also known as carborundum (), is a hard chemical compound containing silicon and carbon. A semiconductor, it occurs in nature as the extremely rare mineral moissanite, but has been mass-produced as a powder and crystal since 1893 for use as an abrasive. Grains of silicon carbide can be bonded together by sintering to form very hard ceramics that are widely used in applications requiring high endurance, such as car brakes, car clutches and ceramic plates in bulletproof vests. Large single crystals of silicon carbide can be grown by the Lely method and they can be cut into gems known as synthetic moissanite.
Electronic applications of silicon carbide such as light-emitting diodes (LEDs) and detectors in early radios were first demonstrated around 1907. SiC is used in semiconductor electronics devices that operate at high temperatures or high voltages, or both.
Natural occurrence[edit]

Moissanite single crystal (≈1 mm in size)
Naturally occurring moissanite is found in only minute quantities in certain types of meteorite, corundum deposits, and kimberlite. Virtually all the silicon carbide sold in the world, including moissanite jewels, is synthetic.
Natural moissanite was first found in 1893 as a small component of the Canyon Diablo meteorite in Arizona by Dr. Ferdinand Henri Moissan, after whom the material was named in 1905.[7] Moissan’s discovery of naturally occurring SiC was initially disputed because his sample may have been contaminated by silicon carbide saw blades that were already on the market at that time.[8]
While rare on Earth, silicon carbide is remarkably common in space. It is a common form of stardust found around carbon-rich stars, and examples of this stardust have been found in pristine condition in primitive (unaltered) meteorites. The silicon carbide found in space and in meteorites is almost exclusively the beta-polymorph. Analysis of SiC grains found in the Murchison meteorite, a carbonaceous chondrite meteorite, has revealed anomalous isotopic ratios of carbon and silicon, indicating that these grains originated outside the solar system.[9]
History[edit]
Early experiments[edit]
Non-systematic, less-recognized and often unverified syntheses of silicon carbide include:
- César-Mansuète Despretz’s passing an electric current through a carbon rod embedded in sand (1849)
- Robert Sydney Marsden’s dissolution of silica in molten silver in a graphite crucible (1881)
- Paul Schuetzenberger’s heating of a mixture of silicon and silica in a graphite crucible (1881)
- Albert Colson’s heating of silicon under a stream of ethylene (1882).[10]
Wide-scale production[edit]

Wide-scale production is credited to Edward Goodrich Acheson in 1891.[11] Acheson was attempting to prepare artificial diamonds when he heated a mixture of clay (aluminium silicate) and powdered coke (carbon) in an iron bowl. He called the blue crystals that formed carborundum, believing it to be a new compound of carbon and aluminium, similar to corundum. Moissan also synthesized SiC by several routes, including dissolution of carbon in molten silicon, melting a mixture of calcium carbide and silica, and by reducing silica with carbon in an electric furnace.
Acheson patented the method for making silicon carbide powder on February 28, 1893.[12] Acheson also developed the electric batch furnace by which SiC is still made today and formed the Carborundum Company to manufacture bulk SiC, initially for use as an abrasive.[13] In 1900 the company settled with the Electric Smelting and Aluminum Company when a judge’s decision gave “priority broadly” to its founders “for reducing ores and other substances by the incandescent method”.[14] It is said that Acheson was trying to dissolve carbon in molten corundum (alumina) and discovered the presence of hard, blue-black crystals which he believed to be a compound of carbon and corundum: hence carborundum. It may be that he named the material “carborundum” by analogy to corundum, which is another very hard substance (9 on the Mohs scale).
The first use of SiC was as an abrasive. This was followed by electronic applications. In the beginning of the 20th century, silicon carbide was used as a detector in the first radios.[15] In 1907 Henry Joseph Round produced the first LED by applying a voltage to a SiC crystal and observing yellow, green and orange emission at the cathode. The effect was later rediscovered by O. V. Losev in the Soviet Union in 1923.[16]
Production[edit]
Synthetic SiC crystals ~3 mm in diameter

Two six-inch wafers made of silicon carbide
Because natural moissanite is extremely scarce, most silicon carbide is synthetic. Silicon carbide is used as an abrasive, as well as a semiconductor and diamond simulant of gem quality. The simplest process to manufacture silicon carbide is to combine silica sand and carbon in an Acheson graphite electric resistance furnace at a high temperature, between 1,600 °C (2,910 °F) and 2,500 °C (4,530 °F). Fine SiO2 particles in plant material (e.g. rice husks) can be converted to SiC by heating in the excess carbon from the organic material.[17] The silica fume, which is a byproduct of producing silicon metal and ferrosilicon alloys, can also be converted to SiC by heating with graphite at 1,500 °C (2,730 °F).[18]
The material formed in the Acheson furnace varies in purity, according to its distance from the graphite resistor heat source. Colorless, pale yellow and green crystals have the highest purity and are found closest to the resistor. The color changes to blue and black at greater distance from the resistor, and these darker crystals are less pure. Nitrogen and aluminium are common impurities, and they affect the electrical conductivity of SiC.[19]

Synthetic SiC Lely crystals
Pure silicon carbide can be made by the Lely process,[20] in which SiC powder is sublimed into high-temperature species of silicon, carbon, silicon dicarbide (SiC2), and disilicon carbide (Si2C) in an argon gas ambient at 2500 °C and redeposited into flake-like single crystals,[21] sized up to 2 × 2 cm, at a slightly colder substrate. This process yields high-quality single crystals, mostly of 6H-SiC phase (because of high growth temperature).
A modified Lely process involving induction heating in graphite crucibles yields even larger single crystals of 4 inches (10 cm) in diameter, having a section 81 times larger compared to the conventional Lely process.[22]
Cubic SiC is usually grown by the more expensive process of chemical vapor deposition (CVD) of silane, hydrogen and nitrogen.[19][23] Homoepitaxial and heteroepitaxial SiC layers can be grown employing both gas and liquid phase approaches.[24]
To form complexly shaped SiC, preceramic polymers can be used as precursors which form the ceramic product through pyrolysis at temperatures in the range 1000–1100 °C.[25] Precursor materials to obtain silicon carbide in such a manner include polycarbosilanes, poly(methylsilyne) and polysilazanes.[26] Silicon carbide materials obtained through the pyrolysis of preceramic polymers are known as polymer derived ceramics or PDCs. Pyrolysis of preceramic polymers is most often conducted under an inert atmosphere at relatively low temperatures. Relative to the CVD process, the pyrolysis method is advantageous because the polymer can be formed into various shapes prior to thermalization into the ceramic.[27][28][29][30]
SiC can also be made into wafers by cutting a single crystal either using a diamond wire saw or by using a laser. SiC is a useful semiconductor used in power electronics.[31]
Structure and properties[edit]
|
|
|
|
| (β)3C-SiC | 4H-SiC | (α)6H-SiC |
![]()
Silicon carbide, image taken under a stereoscopic microscope.
Silicon carbide exists in about 250 crystalline forms.[32] Through inert atmospheric pyrolysis of preceramic polymers, silicon carbide in a glassy amorphous form is also produced.[33] The polymorphism of SiC is characterized by a large family of similar crystalline structures called polytypes. They are variations of the same chemical compound that are identical in two dimensions and differ in the third. Thus, they can be viewed as layers stacked in a certain sequence.[34]
Alpha silicon carbide (α-SiC) is the most commonly encountered polymorph, and is formed at temperatures greater than 1700 °C and has a hexagonal crystal structure (similar to Wurtzite). The beta modification (β-SiC), with a zinc blende crystal structure (similar to diamond), is formed at temperatures below 1700 °C.[35] Until recently, the beta form has had relatively few commercial uses, although there is now increasing interest in its use as a support for heterogeneous catalysts, owing to its higher surface area compared to the alpha form.
| Polytype | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Crystal structure | Zinc blende (cubic) | Hexagonal | Hexagonal |
| Space group | T2d-F43m | C46v-P63mc | C46v-P63mc |
| Pearson symbol | cF8 | hP8 | hP12 |
| Lattice constants (Å) | 4.3596 | 3.0730; 10.053 | 3.0810; 15.12 |
| Density (g/cm3) | 3.21 | 3.21 | 3.21 |
| Bandgap (eV) | 2.36 | 3.23 | 3.05 |
| Bulk modulus (GPa) | 250 | 220 | 220 |
| Thermal conductivity (W⋅m−1⋅K−1)
@ 300 K (see [36][37] for temp. dependence) |
320 | 348 | 325 |
Pure SiC is colorless. The brown to black color of the industrial product results from iron impurities.[38] The rainbow-like luster of the crystals is due to the thin-film interference of a passivation layer of silicon dioxide that forms on the surface.
The high sublimation temperature of SiC (approximately 2700 °C) makes it useful for bearings and furnace parts. Silicon carbide does not melt at any known temperature. It is also highly inert chemically. There is currently much interest in its use as a semiconductor material in electronics, where its high thermal conductivity, high electric field breakdown strength and high maximum current density make it more promising than silicon for high-powered devices.[39] SiC also has a very low coefficient of thermal expansion (4.0 × 10−6/K) and experiences no phase transitions that would cause discontinuities in thermal expansion.[19]
Electrical conductivity[edit]
Silicon carbide is a semiconductor, which can be doped n-type by nitrogen or phosphorus and p-type by beryllium, boron, aluminium, or gallium.[5] Metallic conductivity has been achieved by heavy doping with boron, aluminium or nitrogen.
Superconductivity has been detected in 3C-SiC:Al, 3C-SiC:B and 6H-SiC:B at similar temperatures ~1.5 K.[35][40] A crucial difference is however observed for the magnetic field behavior between aluminium and boron doping: 3C-SiC:Al is type-II. In contrast, 3C-SiC:B is type-I, as is 6H-SiC:B. Thus the superconducting properties seem to depend more on dopant (B vs. Al) than on polytype (3C- vs 6H-). In an attempt to explain this dependence, it was noted that B substitutes at C sites in SiC, but Al substitutes at Si sites. Therefore, Al and B “see” different environments, in both polytypes.[41]
Uses[edit]
Abrasive and cutting tools[edit]

Cutting disks made of SiC
In the arts, silicon carbide is a popular abrasive in modern lapidary due to the durability and low cost of the material. In manufacturing, it is used for its hardness in abrasive machining processes such as grinding, honing, water-jet cutting and sandblasting.SiC provide a much sharper and harder alternative for sand blasting as compared to Aluminium Oxide[42] Particles of silicon carbide are laminated to paper to create sandpapers and the grip tape on skateboards.[43]
In 1982 an exceptionally strong composite of aluminium oxide and silicon carbide whiskers was discovered. Development of this laboratory-produced composite to a commercial product took only three years. In 1985, the first commercial cutting tools made from this alumina and silicon carbide whisker-reinforced composite were introduced into the market.[44]
Structural material[edit]

In the 1980s and 1990s, silicon carbide was studied in several research programs for high-temperature gas turbines in Europe, Japan and the United States. The components were intended to replace nickel superalloy turbine blades or nozzle vanes.[45] However, none of these projects resulted in a production quantity, mainly because of its low impact resistance and its low fracture toughness.[46]
Like other hard ceramics (namely alumina and boron carbide), silicon carbide is used in composite armor (e.g. Chobham armor), and in ceramic plates in bulletproof vests. Dragon Skin, which was produced by Pinnacle Armor, used disks of silicon carbide.[47] Improved fracture toughness in SiC armor can be facilitated through the phenomenon of abnormal grain growth or AGG. The growth of abnormally long silicon carbide grains may serve to impart a toughening effect through crack-wake bridging, similar to whisker reinforcement. Similar
AGG-toughening effects have been reported in Silicon nitride (Si3N4).[48]
Silicon carbide is used as a support and shelving material in high temperature kilns such as for firing ceramics, glass fusing, or glass casting. SiC kiln shelves are considerably lighter and more durable than traditional alumina shelves.[49]
In December 2015, infusion of silicon carbide nano-particles in molten magnesium was mentioned as a way to produce a new strong and plastic alloy suitable for use in aeronautics, aerospace, automobile and micro-electronics.[50]
Automobile parts[edit]

The Porsche Carrera GT’s silicon carbide “carbon-ceramic” disk brake
Silicon-infiltrated carbon-carbon composite is used for high performance “ceramic” brake disks, as they are able to withstand extreme temperatures. The silicon reacts with the graphite in the carbon-carbon composite to become carbon-fiber-reinforced silicon carbide (C/SiC). These brake disks are used on some road-going sports cars, supercars, as well as other performance cars including the Porsche Carrera GT, the Bugatti Veyron, the Chevrolet Corvette ZR1, the McLaren P1,[51] Bentley, Ferrari, Lamborghini and some specific high-performance Audi cars. Silicon carbide is also used in a sintered form for diesel particulate filters.[52] It’s also used as an oil additive[dubious – discuss][clarification needed] to reduce friction, emissions, and harmonics.[53][54]
Foundry crucibles[edit]
SiC is used in crucibles for holding melting metal in small and large foundry applications.[55][56]
Electric systems[edit]
The earliest electrical application of SiC was in lightning arresters in electric power systems. These devices must exhibit high resistance until the voltage across them reaches a certain threshold VT at which point their resistance must drop to a lower level and maintain this level until the applied voltage drops below VT.[57]
It was recognized early on[when?] that SiC had such a voltage-dependent resistance, and so columns of SiC pellets were connected between high-voltage power lines and the earth. When a lightning strike to the line raises the line voltage sufficiently, the SiC column will conduct, allowing strike current to pass harmlessly to the earth instead of along the power line. The SiC columns proved to conduct significantly at normal power-line operating voltages and thus had to be placed in series with a spark gap. This spark gap is ionized and rendered conductive when lightning raises the voltage of the power line conductor, thus effectively connecting the SiC column between the power conductor and the earth. Spark gaps used in lightning arresters are unreliable, either failing to strike an arc when needed or failing to turn off afterwards, in the latter case due to material failure or contamination by dust or salt. Usage of SiC columns was originally intended to eliminate the need for the spark gap in lightning arresters. Gapped SiC arresters were used for lightning-protection and sold under the GE and Westinghouse brand names, among others. The gapped SiC arrester has been largely displaced by no-gap varistors that use columns of zinc oxide pellets.[58]
Electronic circuit elements[edit]
Silicon carbide was the first commercially important semiconductor material. A crystal radio “carborundum” (synthetic silicon carbide) detector diode was patented by Henry Harrison Chase Dunwoody in 1906. It found much early use in shipboard receivers.
Power electronic devices[edit]
In 1993 the silicon carbide was considered a semiconductor in both research and early mass production providing advantages for fast, high-temperature and/or high-voltage devices. The first devices available were Schottky diodes, followed by junction-gate FETs and MOSFETs for high-power switching. Bipolar transistors and thyristors are currently[when?] developed.[39]
A major problem for SiC commercialization has been the elimination of defects: edge dislocations, screw dislocations (both hollow and closed core), triangular defects and basal plane dislocations.[59] As a result, devices made of SiC crystals initially displayed poor reverse blocking performance, though researchers have been tentatively finding solutions to improve the breakdown performance.[60]
Apart from crystal quality, problems with the interface of SiC with silicon dioxide have hampered the development of SiC-based power MOSFETs and insulated-gate bipolar transistors. Although the mechanism is still unclear, nitriding has dramatically reduced the defects causing the interface problems.[61]
In 2008, the first commercial JFETs rated at 1200 V were introduced to the market,[62] followed in 2011 by the first commercial MOSFETs rated at 1200 V. JFETs are now available rated 650 V to 1700 V with resistance as low as 25 mΩ.[63] Beside SiC switches and SiC Schottky diodes (also Schottky barrier diode, SBD) in the popular TO-247 and TO-220 packages, companies started even earlier to implement the bare chips into their power electronic modules.
SiC SBD diodes found wide market spread being used in PFC circuits and IGBT power modules.[64]
Conferences such as the International Conference on Integrated Power Electronics Systems (CIPS) report regularly about the technological progress of SiC power devices.
Major challenges for fully unleashing the capabilities of SiC power devices are:
- Gate drive: SiC devices often require gate drive voltage levels that are different from their silicon counterparts and may be even unsymmetric, for example, +20 V and −5 V.[65]
- Packaging: SiC chips may have a higher power density than silicon power devices and are able to handle higher temperatures exceeding the silicon limit of 150 °C. New die attach technologies such as sintering are required to efficiently get the heat out of the devices and ensure a reliable interconnection.[66]
Beginning with Tesla Model 3 the inverters in the drive unit use 24 pairs of silicon carbide (SiC) MOSFET chips rated for 650 volts each. Silicon carbide in this instance gave Tesla a significant advantage over chips made of silicon in terms of size and weight. A number of automobile manufacturers are planning to incorporate silicon carbide into power electronic devices in their products. A significant increase in production of silicon carbide is projected, beginning with a large plant planned by Wolfspeed in upstate New York.[67][68]

LEDs[edit]
The phenomenon of electroluminescence was discovered in 1907 using silicon carbide and the first commercial LEDs were based on SiC. Yellow LEDs made from 3C-SiC were manufactured in the Soviet Union in the 1970s[69] and blue LEDs (6H-SiC) worldwide in the 1980s.[70]
Carbide LED production soon stopped when a different material, gallium nitride, showed 10–100 times brighter emission. This difference in efficiency is due to the unfavorable indirect bandgap of SiC, whereas GaN has a direct bandgap which favors light emission. However, SiC is still one of the important LED components: It is a popular substrate for growing GaN devices, and it also serves as a heat spreader in high-power LEDs.[70]
Astronomy[edit]
The low thermal expansion coefficient, high hardness, rigidity and thermal conductivity make silicon carbide a desirable mirror material for astronomical telescopes. The growth technology (chemical vapor deposition) has been scaled up to produce disks of polycrystalline silicon carbide up to 3.5 m (11 ft) in diameter, and several telescopes like the Herschel Space Telescope are already equipped with SiC optics,[71][72] as well the Gaia space observatory spacecraft subsystems are mounted on a rigid silicon carbide frame, which provides a stable structure that will not expand or contract due to heat.
Thin filament pyrometry[edit]

Test flame and glowing SiC fibers. The flame is about 7 cm (2.8 in) tall.
Silicon carbide fibers are used to measure gas temperatures in an optical technique called thin filament pyrometry. It involves the placement of a thin filament in a hot gas stream. Radiative emissions from the filament can be correlated with filament temperature. Filaments are SiC fibers with a diameter of 15 micrometers, about one fifth that of a human hair. Because the fibers are so thin, they do little to disturb the flame and their temperature remains close to that of the local gas. Temperatures of about 800–2500 K can be measured.[73][74]
Heating elements[edit]
References to silicon carbide heating elements exist from the early 20th century when they were produced by Acheson’s Carborundum Co. in the U.S. and EKL in Berlin. Silicon carbide offered increased operating temperatures compared with metallic heaters. Silicon carbide elements are used today in the melting of glass and non-ferrous metal, heat treatment of metals, float glass production, production of ceramics and electronics components, igniters in pilot lights for gas heaters, etc.[75]
Heat shielding[edit]
The outer thermal protection layer of NASA’s LOFTID inflatable heat shield incorporates a woven ceramic made from silicon carbide, with fiber of such small diameter that it can be bundled and spun into a yarn.[76]
Nuclear fuel particles and cladding[edit]
Silicon carbide is an important material in TRISO-coated fuel particles, the type of nuclear fuel found in high temperature gas cooled reactors such as the Pebble Bed Reactor. A layer of silicon carbide gives coated fuel particles structural support and is the main diffusion barrier to the release of fission products.[77]
Silicon carbide composite material has been investigated for use as a replacement for Zircaloy cladding in light water reactors. One of the reasons for this investigation is that, Zircaloy experiences hydrogen embrittlement as a consequence of the corrosion reaction with water. This produces a reduction in fracture toughness with increasing volumetric fraction of radial hydrides. This phenomenon increases drastically with increasing temperature to the detriment of the material.[78] Silicon carbide cladding does not experience this same mechanical degradation, but instead retains strength properties with increasing temperature. The composite consists of SiC fibers wrapped around a SiC inner layer and surrounded by an SiC outer layer.[79] Problems have been reported with the ability to join the pieces of the SiC composite.[80]
Jewelry[edit]

As a gemstone used in jewelry, silicon carbide is called “synthetic moissanite” or just “moissanite” after the mineral name. Moissanite is similar to diamond in several important respects: it is transparent and hard (9–9.5 on the Mohs scale, compared to 10 for diamond), with a refractive index between 2.65 and 2.69 (compared to 2.42 for diamond). Moissanite is somewhat harder than common cubic zirconia. Unlike diamond, moissanite can be strongly birefringent. For this reason, moissanite jewels are cut along the optic axis of the crystal to minimize birefringent effects. It is lighter (density 3.21 g/cm3 vs. 3.53 g/cm3), and much more resistant to heat than diamond. This results in a stone of higher luster, sharper facets, and good resilience. Loose moissanite stones may be placed directly into wax ring moulds for lost-wax casting, as can diamond,[81] as moissanite remains undamaged by temperatures up to 1,800 °C (3,270 °F). Moissanite has become popular as a diamond substitute, and may be misidentified as diamond, since its thermal conductivity is closer to diamond than any other substitute. Many thermal diamond-testing devices cannot distinguish moissanite from diamond, but the gem is distinct in its birefringence and a very slight green or yellow fluorescence under ultraviolet light. Some moissanite stones also have curved, string-like inclusions, which diamonds never have.[82]
Steel production[edit]
![]()
Piece of silicon carbide used in steel making
Silicon carbide, dissolved in a basic oxygen furnace used for making steel, acts as a fuel. The additional energy liberated allows the furnace to process more scrap with the same charge of hot metal. It can also be used to raise tap temperatures and adjust the carbon and silicon content. Silicon carbide is cheaper than a combination of ferrosilicon and carbon, produces cleaner steel and lower emissions due to low levels of trace elements, has a low gas content, and does not lower the temperature of steel.[83]
Catalyst support[edit]
The natural resistance to oxidation exhibited by silicon carbide, as well as the discovery of new ways to synthesize the cubic β-SiC form, with its larger surface area, has led to significant interest in its use as a heterogeneous catalyst support. This form has already been employed as a catalyst support for the oxidation of hydrocarbons, such as n-butane, to maleic anhydride.[84][85]
Carborundum printmaking[edit]
Silicon carbide is used in carborundum printmaking – a collagraph printmaking technique. Carborundum grit is applied in a paste to the surface of an aluminium plate. When the paste is dry, ink is applied and trapped in its granular surface, then wiped from the bare areas of the plate. The ink plate is then printed onto paper in a rolling-bed press used for intaglio printmaking. The result is a print of painted marks embossed into the paper.
Carborundum grit is also used in stone Lithography. Its uniform particle size allows it to be used to “Grain” a stone which removes the previous image. In a similar process to sanding, coarser grit Carborundum is applied to the stone and worked with a Levigator, then gradually finer and finer grit is applied until the stone is clean. This creates a grease sensitive surface.[86]
Graphene production[edit]
Silicon carbide can be used in the production of graphene because of its chemical properties that promote the epitaxial production of graphene on the surface of SiC nanostructures.
When it comes to its production, silicon is used primarily as a substrate to grow the graphene. But there are actually several methods that can be used to grow the graphene on the silicon carbide. The confinement controlled sublimation (CCS) growth method consists of a SiC chip that is heated under vacuum with graphite. Then the vacuum is released very gradually to control the growth of graphene. This method yields the highest quality graphene layers. But other methods have been reported to yield the same product as well.
Another way of growing graphene would be thermally decomposing SiC at a high temperature within a vacuum.[87] But this method turns out to yield graphene layers that contain smaller grains within the layers.[88] So there have been efforts to improve the quality and yield of graphene. One such method is to perform ex situ graphitization of silicon terminated SiC in an atmosphere consisting of argon. This method has proved to yield layers of graphene with larger domain sizes than the layer that would be attainable via other methods. This new method can be very viable to make higher quality graphene for a multitude of technological applications.
When it comes to understanding how or when to use these methods of graphene production, most of them mainly produce or grow this graphene on the SiC within a growth enabling environment. It is utilized most often at rather higher temperatures (such as 1300 °C) because of SiC thermal properties.[89] However, there have been certain procedures that have been performed and studied that could potentially yield methods that use lower temperatures to help manufacture graphene. More specifically this different approach to graphene growth has been observed to produce graphene within a temperature environment of around 750 °C. This method entails the combination of certain methods like chemical vapor deposition (CVD) and surface segregation. And when it comes to the substrate, the procedure would consist of coating a SiC substrate with thin films of a transition metal. And after the rapid heat treating of this substance, the carbon atoms would then become more abundant at the surface interface of the transition metal film which would then yield graphene. And this process was found to yield graphene layers that were more continuous throughout the substrate surface.[90]
Quantum physics[edit]
Silicon carbide can host point defects in the crystal lattice which are known as color centers. These defects can produce single photons on demand and thus serve as a platform for single-photon source.[91] Such a device is a fundamental resource for many emerging applications of quantum information science. If one pumps a color center via an external optical source or electrical current, the color center will be brought to the excited state and then relax with the emission of one photon.[92][93]
One well known point defect in silicon carbide is the divacancy which has a similar electronic structure as the nitrogen-vacancy center in diamond. In 4H-SiC, the divacancy has four different configurations which correspond to four zero-phonon lines (ZPL). These ZPL values are written using the notation VSi-VC and the unit eV: hh(1.095), kk(1.096), kh(1.119), and hk(1.150).[94]
Fishing rod guides[edit]
Silicon carbide is used in the manufacturing of fishing guides because of its durability and wear resistance.[95] Silicon Carbide rings are fit into a guide frame, typically made from stainless steel or titanium which keep the line from touching the rod blank. The rings provide a low friction surface which improves casting distance while providing adequate hardness that prevents abrasion from braided fishing line.[96]
Pottery Glazes[edit]
Silicon carbide is used as a raw ingredient in some glazes applied to ceramics. At high temperatures it can reduce metal oxides forming silica and carbon dioxide. This can be used to make the glaze foam and crater due to the evolved carbon dioxide gas, or to reduce the colorant oxides and achieve colors such as copper reds otherwise only possible in a fuel powered reduction firing in an electric kiln.[97]
See also[edit]
- Reaction bonded silicon carbide
- Globar
- Carborundum Universal
References[edit]
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. “#0555”. National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.88. ISBN 1-4398-5511-0.
- ^ Pubchem. “Silicon carbide”. pubchem.ncbi.nlm.nih.gov. Retrieved 2018-11-27.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.135. ISBN 1-4398-5511-0.
- ^ a b c “Properties of Silicon Carbide (SiC)”. Ioffe Institute. Retrieved 2009-06-06.
- ^ “C&L Inventory”. echa.europa.eu. Retrieved 12 December 2021.
- ^ Moissan, Henri (1904). “Nouvelles recherches sur la météorité de Cañon Diablo”. Comptes rendus. 139: 773–86.
- ^ Di Pierro S.; Gnos E.; Grobety B.H.; Armbruster T.; Bernasconi S.M. & Ulmer P. (2003). “Rock-forming moissanite (natural α-silicon carbide)”. American Mineralogist. 88 (11–12): 1817–21. Bibcode:2003AmMin..88.1817D. doi:10.2138/am-2003-11-1223. S2CID 128600868.
- ^ Kelly, Jim. “The Astrophysical Nature of Silicon Carbide”. University College London. Archived from the original on May 4, 2017. Retrieved 2009-06-06.
- ^ Weimer, A. W. (1997). Carbide, nitride, and boride materials synthesis and processing. Springer. p. 115. ISBN 978-0-412-54060-8.
- ^ Encyclopædia Britannica, eb.com
- ^ Acheson, G. (1893) U.S. Patent 492,767 “Production of artificial crystalline carbonaceous material”
- ^ “The Manufacture of Carborundum- a New Industry”. Scientific American. April 7, 1894. Archived from the original on January 23, 2009. Retrieved 2009-06-06.
- ^ Mabery, Charles F. (1900). “Notes, On Carborundum”. Journal of the American Chemical Society. XXII (Part II): 706–707. doi:10.1021/ja02048a014. Retrieved 2007-10-28.
- ^ Dunwoody, Henry H.C. (1906) U.S. Patent 837,616 Wireless telegraph system (silicon carbide detector)
- ^ Hart, Jeffrey A.; Stefanie Ann Lenway; Thomas Murtha. “A History of Electroluminescent Displays”.
- ^ Vlasov, A.S.; et al. (1991). “Obtaining silicon carbide from rice husks”. Refractories and Industrial Ceramics. 32 (9–10): 521–523. doi:10.1007/bf01287542. S2CID 135784055.
- ^ Zhong, Y.; Shaw, Leon L.; Manjarres, Misael & Zawrah, Mahmoud F. (2010). “Synthesis of Silicon Carbide Nanopowder Using Silica Fume”. Journal of the American Ceramic Society. 93 (10): 3159–3167. doi:10.1111/j.1551-2916.2010.03867.x.
- ^ a b c Harris, Gary Lynn (1995). Properties of silicon carbide. IET. p. 19; 170–180. ISBN 978-0-85296-870-3.
- ^ Lely, Jan Anthony (1955). “Darstellung von Einkristallen von Silicium Carbid und Beherrschung von Art und Menge der eingebauten Verunreinigungen”. Berichte der Deutschen Keramischen Gesellschaft. 32: 229–236.
- ^ Lely SiC Wafers. Nitride-crystals.com. Retrieved on 2013-05-04.
- ^ Ohtani, N.; et al. (2001). Nippon Steel Technical Report no. 84 : Large high-quality silicon carbide substrates (PDF). Archived from the original (PDF) on 2010-12-17.
- ^ Byrappa, K.; Ohachi, T. (2003). Crystal growth technology. Springer. pp. 180–200. ISBN 978-3-540-00367-0.
- ^ Bakin, Andrey S. (2006). “SiC Homoepitaxy and Heteroepitaxy”. In M. Shur; S. Rumyantsev; M. Levinshtein (eds.). SiC materials and devices. Vol. 1. World Scientific. pp. 43–76. ISBN 978-981-256-835-9.
- ^ AM of Ceramics from Preceramic Polymers Published in Additive Manufacturing 2019, vol. 27 pp 80-90
- ^ Europe Makes Ceramics Preceramics
- ^ a b Park, Yoon-Soo (1998). SiC materials and devices. Academic Press. pp. 20–60. ISBN 978-0-12-752160-2.
- ^ Pitcher, M. W.; Joray, S. J.; Bianconi, P. A. (2004). “Smooth Continuous Films of Stoichiometric Silicon Carbide from Poly(methylsilyne)”. Advanced Materials. 16 (8): 706–709. Bibcode:2004AdM….16..706P. doi:10.1002/adma.200306467. S2CID 97161599.
- ^ Bunsell, A. R.; Piant, A. (2006). “A review of the development of three generations of small diameter silicon carbide fibres”. Journal of Materials Science. 41 (3): 823–839. Bibcode:2006JMatS..41..823B. doi:10.1007/s10853-006-6566-z. S2CID 135586321.
- ^ Laine, Richard M.; Babonneau, Florence (1993). “Preceramic polymer routes to silicon carbide”. Chemistry of Materials. 5 (3): 260–279. doi:10.1021/cm00027a007.
- ^ “KABRA|DISCO Corporation”.
- ^ Cheung, Rebecca (2006). Silicon carbide microelectromechanical systems for harsh environments. Imperial College Press. p. 3. ISBN 978-1-86094-624-0.
- ^ Additive Manufacturing of Ceramics from Preceramic Polymers Published in Additive Manufacturing 2019, vol. 27 pp 80-90
- ^ Morkoç, H.; Strite, S.; Gao, G. B.; Lin, M. E.; Sverdlov, B.; Burns, M. (1994). “Large-band-gap SiC, III-V nitride, and II-VI ZnSe-based semiconductor device technologies”. Journal of Applied Physics. 76 (3): 1363. Bibcode:1994JAP….76.1363M. doi:10.1063/1.358463.
- ^ a b Muranaka, T.; Kikuchi, Yoshitake; Yoshizawa, Taku; Shirakawa, Naoki; Akimitsu, Jun (2008). “Superconductivity in carrier-doped silicon carbide”. Sci. Technol. Adv. Mater. 9 (4): 044204. Bibcode:2008STAdM…9d4204M. doi:10.1088/1468-6996/9/4/044204. PMC 5099635. PMID 27878021.
- ^ Silicon Carbide. Thermal properties. Ioffe Institute Semiconductors Database.
- ^ Zheng, Qiye; Li, Chunhua; Rai, Akash; Leach, Jacob H.; Broido, David A.; Cahill, David G. (2019-01-03). “Thermal conductivity of GaN, $^{71}mathrm{GaN}$, and SiC from 150 K to 850 K”. Physical Review Materials. 3 (1): 014601. doi:10.1103/PhysRevMaterials.3.014601. S2CID 139945430.
- ^ “Adept Armor – Silicon Carbide”. ADEPT. Retrieved 21 March 2023.
- ^ a b Bhatnagar, M.; Baliga, B.J. (March 1993). “Comparison of 6H-SiC, 3C-SiC, and Si for power devices”. IEEE Transactions on Electron Devices. 40 (3): 645–655. Bibcode:1993ITED…40..645B. doi:10.1109/16.199372.
- ^ Kriener, M.; Muranaka, Takahiro; Kato, Junya; Ren, Zhi-An; Akimitsu, Jun; Maeno, Yoshiteru (2008). “Superconductivity in heavily boron-doped silicon carbide”. Sci. Technol. Adv. Mater. 9 (4): 044205. arXiv:0810.0056. Bibcode:2008STAdM…9d4205K. doi:10.1088/1468-6996/9/4/044205. PMC 5099636. PMID 27878022.
- ^ Yanase, Y. & Yorozu, N. (2008). “Superconductivity in compensated and uncompensated semiconductors”. Sci. Technol. Adv. Mater. 9 (4): 044201. Bibcode:2008STAdM…9d4201Y. doi:10.1088/1468-6996/9/4/044201. PMC 5099632. PMID 27878018.
- ^ https://www.abrasivegrit.in/product/aluminum-oxide[bare URL]
- ^ Fuster, Marco A. (1997) “Skateboard grip tape”, U.S. Patent 5,622,759
- ^ Bansal, Narottam P. (2005). Handbook of ceramic composites. Springer. p. 312. ISBN 978-1-4020-8133-0.
- ^ “Production of Silicon Carbide”. siliconcarbide.net.
- ^ “Ceramics for turbine engines”. unipass.com. Archived from the original on 2009-04-06. Retrieved 2009-06-06.
- ^ “Dragon Skin – Most Protective Body Armor – Lightweight”. Future Firepower. Archived from the original on 2012-02-17. Retrieved 2009-06-06.
- ^ Abnormal Grain Growth in Journal of Crystal Growth 2012, Volume 359, Pages 83-91
- ^ “Silicon Carbide”. Ceramic Arts Daily.
- ^ UCLA researchers create exceptionally strong and lightweight new metal
- ^ “Top 10 Fast Cars”. topmost10.com. Archived from the original on 2009-03-26. Retrieved 2009-06-06.
- ^ O’Sullivan, D.; Pomeroy, M.J.; Hampshire, S.; Murtagh, M.J. (2004). “Degradation resistance of silicon carbide diesel particulate filters to diesel fuel ash deposits”. MRS Proceedings. 19 (10): 2913–2921. Bibcode:2004JMatR..19.2913O. doi:10.1557/JMR.2004.0373.
- ^ “SiC Lubrication”. Cerma.
- ^ Studt, P. (1987). “Influence of lubricating oil additives on friction of ceramics under conditions of boundary lubrication”. Wear. 115 (1–2): 185–191. doi:10.1016/0043-1648(87)90208-0.
- ^ Friedrichs, Peter; Kimoto, Tsunenobu; Ley, Lothar; Pensl, Gerhard (2011). Silicon Carbide: Volume 1: Growth, Defects, and Novel Applications. John Wiley & Sons. pp. 49–. ISBN 978-3-527-62906-0.
- ^ Brown, John (1999). Foseco Non-Ferrous Foundryman’s Handbook. Butterworth-Heinemann. pp. 52–. ISBN 978-0-08-053187-8.
- ^ Whitaker, Jerry C. (2005). The electronics handbook. CRC Press. p. 1108. ISBN 978-0-8493-1889-4.
- ^ Bayliss, Colin R. (1999). Transmission and distribution electrical engineering. Newnes. p. 250. ISBN 978-0-7506-4059-6.
- ^ Chen, H.; Raghothamachar, Balaji; Vetter, William; Dudley, Michael; Wang, Y.; Skromme, B.J. (2006). “Effects of defect types on the performance of devices fabricated on a 4H-SiC homoepitaxial layer”. Mater. Res. Soc. Symp. Proc. 911: 169. doi:10.1557/PROC-0911-B12-03.
- ^ Madar, Roland (26 August 2004). “Materials science: Silicon carbide in contention”. Nature. 430 (7003): 974–975. Bibcode:2004Natur.430..974M. doi:10.1038/430974a. PMID 15329702. S2CID 4328365.
- ^ Chen, Z.; Ahyi, A.C.; Zhu, X.; Li, M.; Isaacs-Smith, T.; Williams, J.R.; Feldman, L.C. (2010). “MOS Characteristics of C-Face 4H-SiC”. J. Of Elec. Mat. 39 (5): 526–529. Bibcode:2010JEMat..39..526C. doi:10.1007/s11664-010-1096-5. S2CID 95074081.
- ^ “At 1200 V and 45 milliohms, SemiSouth introduces the industry’s lowest resistance SiC power transistor for efficient power management”. Reuters (Press release). 5 May 2011. Archived from the original on 15 March 2016.
- ^ “SiC JFETs Archives”. United Silicon Carbide Inc. Retrieved 2021-01-11.
- ^ “Cree launches industry’s first commercial silicon carbide power MOSFET; destined to replace silicon devices in high-voltage (≥ 1200 V) power electronics” (Press release). Cree. 17 January 2011.
- ^ Meißer, Michael (2013). Resonant Behaviour of Pulse Generators for the Efficient Drive of Optical Radiation Sources Based on Dielectric Barrier Discharges. KIT Scientific Publishing. p. 94. ISBN 978-3-7315-0083-4.
- ^ Horio, Masafumi; Iizuka, Yuji; Ikeda, Yoshinari (2012). “Packaging Technologies for SiC Power Modules” (PDF). Fuji Electric Review. 58 (2): 75–78.
- ^ Barbarini, Elena (June 25, 2018). STMicroelectronics SiC Module in Tesla Model3 Inverter (PDF) (Report). SystemPlus Consulting. Archived (PDF) from the original on December 27, 2020. Retrieved September 20, 2018.
full SiC power module, in its Model 3. … STMicroelectronics … Tesla inverter … 24 1-in-1 power modules … module contains two SiC MOSFETs
- ^ Amos Zeeberg (May 16, 2022). “What’s Down the Road for Silicon?: Meet the new materials overpowering the electric economy”. The New York Times. Retrieved May 17, 2022.
- ^ Klipstein, Don. “Yellow SiC LED”. Retrieved 6 June 2009.
- ^ a b Stringfellow, Gerald B. (1997). High brightness light emitting diodes. Academic Press. pp. 48, 57, 425. ISBN 978-0-12-752156-5.
- ^ “The largest telescope mirror ever put into space”. European Space Agency. Retrieved 2009-06-06.
- ^ Petrovsky, Gury T.; Tolstoy, Michael N.; Lubarsky, Sergey V.; Khimitch, Yuri P.; Robb, Paul N.; Tolstoy; Lubarsky; Khimitch; Robb (1994). Stepp, Larry M. (ed.). “2.7-meter-diameter silicon carbide primary mirror for the SOFIA telescope”. Proc. SPIE. Advanced Technology Optical Telescopes V. 2199: 263. Bibcode:1994SPIE.2199..263P. doi:10.1117/12.176195. S2CID 120854083.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ “Thin-Filament Pyrometry Developed for Measuring Temperatures in Flames”. NASA. Archived from the original on 2012-03-15. Retrieved 2009-06-06.
{{cite news}}: CS1 maint: bot: original URL status unknown (link) - ^ Maun, Jignesh D.; Sunderland, P. B.; Urban, D. L. (2007). “Thin-filament pyrometry with a digital still camera” (PDF). Applied Optics. 46 (4): 483–8. Bibcode:2007ApOpt..46..483M. doi:10.1364/AO.46.000483. hdl:1903/3602. PMID 17230239.
- ^ Deshmukh, Yeshvant V. (2005). Industrial heating: principles, techniques, materials, applications, and design. CRC Press. pp. 383–393. ISBN 978-0-8493-3405-4.
- ^ “NASA Inflatable Heat Shield Finds Strength in Flexibility”. NASA. Archived from the original on 2022-11-10. Retrieved 2022-11-10.
{{cite news}}: CS1 maint: bot: original URL status unknown (link) - ^ López-Honorato, E.; Tan, J.; Meadows, P. J.; Marsh, G.; Xiao, P. (2009). “TRISO coated fuel particles with enhanced SiC properties”. Journal of Nuclear Materials. 392 (2): 219–224. Bibcode:2009JNuM..392..219L. doi:10.1016/j.jnucmat.2009.03.013.
- ^ Bertolino, Meyer, G. (2002). “Degradation of the mechanical properties of Zircaloy-4 due to hydrogen embrittlement”. Journal of Alloys and Compounds. 330–332: 408–413. doi:10.1016/S0925-8388(01)01576-6.
- ^ Carpenter, David; Ahn, K.; Kao, S.P.; Hejzlar, Pavel; Kazimi, Mujid S. “Assessment of Silicon Carbide Cladding for High Performance Light Water Reactors”. Nuclear Fuel Cycle Program, Volume MIT-NFC-TR-098 (2007). Archived from the original on 2012-04-25. Retrieved 2011-10-13.
- ^ Ames, Nate (June 17, 2010). “SiC Fuel Cladding”. Nuclear Fabrication Consortium, nuclearfabrication.org. Archived from the original on April 25, 2012. Retrieved 2011-10-13.
- ^ Teague, Tyler. Casting Metal Directly onto Stones, Jett Industries
- ^ O’Donoghue, M. (2006). Gems. Elsevier. p. 89. ISBN 978-0-7506-5856-0.
- ^ “Silicon carbide (steel industry)”. Archived from the original on 2012-02-04. Retrieved 2009-06-06.
- ^ Rase, Howard F. (2000). Handbook of commercial catalysts: heterogeneous catalysts. CRC Press. p. 258. ISBN 978-0-8493-9417-1.
- ^ Singh, S. K.; Parida, K. M.; Mohanty, B. C.; Rao, S. B. (1995). “High surface area silicon carbide from rice husk: A support material for catalysts”. Reaction Kinetics and Catalysis Letters. 54 (1): 29–34. doi:10.1007/BF02071177. S2CID 95550450.
- ^ “Printmaking”. Bircham Gallery, birchamgallery.co.uk. Retrieved 2009-07-31.
- ^ Ruan, Ming; Hu, Yike; Guo, Zelei; Dong, Rui; Palmer, James; Hankinson, John; Berger, Claire; Heer, Walt A. de (December 2012). “Epitaxial graphene on silicon carbide: Introduction to structured graphene” (PDF). MRS Bulletin. 37 (12): 1138–1147. doi:10.1557/mrs.2012.231. ISSN 0883-7694. S2CID 40188237.
- ^ Emtsev, Konstantin V.; Bostwick, Aaron; Horn, Karsten; Jobst, Johannes; Kellogg, Gary L.; Ley, Lothar; McChesney, Jessica L.; Ohta, Taisuke; Reshanov, Sergey A. (2009-02-08). “Towards wafer-size graphene layers by atmospheric pressure graphitization of silicon carbide”. Nature Materials. 8 (3): 203–207. Bibcode:2009NatMa…8..203E. doi:10.1038/nmat2382. hdl:11858/00-001M-0000-0010-FA05-E. ISSN 1476-1122. PMID 19202545.
- ^ de Heer, Walt A.; Berger, Claire; Wu, Xiaosong; First, Phillip N.; Conrad, Edward H.; Li, Xuebin; Li, Tianbo; Sprinkle, Michael; Hass, Joanna (July 2007). “Epitaxial graphene”. Solid State Communications. 143 (1–2): 92–100. arXiv:0704.0285. Bibcode:2007SSCom.143…92D. doi:10.1016/j.ssc.2007.04.023. ISSN 0038-1098. S2CID 44542277.
- ^ Juang, Zhen-Yu; Wu, Chih-Yu; Lo, Chien-Wei; Chen, Wei-Yu; Huang, Chih-Fang; Hwang, Jenn-Chang; Chen, Fu-Rong; Leou, Keh-Chyang; Tsai, Chuen-Horng (2009-07-01). “Synthesis of graphene on silicon carbide substrates at low temperature”. Carbon. 47 (8): 2026–2031. doi:10.1016/j.carbon.2009.03.051. ISSN 0008-6223.
- ^ Castelletto, Stefania; Johnson, Brett; Iv{‘a}dy, Viktor; Stavrias, Nicholas; Umeda, T; Gali, Adam; Ohshima, Takeshi (2014). “A silicon carbide room-temperature single-photon source”. Nature Materials. 13 (2): 151–156. Bibcode:2014NatMa..13..151C. doi:10.1038/nmat3806. PMID 24240243. S2CID 37160386.
- ^ Lohrmann, A.; Iwamoto, N.; Bodrog, Z.; Castalletto, S.; Ohshima, T.; Karle, T.J.; Gali, A.; Prawer, S.; McCallum, J.C.; Johnson, B.C. (2015). “Single-photon emitting diode in silicon carbide”. Nature Communications. 6: 7783. arXiv:1503.07566. Bibcode:2015NatCo…6.7783L. doi:10.1038/ncomms8783. PMID 26205309. S2CID 205338373.
- ^ Khramtsov, I.A.; Vyshnevyy, A.A.; Fedyanin, D. Yu. (2018). “Enhancing the brightness of electrically driven single-photon sources using color centers in silicon carbide”. NPJ Quantum Information. 4: 15. Bibcode:2018npjQI…4…15K. doi:10.1038/s41534-018-0066-2.
- ^ Davidsson, J.; Ivády, V.; Armiento, R.; Son, N.T.; Gali, A.; Abrikosov, I. A. (2018). “First principles predictions of magneto-optical data for semiconductor point defect identification: the case of divacancy defects in 4H–SiC”. New Journal of Physics. 20 (2): 023035. arXiv:1708.04508. Bibcode:2018NJPh…20b3035D. doi:10.1088/1367-2630/aaa752. S2CID 4867492.
- ^ “The best spinning rod”. Retrieved 2020-06-27.
- ^ C. Boyd Pfeiffer (15 January 2013). Complete Book of Rod Building and Tackle Making. Rowman & Littlefield. ISBN 978-0-7627-9502-4.
- ^ Hansen, Tony. “Silicon carbide”. Digital Fire. Retrieved 30 April 2023.
External links[edit]
![]()
- Kelly, J.F. “A Brief History of Silicon Carbide”. University of London.
- “Moissanite”. Mindat.org.
- “Silicon carbide”. NIOSH Pocket Guide to Chemical Hazards.
- Mantooth, Alan; Zetterling, Carl-Mikael; Rusu, Ana (28 April 2021). “The Radio We Could Send to Hell: Silicon carbide radio circuits can take the volcanic heat of Venus”. IEEE Spectrum.
- Asianometry (July 2022). “Silicon Carbide: A Power Electronics Revolution”. YouTube.
Что представляет собой Карборунд
Карборунд – это коммерческое и техническое название синтетического соединения, свойства и состав которого аналогичны натуральному камню муассаниту. То есть по сути это синтетический муассанит.
Это плотный материал разной степени прозрачности, результат сплавления песка с углем.
Внешне выглядит как антрацит, в основном черной гаммы. Есть экземпляры зеленого, голубого, фиолетового, синего цвета.
На свету камень переливается подобно радуге, создавая на поверхности причудливые узоры.
Карборунд: что это такое?
На самом деле, камень, созданный по велению небес, имеет природное происхождение, но встречается там в очень мизерных количествах. Карборунд, на языке ученых называемый карбидом кремния, имеет вид бесцветных, переливчатых кристаллов с алмазным блеском.
Итак, карборунд относится ко классу полупроводникового бинарного химического соединения, состоит из кремния и углерода, обозначается химической формулой SiC.
Этот материал очень тугоплавок и прочен. По сравнению с муассанитом, даже сам бриллиант, тихонечко отдыхает в сторонке. По прочности карборунд уступает пальму первенства лишь алмазу и боразону.
Природное происхождение карборунда
Уникальное, на диво прекрасное слияние кремния и углерода породило появление на свет блистательного минерала с легким оттеночным алмазным сиянием, это зрелище Богов, которое берет за душу своей непреклонной хрупкостью, удивительной нежностью и ангельской глубиной красоты.
В природе горстки мелких камушков – карбида кремния, распространены в очень малых количествах, поэтому крупные залежи найти не удалось. А почему не удалось – загадка века, над которой ломают головы все ученые.
Искусственное происхождение карборунда
Ювелирное искусство во все времена вызывало интерес у всех слоев населения. Чистый, радужный, наивный блеск драгоценностей будоражил сердце, заставляя его колотиться в сто крат сильнее, люди, как вороны, тянулись к тому, что сверкает и блестит.
И вот в 20 веке, на счастье народа, появился самый блестящий камень на планете – муассанит, от природы сам по себе очень красив, но какова красота усовершенствованного камня – просто ошеломительна!
Искусственный муассанит – это уникальное в своем роде сочетание истинного искусства и науки. В настоящее время на обработке карборунда специализируется всего одна-единственная компания в мире под названием Charles&Colvard.
Весь процесс происходит на новейшем высокотехнологичном оборудовании, специалисты внимательно следят за стадией роста камня, поэтому в структуре данного минерала нет ни единого изъяна! В результате в свет вышла новинка, произведенная по запатентованной технологии, эта новинка по красоте бьет все рекорды, это минерал наивысочайшего качества, который запечатлен в сердцах миллионов людей надолго.
Легендарный муассанит с его глубокой игрой света на гранях – один из самых благородных минералов в ювелирной коллекции, муассанит переливается самыми чистыми оттенками на свете, благодаря этому достигается уникальная внутренняя его красота, несравнимая с красотой любого другого камня на свете.
Глубокие ценители утонченности и эстетической красоты – ювелиры и коллекционеры, говорят о минерале, как о «венце творения»! Этот камень настолько хрупок, чист и священен, насколько это только можно! Это камень на миллион!
История
Способ получения данного соединения известен еще с середины 19 века, но запатентован только в 1893 году Эдвардом Ачесоном.
До 2020 года все права на производство принадлежали США. Сегодня главный поставщик карборунда фабричного происхождения на мировой рынок – Китай. Всего создано две с половиной сотни кристаллических модификаций разных цветов. Разработана технология для ювелирной промышленности: камни покрывают специальной пленкой, из-за чего даже тестеры не могут отличить кристалл от настоящего бриллианта.
Открытие и начало производства
Повторение эксперимента Г. Д. Раунда
О ранних, не систематических и часто непризнанных синтезах карбида кремния сообщали Деспретз (1849), Марсден (1880) и Колсон (1882 год)[4]. Широкомасштабное производство начал Эдвард Гудрич Ачесон в 1893. Он запатентовал метод получения порошкообразного карбида кремния 28 февраля 1893[5]. Ачесон также разработал электрическую печь, в которой карбид кремния создаётся до сих пор. Он основал компанию The Carborundum Company
для производства порошкообразного вещества, которое первоначально использовалось в качестве абразива[6].
Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках[7]. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевым в СССР в 1923 году[8].
Физико-химические характеристики
По химической классификации карборунд – это карбид кремния с простой формулой.

Тверже него только алмаз. Карборунд плотен, тугоплавок, равнодушен к истиранию, кислотам, прочим агрессивным веществам.
Карбид кремния:
- Плотность 3,05 г/см³.
- Состав 93 % карбида кремния.
- Предел прочности на изгиб 320…350 МПа.
- Предел прочности на сжатие 2300 МПа.
- Модуль упругости 380 ГПа.
- Твердость 87…92 HRC.
- Трещиностойкость в пределах 3.5 — 4.5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 140—200 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 3,5…4,0 К−1⋅10−6.
- Вязкость разрушения 3,5 МПа·м1/2.
Самосвязанный карбид кремния:
- Плотность 3,1 г/см³.
- Состав 99 % карбида кремния.
- Предел прочности на изгиб 350—450 МПа.
- Предел прочности на сжатие 2500 МПа.
- Модуль упругости 390—420 ГПа.
- Твердость 90…95 HRC.
- Трещиностойкость в пределах 4 — 5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 80 — 130 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 2,8…4 К−1⋅10−6.
- Вязкость разрушения 5 МПа·м1/2.
ВК6ОМ:
- Плотность 14,8 г/см³.
- Состав Карбид вольфрама.
- Предел прочности на изгиб 1700…1900 МПа.
- Предел прочности на сжатие 3500 МПа.
- Модуль упругости 550 ГПа.
- Твердость 90 HRA.
- Трещиностойкость в пределах 8-25 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 75…85 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,5 К−1⋅10−6.
- Вязкость разрушения 10…15 МПа·м1/2.
Силицированный графит СГ-Т:
- Плотность 2,6 г/см³.
- Состав 50 % карбида кремния.
- Предел прочности на изгиб 90…110 МПа.
- Предел прочности на сжатие 300…320 МПа.
- Модуль упругости 95 ГПа.
- Твердость 50…70 HRC.
- Трещиностойкость в пределах 2-3 МПа·м1/2.
- Коэффициент теплопроводности при 10 °C, 100…115 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,6 К−1⋅10−6.
- Вязкость разрушения 3…4 МПа·м1/2.
Однако лучи света камень преломляет сильнее алмаза, по этому параметру сопоставим с муассанитом.
Где используется
Прочностные и эстетические кондиции обусловили широкую востребованность синтетического камня:
- В строительстве он нашел применение как материал внутренней и наружной отделки помещений, добавка в базовый состав дорожного покрытия.
- В промышленности это абразивы, бронированные сорта стали для армии, полупроводники для электротехники, катализаторы для металлургии и химической промышленности.
- Для научных потребностей используется как оптика (например, линзы микро- и телескопов).
По особой технологии изготавливается ювелирная разновидность кристаллов.
Стоимость
В России можно купить ювелирные украшения и коллекционный материал из карборунда. Цена не запредельна (тыс. руб.):
- кольца, подвески (серебро) – 4-10;
- браслеты, колье (серебро) – 10-15;
- необработанные самородки (Китай, 8-55 г) – 0, 6-1,1.
В Италии, возле вулкана Везувий, как карборунд туристам продают его застывшую лаву.

Магические свойства
Установлено, что магические свойства карборунда позитивно отражаются на душевном состоянии человека:
- Камень символизирует материальное благополучие, притягивает деньги.
- Его влияние и помощь почувствует человек, который желает, но не способен побороть лень или не знает, как одолеть страх на пути к цели.
- Кристалл голубого цвета подходит стремящимся обрести сексуальную притягательность или стать умнее.
Магия карборунда дарит душевное равновесие, защищает от внешнего негатива, привносит спокойствие в дом.
Однако носить украшения или необработанный камень при себе постоянно не нужно: это чревато стрессом либо бессонницей.
Структура и свойства
Многие с уверенностью ответят, что сапфир и рубин — два разных камня, не имеющих ничего общего между собой. Но благодаря развитию науки стало известно, что это одна группа минералов, которая носит название корунд. Самостоятельные названия прижились благодаря ювелирам.

Конечно же, проще именовать каждый по отдельности, но научное разграничение от этого не меняется.
В химических определениях корунд является оксидом алюминия. Минерал имеет серую окраску и это довольно частое явление.
Настоящим сокровищем является кристально чистый корунд, но он встречается в природе крайне редко. Именно поэтому его ценят ювелиры, такой минерал поддается окраске практически в любые цвета.
Корунд уже не один век известен человечеству. Известно, что в Древнем Египте и Иерусалиме были популярны украшения из корундов. Позднее они попали в Индию и там обрели настоящую популярность.
Предлагаем ознакомиться Ювелирный камень Ситалл: что это такое, особенности
Рубин и сапфир, это два самых популярных вида корунда. Камни признаны очень ценными.
- Рубин относят к прозрачным корундам, которые имеют насыщенный алый оттенок. Интенсивность цвета колеблется, но, разумеется, самой дорогой считается темно-вишневая гамма.
- Сапфир не уступает рубину в цене, но имеет оттенок от бледно-синего до глубокого. Однако, сапфир имеет подгруппы редких цветов: желтые, оранжевые, розовые. Такие сапфиры стали называть фантазийными.
- Лейкосапфир, имеет абсолютную прозрачность, вероятно именно эта особенность подарила ему сравнение с алмазом.
- Падпараджа, по названию угадывается Индия, там эту разновидность очень ценят. Цвет находится в пределах желтого и оранжевого.
- Хлорсапфир, причудливое название, а между тем его часто сравнивают с изумрудом, а все благодаря интенсивной зеленой окраске.
Природная прелесть самоцвета не даёт оторвать от него глаз. Твёрдость, прозрачность кристалла поднимает его до уровня алмаза и бриллианта.
Мощные, властные и таинственные магические свойства кристалла вызывают преклонение перед его силой. Многообразие цветовой палитры и названий показывает уровень его широкой популярности с глубокой древности до сегодняшнего дня.
Корунд – это драгоценный минерал. По твёрдости камень следует за алмазом. Расцветки минерала зависят от примесей (ванадия, хрома, железа). В зависимости от их присутствия, самоцвет приобретает оранжевые, желтоватые, преимущественно красные и синие оттенки.
Он известен человечеству под различными названиями. Часть из них получена от указания на местность, где его добывали:
- восточный (хризолит, топаз, изумруд, гиацинт, аметист, алмаз, аквамарин);
- старорусское название разновидностей самоцвета – «яхонт»;
- бенгальский аметист;
- в металлообработке минерал называют наждаком.
Корунд радует человечество неземной красотой с далёкой древности. Роскошные ювелирные изделия украшали женщин Древнего Египта и Иерусалима. Их изысканность и утончённость хорошо известны Индии, где драгоценный камень приобрёл популярность.
Рубины и сапфиры являются кристаллами оксида алюминия, добываемые в природе:
- в виде кристаллических групп;
- вкраплений;
- зёрен.
В Европе камень появился из Южной Азии и Индии, где его добывали. Он широко применялся во многих сферах человеческой деятельности:
- В машиностроении используют прочные стекла для приборов из сапфира.
- В металлообработке Корунд используют как наждак.
- Для научного мира это оксид алюминия.
- Ювелиры из минерала создают роскошные украшения.
Влюблённые в самоцвет за необычайное многообразие цветовой гаммы, чистоту линий, они с глубокой древности изготавливали из минерала великолепные украшения:
- Выше алмаза на ювелирном рынке ценится красный Корунд, носящий имя «Рубин».
- По совершенству бледно-голубого сияния и сложной пирамидальной огранке рубин превосходит сапфир с чарующим названием «Голубая принцесса» весом в 114 карат (22,8 г). Драгоценность принадлежит ювелирному дому Голландии.
- Чистота голубой окраски сапфировых кабошонов с ярко проявляющимся астеризмом (звезда с шестью лучами) издавна является предметом даров и обменов. Хорошим тоном в высшей дипломатии считается преподнесение властителю сопредельного государства синего или красного Корунда.
- Свыше 31 карата в восьмиугольной сапфировой розе, хранящейся коллекции Великобритании. Ювелирное изделие в ХVII веке было достоянием сэра Ганса Слоан, английского просветителя.
Корунды крупных размеров считаются редкостью. Известно, что в США из сапфиров большого размера среднего качества выполнили портреты президентов. Музеи естествознания мира хранят друзы кристаллов Корунда до нескольких десятков кг.
Месторождения
Камень добывается во многих странах мира. К главным месторождениям относят:
- Россия (Кольский полуостров, Карелию, Урал, Челябинскую область), Красноярский край.
- США.
- Норвегию.
- Канаду.
- Грецию.
- Мадагаскар.
- Таиланд.
- Бирму.
- Шри-Ланка.
- Индию.
Он располагается гнёздами, сланцами, вкраплениями, жилами. К недавним находкам самоцветов относится крупное месторождение Казахстана.
Физические свойства

Природный камень добывают в вулканических породах, содержащих небольшое количество кремнезёма, в виде:
- мелкозернистых масс;
- агрегатов (зернистых и плотных);
- вкраплений и зёрен;
- групп, а также отдельных кристаллов.
Ювелирные минералы встречают в россыпях.
ПараметрыСвойства
| Формула | AI2O2 |
| Сингония | Тригональная. |
| Блеск | Стеклянный, матовый. |
| Температура плавления | 2050°C |
| Плотность | 3,9–4,1 г/см³ |
| Излом | Неровный. |
| Твёрдость | 9 |
| Прозрачность | Непрозрачный, бывают и прозрачным. |
| Цвет | Голубой, розовый, коричневый, красный, жёлтый, серый. |
Целебный камень Корунд обладает позитивным влиянием на здоровье человека. Обычно связывают с влиянием прозрачных разновидностей Корунда (рубина и сапфира) исцеление от многих заболеваний, которые лечатся при помощи кристалла определённого цвета:
- Оказывает благотворное воздействие на органы пищеварения, печень и почки.
- Облегчает боль в спине, которую вызывает остеохондроз, способствует излечению суставов и позвоночника.
- Синий цвет оказывает благотворное влияние на излечение органов зрения.
- Красный Корунд снижает артериальное давление, помогает исцелить болезни сердца, системы кровообращения.
- Фиолетовый самоцвет оказывает положительное влияние при шизофрении, ночных кошмарах, бессоннице, депрессии, заболеваниях нервной системы.
Предлагаем ознакомиться Золотая лихорадка — это… Что такое, история приисков в Сибири, Калифорнии (США), Бразилии, Клондайке || Золотая лихорадка что это такое
Магические свойства
С древности магический камень корунд наделялся силой воздействия против бед. На его помощь могут рассчитывать целеустремлённые люди. Нерасторопным (малоподвижным, медлительным) камень носить не желательно, поскольку энергетика самоцвета может навредить им из-за несовместимости.
Кристалл имеет свойство к побуждению внутреннего потенциала. Если владелец самоцвета проявит интерес, приложит усилия к достижению цели, кристалл поможет достичь её. Камень наделен позитивным влиянием на людей:
- Ему свойственна способность снимать депрессии и страхи, придавать смелости. Он повышает чувство собственного достоинства.
- У кольца с кристаллом есть свойство раскрывать ранее неизвестные таланты.
- Серьги с самоцветом помогут установить гармоничные отношения с жизнью. Издавна считается, что украшения в ушах, нашёптывают своему владельцу правильное решение.
- Ожерелья, кулоны, бусы несут спокойствие.
- Кристалл приводит к успеху.
В старину камень носили люди, занимающиеся умственным трудом. Сегодня специалисты советуют носить его аналитикам, студентам, всем, кто нуждается в логике и концентрации внимания.
Маги считают, что между владельцем и кристаллом устанавливается неразрывная связь. Обе стороны стремятся к одной цели:
- Владелец создаёт стремления к достижению целей, питает ими самоцвет.
- Кристалл отдаёт хозяину свою энергетику, направленную на исполнение желаемого.
При таком сочетании энергий, их обмене позитивная энергия обеих сторон способствует достижению задуманного. В этом сила кристалла, помогающая ему освободить своего владельца от просчётов, неудач. Если кристалл имеет нужный цвет, правильно расположен на теле, удача будет сопутствовать его обладателю во всем.

Драгоценными, пригодными к изготовлению ювелирных украшений считаются прозрачные кристаллы (сапфир и рубин). Популярно применение самоцвета в изготовлении украшений. Выглядит камень очень скромно.
У него серая окраска, поэтому особо ценятся редко встречающиеся кристально прозрачные образцы. У кристалла есть прекрасное свойство, окрашиваться почти во все оттенки. Отдельные самоцветы имеют природные цвета:
- белые;
- синие;
- красные;
- жёлтые.
Популярные вставки для ювелирных украшений изготавливаются из сапфиров и рубинов. Цена зависит от прозрачности, цвета, обрамления. Дешевле других стоят украшения с коричневыми Корундом.
Цена украшений складывается из качества, цены кристаллов, драгоценных металлов, вставок других драгоценностей. Стоимость украшений примерная, точные данные можно получить в регионе продаж.
Минерал имеет разновидности:
- Наждак – порода с примесями гематита и магнетита серого цвета с чёрным оттенком.
- Обыкновенный Корунд минерал (непрозрачный), имеющий серый оттенок. Усыпан крупными кристаллами.
- Лейко сапфир – драгоценный камень, имеющий доступную цену, прозрачный, не имеющий цвета, чем обязан сравнению с алмазом.
- Драгоценный камень с эффектом астеризма «Звездчатый рубин».
- Жёлтый или оранжевый с жёлтым Корунд с индийским названием «Падпараджа» получил свою окраску, благодаря присутствию в составе никеля и окиси железа.
- Сапфир, синий (голубой) по окраске. Это драгоценный камень, имеющий первую категорию ювелирной ценности (но значительно ниже рубина). Это «Синий яхонт». У минерала бывают редкие оттенки (розовые, оранжевые, жёлтые). Они возникают, благодаря присутствию железа и титана. Ювелирной ценности не имеют светлые и тёмные образцы, поэтому стоят дешёво. К ним относят:
- индиго – тёмно-синий кристалл;
- у восточного аметиста фиолетовый цвет;
- у восточного изумруда зелёный цвет.
- Рубин имеет первую категорию, относится к драгоценным камням. У него насыщенный красный оттенок. К наиболее дорогим самоцветам относят вишнёвые кристаллы. Цена на прозрачные, хорошо окрашенные образцы поднимается выше, чем у алмаза и бриллианта. Спрос на ювелирные изделия с рубиновыми вставками в десятки раз выше, чем на сапфир, но камни с коричневыми оттенками ценятся значительно ниже.
- При термической обработке сырья с высоким содержанием глины производят синтетический Рубин. Производятся украшения с камнем из искусственного рубина в большом количестве. Цена на такие изделия значительно ниже, чем на натуральный камень.
Благодаря камню можно избавиться от приступов лени и устранить страхи, которые мешают достижению целей.

![{displaystyle {ce {SiO2{}+3C->[1600{-}2500~^{circ }{text{C}}]SiC{}+2COuparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c850507c7e35d44f814a1f97b995ef265f9ea254)



![{displaystyle {ce {2SiC{}+3O2->[950{-}1700~^{circ }{text{C}}]2SiO2{}+2COuparrow ,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/801156f136f9a480422a0e4281efbb1ee2716dad)
![{displaystyle {ce {SiC{}+2Cl2->[600{-}1200~^{circ }{text{C}}]SiCl4{}+C,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/35446bc6497525a80837c011b87ac3e324ef5f51)
![{displaystyle {ce {6SiC{}+7N2->[1000{-}1400~^{circ }{text{C}}]2Si3N4{}+3C2N2,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f6be86f43830f2c2ff0799faa2e6aa051d78f187)
![{displaystyle {ce {2SiC{}+5Mg->[700~^{circ }{text{C}}]2Mg2Si{}+MgC2,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7d6f86ead148db02b402da65767d1b6b147809e)







![~mathsf{3SiC + 18HF + 8HNO_3 longrightarrow 3H_2[SiF_6] + 3CO_2 + 8NO + 10H_2O}](https://dic.academic.ru/dic.nsf/ruwiki/4a33d3d9b7b9c18a366ea94904f51ad3.png)