Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 апреля 2022 года; проверки требуют 6 правок.
| Карбонат аммония | |
|---|---|
 |
|
 |
|
| Общие | |
| Традиционные названия | Углекислый аммоний |
| Хим. формула | (NH4)2CO3 |
| Физические свойства | |
| Состояние | Твёрдое |
| Плотность | 1,6 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 60 °C |
| Химические свойства | |
| Растворимость | |
| • в воде |
растворим (0 °C) 100,1 (15 °C) Разл. (100 °C) |
| Классификация | |
| Рег. номер CAS | 506-87-6 |
| PubChem | 10480 |
| Рег. номер EINECS | 208-058-0 |
| SMILES |
C(=O)(O)O.N.N |
| InChI |
InChI=1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 PRKQVKDSMLBJBJ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E503(i) и E503 |
| ChemSpider | 10048 |
| Безопасность | |
| NFPA 704 |
0 0 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Карбона́т аммо́ния (углеки́слый аммо́ний, химическая формула — (NH4)2CO3 — аммониевая соль угольной кислоты.
При стандартных условиях, карбонат аммония — это бесцветные, или белые кристаллы, хорошо растворимые в воде.
Физические свойства[править | править код]
Бесцветные кристаллы соединения хорошо растворимы в воде. Не образует кристаллогидратов.
Химические свойства[править | править код]
- Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония (NH4HCO3). При температуре 60 °C быстро распадается на аммиак, углекислый газ и воду:
- Подвергается гидролизу:
- Разлагается кислотами и концентрированными щелочами[1]:
Применение[править | править код]
На процессе разложения, связанном с выделением газов, основано применение карбоната аммония в качестве разрыхлителя в хлебопечении и кондитерской промышленности (пищевая добавка Е503). Получают карбонат аммония взаимодействием газообразных 




Карбонат аммония применяется для получения сульфата аммония из гипса по реакции
При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные 





Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение.
Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
- в качестве компонента раствора чистки стволов огнестрельного оружия (РЧС)
- в качестве азотного удобрения в сельском хозяйстве
Примечания[править | править код]
- ↑ Лидин, 2000, с. 141.
- ↑ Фосфогипс. Справочник стройматериалов. Суперсептик.Ру. Архивировано 5 июля 2010 года.
Литература[править | править код]
- Кнунянц И. Л. и др. т.1 А-Дарзана // Химическая энциклопедия. — М.: Советская энциклопедия, 1988. — 623 с. — 100 000 экз.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Определение и формула
Неорганическое химическое соединение, являющееся солью гидроксида аммония и угольной кислоты.
Альтернативное название – углекислый аммоний.
Формула
(NH4)2CO3.
Получение
Соединение синтезируют преимущественно химическим путем. Получение из натуральных ингредиентов утратило актуальность.
Естественные источники получения
До расцвета химической промышленности для получения углекислого аммония использовались вещества натурального происхождения, содержащие в составе азот, – ногтевые платины, волосы, костные выросты, рога. Они подвергались высокотемпературной дистилляции. В настоящее время способ устарел.
Искусственные источники получения
В лабораторных условиях и промышленности карбонат аммония получают тремя способами:
- Путем разложения хлористого аммония.
- При пропускании углекислого газа через водный раствор аммиака.
- При смешивании газообразного аммиака, водяных паров и углекислого газа.
Свойства карбоната аммония
Физические свойства соединения
Углекислый аммоний – это белое кристаллическое вещество, отлично растворимое в воде. И твердая форма, и водные растворы на воздухе не устойчивы. Они быстро разлагаются на составляющие компоненты. В ходе реакции улетучивается аммиак и остается кислая соль – гидрокарбонат аммония NH4HCO3.
| Свойство | Описание |
|---|---|
| плотность | 1,6 г/см³ |
| молярная масса | 96 г/моль |
| температура разложения | 60°C |
| растворимость в воде | 100,1 (15°C) |
Химические свойства
Карбонат аммония демонстрирует свойства, характерные для своего класса соединений.
- Подвергается гидролизу по катиону и аниону как соль, образованная слабым основанием и слабой кислотой.
(NH4)2CO3+ HOH ↔ NH4CO3 + NH4OH
Диссоциация на ионы:
(NH4)2CO3↔ 2NH4+ + CO32-
Гидролиз по катиону:
NH4+ + HOH↔NH4OH + H+
Гидролиз по аниону:
CO32- + HOH ↔ HCO3– + OH–
Ионное уравнение:
2NH4+ + CO32- + HOH ↔ HCO3– + NH4OH
- Разлагается при термическом воздействии.
(NH4)2CO3 → CO2↑ + 2NH3↑ + H2O↑
- Вступает в реакции с кислотами (любыми, так как угольная кислота самая слабая среди неорганических).
(NH4)2CO3+ H2SO4 → (NH4)2SO4 + CO2↑ + H2O
- Взаимодействует с основаниями.
(NH4)2CO3+ NaOH → Na2CO3 + 2NH3↑ + 2H2O
- Вступает во взаимодействие с другими солями.
(NH4)2CO3+СaCl2 → CaCO3↓ + 2NH4Cl
Практическое применение карбоната аммония
Углекислый аммоний используется в разных сферах:
• в пищевой промышленности как заменитель дрожжей (за счет выделения углекислого газа);
• в качестве сырья для получения сульфата аммония;
• для осаждения солей магния при добыче калия из морской воды;
• в производстве косметики в качестве красящего соединения;
• в фармацевтической промышленности при производстве лекарств от кашля и нашатыря;
• для ускорения процесса ферментации при производстве вина;
• в качестве одного из компонентов составов для тушения огня.
Тест по теме «Карбонат аммония»
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
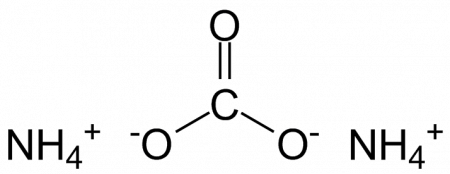
| Карбонат аммония | |
|---|---|
 |
|
 |
|
| Традиционные названия | углекислый аммоний |
| Хим. формула | (NH4)2CO3 |
| Плотность | 1,6 г/см³ |
| Температура | |
| • разложения | 60 °C |
| Растворимость | |
| • в воде | растворим (0 °C) 100,1 (15 °C) Разл. (100 °C) |
| ГОСТ | ГОСТ 3770-75 ГОСТ 9325-79 |
| Рег. номер CAS | 506-87-6 |
| PubChem | 10480 |
| Рег. номер EINECS | 208-058-0 |
| SMILES |
C(=O)(O)O.N.N |
| InChI |
1S/CH2O3.2H3N/c2-1(3)4;;/h(H2,2,3,4);2*1H3 PRKQVKDSMLBJBJ-UHFFFAOYSA-N |
| Кодекс Алиментариус | E503i |
| ChEBI | 10048 |
| ChemSpider | 10048 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Карбонат аммония, углекислый аммоний, (NH4)2CO3 — аммониевая соль угольной кислоты.
Содержание
- 1 Свойства
- 2 Применение

Свойства
Бесцветные кристаллы соединения хорошо растворимы в воде. Карбонат аммония очень неустойчив как на воздухе, так и в растворе, так как уже при комнатной температуре выделяет аммиак, превращаясь в гидрокарбонат аммония NH4HCO3. При температуре 60 °C быстро распадается на NH3, CO2 и H2O.
Подвергается гидролизу:
-
- (NH4)2CO3 + H2O ⇄ NH4HCO3 + NH4OH

Применение
На процессе разложения, связанном с выделением газов, основано применение карбоната аммония вместо дрожжей в хлебопечении и кондитерской промышленности (пищевая добавка E503). Получают карбонат аммония взаимодействием газообразных NH3, CO2 и H2O при быстром охлаждении продуктов реакции. Технический продукт содержит наряду с (NH4)2CO3 соединение гидрокарбоната аммония с карбаминатом аммония NH4HCO3 ⋅ NH4COONH2.
Карбонат аммония применяется для получения сульфата аммония из гипса по реакции
-
- (NH4)2CO3 + CaSO4 → (NH4)2SO4 + CaCO3
При этом карбонат аммония можно вводить в виде раствора (жидкостный процесс конверсии), вместо карбоната аммония можно вводить газообразные NH3 и CO2 (газовый процесс конверсии), а также можно вводить газообразные NH3 и CO2 дополнительно к раствору (NH 4)2CO3 в количестве 10—15 % стехиометрического количества в расчёте на CaSO4 (газожидкостный процесс конверсии). В последнем случае при растворении газов выделяется дополнительная теплота, необходимая для протекания реакции. Карбонат аммония может рассматриваться как источник карбонат-ионов и в перспективе может применяться, например, для осаждения солей магния для отделения его от солей калия. При добыче калия из морской воды соли калия выделяются вместе с солями магния и не могут быть очищены от него перекристаллизацией. При добавлении карбоната аммония магний выпадает в осадок в виде карбоната, в растворе остаются в основном хлорид калия и хлорид аммония, которые впоследствии могут быть разделены (рекристаллизацией или возгонкой), либо не разделяться, а использоваться как азотно-калийное удобрение. Также карбонат аммония применяется:
- в лекарственных препаратах (сиропы от кашля, нашатырь и др.);
- в качестве ускорителя ферментации при производстве вина;
- в качестве компонента огнетушащих составов
- в косметике в качестве красителей
- в качестве компонента раствора чистки стволов огнестрельного оружия (РЧС)
|
Соединения аммония |
|---|
|
Карбонат аммония
Характеристики и физические свойства карбоната аммония
В виде раствора он несколько более устойчив к нагреванию. Хорошо растворяется в воде (гидролизуется по аниону), образует сильнощелочной раствор. Кристаллогидратов не имеет.

Рис. 1. Карбонат аммония. Внешний вид.
Основные характеристики карбоната аммония приведены в таблице ниже:
|
Молекулярная формула |
(NH4)2CO3 |
|
Молярная масса, г/моль |
96 |
|
Температура разложения, oС |
60 |
Получение карбоната аммония
Выделение карбоната аммония в качестве самостоятельного вещества было осуществлено из роговых образований кожи человека и животных (волосы, ногти, рога и т.д.), которые содержат в своем составе азот, путем дистилляции при воздействии высоких температур.
В настоящее время основным способом получения карбоната аммония является нагревание хлористого аммония.
Химические свойства карбоната аммония
Карбонат аммония – средняя соль, образованная слабым основанием – гидроксидом аммония (NH4OH) и слабой кислотой – угольной (H2CO3). В водном растворе он гидролизуется по анионуи катиону. Характер среды – нейтральный. Уравнение гидролиза выглядит следующим образом:
(NH4)2CO3↔ 2NH4+ + CO32- (диссоциация соли);
CO32- + HOH ↔ HCO3— + OH— (гидролиз по аниону);
NH4+ + HOH↔NH4OH + H+ (гидролиз по катиону);
2NH4+ + CO32- + HOH ↔ HCO3— + NH4OH (ионное уравнение)
(NH4)2CO3+ HOH ↔ NH4CO3 + NH4OH (молекулярное уравнение).
Карбонат аммония относится к классу неорганических солей. Он способен взаимодействовать:
- с кислотами
(NH4)2CO3+ H2SO4 = (NH4)2SO4 + CO2↑ + H2O.
- со щелочами
(NH4)2CO3+ NaOH = Na2CO3 + 2NH3↑ + 2H2O.
- c другими солями
(NH4)2CO3+СaCl2 = CaCO3↓ + 2NH4Cl.
- Подвергается разложению при нагревании
(NH4)2CO3 = CO2↑ + 2NH3↑ + H2O↑.
Применение карбоната аммония
Карбонат аммония используется в пищевой промышленности в качестве добавки к пище Е503, которая выступает в роли заменителя дрожжей и соды. Кроме этого его используют в фармации и при производстве косметических средств.






