Запрос «Поташ» перенаправляется сюда; см. также другие значения.
| Карбонат калия | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Карбонат калия | |
| Традиционные названия | углекислый калий, поташ | |
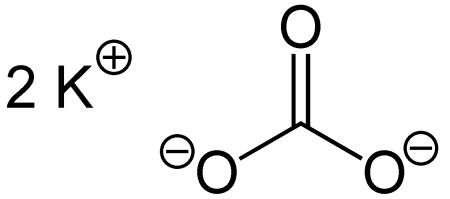
| Хим. формула | K2CO3 | |
| Физические свойства | ||
| Состояние | кристаллическое | |
| Молярная масса | 138,205 г/моль | |
| Плотность | 2,44 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 891 °C | |
| • разложения | 1200 °C | |
| Энтальпия | ||
| • образования | -1146,1 кДж/моль | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 110,5 г/100мл (20 °C) | |
| Классификация | ||
| Рег. номер CAS | 584-08-7 | |
| PubChem | 11430 | |
| Рег. номер EINECS | 209-529-3 | |
| SMILES |
C(=O)([O-])[O-].[K+].[K+] |
|
| InChI |
InChI=1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 BWHMMNNQKKPAPP-UHFFFAOYSA-L |
|
| Кодекс Алиментариус | E501(i) и E501 | |
| RTECS | TS7750000 | |
| ChEBI | 131526 | |
| ChemSpider | 10949 | |
| Безопасность | ||
| NFPA 704 |
0 1 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Карбона́т ка́лия, углеки́слый калий, арх. пота́ш K2CO3 — средняя соль калия и угольной кислоты. Белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности[1].
Старое название соли пота́ш из нидерл. potasch напрямую или через нем. Pottasche, фр. potasse[2].
История[править | править код]
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом, в Европе, но, в основном, в России и Северной Америке.
В России Пётр I в 1721 году установил монополию на производство поташа: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу» — с целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков»[3]. До введения монополии крупнейшим центром производства поташа́ в XVII веке в России, а следовательно и в мире были Нижегородский, Арзамасский и Муромский уезды с их богатыми лесами, позаимствованной из Литвы технологии и с привлечением литовских специалистов уничтожавшимися на зольных «майданах» или «будах» (будных станах)[4].
Физические и химические свойства[править | править код]
При нормальных условиях выглядит как бесцветные или белые кристаллы (моноклинная модификация), плотностью 2,44 г/см3.
При 420 °C переходит в гексагональную модификацию плотностью 2,27 г/см3. Плавится при 891 °C[5].
При нагревании до 1200 °C разлагается на углекислый газ и оксид калия[6]:
Хорошо растворим в воде: 105,5 г/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C), гигроскопичен.
Образует несколько кристаллогидратов: K2CO3·5H2O, K2CO3·1,5H2O и K2CO3·0,5H2O, второй из них образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C[5][7].
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия[5].
С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода[5].
Получение[править | править код]
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов[7].
- воздействием CO2 на раствор гидроксида калия[7]:
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия (см. выше).
Для использования в качестве удобрения поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение[править | править код]
Карбонат калия применяют:
- для изготовления жидкого мыла[7];
- для производства пигментов[7];
- для производства хрустального, оптического[7] или тугоплавкого стекла;
- для крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей[8];
- в качестве добавки в строительный раствор и бетон для понижения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия[7];
- как поглотитель сероводорода при очистке газов[7];
- как обезвоживающий агент[7];
- в качестве средства экстренного пожаротушения (в продукте Firevase компании Samsung)
- зарегистрирован в качестве пищевой добавки E501.
Безопасность[править | править код]
Карбонат калия считается «общепризнанным безопасным» (GRAS) в США в качестве пищевой добавки для человека Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). Он используется в качестве ароматизатора и адъюванта, питательной добавки, средства контроля рН или вспомогательного средства для обработки пищевых продуктов без каких-либо ограничений[9]. В Европейском союзе карбонат калия указан в Постановлении Комиссии (ЕС) № 231/2012 в качестве разрешённой безопасной пищевой добавки и отнесён к категории «добавки, отличные от красителей и подсластителей»[10][11]. Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам в 1965 году не стал устанавливать допустимое суточное потребление (ДСП) для карбоната калия, присвоив добавке статус «ДСП не определён»[12]. Это происходит в тех случаях, когда в ходе исследований за животными и людьми не удаётся определить вредный уровень для здоровья, а значит нет необходимости регулировать количество добавки в пищевых продуктах.
См. также[править | править код]
- Соляной рыбный двор
Примечания[править | править код]
- ↑ Карбонат калия. Дата обращения: 18 апреля 2014. Архивировано 19 апреля 2014 года.
- ↑ *Андреевъ П. П. = P. P. ANDRÉEFF. Поташъ // РУССКІЙ ТОВАРНЫЙ СЛОВАРЬ. ПОСОБІЕ КЪ ТОВАРОВѢДѢНІЮ, ЗАКЛЮЧАЮЩЕЕ НАЗВАНІЯ ОБРАЩАЮЩИХСЯ ВЪ ТОРГОВЛѢ ТОВАРОВЪ, ПРОДУКТОВЪ ХИМИЧЕСКОЙ ОБРАБОТКИ, А ТАКЖЕ ПРЕДМЕТОВЪ, ОТНОСЯЩИХСЯ КЪ ТЕХНОЛОГІИ ВОЛОКНИСТЫХЪ И ПИТАТЕЛЬНЫХЪ ВЕЩЕСТВЪ, СЪ УКАЗАНІЕМЪ СИНОНИМОВЪ, КАК НА РУССКОМЪ, ТАКЪ И НА ИНОСТРАННЫХЪ ЯЗЫКАХЪ = DICTIONNAIRE RUSSE DES MARCHANDISES AVEC la table alphabétique des termes étrangers. — Russisches Waaren-Lexikon mit alphabetischem Register der Fremdwörter. — RUSSIAN GOODS-DICTIONARY with ALPHABETICAL TABLE OF FOREIGN TERMS / СОСТАВИЛЪ ДѢЙСТВИТЕЛЬНЫЙ ЧЛЕНЪ ИМПЕРАТОРСКАГО РУССКАГО ТЕХНИЧЕСКАГО ОБЩЕСТВА, ИНЖЕНЕРЪ-ТЕХНОЛОГЪ П. П. Андреевъ. — С.-ПЕТЕРБУРГЪ = S.-PÉTERSBOURG: Изданіе книжнаго магазина А. Ф. Цинзерлинга. Невскій пр., № 46 = Librairie A. Zinserling Perspective Nevsky 46, 1889. — С. 153. — 231, 166 с.
- ↑ Историческое описание российской коммерции при всех портах и границах : От древних времян до ныне настоящаго и всех преимущественных узаконений по оной государя имп. Петра Великаго и ныне благополучно царствующей государыни имп. Екатерины Великия, / Сочиненное Михайлом Чулковым Т.6, кн.2. — 1786. Архивная копия от 21 февраля 2019 на Wayback Machine
- ↑ Майданы как место сбора поташа. Дата обращения: 10 июня 2022. Архивировано 1 марта 2021 года.
- ↑ 1 2 3 4 Ксензенко, 1990.
- ↑ Лидин Р.А. Справочник по общей и неорганической химии. — М., 1997. — С. 120.
- ↑ 1 2 3 4 5 6 7 8 9 Кнунянц, 1983, с. 233.
- ↑ Гурлев, 1988, с. 290.
- ↑ CFR – Code of Federal Regulations Title 21. Food and Drug Administration. Дата обращения: 14 августа 2022.
- ↑ Regulation (EC) No 1333/2008 of the European Parliament and of the Council of 16 December 2008 on food additives, Europe Commission.
- ↑ EUR-Lex – 02008R1333-20200702 – EN – EUR-Lex (англ.). EUR-Lex. Дата обращения: 14 августа 2022.
- ↑ Potassium carbonate. World Health Organization. Дата обращения: 14 августа 2022.
Литература[править | править код]
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Калия карбонат // Химический энциклопедический словарь / Гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с.
- Ксензенко В. И., Стасиневич Д. С. Калия карбонат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа — Меди. — С. 288. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Ссылки[править | править код]
- ГОСТ Р 55053-2012. Добавки пищевые. Калия карбонаты Е501. Общие технические условия
- ГОСТ 10690-73.
| Карбонат калия | |
|---|---|
 |
|
 |
|
| Систематическое наименование |
Карбонат калия |
| Традиционные названия | поташ |
| Хим. формула | CK₂O₃ |
| Состояние | кристаллическое |
| Молярная масса | 138,205 г/моль |
| Плотность | 2,44 г/см³ |
| Т. плав. | 891 °C |
| Растворимость в воде | 110,5 г/100мл (20 °C) |
| ГОСТ | ГОСТ 4221-76 ГОСТ 10690-73 |
| Рег. номер CAS | 584-08-7 |
| PubChem | 11430 |
| Рег. номер EINECS | 209-529-3 |
| SMILES |
C(=O)([O-])[O-].[K+].[K+] |
| InChI |
1S/CH2O3.2K/c2-1(3)4;;/h(H2,2,3,4);;/q;2*+1/p-2 BWHMMNNQKKPAPP-UHFFFAOYSA-L |
| Кодекс Алиментариус | E501(i) |
| RTECS | TS7750000 |
| ChEBI | 131526 |
| ChemSpider | 10949 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
Карбонат калия, углекислый калий, арх. поташ K2CO3 — средняя соль калия и угольной кислоты. Это белое кристаллическое вещество, хорошо растворимое в воде. Малотоксичен, относится к III классу опасности.
Старое название соли — поташ из нидерл. рotasсh напрямую или через нем. Pottasche, фр. potasse.
История
Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке, — то есть именно там, где за несколько тысяч лет до н. э. находились языки отходящих в сторону северного полюса вместе с глобальным потеплением ледников (как правило, в тех местностях, где вода предельно жёсткая).
На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу». С целью сбережения леса, поскольку вводил технологию производства поташа из «худых бочек, сучьев и прочих обрезков» то есть вторичная переработка.
Физические и химические свойства
Выглядит как бесцветные или белые кристаллы, имеющие моноклинную сингонию, переходит в гексагональную при 420 °C. Плотность моноклинной модификации 2,44 г/см3, гексагональной 2,27 г/см3. Температура плавления — 891 °C. Растворим в воде: 105,5/100 мл (0 °C), 110,5 (20 °C), 155,7 (100 °C). Гигроскопичен.
Образует несколько различных гидратов с 5, 1,5 и 0,5 молекулами воды, гидрат с 1,5·H2O образуется при кристаллизации из водных растворов и хранении безводной формы на воздухе. Все перечисленные гидраты полностью обезвоживаются при 150—160 °C.
Водные растворы карбоната калия присоединяют углекислый газ с образованием гидрокарбоната калия. С двуокисью серы водные растворы реагируют с образованием гидросульфита калия и двуокиси углерода.
Получение
Карбонат калия получают:
- как побочный продукт получается при переработке нефелинов.
- путём электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
- 2KOH + CO2 → K2CO3 + H2O
- воздействием CO2 на раствор гидроксида калия.
Для использования в качестве удобрения, поташ получают из щёлока при выщелачивании водой золы из злаков или водорослей, так как именно карбоната калия больше всего в растворимой части растительных остатков (белая «зола» от костра — в основном поташ). Принцип добычи: в глиняный обожжённый сосуд с небольшим отверстием на дне насыпали золу и слегка утрамбовывали. Потом его заливали определённым количеством воды. Воду, прошедшую через сосуд, тщательно собирали и ею заливали следующую партию. И так до тех пор, пока жидкость не приобретала сиропообразную консистенцию. После лишнюю жидкость выпаривали в металлической посуде и получали поташ.
Применение
Карбонат калия применяют:
- для изготовления жидкого мыла;
- для производства пигментов;
- для производства хрустального, оптического или тугоплавкого стекла;
- крашения;
- для выращивания сельскохозяйственных культур (соли калия являются хорошим удобрением для растений);
- в фотографии как элемент проявителей;
- в качестве добавки в строительный раствор и бетон для уменьшения температуры замерзания (даёт белые пятна, поэтому разрабатываются специальные противоморозные присадки, не дающие разводов);
- для производства других соединений калия;
- как поглотитель сероводорода при очистке газов;
- как обезвоживающий агент;
- зарегистрирован в качестве пищевой добавки E501.
Как научиться писать формулу карбоната
При выполнении заданий по химии, которые включают в себя тестирование, решение расчетных задач, практическую работу или лабораторный опыт могут понадобиться умения и навыки при написании формул солей. Таблица растворимости, в которой указаны значения зарядов ионов металлов и кислотных остатков, а также знание принципа ее использования поможет верно написать формулы и других веществ.

Вам понадобится
- – таблица растворимости солей, кислот, оснований
Инструкция
Карбонаты – это соли, состоящие из атомов металла и кислотного остатка, который имеет один атом углерода и три атома кислорода – СO3. Соли могут быть как средними – карбонаты, так и кислыми – гидрокарбонаты. Чтобы правильно написать формулу, необходимо воспользоваться таблицей растворимости кислот, солей и оснований, являющейся справочным материалом на всех видах контроля, включая даже ЕГЭ по химии.
Карбонат-ион имеет заряд 2-. Чтобы формула соли была написана правильно, найдите, какой заряд имеет металл, который входит в состав карбоната. В любом случае, суммарное число положительных зарядов ионов должно равняться суммарному числу отрицательных. При этом необходимо обязательно учитывать индексы, стоящие внизу справа от химического символа. Значение заряда иона и индекса, стоящего у этого же иона, перемножаются.
Пример № 1. Напишите формулу карбоната калия.
В таблице растворимости посмотрите на кислотный остаток и на металл, входящий в состав соли. Кислотный остаток – СO3 имеет заряд 2-, а ион калия имеет заряд + (считается +1, но единица не пишется).
Напишите формулу, учитывая, что металл всегда стоит на первом месте: КСO3.
Если сравнить количество зарядов, то отрицательных получилось два (2-), а положительных только один (+). Значит, в формуле должно быть 2 атома калия, которые дадут два положительных заряда (2+), так как значение заряда и индекса перемножается. Следовательно, и молекула будет электронейтральна: К2СO3. Полученная соль называется карбонат калия.
Пример № 2. Напишите формулу карбоната кальция.
Кислотный остаток тот же, то есть – СO3 с зарядом (2-). В таблице растворимости найдите металл кальций и его заряд, который равен 2+ . Напишите формулу, имеющую вид: СаСO3. В итоге получилось одинаковое количество отрицательных (2-) и положительных 2(+) зарядов. Следовательно, формула написана правильно, так как в целом она электронейтральна. Полученная соль называется карбонат кальция, она знакома как мел или известняк.
Пример № 3. Напишите формулу гидрокарбоната калия.
Гидрокарбонат-иона в таблице растворимости нет, а потому следует запомнить, что он имеет вид – НСO3 и у него заряд, равный (-). Ион калия имеет противоположный заряд (+), поэтому формула будет выглядеть таким образом:
КНСO3.
Полученное соединение называется гидрокарбонат калия, которое представляет собой кислую соль.
Видео по теме
Источники:
- карбонат кальция формула
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Карбонат калия
Брутто-формула:
CK2O3
CAS# 584-08-7
Названия
Русский:
- Карбонат калия(IUPAC) [Wiki]
- калия карбонат
- поташ
- углекислый калий
English:
- EINECS:209-529-3
- Potash
- Potassium carbonate(IUPAC) [Wiki]
- pearl ash
Варианты формулы:
Реакции, в которых участвует Карбонат калия
-
{M}2O + {X}O2 -> {M}2{X}O3
, где M =
Na K Li Rb Cs; X =
C S Si -
4KO2 + 3C -> 2K2CO3 + CO2″|^”
-
4KO2 + 2CO2 “H2O”–> 2K2CO3 + 3O2″|^”
-
2{M}2CO3 + 2I2 + HCHO -> 4{M}I + 3CO2″|^” + H2O
, где M =
Li Na K -
ZnSO4 + 4KHCO3 -> ZnCO3″|v” + K2SO4 + K2CO3 + 2CO2 + 2H2O
From Wikipedia, the free encyclopedia
|
|
|
|

|
|
| Names | |
|---|---|
| IUPAC name
Potassium carbonate |
|
| Other names
Carbonate of potash, dipotassium carbonate, sub-carbonate of potash, pearl ash, potash, salt of tartar, salt of wormwood. |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChEBI |
|
| ChemSpider |
|
| ECHA InfoCard | 100.008.665 |
| E number | E501(i) (acidity regulators, …) |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
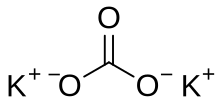
K 2CO 3 |
| Molar mass | 138.205 g/mol |
| Appearance | White, hygroscopic solid |
| Density | 2.43 g/cm3 |
| Melting point | 891 °C (1,636 °F; 1,164 K) |
| Boiling point | Decomposes |
|
Solubility in water |
110.3 g/100 mL (20 °C) 149.2 g/100 mL (100 °C) |
| Solubility |
|
| Acidity (pKa) | 10.25 |
|
Magnetic susceptibility (χ) |
−59.0·10−6 cm3/mol |
| Thermochemistry[1] | |
|
Heat capacity (C) |
114.4 J·mol−1·K−1 |
|
Std molar |
155.5 J·mol−1·K−1 |
|
Std enthalpy of |
−1151.0 kJ·mol−1 |
|
Gibbs free energy (ΔfG⦵) |
−1063.5 kJ·mol−1 |
|
Enthalpy of fusion (ΔfH⦵fus) |
27.6 kJ·mol−1 |
| Hazards | |
| GHS labelling: | |
|
Pictograms |

|
|
Signal word |
Warning |
|
Hazard statements |
H302, H315, H319, H335 |
|
Precautionary statements |
P261, P305+P351+P338 |
| NFPA 704 (fire diamond) |
1 0 0 |
| Flash point | Non-flammable |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
1870 mg/kg (oral, rat)[2] |
| Safety data sheet (SDS) | ICSC 1588 |
| Related compounds | |
|
Other anions |
Potassium bicarbonate |
|
Other cations |
Lithium carbonate Sodium carbonate Rubidium carbonate Caesium carbonate |
|
Related compounds |
Ammonium carbonate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Potassium carbonate is the inorganic compound with the formula K2CO3. It is a white salt, which is soluble in water and forms a strongly alkaline solution. It is deliquescent, often appearing as a damp or wet solid. Potassium carbonate is mainly used in the production of soap and glass.[3]
History[edit]
Potassium carbonate is the primary component of potash and the more refined pearl ash or salts of tartar. Historically, pearl ash was created by baking potash in a kiln to remove impurities. The fine, white powder remaining was the pearl ash. The first patent issued by the US Patent Office was awarded to Samuel Hopkins in 1790 for an improved method of making potash and pearl ash.
In late 18th-century North America, before the development of baking powder, pearl ash was used as a leavening agent for quick breads.[4][5]
Production[edit]
Potassium carbonate is prepared commercially by the reaction of potassium hydroxide with carbon dioxide:[3]
- 2 KOH + CO2 → K2CO3 + H2O
From the solution crystallizes the sesquihydrate K2CO3·3⁄2H2O (“potash hydrate”). Heating this solid above 200 °C (392 °F) gives the anhydrous salt. In an alternative method, potassium chloride is treated with carbon dioxide in the presence of an organic amine to give potassium bicarbonate, which is then calcined:
- 2 KHCO3 → K2CO3 + H2O + CO2
Applications[edit]
- (historically) for soap, glass, and dishware production
- as a mild drying agent where other drying agents, such as calcium chloride and magnesium sulfate, may be incompatible. It is not suitable for acidic compounds, but can be useful for drying an organic phase if one has a small amount of acidic impurity. It may also be used to dry some ketones, alcohols, and amines prior to distillation.[6]
- in cuisine, where it has many traditional uses. It is used in some types of Chinese noodles and mooncakes, as well as Asian grass jelly and Japanese ramen. German gingerbread recipes often use potassium carbonate as a baking agent, although in combination with hartshorn.
- in the alkalization of cocoa powder to produce Dutch process chocolate by balancing the pH (i.e., reduce the acidity) of natural cocoa beans; it also enhances aroma. The process of adding potassium carbonate to cocoa powder is usually called “Dutching” (and the products referred to as Dutch-processed cocoa powder), as the process was first developed in 1828 by Dutchman Coenraad Johannes van Houten.
- as a buffering agent in the production of mead or wine.
- in antique documents, it is reported to have been used to soften hard water.[7]
- as a fire suppressant in extinguishing deep-fat fryers and various other B class-related fires.
- in condensed aerosol fire suppression, although as the byproduct of potassium nitrate.
- as an ingredient in welding fluxes, and in the flux coating on arc-welding rods.
- as an animal feed ingredient to satisfy the potassium requirements of farmed animals such as broiler breeder chickens.
- as an acidity regulator in Swedish snus snuff tobacco
References[edit]
- ^ CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data. William M. Haynes, David R. Lide, Thomas J. Bruno (2016-2017, 97th ed.). Boca Raton, Florida. 2016. ISBN 978-1-4987-5428-6. OCLC 930681942.
{{cite book}}: CS1 maint: others (link) - ^ Chambers, Michael. “ChemIDplus – 584-08-7 – BWHMMNNQKKPAPP-UHFFFAOYSA-L – Potassium carbonate [USP] – Similar structures search, synonyms, formulas, resource links, and other chemical information”. chem.sis.nlm.nih.gov. Archived from the original on 2014-08-12.
- ^ a b H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). “Potassium Compounds”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 3527306730.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ^ See references to “pearl ash” in “American Cookery” by Amelia Simmons, printed by Hudson & Goodwin, Hartford, 1796.
- ^ Civitello, Linda (2017). Baking powder wars : the cutthroat food fight that revolutionized cooking. Urbana, Illinois: University of Illinois Press. pp. 18–22. ISBN 9780252041082.
- ^ Leonard, J.; Lygo, B.; Procter, G. “Advanced Practical Organic Chemistry” 1998, Stanley Thomas Publishers Ltd
- ^ Child, Lydia M. “The American Frugal Housewife” 1832
Bibliography[edit]
- A Dictionary of Science, Oxford University Press, New York, 2004
- Yu. Platonov, Andrew; Evdokimov, Andrey; Kurzin, Alexander; D. Maiyorova, Helen (29 June 2002). “Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol”. Journal of Chemical & Engineering Data. 47 (5): 1175–1176. doi:10.1021/je020012v.
External links[edit]
- International Chemical Safety Card 1588