С момента появления химии человечеству стало понятно, что все вокруг состоит из вещества, в состав которого входят химические элементы. Многообразие веществ обеспечивается различными соединениями простых элементов. На сегодня открыто и внесено в периодическую таблицу Д. Менделеева 118 химических элементов. Среди них стоит выделить ряд ведущих, наличие которых определило появление органической жизни на Земле. В этот перечень входят: азот, углерод, кислород, водород, сера и фосфор.
Кислород: история открытия
Все эти элементы, а также ряд других, способствовали развитию эволюции жизни на нашей планете в том виде, в котором мы сейчас наблюдаем. Среди всех компонентов именно кислорода в природе больше остальных элементов.
Кислород как отдельный элемент был открыт 1 августа 1774 года Джозефом Пристли. В ходе эксперимента по получению воздуха из окалины ртути путём нагревания при помощи обычной линзы он обнаружил, что свеча горит необычно ярким пламенем.
Долгое время Пристли пытался найти этому разумное объяснение. На тот момент этому явлению было дано название «второй воздух». Несколько ранее изобретатель подводной лодки К. Дреббель в начале XVII века выделил кислород и использовал его для дыхания в своём изобретении. Но его опыты не оказали влияния на понимание того, какую роль играет кислород в природе энергообмена живых организмов. Однако учёным, официально открывшим кислород, признан французский химик Антуан Лоран Лавуазье. Он повторил эксперимент Пристли и понял, что образующийся газ является отдельным элементом.
Кислород взаимодействует практически со всеми простыми и сложными веществами, кроме инертных газов и благородных металлов.
Нахождение кислорода в природе
Среди всех элементов нашей планеты наибольшую долю занимает кислород. Распространение кислорода в природе весьма разнообразно. Он присутствует как в связанном виде, так и в свободном. Как правило, являясь сильным окислителем, он пребывает в связанном состоянии. Нахождение кислорода в природе как отдельного несвязанного элемента зафиксировано только в атмосфере планеты.
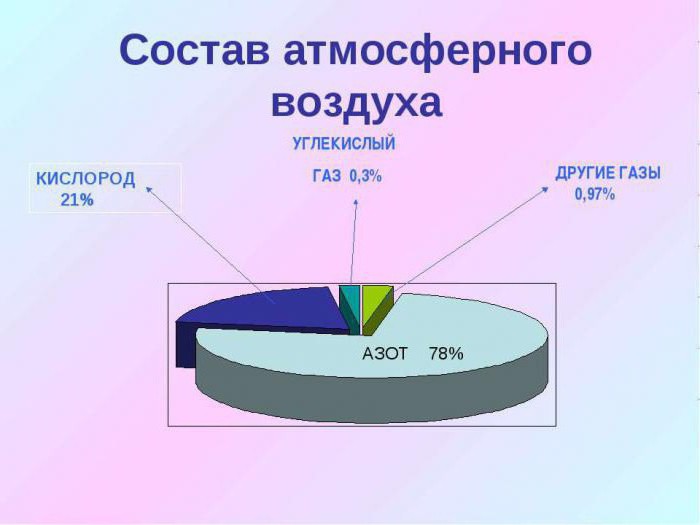
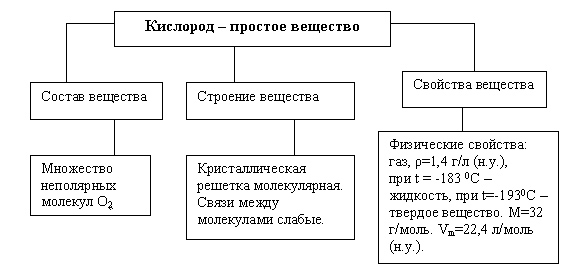
Содержится в виде газа и представляет собой соединение двух атомов кислорода. Составляет около 21 % от общего объёма атмосферы.
Кислород в воздухе, кроме обычной своей формы, имеет изотропную форму в виде озона. Молекула озона состоит из трёх атомов кислорода. Голубой цвет неба непосредственно связан с наличием этого соединения в верхних слоях атмосферы. Благодаря озону, жёсткое коротковолновое излучение от нашего Солнца поглощается и не попадает на поверхность.
В случае отсутствия озонового слоя органическая жизнь была бы уничтожена, подобно поджаренной еде в микроволновой печи.
В гидросфере нашей планеты этот элемент находится в связанном виде с двумя молекулами водорода и образует воду. Доля содержания кислорода в океанах, морях, реках и подземных водах оценивается около 86- 89 %, с учётом растворенных солей.
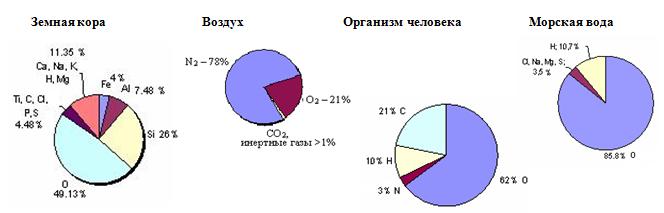
В земной коре кислород находится в связанном виде и является наиболее распространённым элементом. Его доля составляет около 47 %. Нахождение кислорода в природе не ограничивается оболочками планеты, этот элемент входит в состав всех органических существ. Его доля в среднем достигает 67 % от общей массы всех элементов.
Кислород – основа жизни
Из–за высокой окислительной активности кислород достаточно легко соединяется с большинством элементов и веществ, образуя оксиды. Высокая окислительная способность элемента обеспечивает всем известный процесс горения. Кислород также участвует в процессах медленного окисления.
Роль кислорода в природе как сильного окислителя незаменима в процессе жизнедеятельности живых организмов. Благодаря этому химическому процессу происходит окисление веществ с выделением энергии. Её живые организмы используют для своей жизнедеятельности.
Растения – источник кислорода в атмосфере
На начальном этапе образования атмосферы на нашей планете существующий кислород находился в связанном состоянии, в виде двуокиси углерода (углекислый газ). Со временем появились растения, способные поглощать углекислый газ.
Данный процесс стал возможен благодаря возникновению фотосинтеза. Со временем, в ходе жизнедеятельности растений, за миллионы лет в атмосфере Земли накопилось большое количество свободного кислорода.
По мнению учёных, в прошлом его массовая доля достигала порядка 30 %, в полтора раза больше, чем сейчас. Растения, как в прошлом, так и сейчас, существенно повлияли на круговорот кислорода в природе, обеспечив тем самым разнообразную флору и фауну нашей планеты.
Значение кислорода в природе не просто огромно, а первостепенно. Система метаболизма животного мира чётко опирается на наличие кислорода в атмосфере. При его отсутствии жизнь становится невозможной в том виде, в котором мы знаем. Среди обитателей планеты останутся только анаэробные (способные жить без наличия кислорода) организмы.
Интенсивный круговорот кислорода в природе обеспечен тем, что он находится в трёх агрегатных состояниях в объединении с другими элементами. Будучи сильным окислителем, он очень легко переходит из свободной формы в связанную. И только благодаря растениям, которые путём фотосинтеза расщепляют углекислый газ, он имеется в свободной форме.
Процесс дыхания животных и насекомых основан на получении несвязанного кислорода для окислительно-восстановительных реакций с последующим получением энергии для обеспечения жизнедеятельности организма. Нахождение кислорода в природе, связанного и свободного, обеспечивает полноценную жизнедеятельность всего живого на планете.
Эволюция и «химия» планеты
Эволюция жизни на планете опиралась на особенности состава атмосферы Земли, состава минералов и наличия воды в жидком состоянии.
Химический состав коры, атмосферы и наличие воды стали основой зарождения жизни на планете и определили направление эволюции живых организмов.
Опираясь на имеющуюся «химию» планеты, эволюция пришла к углеродной органической жизни на основе воды как растворителя химических веществ, а также использовании кислорода как окислителя с целью получения энергии.
Иная эволюция
На данном этапе современная наука не опровергает возможность жизни в иных средах, отличных от земных условий, где за основу построения органической молекулы может быть взят кремний или мышьяк. А среда жидкости, как растворителя, может представлять собой смесь жидкого аммиака с гелием. Что касается атмосферы, то она может быть представлена в виде газообразного водорода с примесью гелия и других газов.
Какие метаболические процессы могут быть при таких условиях, современная наука пока не в состоянии смоделировать. Однако такое направление эволюции жизни вполне допустимо. Как доказывает время, человечество постоянно сталкивается с расширением границ нашего понимания окружающего мира и жизни в нем.
На Земле находится 49,4% кислорода, который встречается либо в свободном виде в воздухе, либо в связанном (вода, соединения и минералы).
Характеристика кислорода
На нашей планете газ кислород распространен больше всех других химических элементов. И это неудивительно, ведь он входит в состав:
- горных пород,
- воды,
- атмосферы,
- живых организмов,
- белков, углеводов и жиров.
Кислород активный газ и поддерживает горение.
Физические свойства
В атмосфере кислород содержится в бесцветном газообразном виде. Он не имеет запаха, малорастворим в воде и других растворителях. У кислорода прочные молекулярные связи, из-за которых он химически малоактивен.
Если кислород нагревать, он начинает окислять и реагировать с большинством неметаллов и металлов. Например, железо, этот газ медленно окисляет и вызывает его ржавление.
При снижении температуры (-182,9°С), и нормальном давлении газообразный кислород переходит в другое состояние (жидкое) и приобретает бледно-синий цвет. Если температуру еще снижать (до -218,7°С) газ затвердеет и изменится до состояния синих кристаллов.
В жидком и твердом состояниях кислород приобретает синий цвет и обладает магнитными свойствами.
Древесный уголь является активным поглотителем кислорода.
Химические свойства
Почти во время всех реакций кислорода с другими веществами образуется и выделяется энергия, сила которой может зависеть от температуры. Например, при обычных температурах этот газ медленно реагирует с водородом, а при температуре выше 550°С возникает реакция со взрывом.
Кислород – активный газ, который входит в реакцию с большинством металлов, кроме платиновых и золота. Сила и динамика взаимодействия, во время которого образуются оксиды, зависит от присутствия в металле примесей, состояния его поверхности и измельчения. Некоторые металлы, во время связи с кислородом, кроме основных оксидов образуют амфотерные и кислотные оксиды. Оксиды золота и платиновых металлов возникают во время их разложения.
Кислород кроме металлов, так же активно взаимодействует практически со всеми химическими элементами (кроме галогенов).
В молекулярном состоянии кислород более активен и эту особенность используют при отбеливании различных материалов.
Роль и значение кислорода в природе
Зеленые растения вырабатывают больше всего кислорода на Земле, причем основная масса производится водными растениями. Если кислорода в воде выработалась больше, то избыток уйдет в воздух. А если меньше, то наоборот, недостающее количество будет дополнено из воздуха.
Морская и пресная вода содержит 88,8 % кислорода (по массе), а в атмосфере его 20,95 % по объёму. В земной коре больше 1500 соединений имеют в составе кислород.
Из всех газов, входящих в состав атмосферы, больше всего важен для природы и человека кислород. Он есть в каждой живой клетке и необходим всем живым организмам для дыхания. Недостаток кислорода в воздухе сразу отражается на жизнедеятельности. Без кислорода невозможно дышать, а значит жить. Человек во время дыхания за 1 мин. в среднем его потребляет 0,5 дм3. Если в воздухе его станет меньше до 1/3 его части, то он потеряет сознание, до 1/4 части — он умрет.
Дрожжи и некоторые бактерии могут жить без кислорода, но теплокровные животные, умирают при его недостатке через несколько минут.
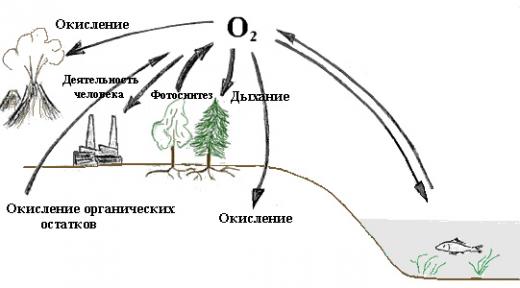
Круговорот кислорода в природе
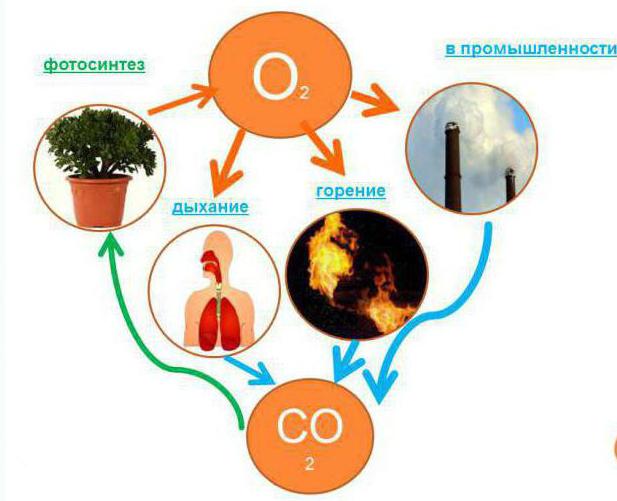
Круговоротом кислорода в природе называется обмен им между атмосферой и океанами, между животными и растениями во время дыхания, а так же в процессе химического горения.
На нашей планете важный источник кислорода – растения, в которых проходит уникальный процесс фотосинтеза. Во время него происходит выделение кислорода.
В верхней части атмосферы тоже образуется кислород, вследствие разделения воды под действием Солнца.
Как происходит круговорот кислорода в природе?
Во время дыхания животных, людей и растений, а так же горения любого топлива тратится кислород и образуется углекислый газ. Потом углекислым газом питаются растения, которые в процессе фотосинтеза снова вырабатывают кислород.
Таким образом, его содержание в воздухе атмосферы поддерживается и не заканчивается.
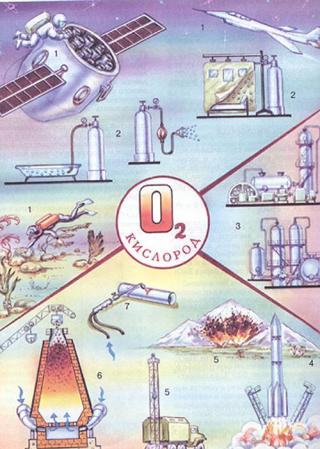
Области применения кислорода
В медицине во время операций и опасных для жизни заболеваний больным дают дышать чистым кислородом, чтобы облегчить их состояние и ускорить выздоровление.
Без баллонов с кислородом альпинисты не поднимаются в горы, а аквалангисты не погружаются на глубину морей и океанов.
Кислород широко применяется в разных видах промышленности и производства:
- для обрезки и сварки различных металлов
- для получения очень высоких температур на заводах
- для получения разнообразных химических соединений • для ускорения плавления металлов.
Так же широко кислород применяется в космической индустрии и авиации.
Круговорот кислорода в природе: схема, интересные факты
Опубликовано:
22 сентября 2021, 18:31

Без кислорода на Земле не могли бы существовать живые организмы, не горел бы огонь, не ржавел бы металл. Мы используем его постоянно. Но почему же он не заканчивается? Потому что существует круговорот кислорода — процесс планетарного масштаба, который постоянно обеспечивает нас этим газом. Объясним, как он протекает и как кислород влияет на нашу жизнь.
Круговорот кислорода
Что такое кислород? Это один из самых распространенных химических элементов на Земле и неотъемлемая составляющая жизни на планете.
Кислород — это бесцветный газ, который присутствует повсюду и которым дышит человек. Вдыхая его, организм выделяет углекислый газ и так обеспечивает свою жизнедеятельность. Кроме этого, оксиген участвует во многих процессах:
- Без воздуха невозможно было бы разжечь костер или зажечь спичку. Во время горения обязательно задействуется кислород и выделяется углекислый газ.
- Он участвует в процессах окисления. Замечали, что под воздействием воды на металле появляется ржавчина? На самом деле причина не в воде, а в кислороде.
- Когда растения или животные умирают, они также поглощают кислород. Газ участвует в процессах разложения.
Кислород расходуется постоянно, почему же его запасы не иссякают? На самом деле он регулярно обновляется в природе, и этот процесс называют круговоротом.
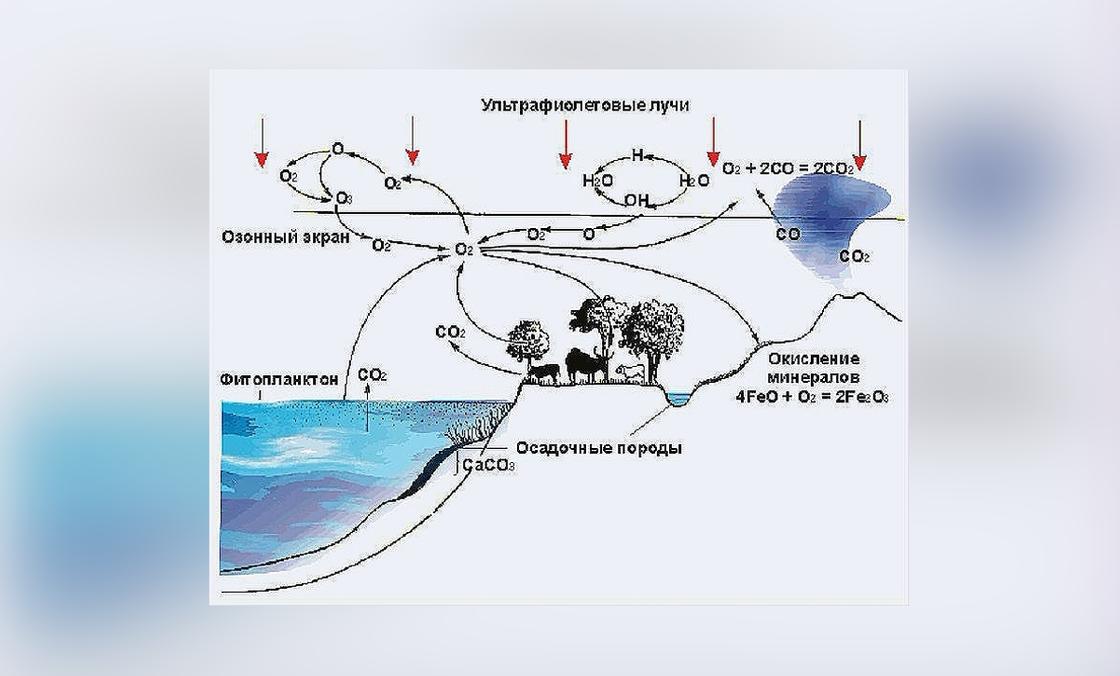
Как происходит круговорот кислорода в природе? Он попадает в атмосферу из растений, воды и земной коры:
- Фотосинтез — главная движущая сила круговорота кислорода. Наземные зеленые растения и фитопланктон океана потребляет углекислый газ и под воздействием солнечных лучей выделяет оксиген.
- Испарение воды из водоемов — еще один источник кислорода в атмосфере. Вода содержит его атомы и под воздействием ультрафиолета распадается, выделяя этот газ.
- Из земной коры кислород также высвобождается в атмосферу. Происходит это в результате выветривания, эрозии, движения подземных вод. Как кислород попадает в литосферу? В коре есть так называемый известняк — порода, созданная из осадков морских организмов, имеющих внешнюю оболочку, богатую кислородом.
Газ, который пришел в атмосферу из биосферы, гидросферы и литосферы, снова участвует в жизненных процессах — поглощении живыми организмами, окислении. Американские исследователи определили, что понадобится около двух тысяч лет, чтобы использованный кислород восстановился в атмосфере — такова скорость его круговорота.
Интересные факты о кислороде
Где находится кислород в природе? Как пишут в учебниках по химии, этим газом насыщены все стихии:
- Он составляет около 21% всей атмосферы планеты.
- Моря и океаны Земли состоят из кислорода на 86%.
- На 47% земная кора — это тоже кислород. Он входит в состав многих пород и минералов, которые формируют земную кору.
Кислород появился на Земле за миллиарды лет до нас. Согласно исследованию датских ученых, он был здесь еще 3,8 миллиарда лет назад. Хотя его концентрация в воздухе не всегда была такой высокой, как сейчас. Впрочем, выявить этот химический элемент ученым удалось только в XVIII веке.
Кто и когда открыл кислород? До 1774 года человечество не подозревало о его существовании. Открытию этого газа мы обязаны двум ученым:
- В 1774-м английский исследователь Джозеф Пристли нагрел оксид ртути в герметически закрытом сосуде, в результате чего выделился газ. Под его воздействием свеча горела ярче, чем обычно. Пристли не понял, какое удивительное открытие совершил, и был уверен, что выявил составляющую воздуха.
- Годом спустя, в 1775-м, француз Антуан Лавуазье взял за основу выводы Пристли, осуществил ряд опытов и доказал, что кислород — отдельное вещество.
Название кислорода — oxygenium — произошло от древнегреческого ‘рождающий кислоту’.
Какое значение имеет кислород? Этот бесцветный газ — залог жизни на планете Земля. Чтобы продемонстрировать его важность, предлагаем несколько фактов:
- Кислород входит в состав белков, жиров и углеводов, из которого состоит организм человека. Его атомы составляют 65% массы человеческого тела.
- Каждый человек вдыхает около 550 литров кислорода в сутки. Таким образом, планете нужно семь деревьев, чтобы обеспечить жизнедеятельность одного человека. Вот почему экологи бьют тревогу по поводу вырубки лесов.
- Чем выше подняться над уровнем моря, тем меньшее содержание кислорода в воздухе. Поэтому многим становится плохо в горах. Это симптомы кислородного голодания. Длительная нехватка этого газа в организме приводит к коме или смерти.
- Без кислорода не могла бы существовать важная часть современной промышленности — металлургическая, так как без него нельзя было бы обработать металл.
Кислород — бесценный ресурс, который восстанавливает себя сам. Но это не значит, что человек не должен влиять на этот процесс. Большинство оксигена приходит в атмосферу из деревьев. Уже сейчас из-за выхлопов и развития промышленности концентрация оксигена в воздухе падает. Вот почему нам всерьез стоит задуматься о состоянии экологии.
Оригинал статьи: https://www.nur.kz/family/school/1709185-krugovorot-kisloroda-v-prirode-interesnye-fakty/
-
Кислород. Нахождение в природе, получение и применение. Озон. “Озоновый щит”.
Кислород – самый распрастраненный
элемент земной коры. В свободном состоянии
находится в атмосферном воздухе, в
связанном виде входит в состав воды,
минералов. Горных пород и всех веществ,
из которых построены организмы растений
и животных. Массовая доля кислорода в
земной коре 47%. Природный кислород
состоит из 3х стабильных изотопов:
,
,
.
Кислород – бесцветный газ, не имеющий
запаха. Он немного тяжелее воздуха.
Кислород образует 2х атомные молекулы,
характеризующиеся выскокой прочностью.
Он обладает магнитными свойствами,
которые указывают на наличие двух
неспаренных электронов. Кислород
образует соединения со всеми химическими
элементами кроме гелия, неона и аргона.
Зарактерной особеностью многих реакций
соединения с кислородом является
выделение теплоты и света (горение)
В настоящее время в промышленности
кислород получают из воздуха. В
лабараториях кислород получают
электролизом водных растворов щелочей.
Кислород играет исключительно важную
роль в природе – при его участии
происходит процеес ддыхания. Так же
кислород участвует в процессах тления
и гниения погибших организмов, тем самым
обеспечивая круговорот органических
веществ в природе.
Кислород применяют для интенсификации
химических процессов на многих
производствах (серная кислота). Кислород
используют для получения высоких
температур, в медицине.
Озон – вещество образующееся при
пропускании электрических искр черещ
кислород или воздух. Обладает специфическим
запахом. Озон состоит из трех молекул
кислорода. Для получения озона
используют электрический ток. При
обычных условиях озон – ядовитый газ.
Озон – не устойчивое вещество, но очень
сильный окислитель. Он окисляет все
металлы кроме золота и платиновыз
металлов. Он переводит низшие оксиды в
высшие. Его применяют для обеззараживания
воды и для дезинфекции воздуха.
Озоновый щит – озоновый слой –
часть стратосферы на высоте от 12 до 50
км, в которой под воздействием
ультрафиолетового излучения Солнца
молекулярный кислород диссоциирует на
атомы, которые образуют озон. Озоновый
слой защищает все живущее на суше от
губительного воздействиясолнечного
ультрафиолета.
-
Оксиды неметаллов. Классификация.
Получение и применение (по 3 примера
оксидов каждого класса). Отношение к
воде выбранных Вами оксидов.
Оксид неметалла – результат взаимодействия
кислорода и неметалла.Оксиды неметаллов
делятся на кислотные (которым
соответствубт кислоты (
))
и несолеобразующие (которые не имеют
своих гидроксидов и не вступают в реакции
обмена
)).
1)
– получают из печных газов, продуктов
разложения природных карбонатов.
Получают из воздуха. В лабораторных
условиях небольшие количества получают
взаимодействием карбонатов и
гидракарбонатов с кислотами (мрамор+соляная
кислота). Используют в пищевой
промышленности (газированная вода). В
пожаротушении, в качестве защиной среды
при сварке проволокой. При взаимодействии
с водой растворяется в ней образуя
угольную кислоту.
– получают сжиганием серы или обжигом
пирита:
Q.
В лабаратория получают действием
концентрированной серной кислоты на
малоактивные металлы при нагревании:
.
Применяют для производства серной
кислоты, для консервации слабоалкогольных
напитках. При взаимодействии с водой
растворяется в ней с образованием
сернистой кислоты.
– получают оксиляя
кислородом воздуха при нагревании в
присутствии катализатора:
или взаимодействием
c озоном:
.
Применяют для производства серной
кислоты. При взаимодействии с водой
образуется едкая серная кислота.
2) NO – получают
непосредственно из свободных элементов
соединением азота с кислородом при
выскоих температурах или электрическом
разряде. В природе образуется при
грозовом разряде:
Применяют
для получения азотной кислоты. В воде
растворим плохо
CO – получают при
горении углерода или соединений на его
основе в условии недостатка кислорода:
или при разложении жидкой муравьиной
кислоты под дейсвтием горячей
концентрированной серной кислоты:
.
Применяется для обработки мяса
животных придовая им красный цвет и вид
свежести не изменяя их вкуса. В воде
растворим плохо.
SiO – получают нагревая
крмений в недостатке кислорода выше
400 С:
Применяют в технике, волоконной
оптике, полупроводниковых устройствах.
С водой взаимодействует при выскоих
температурах.
-
Оксиды металлов (металлические, ионные).
Кислотно–оснόвные
свойства. Получение и применение (по 2
примера). Отношение к воде выбранных
Вами оксидов.
Оксид металла – результат
взаимодействия кислорода и металла.
Оксиды металлов бывают основными
(
),
кислотными (
,
)
и амфотерными (
).
Кислотные свойства оксидов при
движении по периоду слева направо
возрастают, а основные ослабевают. При
движении сверху вниз по главной подгруппе
возрастают основные свойства оксидов,
а кислотные ослабевают.
1)
–
получают взаимодействием металлического
лития с кислородом:
.
С водой образует щелочь
.
Применяют как компонент специальных
стекол, глазурей и эмалей.
– получают взаимодействием
металлического натрия с кислородом:
.
C водой образует щелочь –
.
Применяется как реактив для синтеза
других веществ.
2)
– получают из печных газов, продуктов
разложения природных карбонатов.
Получают из воздуха. В лабораторных
условиях небольшие количества получают
взаимодействием карбонатов и
гидракарбонатов с кислотами (мрамор+соляная
кислота). Используют в пищевой
промышленности (газированная вода). В
пожаротушении, в качестве защиной среды
при сварке проволокой. При взаимодействии
с водой растворяется в ней образуя
угольную кислоту.
– получают оксиляя
кислородом воздуха при нагревании в
присутствии катализатора:
или взаимодействием
c озоном:
.
Применяют для производства серной
кислоты. При взаимодействии с водой
образуется едкая серная кислота.
3)ZnO – существует как
природный минерад цинкит. В воде
растворим плохо. Применяют как
катализатор синтеза метанола, в медицине
SnO – получают из диоксида
олова,
.
В воде не растворим. Применяют для
синтеза других соединений олова.
-
Пероксиды.
Окислительно-восстановительные
свойства, получение и применение
пероксида водорода. Взаимодействие
пероксидов и надпероксидов с углекислым
газом.
Пероксиды
– сложные вещества в которых атомы
кислорода соединены друг с другом.
Пероксиды бывают – перекисями
(сложные вещества содержащие пероксокруппу
–О-О- #
),
надпероксидами
(неорганические соединения, содержащие
анион
#
)
и озонидами
( неорганические соединения содержащие
ион
или продукты непредельных органических
соединений с озоном).
Перекись водорода
обладает как осиклительными (более
характерно), так и восстановительными
свойствами.
Перекись в качестве
окислителя:
Перекись в качестве восстановителя:

Если сложить
уравнения, отвечающие восстановлению
пероксида водорода и его окислению, то
получиться уравнение
самоокисления-самовосстановления
пероксида водорода (уравнение процесса
разложения перекиси водорода):
Пероксид
водорода получают анодным окислением
растворов серной кислоты с последующим
гидролизом образующейся при этом
кислоты:

Перекись водорода
применяют для отбелки тканей и мехов,
в медицине, в пищевой промышленности и
для обновления старых картин, написаных
масляными красками и потемневших от
времени свинцовых белил:

Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Запрос «Oxygen» перенаправляется сюда; о других значениях см. Oxygene.
| Кислород | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Азот | Фтор → | ||||||||||||||||||||
|
||||||||||||||||||||
| Внешний вид простого вещества | ||||||||||||||||||||

Жидкий кислород |
||||||||||||||||||||
| Свойства атома | ||||||||||||||||||||
| Название, символ, номер | Кислоро́д / Oxygenium (Oxygen)(O), 8 | |||||||||||||||||||
| Группа, период, блок |
16 (устар. 6), 2, p-элемент |
|||||||||||||||||||
| Атомная масса (молярная масса) |
[15,99903; 15,99977][комм 1][1] а. е. м. (г/моль) | |||||||||||||||||||
| Электронная конфигурация |
[He] 2s22p4 1s22s22p4 |
|||||||||||||||||||
| Радиус атома | 60 (48) пм | |||||||||||||||||||
| Химические свойства | ||||||||||||||||||||
| Ковалентный радиус | 73 пм | |||||||||||||||||||
| Радиус иона | 132 (-2e) пм | |||||||||||||||||||
| Электроотрицательность | 3,44 (шкала Полинга) | |||||||||||||||||||
| Электродный потенциал | 0 | |||||||||||||||||||
| Степени окисления | –2, −1, –½, –⅓, 0, +½, +1, +2 | |||||||||||||||||||
| Энергия ионизации (первый электрон) |
1313,1 (13,61) кДж/моль (эВ) | |||||||||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||||||||
| Термодинамическая фаза | Газ | |||||||||||||||||||
| Плотность (при н. у.) | 0,00142897 г/см³ | |||||||||||||||||||
| Температура плавления | 54,8 К (-218,35 °C) | |||||||||||||||||||
| Температура кипения | 90,19 К (-182,96 °C) | |||||||||||||||||||
| Уд. теплота плавления | 0,444 кДж/моль | |||||||||||||||||||
| Уд. теплота испарения | 3,4099 кДж/моль | |||||||||||||||||||
| Молярная теплоёмкость | 29,4[2] Дж/(K·моль) | |||||||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | |||||||||||||||||||
|
||||||||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||||||||
| Структура решётки | Моноклинная | |||||||||||||||||||
| Параметры решётки | a=5,403 b=3,429 c=5,086 β=135,53 Å | |||||||||||||||||||
| Температура Дебая | 155 K | |||||||||||||||||||
| Прочие характеристики | ||||||||||||||||||||
| Теплопроводность | (300 K) 0,027 Вт/(м·К) | |||||||||||||||||||
| Эмиссионный спектр | ||||||||||||||||||||
|
|
||||||||||||||||||||
| Наиболее долгоживущие изотопы | ||||||||||||||||||||
|
Основная статья: Изотопы кислорода
|
Кислоро́д (химический символ — O, от лат. Oxygenium) — химический элемент 16-й группы (по устаревшей классификации — главной подгруппы шестой группы, VIA), второго периода периодической системы Д. И. Менделеева, с атомным номером 8.
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов.
Как простое вещество (при нормальных условиях) кислород — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов (формула — O2). Систематическое название: дикислород[3].
Жидкий кислород (при низких температурах) имеет светло-голубой цвет, а твёрдый (при низких температурах) представляет собой кристаллы светло-синего цвета.
Существуют и другие аллотропные формы кислорода, например, озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3). Систематическое название: трикислород. Часто можно почувствовать запах озона после грозы. Озон образует озоновый слой в стратосфере, который образуется там за счёт ионизации кислорода ультрафиолетом.
История открытия[править | править код]
Официально считается[4][5], что кислород был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью большой линзы).
.
Однако Пристли первоначально не понял, что открыл новое простое вещество, он считал, что выделил одну из составных частей воздуха (и назвал этот газ «дефлогистированным воздухом»). О своём открытии Пристли сообщил выдающемуся французскому химику Антуану Лавуазье. В 1775 году Лавуазье установил, что кислород является составной частью воздуха, кислот и содержится во многих веществах.
Несколькими годами ранее (в 1771 году) кислород получил шведский химик Карл Шееле. Он прокаливал селитру с серной кислотой и затем разлагал получившийся оксид азота. Шееле назвал этот газ «огненным воздухом» и описал своё открытие в изданной в 1777 году книге (именно потому, что книга опубликована позже, чем сообщил о своём открытии Пристли, последний и считается первооткрывателем кислорода). Шееле также сообщил о своём опыте Лавуазье.
Важным этапом, который способствовал открытию кислорода, были работы французского химика Пьера Байена, который опубликовал работы по окислению ртути и последующему разложению её оксида.
Наконец, окончательно разобрался в природе полученного газа А. Лавуазье, воспользовавшийся информацией от Пристли и Шееле. Его работа имела очень большое значение, потому что благодаря ей была ниспровергнута господствовавшая в то время и тормозившая развитие химии флогистонная теория. Лавуазье провёл опыт по сжиганию различных веществ и опроверг теорию флогистона, опубликовав результаты по изменению веса сожжённых элементов. Вес золы превышал первоначальный вес элемента, что дало Лавуазье право утверждать, что при горении происходит химическая реакция (окисление) вещества, в связи с этим масса исходного вещества увеличивается, что опровергает теорию флогистона.
Таким образом, заслугу открытия кислорода фактически делят между собой Пристли, Шееле и Лавуазье.
Происхождение названия[править | править код]
Слово кислород (именовался в начале XIX века ещё «кислотвором») своим появлением в русском языке до какой-то степени обязано М. В. Ломоносову, который ввёл в употребление, наряду с другими неологизмами, слово «кислота»; таким образом слово «кислород», в свою очередь, явилось калькой термина «оксиген» (фр. oxygène), предложенного А. Лавуазье (от др.-греч. ὀξύς — «кислый» и γεννάω — «рождаю»), который переводится как «порождающий кислоту», что связано с первоначальным значением его — «кислота», ранее подразумевавшим вещества, именуемые по современной международной номенклатуре оксидами.
Нахождение в природе[править | править код]
Накопление O2 в атмосфере Земли. Зелёный график — нижняя оценка уровня кислорода, красный — верхняя оценка.
1. (3,85—2,45 млрд лет назад) — O2 не производился
2. (2,45—1,85 млрд лет назад) — O2 производился, но поглощался океаном и породами морского дна
3. (1,85—0,85 млрд лет назад) — O2 выходит из океана, но расходуется при окислении горных пород на суше и при образовании озонового слоя
4. (0,85—0,54 млрд лет назад) — все горные породы на суше окислены, начинается накопление O2 в атмосфере
5. (0,54 млрд лет назад — по настоящее время) — современный период, содержание O2 в атмосфере стабилизировалось
Кислород — самый распространённый в земной коре элемент, на его долю (в составе различных соединений, главным образом силикатов) приходится около 47 % массы твёрдой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 85,82 % (по массе). Более 1500 соединений земной коры в своём составе содержат кислород[6].
В атмосфере содержание свободного кислорода составляет 20,95 % по объёму и 23,10 % по массе (около 1015 тонн[7]). Однако до появления первых фотосинтезирующих микробов в архее 3,5 млрд лет назад в атмосфере его практически не было. Свободный кислород в больших количествах начал появляться в палеопротерозое (3—2,3 млрд лет назад) в результате глобального изменения состава атмосферы (кислородной катастрофы). Первый миллиард лет практически весь кислород поглощался растворённым в океанах железом и формировал залежи джеспилита. 3—2,7 млрд лет назад кислород начал выделяться в атмосферу и 1,7 млрд лет назад достиг 10 % от нынешнего уровня[8][9].
Наличие большого количества растворённого и свободного кислорода в океанах и атмосфере привело к вымиранию большинства анаэробных организмов. Тем не менее, клеточное дыхание с помощью кислорода позволило аэробным организмам производить гораздо больше АТФ, чем анаэробным, сделав их доминирующими[10].
С начала кембрия 540 млн лет назад содержание кислорода колебалось от 15 % до 30 % по объёму[11]. К концу каменноугольного периода (около 300 миллионов лет назад) его уровень достиг максимума в 35 % по объёму, который, возможно, способствовал большому размеру насекомых и земноводных в это время[12].
Основная часть кислорода на Земле выделяется фитопланктоном Мирового океана. Около 60 % кислорода от используемого живыми существами расходуется на процессы гниения и разложения, 80 % кислорода, производимого лесами, уходит на гниение и разложение растительности лесов[13].
Деятельность человека очень мало влияет на количество свободного кислорода в атмосфере[14][нет в источнике]. При нынешних темпах фотосинтеза понадобится около 2000 лет, чтобы восстановить весь кислород в атмосфере[15].
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %[6].
В 2016 году датские учёные доказали, что свободный кислород входил в состав атмосферы уже 3,8 млрд лет назад[16].
Физические свойства[править | править код]
В мировом океане концентрация растворённого O2 больше в холодных водах, меньше — в тёплых
При нормальных условиях кислород — это газ без цвета, вкуса и запаха.
1 л его при нормальных условиях имеет массу 1,429 г, то есть немного тяжелее воздуха. Слабо растворяется в воде (4,9 мл/100 г при 0 °C, 2,09 мл/100 г при +50 °C) и спирте (2,78 мл/100 г при +25 °C). Хорошо растворяется в расплавленном серебре (22 объёма O2 в 1 объёме Ag при +961 °C). Хорошо растворяется в перфторированных углеводородах (20—40 об %).
Межатомное расстояние — 0,12074 нм. Является парамагнетиком. В жидком виде притягивается магнитом.
При нагревании газообразного кислорода происходит его обратимая диссоциация на атомы, концентрация диссоциированных атомов в смеси при +2000 °C — 0,03 %, при +2600 °C — 1 %, +4000 °C — 59 %, +6000 °C — 99,5 %.
Жидкий кислород кипит под давлением 101,325 кПа при температуре −182,98 °C и представляет собой бледно-голубую жидкость. Критическая температура кислорода 154,58 К (-118,57 °C), критическое давление 4,882 МПа[17].
Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Известны 6 кристаллических фаз, из которых три существуют при давлении в 1 атм.:
- α-О2 — существует при температуре ниже 23,65 K; ярко-синие кристаллы относятся к моноклинной сингонии, параметры ячейки a=5,403 Å, b=3,429 Å, c=5,086 Å; β=132,53°[18].
- β-O2 — существует в интервале температур от 23,65 до 43,65 K; бледно-синие кристаллы (при повышении давления цвет переходит в розовый) имеют ромбоэдрическую решётку, параметры ячейки a=4,21 Å, α=46,25°[18].
- γ-O2 — существует при температурах от 43,65 до 54,21 K; бледно-синие кристаллы имеют кубическую симметрию, период решётки a=6,83 Å[18].
Ещё три фазы существуют при высоких давлениях:
- δ-O2 — интервал температур 20—240 K и давление 6—8 ГПа, оранжевые кристаллы;
- ε-фаза, содержит молекулы O4[19] или O8[20][21], существует при давлении от 10 и до 96 ГПа, цвет кристаллов от тёмно-красного до чёрного, моноклинная сингония;
- ζ-On — давление более 96 ГПа, металлическое состояние с характерным металлическим блеском, при низких температурах переходит в сверхпроводящее состояние.
Химические свойства[править | править код]
Сильный окислитель, самый активный неметалл после фтора, образует бинарные соединения (оксиды) со всеми элементами, кроме гелия, неона, аргона, фтора (с фтором кислород образует фторид кислорода, так как фтор более электроотрицателен, чем кислород). Наиболее распространённая степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
Окисляет большинство органических соединений в реакциях горения:
При определённых условиях можно провести мягкое окисление органического соединения:
Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором (см. ниже #Фториды кислорода).
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
- Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- Некоторые оксиды поглощают кислород:
- По теории горения, разработанной А. Н. Бахом и К. О. Энглером, окисление происходит в две стадии с образованием промежуточного пероксидного соединения. Это промежуточное соединение можно выделить, например, при охлаждении пламени горящего водорода льдом, наряду с водой, образуется пероксид водорода:
- В надпероксидах кислород формально имеет степень окисления −½, то есть один электрон на два атома кислорода (ион O−
2). Получают взаимодействием пероксидов с кислородом при повышенных давлении и температуре:
- Калий K, рубидий Rb и цезий Cs реагируют с кислородом с образованием надпероксидов:
- Неорганические озониды содержат ион O−
3 со степенью окисления кислорода, формально равной −⅓. Получают действием озона на гидроксиды щелочных металлов:
- В ионе диоксигенила O+
2 кислород имеет формально степень окисления +½. Получают по реакции:
В этой реакции кислород проявляет восстановительные свойства.
Фториды кислорода[править | править код]
- Дифторид кислорода, OF2, степень окисления кислорода +2, получают пропусканием фтора через разбавленный раствор щёлочи:
- Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления кислорода +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре −196 °C:
- Пропуская тлеющий разряд через смесь фтора с кислородом при определённых давлении и температуре, получают смеси высших фторидов кислорода O3F2, O4F2, O5F2 и O6F2.
- Квантовомеханические расчёты предсказывают устойчивое существование иона трифтороксония[en][22] OF+
3. Если этот ион действительно существует, то степень окисления кислорода в нём будет равна +4.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон). Как установили в 1899 году Пьер Кюри и Мария Склодовская-Кюри, под воздействием ионизирующего излучения O2 переходит в O3[23][24].
Получение[править | править код]
Перегонка жидкого воздуха[править | править код]
В настоящее время в промышленности кислород получают из воздуха.
Основным промышленным способом получения кислорода является криогенная ректификация.
Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии, а также использующие принцип адсорбции.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Разложение кислородсодержащих веществ[править | править код]
Небольшие количества кислорода можно получать нагреванием перманганата калия 
.
Используют также реакцию каталитического разложения пероксида водорода 
.
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) 
.
Разложение оксида ртути(II) {{{1}}} было первым методом получения кислорода:
.
Электролиз водных растворов[править | править код]
К лабораторным способам получения кислорода относится метод электролиза разбавленных водных растворов щелочей, кислот и некоторых солей (сульфатов, нитратов щелочных металлов):
Реакция перекисных соединений с углекислым газом[править | править код]
На подводных лодках и орбитальных станциях обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:
Для соблюдения баланса объёмов поглощённого углекислого газа и выделившегося кислорода, к нему добавляют надпероксид калия. В космических кораблях для уменьшения веса иногда используется пероксид лития.
Применение[править | править код]
Широкое промышленное применение кислорода началось в середине XX века, после изобретения турбодетандеров — устройств для сжижения и разделения жидкого воздуха.
В металлургии[править | править код]
Конвертерный способ производства стали или переработки штейнов связан с применением кислорода. Во многих металлургических агрегатах для более эффективного сжигания топлива вместо воздуха в горелках используют кислородно-воздушную смесь.
Сварка и резка металлов[править | править код]
Кислород в баллонах голубого цвета широко используется для газопламенной резки и сварки металлов.
Компонент ракетного топлива[править | править код]
В качестве окислителя для ракетного топлива применяется жидкий кислород, пероксид водорода, азотная кислота и другие богатые кислородом соединения.
Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива (удельный импульс смеси водород — озон превышает удельный импульс для пары водород-фтор и водород-фторид кислорода).
В медицине[править | править код]
Медицинский кислород хранится в металлических газовых баллонах высокого давления голубого цвета различной ёмкости от 1,2 до 10,0 литров под давлением до 15 МПа (150 атм) и используется для обогащения дыхательных газовых смесей в наркозной аппаратуре, при нарушении дыхания, для купирования приступа бронхиальной астмы, устранения гипоксии любого генеза, при декомпрессионной болезни. Крупные медицинские учреждения могут использовать не сжатый кислород в баллонах, а сжиженный в сосуде Дьюара большой ёмкости. Для индивидуального применения медицинским кислородом из баллонов заполняют специальные прорезиненные ёмкости — кислородные подушки. Для подачи кислорода или кислородо-воздушной смеси одновременно одному или двум пострадавшим в полевых условиях или в условиях стационара применяются кислородные ингаляторы различных моделей и модификаций. Достоинством кислородного ингалятора является наличие конденсатора-увлажнителя газовой смеси, использующего влагу выдыхаемого воздуха. Для расчёта оставшегося в баллоне количества кислорода в литрах обычно величину давления в баллоне в атмосферах (по манометру редуктора) умножают на величину ёмкости баллона в литрах. Например, в баллоне вместимостью 2 литра манометр показывает давление кислорода 100 атм. Объём кислорода в этом случае равен 100 × 2 = 200 литров[25].
В пищевой промышленности[править | править код]
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948[26], как пропеллент и упаковочный газ.
В химической промышленности[править | править код]
В химической промышленности кислород используют как реактив-окислитель в многочисленных синтезах, например, окисления углеводородов в кислородсодержащие соединения (спирты, альдегиды, кислоты), диоксид серы в триоксид серы, аммиака в оксиды азота в производстве азотной кислоты. Вследствие высоких температур, развивающихся при окислении, последние описанные реакции часто проводят в режиме горения.
В сельском хозяйстве[править | править код]
В тепличном хозяйстве для изготовления кислородных коктейлей, для прибавки в весе у животных, для обогащения кислородом водной среды в рыбоводстве.
Биологическая роль кислорода[править | править код]
Аварийный запас кислорода в бомбоубежище
Большинство живых существ (аэробы) дышат кислородом.
Широко используется кислород в медицине. При сердечно-сосудистых заболеваниях для улучшения обменных процессов в желудок вводили кислородную пену («кислородный коктейль»). Подкожное введение кислорода используют при трофических язвах, слоновости, гангрене и других серьёзных заболеваниях. Для обеззараживания и дезодорации воздуха и очистки питьевой воды применяют искусственное обогащение озоном. Радиоактивный изотоп кислорода 15O применяется для исследований скорости кровотока, лёгочной вентиляции.
Токсические производные кислорода[править | править код]
Некоторые производные кислорода (т. н. реактивные формы кислорода), такие, как синглетный кислород, пероксид водорода, супероксид, озон и гидроксильный радикал, являются токсичными и реакционноспособными продуктами. Они образуются в процессе активирования или частичного восстановления кислорода. Супероксид (супероксидный радикал), пероксид водорода и гидроксильный радикал могут образовываться в клетках и тканях организма человека и животных и вызывают оксидативный стресс.
Токсичность кислорода[править | править код]
Длительное вдыхание чистого кислорода может иметь опасные последствия для организма. Безопасно длительно дышать при обычном давлении смесями, содержащими до 60 % кислорода, вдыхая и выдыхая через нос, поскольку зубная эмаль и верхние дыхательные пути особенно страдают от контакта с чистым кислородом[27]. Дыхание 90 % кислородом в течение 3 суток приводит к тахикардии, рвоте, пневмонии, судорогам. При повышении давления токсическое действие кислорода ускоряется и усиливается. Молодые люди более чувствительны к токсическому действию кислорода, чем пожилые[28].
Изотопы[править | править код]
Кислород имеет три устойчивых изотопа: 16O, 17O и 18O, среднее содержание которых составляет соответственно 99,759 %, 0,037 % и 0,204 % от общего числа атомов кислорода на Земле. Резкое преобладание в смеси изотопов наиболее лёгкого из них 16O связано с тем, что ядро атома 16O состоит из 8 протонов и 8 нейтронов (дважды магическое ядро с заполненными нейтронной и протонной оболочками). А такие ядра, как следует из теории строения атомного ядра, обладают особой устойчивостью.
Также известны радиоактивные изотопы кислорода с массовыми числами от 12O до 28O. Все радиоактивные изотопы кислорода имеют малый период полураспада, наиболее долгоживущий из них — 15O с периодом полураспада ~120 секунд. Наиболее краткоживущий изотоп 12O имеет период полураспада 5,8⋅10−22 секунд.
См. также[править | править код]
- Категория:Соединения кислорода
Примечания[править | править код]
- Комментарии
- ↑ Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.
- Источники
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 387. — 671 с. — 100 000 экз.
- ↑ Дикислород Архивная копия от 4 марта 2016 на Wayback Machine // Большая Энциклопедия Нефти Газа
- ↑ J. Priestley, Experiments and Observations on Different Kinds of Air, 1776.
- ↑ W. Ramsay, The Gases of the Atmosphere (the History of Their Discovery), Macmillan and Co, London, 1896.
- ↑ 1 2 Кнунянц И. Л. и др. Химическая энциклопедия. — Москва: Советская энциклопедия, 1990. — Т. 2. — С. 387—389. — 671 с. — 100 000 экз.
- ↑ Я. А. Угай. Общая и неорганическая химия. — Москва: Высшая школа, 1997. — С. 432—435. — 527 с.
- ↑ Crowe, S. A.; Døssing, L. N.; Beukes, N. J.; Bau, M.; Kruger, S. J.; Frei, R.; Canfield, D. E. Atmospheric oxygenation three billion years ago (англ.). — Nature, 2013. — Iss. 501, no. 7468. — P. 535—538. — doi:10.1038/nature12426. — PMID 24067713.
- ↑ Campbell, Neil A.; Reece, Jane B. Biology, 7th Edition. — San Francisco: Pearson – Benjamin Cummings, 2005. — С. 522–23. — ISBN 0-8053-7171-0.
- ↑ Freeman, Scott. Biological Science, 2nd. — Upper Saddle River, NJ: Pearson – Prentice Hall, 2005. — P. 214, 586. — ISBN Biological Science, 2nd.
- ↑ Berner, Robert A. Atmospheric oxygen over Phanerozoic time. — Proceedings of the National Academy of Sciences of the USA, 1999. — doi:10.1073/pnas.96.20.10955. — PMID 10500106. Архивировано 7 октября 2019 года.
- ↑ Butterfield, N. J. Oxygen, animals and oceanic ventilation: An alternative view (англ.). — Geobiology, 2009. — Iss. 7, no. 1. — P. 1—7. — doi:10.1111/j.1472-4669.2009.00188.x. — PMID 19200141.
- ↑ «Лёгкие планеты» находятся в океане. Дата обращения: 26 июля 2015. Архивировано 8 декабря 2015 года.
- ↑ Образование кислорода в природе и получение его в технике. © Зооинженерный факультет МСХА. Дата обращения: 26 июля 2015. Архивировано 8 декабря 2015 года.
- ↑ Dole, Malcolm. The Journal of General Physiology (англ.). — 1965. — Iss. 49, no. 1. — doi:10.1085/jgp.49.1.5. — PMID 5859927. Архивировано 17 января 2014 года.
- ↑ ТАСС: Наука — Учёные: кислород в атмосфере Земли появился на 800 млн лет раньше, чем считалось ранее. Дата обращения: 25 марта 2016. Архивировано 23 апреля 2016 года.
- ↑ Рябин В. А. и др., Термодинамические свойства веществ, 1977, с. 127.
- ↑ 1 2 3 Inorganic Crystal Structure Database. Дата обращения: 3 августа 2009. Архивировано 3 марта 2012 года.
- ↑ Yu. A. Freiman, H. J. Jodl. Solid oxygen // Physics Reports. — 2004. — Т. 401, № 1—4. — С. 1—228. — doi:10.1016/j.physrep.2004.06.002.
- ↑ Hiroshi Fujihisa, Yuichi Akahama, Haruki Kawamura, Yasuo Ohishi, Osamu Shimomura, Hiroshi Yamawaki, Mami Sakashita, Yoshito Gotoh, Satoshi Takeya, and Kazumasa Honda. O8 Cluster Structure of the Epsilon Phase of Solid Oxygen // Phys. Rev. Lett.. — 2006. — Т. 97. — С. 085503. — doi:10.1103/PhysRevLett.97.085503.
- ↑ Lars F. Lundegaard, Gunnar Weck, Malcolm I. McMahon, Serge Desgreniers, Paul Loubeyre. Observation of an O8 molecular lattice in the ε phase of solid oxygen (англ.) // Nature. — 2006. — Vol. 443. — P. 201—204. — doi:10.1038/nature05174.
- ↑ Margaret-Jane Crawford и Thomas M. Klapötke. The trifluorooxonium cation, OF3+ (англ.) // Journal of Fluorine Chemistry. — 1999. — Vol. 99, iss. 2. — P. 151—156. — doi:10.1016/S0022-1139(99)00139-6. Архивировано 24 сентября 2015 года.
- ↑ Curie P., Curie M. Effets chimiques produits par les rayons de Becquerel (фр.) // Comptes rendus de l’Académie des Sciences (англ.) (рус. : magazine. — 1899. — Vol. 129. — P. 823—825. Архивировано 16 февраля 2016 года.
- ↑ Радиационная химия // Энциклопедический словарь юного химика. 2-е изд. / Сост. В. А. Крицман, В. В. Станцо. — М.: Педагогика, 1990. — С. 200. — ISBN 5-7155-0292-6.
- ↑ Руководство для врачей скорой помощи / Михайлович В. А. — 2-е изд., перераб. и доп. — Л.: Медицина, 1990. — С. 28—33. — 544 с. — 120 000 экз. — ISBN 5-225-01503-4.
- ↑ Food-Info.net: E-numbers: E948 : Oxygen Архивная копия от 4 апреля 2009 на Wayback Machine.
- ↑ Трагедии советского подплава – Владимир Шигин – Google Books
- ↑ Вредные химические вещества: Неорганические соединения элементов V—VIII групп. Справочник. — Л., 1989. — С. 150—170
Литература[править | править код]
- Кислород / Зломанов В. П. // Киреев — Конго. — М. : Большая российская энциклопедия, 2009. — С. 59. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 14). — ISBN 978-5-85270-345-3.
- Рябин В. А., Остроумов М. А., Свит Т. Ф. Термодинамические свойства веществ. Справочник. — Л.: Химия, 1977. — 392 с.
Из БРЭ:
- Saunders N. Oxygen and the elements of group 16. Oxf., 2003. (англ.)
- Дроздов А. А., Зломанов В. П., Мазо Г. Н., Спиридонов Ф. М. Неорганическая химия. М., 2004. Т. 2.
- Шрайвер Д., Эткинс П. Неорганическая химия. М., 2004. Т. 1-2.
Ссылки[править | править код]
- Кислород на Webelements Архивная копия от 30 августа 2004 на Wayback Machine (англ.)
- Кислород в Популярной библиотеке химических элементов Архивная копия от 30 сентября 2007 на Wayback Machine
- Твёрдый кислород при сверхбольших давлениях: образование молекул O4 Архивная копия от 14 января 2020 на Wayback Machine
- Выяснено магнитное упорядочение оранжевого кислорода Архивная копия от 12 сентября 2011 на Wayback Machine
- Магнитный коллапс в твёрдом кислороде Архивная копия от 27 марта 2008 на Wayback Machine
- Растворимость кислорода в воде TWT department of MPEI: Live Calculations by MAS
- Учёным удалось напрямую получить молекулы кислорода из углекислого газа Архивная копия от 3 февраля 2015 на Wayback Machine
- Российским кислородом дышит весь мир: О проблемах сохранения леса














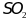


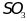

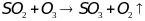











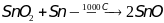







![{displaystyle {ce {2HgO ->[t] 2Hg + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/804710fd51b4d0c4adca861caa5d341fb5921d84)



















![{displaystyle {ce {2 KMnO4 ->[t] K2MnO4 + MnO2 + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9cfb966f6b5d6c6865f0f56ef87181f3defaef4b)
![{displaystyle {ce {2 H2O2 ->[{ce {MnO2}}] 2 H2O + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85f0079d82b29aa9af6fe4a616e5202fed2b946)

![{displaystyle {ce {2 HgO ->[100 {ce {^{o}C}}] 2 Hg + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/00eeaa80d9f71d225d67c1f41bd4109a6d39a909)
![{displaystyle {ce {2H2O ->[e^-] 2H2 ^ + O2 ^}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8db728b3843f8a1cdd2018f9fc927b902a80673f)


