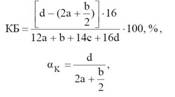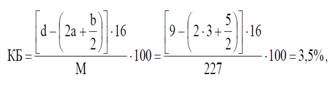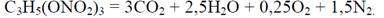Расчет кислородного баланса вв
Кислородным
балансом
(КБ) называется выраженное в процентах
отношение массы свободного кислорода,
остающегося после окисления всего
углерода, содержащегося в ВВ, в углекислый
газ СО2,
всего водорода в H2O,
всех металлов в высшие оксиды к массе
взятого ВВ. Азот при этом должен оставаться
свободным в виде N2.
Вещества с
положительным КБ (селитра, нитроглицерин),
т.е. окислители, для увеличения мощности
ВВ необходимо смешивать с соединениями,
имеющими отрицательный кислородный
баланс, или с горючими, в которых не
содержится кислорода.
При отрицательном
кислородном балансе в результате взрыва
могут образоваться ядовитые газы (СО),
сажа (С), а при положительном – ядовитые
оксиды азота. Поэтому в промышленности
стремятся использовать ВВ такого
состава, чтобы их кислородный баланс
приближался к нулю. Кислород ВВ в этом
случае расходуется таким образом, что
в первую очередь он идёт на окисление
металлов, водорода, серы в диоксид,
углерода первостепенно в оксид, далее
в диоксид.
Кислородный
баланс индивидуальных взрывчатых
веществ можно вычислить по их химическим
формулам. Если индивидуальное ВВ содержит
атомы кислорода, водорода и азота и его
химический состав описывается формулой
CaHbNcOd
, то его
кислородный баланс вычисляется по
формуле:
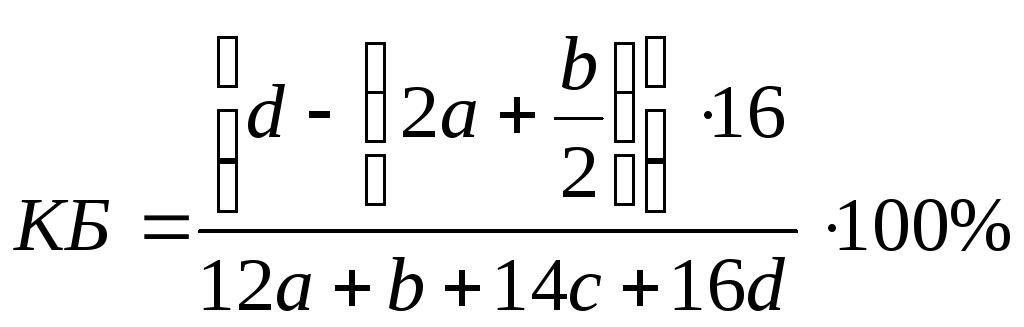
где
2a
– число атомов кислорода в СО2
, b/2
– число атомов кислорода в H2O,
а знаменатель – это масса моля ВВ, г/моль.
Для смесевых ВВ
вычисление КБ производится, исходя из
процентного содержания компонентов
смеси и по ее условной химической
формуле, или по величине кислородного
баланса каждого компонента, приводимого
в справочниках.
В
том случае, если помимо атомов водорода,
кислорода, углерода и азота в состав ВВ
входит алюминий и его химический состав
выражается условной формулой CaHbNcOdAll
, кислородный баланс ВВ вычисляют по
формуле:

в
которой 3/2 l
– число атомов
кислорода в Al2O3.
Кислородный баланс
смесевых ВВ на практике чаще вычисляют,
относя к одному килограмму смеси. В этом
случае расчетная формула имеет вид:
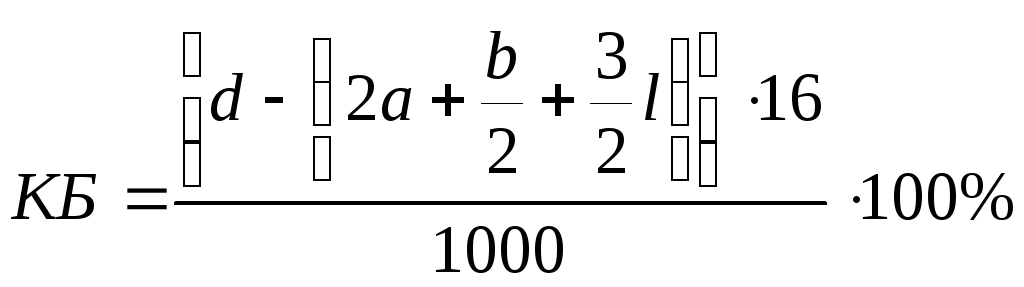
В
случае, когда известны величина
кислородного баланса и массовое
содержание (wi)
каждого компонента смесевого ВВ, формула
для расчета кислородного баланса примет
вид:
КБ
= S(КБi
×
wI).
Расчет тепловых эффектов реакций взрыва
Расчет теплового эффекта реакций взрыва
производят на основе первого начала
(закона) термодинамики и закона Гесса.
Согласно первому началу термодинамики
вся теплота, сообщенная системе,
расходуется на изменение внутренней
энергии системы, а также на совершение
работы системой:
Q=DU+А
или dQ=dU+dА
Где
U
– внутренняя энергия; А – работа.
Для
случая изобарного процесса (при
постоянстве давления Р=const)
это уравнение, определяющее тепловой
эффект реакции взрыва QP,
примет вид:
dQP=dU+PdV=d(U+PV)
или dQP=dН
где
величина Н=U+PV
называется энтальпией. Энтальпия
является функцией состояния системы и
определяется ее параметрами.
В
случае изохорного процесса (при
постоянстве объёма V=const)
тепловой эффект реакции взрыва равен
dQv=dU
или Qv=DU(298)=DН(298)-Sn·R·298
где
Sn
– сумма стехиометрических коэффициентов
при газовых компонентах в уравнении
реакции взрыва; R=8,31 Дж/(моль·К)
– универсальная газовая постоянная.
Для
реакций, протекающих в изотермических
условиях (при постоянстве температуры
Т=const),
тепловой эффект вычисляют в соответствии
с законом Гесса
DrH0298=[ånкон(DfH0298)кон-ånисх(DfH0298)исх]
где:
DfН0298
– стандартные энтальпии образования
исходных и конечных веществ, т.е. энтальпии
реакции образования 1 моль этих веществ
из простых веществ, взятые в форме,
устойчивой при нормальных условиях
(Р0=101,3 кПа;
Т0=298К).
Размерность их следующая: кДж/моль или
ккал/моль (в более поздней литературе).
Эти величины приводятся в справочниках
физико-химических величин (см. приложение);
n
– стехиометрические коэффициенты в
реакции.
В
настоящее время помимо термодинамической
системы знаков существует термохимическая
система знаков теплоты и работы. Согласно
последней тепловой эффект Q
противоположен по знаку изменению
энтальпий реакции DrH0298:
Q=
-DrH0298,
кДж/моль или Q=
-DrH0298·n,
кДж
где
n
– число молей вещества. Таким образом,
если величина DrH0298<0,
то реакция протекает с тепловыделением
(+Q,
-DH),
и, наоборот, в случае, когда DrH0298>0,
реакция протекает с теплопоглощением
(-Q,
+DH).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Oxygen balance (OB, OB%, or Ω) is an expression that is used to indicate the degree to which an explosive can be oxidized,[1] to determine if an explosive molecule contains enough oxygen to fully oxidize the other atoms in the explosive. For example, fully oxidized carbon forms carbon dioxide, hydrogen forms water, sulfur forms sulfur dioxide, and metals form metal oxides. A molecule is said to have a positive oxygen balance if it contains more oxygen than is needed and a negative oxygen balance if it contains less oxygen than is needed.[2]
An explosive with a negative oxygen balance will lead to incomplete combustion, which commonly produces carbon monoxide, which is a toxic gas. Explosives with negative or positive oxygen balance are commonly mixed with other energetic materials that are either oxygen positive or negative, respectively, to increase the explosive’s power. For example, TNT is an oxygen negative explosive and is commonly mixed with oxygen positive energetic materials or fuels to increase its power.[3][4]
Calculating oxygen balance[edit]
The procedure for calculating oxygen balance in terms of 100 grams of the explosive material is to determine the number of moles of oxygen that are excess or deficient for 100 grams of the compound.
[citation needed]
X = number of atoms of carbon, Y = number of atoms of hydrogen, Z = number of atoms of oxygen, and M = number of atoms of metal (metallic oxide produced).
In the case of TNT (C6H2(NO2)3CH3),
Molecular weight = 227.1
X = 7 (number of carbon atoms)
Y = 5 (number of hydrogen atoms)
Z = 6 (number of oxygen atoms)
Therefore,
- OB% = −73.97% for TNT
Examples of materials with negative oxygen balance are e.g. nitromethane (-39%), trinitrotoluene (−74%), aluminium powder (−89%), sulfur (−100%), or carbon (−266.7%). Examples of materials with positive oxygen balance are e.g. ammonium nitrate (+20%), ammonium perchlorate (+34%), potassium chlorate (+39.2%), sodium chlorate (+45%), potassium nitrate (+47.5%), tetranitromethane (+49%), lithium perchlorate (+60%), or nitroglycerine (+3.5%). Ethylene glycol dinitrate has an oxygen balance of zero, as does the theoretical compound trinitrotriazine.[citation needed]
Oxygen balance and power[edit]
Because sensitivity, brisance, and strength are properties resulting from a complex explosive chemical reaction, a simple relationship such as oxygen balance cannot be depended upon to yield universally consistent results. When using oxygen balance to predict properties of one explosive relative to another, it is to be expected that one with an oxygen balance closer to zero will be the more brisant, powerful, and sensitive; however, many exceptions to this rule do exist.[citation needed]
One area in which oxygen balance can be applied is in the processing of mixtures of explosives. The family of explosives called amatols are mixtures of ammonium nitrate and TNT. Ammonium nitrate has an oxygen balance of +20% and TNT has an oxygen balance of −74%, so it would appear that the mixture yielding an oxygen balance of zero would also result in the best explosive properties. In actual practice a mixture of 80% ammonium nitrate and 20% TNT by weight yields an oxygen balance of +1%, the best properties of all mixtures, and an increase in strength of 30% over TNT.[citation needed]
References[edit]
- ^ “The Oxygen Balance for Thermal Hazards Assessment”. iomosaic.com. Retrieved 2022-10-11.
- ^ Meyer, Rudolf; Köhler, Josef; Homburg, Axel (2007). Explosives (6th ed.). Wiley VCH. ISBN 978-3-527-31656-4.
- ^ Campbell J (1985). Naval weapons of World War Two. London: Conway Maritime Press. p. 100. ISBN 978-0-85177-329-2.
- ^ U.S. Explosive Ordnance, Bureau of Ordnance. Washington, D.C.: U.S. Department of the Navy. 1947. p. 580.
Кислородный баланс
Кислородный баланс характеризует соотношение между содержанием во взрывчатом веществе горючих элементов и кислорода.
Вычисляют кислородный баланс обычно как разность между весовым количеством кислорода, содержащегося во ВВ, и количеством кислорода, потребным для полного окисления горючих элементов, входящих в его состав.
Расчет ведут на 100 г ВВ, в соответствии, с чем кислородный баланс выражают в процентах. Обеспеченность состава кислородом характеризуется кислородным балансом (КБ) или кислородным коэффициентом ak, которые в относительных величинах выражают избыток или недостаток кислорода для полного окисления горючих элементов до высших оксидов, например, СО2и Н2О.
Если ВВ содержит как раз столько кислорода, сколько нужно для полного окисления входящих в его состав горючих элементов, то кислородный баланс его равен нулю.
Если избыток – КБ положителен, при недостатке кислорода – КБ отрицателен.
Сбалансированность ВВ по кислороду соответствует КБ – 0; ak= 1.
Если ВВ содержит углерод, водород, азот и кислород и описывается уравнением СаHbNcOd, то величины кислородного баланса и кислородного коэффициента могут определяться по формулам
a, b, c, d – число атомов соответственно С, H, N и O. В химической формуле ВВ; 12, 1, 14, 16 –округленные до целого числа атомной массы соответственно.
Знаменатель определяет молекулярную массу ВВ: М=12а+b+14с+16d.
a, b, c, d – число атомов соответственно С, H, N и O. В химической формуле ВВ; 12, 1, 14, 16 –округленные до целого числа атомной массы соответственно.
Знаменатель определяет молекулярную массу ВВ: М=12а+b+14с+16d.
Расчет состава продуктов взрывчатого разложения ВВ с положительным кислородным балансом (I группа ВВ)
При составлении уравнений реакций взрыва ВВ с положительным кислородным балансом руководствуются следующими положениями: углерод окисляется до углекислоты СО2, водород до воды Н2О, азот и избыток кислорода выделяются в элементарном виде (N2, O2).
Пример 1. Составить уравнение реакции (определить состав продуктов взрыва) взрывчатого разложения индивидуального ВВ.
Нитроглицерин: С3Н5(ONO2)3, М = 227.
Определяем величину кислородного баланса для нитроглицерина:
КБ > 0 Запишем уравнение реакции:
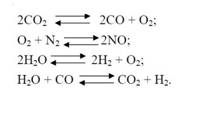
Кроме основной реакции протекают реакции диссоциации:
Но так как КБ = 3, 5 (намного больше нуля) –реакции смещены в сторону образования СО2, Н2О, N2, следовательно доля газов СО, Н2и NО в продуктах взрывчатого разложения незначительна и ими можно пренебречь.
Расчет состава продуктов взрывчатого разложения ВВ с отрицательным кислородным балансом (II группа ВВ) при составлении уравнений реакций взрывчатого разложения ВВ II группы необходимо учитывать следующие особенности:
• водород окисляется до Н2О,
• углерод окисляется до СО,
• оставшийся кислород окисляет часть СО до СО2,
• азот выделяется в виде N2.
Пример 2. Составить уравнение реакции взрывчатого разложения пентаэритриттетранитрата (тэна) С(СН2ОNO2)4, М = 316. КБ = – 10, 1%.
1. Составляем уравнение реакции разложения тэна:
Для определения величины коэффициентов СО и СО2:
5СО + 1, 5О2= хСО + уСО2,
х + у = n –сумма атомов углерода,
х + 2у = m –сумма атомов кислорода,


Задачи для самостоятельного решения( прислать на почту mitrofanovanngasu@yandex. ru до 25. 05)
1. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва 10 кг бутилового спирта (С4Н9ОН): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
2. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва5 кг метана (СН4): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
3. Рассчитать мощность (тротиловый эквивалент)возможного аварийного взрыва 20 кг глицерина (С3Н8О3): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
4. Определить количество взорвавшихся паров пропана (С3Н8), если после аварии отмечены разрушения на расстоянии 25 м от эпицентра взрыва. Взрыв произошел в технологическом оборудовании.
5. Рассчитать мощность (тротиловый эквивалент)возможного аварийного взрыва 40 кг ксилола (С8Н10): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
6. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва15 кг диметилгептана (С9Н20): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
7. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 30 кг диметилбутана (С6Н14): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
8. Определить количество взорвавшихся паров бензола(С6Н6), если послеаварии отмечены разрушения на расстоянии 100 м от эпицентра взрыва. Взрыв произошел в помещении.
9. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 25 кг диметилового эфира (С2Н6О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
10. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва 5 кг бензола (С6Н6): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
11. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 12 кг дибутилового эфира (С4Н10О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
12. Определить количество взорвавшихся паров меана (СН4), если после аварии отмечены разрушения на расстоянии 14 м от эпицентра взрыва. Взрыв произошел в технологическом оборудовании.
13. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 2 кг нитроэтана (С2Н5NО2): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
14. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 15 кг уксуснобутилового эфира (С6Н12О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
15. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 15 кг этилбензола (С8Н10): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
16. Определить количество взорвавшихся паровтолуола (С7Н8), если послеаварии отмечены разрушения на расстоянии 100 м от эпицентра взрыва. Взрыв произошел в помещении.
17. Рассчитать мощность (тротиловый эквивалент) возможного аварийного взрыва при взрыве 5 кг этиленгликоля (С2Н6О): а) в технологическом оборудовании, б) в облаке. Оценить безопасное расстояние по действию ударной воздушной волны.
Кислоро́дный бала́нс — отношение количества кислорода, содержащегося во взрывчатом веществе (ВВ) к его количеству, необходимому для полного окисления всех остальных компонентов этого ВВ[1].
Кислородный баланс зависит в основном от состава ВВ, а также от состояния заряда (плотность, влажность, степень измельчения) и условий взрывания (наличие оболочки, материал оболочки и др.).
При полном соответствии количества кислорода количеству окисляемых компонентов ВВ кислородный баланс равен нулю (нулевой кислородный баланс). Соотношение компонентов при этом называют стехиометрическим. При избытке кислорода баланс считается положительным (положительный кислородный баланс), а при недостатке — отрицательным (отрицательный кислородный баланс).
Обычно кислородный баланс выражают[1]:
- в граммах избытка (+) или недостатка (−) кислорода на 1 грамм ВВ;
- в процентах.
В зависимости от кислородного баланса при взрыве ВВ образуются различные продукты взрыва.
Кислородный баланс некоторых ВВ:
- Аммонит скальный № 1: (−0,79)[2] %
- Аммонал: (+0,18) [2]%
- Гексоген: (−21,5) %
- Нитроглицерин: (+3,5) %
- 2,4,6-тринитротолуол (тротил): (−74,0) %
- Этиленгликольдинитрат (ЭГДН): (0,0) %
Примечания[править | править код]
- ↑ 1 2 Поздняков З. Г., Росси Б. Д. Справочник по промышленным взрывчатым веществам и средствам взрывания. — М.: Недра, 1977. — С. 27.
- ↑ 1 2 Поздняков З. Г., Росси Б. Д. Справочник по промышленным взрывчатым веществам и средствам взрывания. — М.: Недра, 1977. — С. 96.