Основность кислоты определяется числом протонов, которое отдает молекула кислоты, реагируя с основанием кислотность основания определяется числом протонов, присоединяемых молекулой основания прн взаимодействии его с кислотой. [c.8]
Что определяет кислотность основания [c.37]
Следовательно, эквивалент основания может быть вычислен как частное от деления молекулярной массы основания на заряд иона металла или, что то же самое, на кислотность основания. По тем же соображениям эквивалент соли может быть вычислен как частное от деления ее молекулярной массы на произведение числа ионов металла и его заряда. [c.5]
Для трех- и более кислотного основания возможно существование нескольких основных солей. Так, Сг(ОН)з и НМОз образуют две основные соли. Для составления формул пищут основные остатки от Сг(ОН)з и определяют их кислотности Сг(0Н)2 и Сг(ОН). Затем добавляют кислотные остатки Сг(ОН)2МОз и СгОН(ЫОз)2. [c.37]
Число способны к ионизации гидроксильных групп определяет кислотность основания (И 5). [c.172]
Какие вещества относятся к классу оснований Приведите примеры характерных для них реакций. Чем определяется кислотность оснований [c.52]
Соответственно молярная масса эквивалента основания равна его молярной массе, деленной на кислотность основания (число гидроксильных групп, участвуюших в реакции). Например [c.184]
В литературе описано несколько более или менее специальных методов вычисления констант диссоциации многоосновных кислот (или много кислотных оснований) по данным титрования. Из этих методов для нас представляет особый интерес метод, примененный Симсом [1]. Симс исходит из того факта, что кривая титрования многоосновной кислоты похожа на кривую титрования смеси соответствующего числа одноосновных кислот, и вычисляет ряд констант равновесия реакций титрования особым методом приближения, предположив, что титруемый раствор является смесью одноосновных кислот. Истинные константы равновесия вычисляют из найденных констант равновесия реакций титрования, используя специально выведенные формулы. Метод Симса в общем более сложен и менее удобен, чем описываемый ниже метод, в котором ступенчатые константы определяют непосредственным приближением ряда промежуточных констант. [c.37]
Для многоосновных кислот и многокислотных оснований характерна ступенчатая диссоциация с отрывом одного нона Н+ или ОН по каждой ступени. Таким образом, число ступеней определяется основностью кислоты или кислотностью основания. Поскольку первый ион отрывается от нейтральной частицы, а последующие от частиц с зарядом противоположного знака, который увеличивается с каждой ступенью на единицу, то степень электролитической диссоциации сильно уменьшается при переходе от первой ступени к каждой следующей. Примером может быть фосфорная кислота при с=0,1 моль/л [c.204]
Кислотность основания определяется числом гидроксильных групп (гидроксогрупп). Например, КОН — однокислотное основание, Са(ОН)а — двухкислотное, Ре(ОН)з—трехкислотное и т. д. Двух- и многокислотные основання диссоциируют ступенчато [c.75]
При нереходе к основным растворителям, у которых lg Ка много меньше суммы остальных членов в уравнении (VI 1,32), логарифм константы основания уже меньше нуля. В зависимости от того, какова основность (или кислотность) основания, р/ в приобретает различные значения. Ранее одинаковые в своей силе основания теперь приобретают индивидуальные свойства. Сила оснований в этих растворителях не только ослабляется, но и дифференцируется. [c.354]
Искомой величиной является абсолютная активность ионов лиония амн+, отнесенная к водному раствору протонов (ионов гидроксония) как к стандарту. Константа кислотности основания через абсолютные активности выразится так [c.414]
В состав молекулы всякого основания входят металл и некоторое, Б зависимости от его валентности, число радикалов ОН. Зная, что гидроксил одновалентен, из формулы основания легко найти валентность металла или по валентности металла составить формулу основания. При рационализированных названиях гидроокисей (с использованием для радикала ОН термина гидроксид или гидроксо ) формула дается прямо в названии например, медь-гидроксид —СиОН или медь-дигидроксид —Си (ОН) 2- Число имеющихся в молекуле гидроксилов определяет кислотность основания. Так, NaOH — однокислотное основание, Mg(0H)2 — двухкислотное и т. д. [c.55]
Эквиваленты одноатомных и многоатомных ионов равны их ионной массе, деленной на заряд. Эквиваленты солей, кислот и оснований в реакциях обмена выражаются через молекулярную массу, деленную на произведение абсолютного значения заряда одного из ионов на число их в соединении. Причем эквивалент кислоты равен ее молекулярной массе, деленной на ее основность в реакции (число водородных ионов, участвующих в химической реакции), а эквивалент основания — молекулярной массе, деленной на кислотность основания в реакции (число гидроксильных групп, принимающих участие в химической реакции). Аналогичный подход применяется и в других более сложных случаях. Например, в окислительно-восстановительных реакциях эквивалент окислителя (восстановителя) соответствует молекулярной массе, деленной на то число электронов, которое приобретается (теряется) одной молекулой окислителя (восстановителя) в рассматриваемой окислительно-восстановительной реакции. [c.26]
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у— кислотность основания. [c.188]
Кислотность основания определяют числом гидроксильных групп (гидроксогрупп) в его молекуле. Например, NH4OH— однокислотное основание, Са(ОН)з — двухкислотное, Ре(ОН)з — трехкислотное и т. д. Двух- и многокислотные основания диссоциируют ступенчато. Например [c.154]
Кислотность основания 36 Кислотный(е) остаток(ки) 31,39,40 Кислотообразующий элемент 38 Кислоты 29, 37, 187, 234 сл. [c.704]
Для характеристики диссоциации оснований в растворе часто используют константу кислотности основания Ка, лучше определяющую суть происходящего в растворе процесса [c.25]
Константа диссоциации основания и константа кислотности основания, т. е. сопряженной с ним катионной кислоты, связаны следующей формулой [c.25]
Основываясь на том, что, как свидетельствуют экспериментальные данные, константы кислотности оснований (катионных кислот) сравнительно мало изменяются при переходе от растворителя к растворителю (см. гл. VI), Гамметт предложил оценивать кислотность любых растворов по степени превращения индикатора основания в его ионную форму. [c.412]
Предположение Гамметта о неизменности констант кислотности индикаторов-оснований равносильно предположению, что константы кислотности оснований выражены через абсолютные активностп, отнесенные к водному раствору как к стандарту. [c.414]
В настоящее время для оценки кислотности кроме функций ш Я( ) предложены функция Я(+), основанная на зависимости положения равновесия реакции BH + В+ + Н+ от кислотности, а также функция кислотности основанная на зависимости положения равновесия реакции ВОН + + Н+ + НаО (R+ — ион карбония, ВОН — арилкарбинол) от кис- [c.416]
Число гидроксигрупп определяет кислотность основания, т. е. способность данного основания нейтрализовать кислоты. Например, NaOH является однокислотным основанием, а Са(ОН)2 двукислотным основанием и т. д., так как при реакции нейтрализации этих оснований одноосновной кислотой (например, H I) на 1 моль основания расходуется соответственно [c.124]
Для основных солей применяют следующее правило вначале указывают слово гидроксо , затем — название кислотного остатка соответствующей кислоты и в конце — название металла MgOH l—гид-роксохлорид магния. Кислые соли образуются только двух- и более основными кислотами, а основные — двух- и более кислотными основаниями. [c.146]
Основания. Основаниями называют вещества, которые при электролитической диссоциации в водных растворах образуют в качестве анионов только гидроксид-ионы ОН . Кислотность основания определяется числом гидроксогрупп в его молекуле. Так, NH4OH, NaOH — однокислотные основания, М (ОН)з — двухкислотное, Fe (ОН)з — трехкислотное. [c.42]
Кислотность основания — число групп ОН способных обмениваться на кислотный остаток. Например, NaOH — однокислотное основание, Са(ОН)2 — двухкислотное основание. По этому признаку основания бывают одно-, двух- и т.д. кислотными. Многокислотные основания диссоциируют ступенчато и могут образовывать несколько рядов солей, напри- [c.24]
Кислотность основания определяется числом его гидроксильных групп (гидроксогрупп). Например, NH OH — однокислотное основание, Са(0Н)2 — двухкислотное, Ре(ОН)з — трехкислотное и т. д. Двух- и многокпслотные основания диссоциируют ступенчато [c.110]
Чи лo гидроксид-ионов, которые образуются при распаде одной частицы, определяет кислотность основания. Например, NaOH — однокислотное основание, Са (ОН)а— двух кислотное, Ре(ОН)з — трех кислотное. Двух- и трехкислотные основания в водных растворах диссоциируют ступенчато, т. е. постепенно отщепляют гидрокснд-ионы. Например, в случае гидроксида кальция Са(ОН)а диссоциация протекает в две tyneHn [c.61]
В состав молекулы всякого основания входят металл и некоторое, в зависимости от его валентности, число радикалов ОН. Зная, что гидроксил одновалентен, легко из формулы основания найти валентность металла или по валентности металла построить формулу основания. Число имеющихся в молекуле гидроксилов определяет кислотность основания. Так, NaOH — однокислотное основание, Mg (ОН) 2 — двухкислотное и т.д. [c.46]
В зависимости от числа гидроксильных групп основания делят иа однокислотные и многокислотные (NaOH — однокислотное основание, Са(0Н)2 — двух-кислотное основание). [c.33]
Число гидроксид-ионоа, которое образуется при распаде одной молекулы, определяет кислотность основания. Например, NaOH и КОН — однокислотные основания, Ва(0Н)2 и Си (ОН) 2 — двухкислотные основания, В1(0Н)з и La(0H)3 — трехкислотные основания. Двух-н трехкислотные основания диссоциируют в водных растворах ступенчато, т. е. постепенно отщепляют гидроксид-ионы. Так, для гидроксида кальция Са(0Н)2 диссоциация протекает в две ступени [c.83]
Шварценбах [26] описал индикатор с необычными свойствами— перхлорат 5-пиридинглутакондиальдегида. Однозарядный бесцветный катион переходит при добавлении щелочи в однозарядный анион, обладающий красной окраской. Поскольку при изменении среды отношение у+ у-, по-видимому, изменяется много меньше, чем Ущ +1У , то следует ожидать, что функции кислотности, основанные на колориметрических измерениях с этим индикатором, более точно отражают активность протона, чем Яо или Я . [c.155]
В кислотно-основной системе (в том смысле, в каком этот термин применяет Бренстед [3]), центральная группа М является. V-кислотным основанием и MA.iv —iV-основной кислотой, образованной присоединением N протонов. В окислительно-восстановительной системе центральная группа М соответствует полностью окисленному, а MA,v—полностью восстановленному соединению, образованному обратимым присоединением N электронов или атомов водорода. Если рассматривать атом водорода как ион водорода плюс электрон, то окислительно-восстановительные процессы всегда можно формально свести к электронным процессам. Окислительно-восстановительные системы существенно отличаются от кислотпо-основяых тем, что в последних промежуточные соединения всегда присутствуют в различимых концентрациях, а в окислительно-восстановительных системах это наблюдается очень редко. В качестве наиболее важных примеров следует отметить уже упомянутые краситель Вурстера и пиоцианин, а также равновесие между ионами Мп (II), Мп (III) и Мп (IV), изученное ГрубейХуберихом [4]. В указанной системе (в отличие от других случаев изменения валентности ионов металла, например при окислении Sn (И) до Sn (IV), Au (I) до Au (III) или T1 (1) до T1 (III) промежуточный ион [c.20]
Неорганическая химия (1987) — [
c.154
]
Химия для поступающих в вузы 1985 (1985) — [
c.110
]
Химия для поступающих в вузы 1993 (1993) — [
c.126
]
Учебник общей химии 1963 (0) — [
c.44
]
Химия Издание 2 (1988) — [
c.102
]
Основы общей химии Том 2 Издание 3 (1973) — [
c.172
]
Иногда вас просят рассчитать pOH, а не pH. Вот обзор определения pOH и пример расчета.
Содержание
- Ключевые выводы: как рассчитать pOH
- Кислоты, основания, pH и pOH
- Как определить pOH с помощью расчетов
- Примеры проблем с pOH
- Понять, почему pH + pOH = 14
Ключевые выводы: как рассчитать pOH
- pH – это показатель кислотности или концентрации ионов водорода, а pOH – показатель щелочности или концентрации гидроксид-ионов.
- Если вы знаете pH, это легко для расчета pOH, потому что pH + pOH = 14.
- Иногда вам нужно рассчитать pOH из концентрации гидроксид-иона [OH – ]. Здесь вам понадобится калькулятор, использующий уравнение pOH = -log [OH-].
Кислоты, основания, pH и pOH
Есть несколько способов определить кислоты и основания, но pH и pOH относятся к концентрации ионов водорода и концентрации гидроксид-иона соответственно. «P» в pH и pOH означает «отрицательный логарифм» и используется для облегчения работы с очень большими или малыми значениями. pH и pOH имеют значение только при нанесении на водные (водные) растворы. Когда вода диссоциирует, она дает ион водорода и гидроксид.
H 2 O ⇆ H + + OH –
При вычислении pOH помните, что [] относится к молярности, M.
K w = [H + ] [OH – ] = 1×10 -14 при 25 ° C
для чистой воды [H + ] = [OH – ] = 1×10 -7
Кислотный раствор: [H + ]> 1×10 -7
Базовое решение: [H + ] -7
Как определить pOH с помощью расчетов
Есть несколько различных формул, которые вы можете использовать для расчета pOH, концентрации гидроксид-иона или pH (если вы знаете pOH):
pOH = -log 10 [OH – ]
[OH – ] = 10 -pOH
pOH + pH = 14 для любого водного раствора
Примеры проблем с pOH
Найдите [OH – ] с учетом pH или pOH. Вам дано, что pH = 4,5.
pOH + pH = 14
pOH + 4,5 = 14
pOH = 14 – 4,5
pOH = 9,5
[OH – ] = 10 -pOH
[OH – ] = 10 -9,5
[OH – ] = 3,2 x 10 -10 M
Найдите ион гидроксида концентрация раствора с pOH 5,90.
pOH = -log [OH – ]
5.90 = -log [OH – ]
Поскольку вы работаете с журналом, вы можете переписать уравнение, чтобы найти концентрацию гидроксид-иона:
[OH – ] = 10 -5.90
Чтобы решить эту проблему, воспользуйтесь научным калькулятором и введите 5,90 и используйте кнопку +/-, чтобы сделать его отрицательным, а затем нажмите клавишу 10 x . На некоторых калькуляторах вы можете просто взять обратный логарифм -5,90.
[OH – ] = 1. 25 x 10 -6 M
Найдите pOH химического раствора, если концентрация гидроксид-иона составляет 4,22 x 10 -5 M.
pOH = -log [OH – ]
pOH = -log [4,22 x 10 -5 ]
Чтобы найдите это на научном калькуляторе, введите 4,22 x 5 (сделайте отрицательным с помощью клавиши +/-), нажмите клавишу 10 x и нажмите равно, чтобы получить число в экспоненциальном представлении. Теперь нажмите журнал. Помните, что ваш ответ – отрицательное значение (-) этого числа.
pOH = – (-4,37)
pOH = 4,37
Понять, почему pH + pOH = 14
Вода, сама по себе или в составе водного раствора, подвергается самоионизации, что может быть представлено уравнением:
2 H 2 O ⇆ H 3 O + + OH –
Формы равновесия между неионизированной водой и гидрокарбонием (H 3 O + ) и гидроксид (OH – ) ионы. Выражение для константы равновесия Kw:
K w = [H 3 O + ] [OH – ]
Строго говоря, это отношение действительно только для водных растворов при 25 ° C, потому что тогда значение K w равно 1 x 10 -14 . Если взять журнал обеих сторон уравнения:
log (1 x 10 -14 ) = log [ H 3 O + ] + log [OH – ]
(Помните, что при умножении чисел добавляются их журналы.)
log (1 x 10 -14 ) = – 14
– 14 = журнал [H 3 O + ] + журнал [OH – ]
Умножение обеих частей уравнения на -1:
14 = – журнал [H 3 O + ] – журнал [OH – ]
pH определяется как – log [H 3 O + ], а pOH определяется как -log [OH – ], поэтому соотношение становится:
14 = pH – (-pOH)
14 = pH + pOH
Оcнованиями
называются химические
вещества, распадающиеся (диссоциирующие)
в водном растворе (или в расплаве) на
положительно заряженные ионы металла
и отрицательно заряженные ионы гидроксила
(определение Аррениуса).
Например:
NaOH
Na
+
+ OH
Гидроксид натрия катион натрия гидроксид-ион
Основаниями являются сложные вещества,
образующиеся при гидратации основных
оксидов.
Например:
CaO
+ H2O
= Ca(OH)2
– гидроксид кальция,
BaO + H2O
= Ва(ОН)2 –
гидроксид бария.
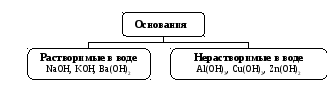
Классификация оснований
По растворимости в воде все основания
можно подразделить на растворимые в
воде и нерастворимые.
Основания, растворимые в воде, называются
щелочами(см. табл. 6 приложения).
Большинство
оснований в воде
нерастворимы.
Основания различаются по
кислотности.
Они бывают однокислотными и многокислотными.
Кислотность оснований
определяется количеством гидроксильных
групп, которые могут быть замещены на
кислотные остатки.
Рис. 2.4. Классификация
оснований
Однокислотные
основания образуются от одновалентных
металлов, а многокислотные
основания – от поливалентных металлов.
Например:
LiОН – однокислотное основание,
Са(ОН)2
– двухкислотное основание,
A1(ОН)3
– трехкислотное основание и т.д.
Графическое изображение формул оснований
При графическом изображении формул
оснований следует иметь в виду, что
число гидроксильных групп определяется
валентностью металла и, что атом водорода
связан с металлом через атом кислорода:
Например:
Ca(OH)2
H-O-Ca-O-H
Al(OH)3 Al O-H
O-H
Номенклатура оснований
По международной номенклатуре
названия оснований складываются из
слова «гидроксид»,
названия металла
и, если металл проявляет переменную
валентность, то в скобках указывается
его валентность.
Например:
КОН – гидроксид калия,
Сu(ОН)2
– гидроксид меди (II),
Fе(ОН)3
– гидроксид железа (III).
Для ряда оснований используются
тривиальные названия.
Например:
NaОН – едкий натр, каустическая
сода, каустик,
КОН – едкое кали,
Bа(ОН)2
– едкий барий,
Са(ОН)2
– гашеная известь.
Химические свойства оснований
Растворы щелочей – мыльные на ощупь и
меняют окраску индикаторов:
а) фиолетовый раствор лакмуса – в синий
цвет,
б) бесцветный раствор фенолфталеина –
в малиновый цвет.
1. Большинство
малорастворимых оснований при нагревании
легко разлагаются на
оксид и воду.
Например:
Сu(ОН)2
СuО + Н2О,
Sn(OH)2
SnO + Н2О.
Основания щелочных металлов
термически устойчивы.
Так, гидроксид натрия NaОН
кипит при Т
= 1400 C
без разложения.
2. Основания
взаимодействуют с кислотами
(реакция нейтрализации), образуя соль
и воду.
Например:
NaОН + НС1 = NaС1
+ Н2О,
Сu(ОН)2
+ Н2SO4
= СuSO4
+ 2H2O,
Мg(ОН)2
+ 2НNO3
= Мg(NO3)2
+ 2Н2О.
3. Основания взаимодействуют с кислотными оксидами.
Например:
Са(ОН)2
+ СO2
= СаСО3
↓+ Н2О,
Ва(OH)2
+ SO3
= ВаSO4
↓+ Н2О,
6NaОН + Р2О5
= 2NaЗPO4
+ 3H2O.
4. Растворимые
в воде основания (щелочи) взаимодействуют
с амфотерными оксидами,
образуя при сплавлении соответствующие
соли.
Например:
Al2O3
+ 2NaOH
NаА1O2
+ Н2О,
ZnO + 2КОН
K2ZnO2
+ H2O.
При
взаимодействии амфотерных оксидов с
концентрированными растворами щелочей
образуются гидроксокомплексы.
ZnO
+ 2КОН + H2O
K2[Zn(OH)4].
тетрагидроксоцинкат калия
5. Щелочи
взаимодействуют с растворами солей,
образуя новое основание и новую соль.
Например:
2NaОН + СuSО4
= Сu(ОH)2
↓+ Na2SО4,
ЗNH4ОН
+ АlСl3
= А1(ОН)3
↓+ 3NH4Cl,
2КОН + МnС12
= Мn(ОН)2
↓+ 2КС.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
24.03.2015588.29 Кб662.doc
- #
25.03.2015198.14 Кб32.doc
- #
- #
- #
- #