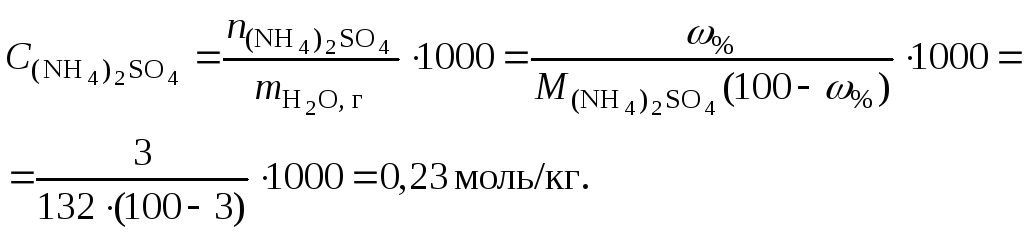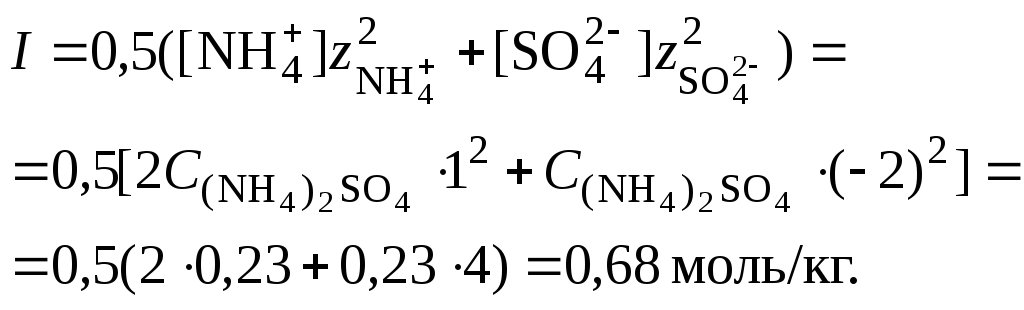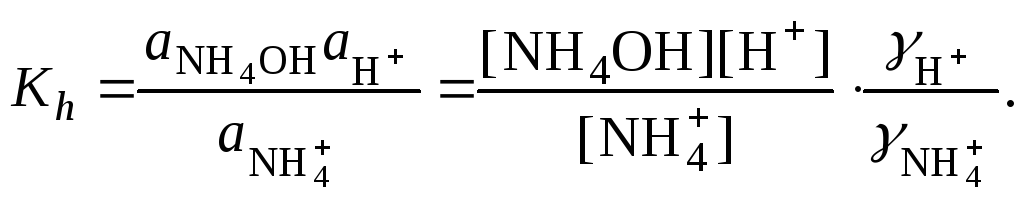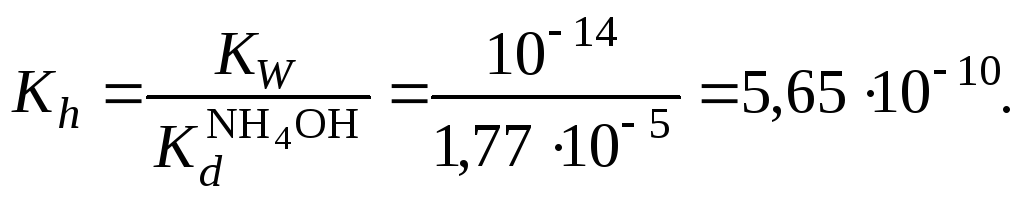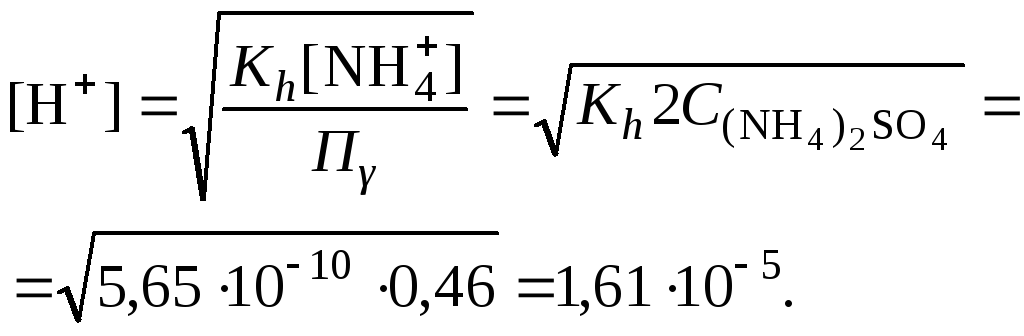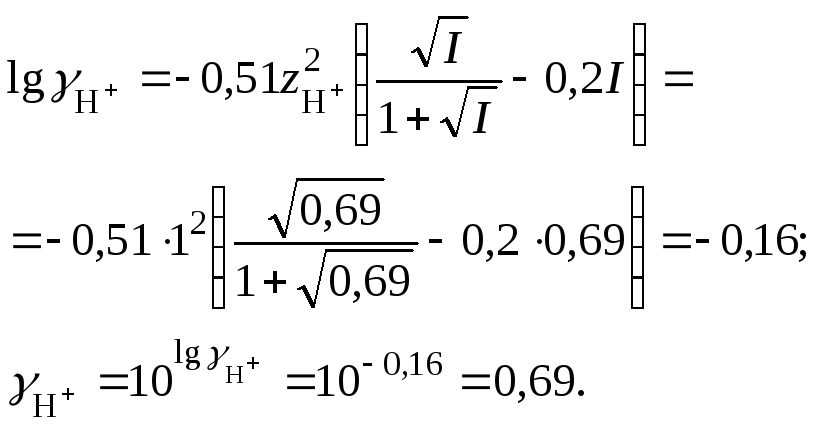1.4.7. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для того, чтобы понять, что такое гидролиз солей, вспомним для начала, как диссоциируют кислоты и щелочи.
Общим между всеми кислотами является то, что при их диссоциации обязательно образуются катионы водорода (Н+), при диссоциации же всех щелочей всегда образуются гидроксид-ионы (ОН−).
В связи с этим, если в растворе, по тем или иным причинам, больше ионов Н+ говорят, что раствор имеет кислую реакцию среды, если ОН− — щелочную реакцию среды.
Если с кислотами и щелочами все понятно, то какая же реакция среды будет в растворах солей?
На первый взгляд, она всегда должна быть нейтральной. И правда же, откуда, например, в растворе сульфида натрия взяться избытку катионов водорода или гидроксид-ионов. Сам сульфид натрия при диссоциации не образует ионов ни одного, ни другого типа:
Na2S = 2Na+ + S2-
Тем не менее, если бы перед вами оказались, к примеру, водные растворы сульфида натрия, хлорида натрия, нитрата цинка и электронный pH-метр (цифровой прибор для определения кислотности среды) вы бы обнаружили необычное явление. Прибор показал бы вам, что рН раствора сульфида натрия больше 7, т.е. в нем явный избыток гидроксид-ионов. Среда раствора хлорида натрия оказалась бы нейтральной (pH = 7), а раствора Zn(NO3)2 кислой.
Единственное, что соответствует нашим ожиданиям – это среда раствора хлорида натрия. Она оказалась нейтральной, как и предполагалось.
Но откуда же взялся избыток гидроксид-ионов в растворе сульфида натрия, и катионов-водорода в растворе нитрата цинка?
Попробуем разобраться. Для этого нам нужно усвоить следующие теоретические моменты.
Любую соль можно представить как продукт взаимодействия кислоты и основания. Кислоты и основания делятся на сильные и слабые. Напомним, что сильными называют те кислоты, и основания, степень диссоциации, которых близка к 100%.
примечание: сернистую (H2SO3) и фосфорную (H3PO4) чаще относят к кислотам средней силы, но при рассмотрении заданий по гидролизу нужно относить их к слабым.
Кислотные остатки слабых кислот, способны обратимо взаимодействовать с молекулами воды, отрывая от них катионы водорода H+. Например, сульфид-ион, являясь кислотным остатком слабой сероводородной кислоты, взаимодействует с ней следующим образом:
S2- + H2O ↔ HS− + OH−
HS−+ H2O ↔ H2S + OH−
Как можно видеть, в результате такого взаимодействия образуется избыток гидроксид-ионов, отвечающий за щелочную реакцию среды. То есть кислотные остатки слабых кислот увеличивают щелочность среды. В случае растворов солей содержащих такие кислотные остатки говорят, что для них наблюдается гидролиз по аниону.
Кислотные остатки сильных кислот, в отличие от слабых, с водой не взаимодействуют. То есть они не оказывают влияния на pH водного раствора. Например, хлорид-ион, являясь кислотным остатком сильной соляной кислоты, с водой не реагирует:
То есть, хлорид-ионы, не влияют на pН раствора.
Из катионов металлов, так же с водой способны взаимодействовать только те, которым соответствуют слабые основания. Например, катион Zn2+, которому соответствует слабое основание гидроксид цинка. В водных растворах солей цинка протекают процессы:
Zn2+ + H2O ↔ Zn(OH) + + H+
Zn(OH) + + H2O ↔ Zn(OH)+ + H+
Как можно видеть из уравнений выше, в результате взаимодействия катионов цинка с водой, в растворе накапливаются катионы водорода, повышающие кислотность среды, то есть понижающие pH. Если в состав соли, входят катионы, которым соответствуют слабые основания, в этом случае говорят что соль гидролизуется по катиону.
Катионы металлов, которым соответствуют сильные основания, с водой не взаимодействуют. Например, катиону Na+ соответствует сильное основание – гидроксид натрия. Поэтому ионы натрия с водой не реагируют и никак не влияют на pH раствора.
Таким образом, исходя из вышесказанного соли можно разделить на 4 типа, а именно, образованные:
1) сильным основанием и сильной кислотой,
Такие соли не содержат ни кислотных остатков, ни катионов металлов, взаимодействующих с водой, т.е. способных повлиять на pH водного раствора. Растворы таких солей имеют нейтральную реакцию среды. Про такие соли говорят, что они не подвергаются гидролизу.
Примеры: Ba(NO3)2, KCl, Li2SO4 и т.д.
2) сильным основанием и слабой кислотой
В растворах таких солей, с водой реагируют только кислотные остатки. Среда водных растворов таких солей щелочная, в отношении солей такого типа говорят, что они гидролизуются по аниону
Примеры: NaF, K2CO3, Li2S и т.д.
3) слабым основанием и сильной кислотой
У таких солей с водой реагируют катионы, а кислотные остатки не реагируют – гидролиз соли по катиону, среда кислая.
Примеры: Zn(NO3)2, Fe2(SO4)3, CuSO4 и т.д.
4) слабым основанием и слабой кислотой.
С водой реагируют как катионы, так и анионы кислотных остатков. Гидролиз солей такого рода идет и по катиону, и по аниону. Нередко такие соли подвергаются необратимому гидролизу.
Что же значит то, что они необратимо гидролизуются?
Поскольку в данном случае с водой реагируют и катионы металла (или NH4+) и анионы кислотного остатка, в раcтворе одновременно возникают и ионы H+, и ионы OH− , которые образуют крайне малодиссоциирующее вещество – воду (H2O).
Это, в свою очередь, приводит к тому, что соли образованные кислотными остатками слабых оснований и слабых кислот не могут быть получены обменными реакциями, а только твердофазным синтезом, либо и вовсе не могут быть получены. Например, при смешении раствора нитрата алюминия с раствором сульфида натрия, вместо ожидаемой реакции:
2Al(NO3)3 + 3Na2S = Al2S3 + 6NaNO3 ( − так реакция не протекает!)
Наблюдается следующая реакция:
2Al(NO3)3 + 3Na2S + 6H2O= 2Al(OH)3↓+ 3H2S↑ + 6NaNO3
Тем не менее, сульфид алюминия без проблем может быть получен сплавлением порошка алюминия с серой:
2Al + 3S = Al2S3
При внесении сульфида алюминия в воду, он также как и при попытке его получения в водном растворе, подвергается необратимому гидролизу.
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
рН в растворе гидролизующейся соли
определяется природой слабого электролита.
При гидролизе соли, образованной сильным
основанием и слабой кислотой, гидролизуется
анион слабой кислоты. В растворе
появляются ионы ОН,
поэтому среда щелочная, рН > 7.
,
(2.17)
Если соль, образована слабым основанием
и сильной кислотой, то гидролизуется
катион слабого основания:
,
(2.18)
в растворе появляются ионы Н+,
поэтому среда кислая, рН < 7.
Гидролиз является обратимым процессом
и имеет ступенчатый характер.
Термодинамической характеристикой
гидролиза является его константа
равновесия – константа гидролиза.
Константу гидролиза проще всего вычислить
через значение константы диссоциации
слабого электролита по уравнению:
,
(2.19)
Первой константе гидролиза соответствует
последняя константа диссоциации,
последней константе гидролиза – первая
константа диссоциации, в чем нетрудно
убедиться, сравнивая состав (по кислотным
остаткам) реакций диссоциации и гидролиза
для фосфорной кислоты:
|
гидролиз |
диссоциация |
||
|
1 |
|
3 |
|
|
2 |
|
2 |
|
|
3 |
|
1 |
|
Обычно константа гидролиза по второй
ступени во много раз меньше, чем по
первой. По третьей ступени константа
диссоциации еще во столько же раз ниже.
Поэтому при расчетах рН обычно учитывают
только первую ступень гидролиза,
пренебрегая последующими его ступенями.
Ионная сила раствора гидролизующейся
соли в этом случае может быть вычислена
без учета реакции гидролиза по концентрации
соли.
В случае гидролиза по аниону (2.17) константа
равновесия запишется следующим образом:

где
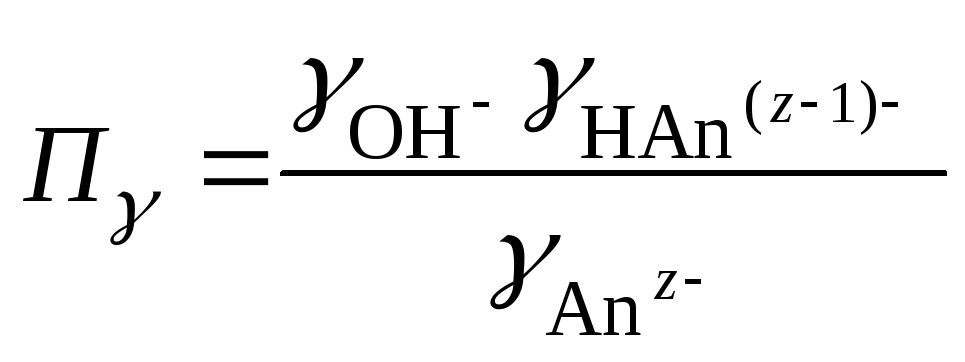
Концентрация ионов
вычисляется по уравнению:

(2.25)
где Сi– моляльная
концентрация гидролизующегося иона.
При гидролизе по катиону (2.18) константа
равновесия запишется следующим образом:
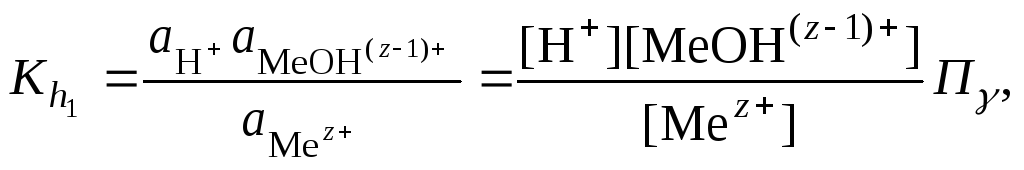
где
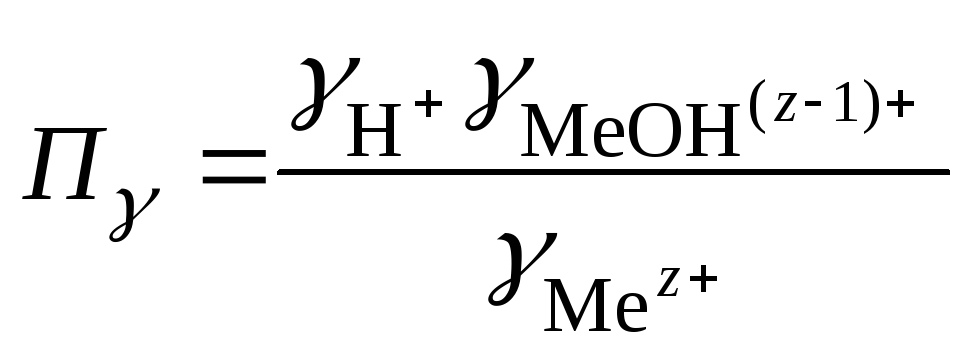
Концентрация катионов водорода
вычисляется по уравнению:
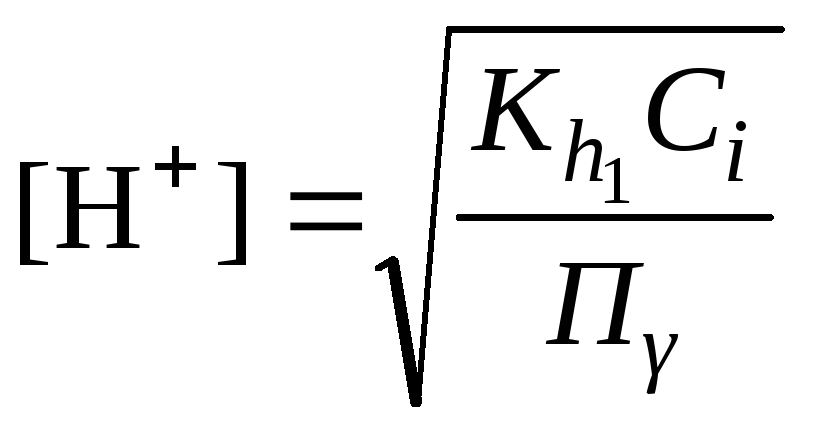
(2.27)
Пример 14.
Вычислить рН раствора сульфата аммония
концентрацией 3 % при 25°С;
.
Решение. 1. Вычислить моляльную
концентрацию сульфата аммония
2. Вычислить ионную силу раствора,
используя концентрацию соли
3. Составить ионное уравнение гидролиза
сульфата аммония:
4. Составить уравнение константы гидролиза
и
.
5. Вычислить константу гидролиза
6. Вычислить концентрацию катионов
водорода
7. Рассчитать коэффициент активности
катионов водорода
8. Вычислить рН раствора
2.3.3. Расчет равновесного ионно-молекулярного состава гидролизующейся соли
Для детального исследования и
математического моделирования гидролиза
необходим расчет равновесного
ионно-молекулярного состава раствора
гидролизующейся соли. Равновесный
состав рассчитывается при решении
системы уравнений, состоящей из уравнений
констант гидролиза по всем ступеням,
уравнений баланса масс, баланса зарядов,
расчета ионной силы раствора и
коэффициентов активности. Для соли,
гидролизующейся по аниону по двум
ступеням состава Me2Anтакая система уравнений будет выглядеть
следующим образом.
Уравнения гидролиза аниона соли и их
константы:
уравнение баланса масс
уравнение баланса зарядов:
уравнение расчета ионной силы раствора:
уравнения расчета коэффициентов
активности:
,
,
уравнение расчета произведения
коэффициентов активности
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Кирилл Иванов
Химия
92
Ищите в ВК Бородатый Химик · 23 июл 2022
Лакмусовой бумажкой или любым другим индикатором.
Есть таблицы с значением рН для раствора соли.
Можно предположить с точки зрения гидролиза: https://youtu.be/X1jX6eilRnU
Ну и если точно надо знать цифирь – рН- метр.:)
Бородатый Химик
Перейти на vk.com/borodatbiihimik
1 эксперт согласен
335
Комментировать ответ…Комментировать…
Перейти к содержанию
Автор Владислав Панарин На чтение 2 мин Просмотров 18.8к. Опубликовано 26.02.2021 Обновлено 18.07.2022
Вам также может понравиться
Таблица электроотрицательности химических элементов
015.5к.
Константы нестойкости комплексных соединений.
018.7к.
Константы устойчивости комплексных соединений.
127.2к.
Электрохимический ряд напряжений (активности) металлов —
016.5к.
Таблица растворимости — это наглядная таблица со списком
018.1к.
Длиннопериодная периодическая таблица (система) химических
010.5к.
Короткопериодная периодическая таблица (система) химических
011.9к.
Стандартные окислительно-восстановительные потенциалы
071.7к.
Знаток
(294),
закрыт
9 лет назад
Дополнен 12 лет назад
NaHCO3
NH4COOH
Na2CO3
K2SO4
Al2(SO4)3
MgSO4
Na2SO3
ZnSO4
Дополнен 12 лет назад
И если можно то прошу объяснить как рассчитывать.
Заранее благодарен.
Ле Мур
Просветленный
(28048)
12 лет назад
Судя по всему не рассчитать, а определить рН в растворах этих солей (немного разные весчи, не пугай людей)
Далее берем таблицу растворимости солей, кислот и оснований. (по хорошему преподаватель заставляет еще и уравнения гидролиза написать, но будем действовать экспресс-методом) . Рассматриваем первую соль Необходимо определить, каким основанием и какой кислотой она образована. Первое – основание NaOH (добавляем функциональную группу основания ОН к металлу в формуле) Смотрим в таблицу – буква Р – основание сильное, значит его ионы в растворе, среда щелочная (рН больше 7) Ион НСО3 относится к слабой кислоте (Н2СО3), в растворе ионов не дает, реакцию среды не изменяет. Значит, среда этой соли окончательно щелочная, рН больше 7.
Вторая соль. NH4COOH. По таблице и основание (NH4OH) и кислота (СН3СООН) – слабые. Значит, рН равен 7
Соль MgSO4 – основание – Mg(ОН) 2 – слабое, нерастворимое, кислота – H2SO4 – сильная кислота, растворимая – значит среда кислая рН – меньше 7. А дальше – тренируемся.