«Говорящие» кислотные остатки
24-Окт-2012 | комментария 4 | Лолита Окольнова
«Говорящие» кислотные остатки
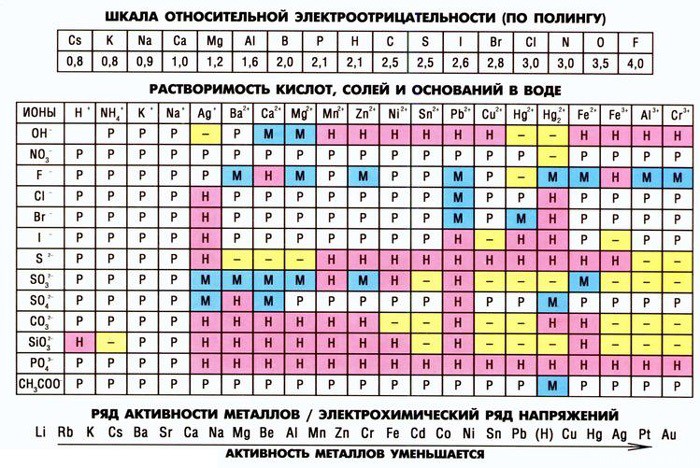
Когда я начинаю занятия по химии и рассказываю о Периодической системе элементов, то всегда говорю, что это как ключ от всех дверей. В ней можно найти ответ на практически любой вопрос по химии.
Таблица растворимости тоже в этом плане очень информативна. Здесь можно найти не только соли и узнать растворимы они или нет. Здесь есть еще один маленький секрет, который может оказаться очень полезным…
Давайте сегодня подробно рассмотрим левый столбец — столбик Анионов, или Кислотных остатков.
Во-первых, я считаю абсолютно необходимым знать названия и заряды кислотных остатков. В принципе, их можно легко вывести, но на экзамене у вас просто не хватит на это времени. Спорить с этим бесполезно. Это факт.
Поэтому, выучиваем:
OH(-) — гидроксид;
NO3(-) — нитрат;
F(-) — фторид;
Cl(-) -хлорид;
Br(-) — бромид;
J(-) — йодид;
S(-2) — сульфид;
SO3(-2) — сульфит;
SO4(-2) — сульфат;
CO3(-2) — карбонат;
SiO3(-2) — силикат;
PO4(-3) — фосфат;
CH3COO(-) — ацетат.
Во-вторых, обратите внимание, что все названия кислотных остатков имеют различие в окончаниях: —ид, -ит и -ат.
Окончания эти говорят о многом:
- -ид (кроме -OH): фторид F(-), хлорид Cl(-), бромид Br(-), йодид J(-), cульфид (-2):
- кислотный остаток состоит из одного элемента;
- этот элемент находится в минимальной степени окисления ( = № группы-8);
Поэтому даже если какого-то кислотного остатка нет в табличке, но у него окончание -ид, мы можем легко написать его формулу.
Например, нитрид алюминия: нитрид, значит, состоит из одного элемента — N, степень окисления минимальная=-3, значит, формула будет AlN.
- —ит: cульфит SO3(-2):
- кислотный остаток состоит из элемента и кислорода;
- элемент находится в средней степени окисления (в данном примере у серы S степень окисления +4)
Например, кислотного остатка нитрита в нашей таблице нет, но окончание -ит, значит это азот и кислород NO, промежуточная степень окисления азота= +3, кислотный оксид будет N2O3, прибавим воду: N2O3 + H2O = 2HNO2, значит, кислотный остаток — NO2(-).
- -ат: сульфат SO4(-2), карбонат CO3(-2), силикат SiO3(-2), фосфат PO4(-3), ацетат CH3COO(-):
- кислотный остаток состоит из элемента и кислорода;
- этот элемент находится в максимальной степени окисления ( = № группы);
Например, кислотный остаток хлорат. Два элемента ClO. Максимальная степень окисления хлора Cl= +5. Кислотный оксид будет иметь вид Cl2O5. Кислота: Cl2O5 + H2O = 2HClO3. Кислотный остаток — ClO3(-).
Как видите, все можно вывести, но стоит ли тратить на это время? Но, бывает, что в заданиях попадаются кислотные остатки, которых нет в таблице растворимости или просто вы их не знаете. Что делать тогда? Выводить их формулу по указанной логике.
Кислотные остатки тоже оказались «говорящими»!
Обсуждение: “«Говорящие» кислотные остатки”
(Правила комментирования)
Таблица кислот и кислотных остатков.
Таблица кислот и кислотных остатков (1 часть):
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HN3 | Азотистоводородная (Азоимид, Азидоводород) | N3– | Азид |
| HNO2 | Азотистая | NO2– | Нитрит |
| HNO3 | Азотная | NO3– | Нитрат |
| HBrO2 | Бромистая | BrO2– | Бромит |
| HBrO3 | Бромноватая | BrO3– | Бромат |
| HBrO | Бромноватистая (Гипобромистая кислота) | BrO– | Гипобромит |
| HBr | Бромоводород (Бромистоводородная кислота) | Br– | Бромид |
| HVO3 | Ванадиевая | VO3– | Ванадат |
| H2WO4 | Вольфрамовая | WO42– | Вольфрамат |
| H4GeO4 или Ge(OH)4 | Германиевая кислота (Гидроксид германия (IV)) | GeO44– | Германат |
| H2S2O7 | Дисерная | S2O72– | Дисульфат |
| H4P2O7 | Дифосфорная | P2O74– | Пирофосфат или дифосфат (по номенклатуре IUPAC) |
| H2Cr2O7 | Дихромовая | Cr2O72– | Дихромат |
| HIO4 | Йодная | IO4– | Периодат |
| HIO | Йодноватистая | IO– | Гипоиодит |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| H2SiO3 | Кремниевая | SiO32– | Силикат |
| H2MnO4 | Марганцовистая | MnO42– | Манганат |
| HMnO4 | Марганцовая | MnO4– | Перманганат |
| HCOOH | Метановая (Муравьиная кислота) | HCOO– | Формиат |
| HBO | Метаборная | BO– | Метаборат |
| HAsO2 | Метамышьяковистая | AsO2– | Метаарсенит |
| H2TiO3 или TiO(OH)2 | Метатитановая (β-титановая кислота) | TiO32– | Титанат |
| HPO3 | Метафосфорная | PO3– | Метафосфат |
Таблица кислот и кислотных остатков (2 часть):
| H2MoO4 | Молибденовая | MoO42– | Молибдат |
| H3BO3 | Ортоборная (Борная кислота) | BO33– | Борат |
| H3AsO4 | Ортомышьяковая | AsO43– | Арсенат |
| H3AsO3 | Ортомышьяковистая | AsO33– | Ортоарсенит |
| H2PbO4 | Ортосвинцовая кислота | PbO42– | Ортоплюмбат или плюмбат |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43– | Фосфат |
| H2SO5 | Кислота Каро (пероксомоносерная кислота, мононадсерная кислота) | SO52– | Пероксомоносульфат или кароат |
| HNCS | Роданистоводородная (Тиоциановая кислота) | SCN– | Тиоцианат |
| C7H6O3 | Салициловая | C7H6O3– | Салицилат |
| H2SO4 | Серная | SO42– | Сульфат |
| H2SO3 | Сернистая | SO32– | Сульфит |
| H2S | Сероводород (Сероводородная кислота) | S2– | Сульфид |
| H2SO3S | Тиосерная | SO3S2– | Тиосульфат |
| H2CO3 | Угольная | CO32– | Карбонат |
| HF | Фтороводород (Плавиковая кислота) | F– | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl– | Хлорид |
| H2CrO4 | Хромовая | CrO42– | Хромат |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO | Хлорноватистая | ClO– | Гипохлорит |
| HCN | Циановодород (Синильная кислота) | CN— | Цианид |
| H2C2O4 | Этандиовая (Щавелевая кислота) | C2O42– | Оксалат |
| CH3COOH | Этановая (Уксусная кислота) | CH3COO– | Ацетат |
| C4H6O5 | Яблочная (Оксиянтарная, Гидроксибутандиовая кислота) | C4H4O52– | Малат |
Коэффициент востребованности
19 673
Содержание
- Химия, Биология, подготовка к ГИА и ЕГЭ
- «Говорящие» кислотные остатки
- Периодический закон
Химия, Биология, подготовка к ГИА и ЕГЭ
«Говорящие» кислотные остатки
Когда я начинаю занятия по химии и рассказываю о Периодической системе элементов , то всегда говорю, что это как ключ от всех дверей. В ней можно найти ответ на практически любой вопрос по химии.
Таблица растворимости тоже в этом плане очень информативна. Здесь можно найти не только соли и узнать растворимы они или нет. Здесь есть еще один маленький секрет, который может оказаться очень полезным…
Давайте сегодня подробно рассмотрим левый столбец — столбик Анионов, или Кислотных остатков.
Во-первых, я считаю абсолютно необходимым знать названия и заряды кислотных остатков. В принципе, их можно легко вывести, но на экзамене у вас просто не хватит на это времени. Спорить с этим бесполезно. Это факт.
Поэтому, выучиваем:
F(-) — фторид;
Cl(-) -хлорид;
Br(-) — бромид;
J(-) — йодид;
Во-вторых, обратите внимание, что все названия кислотных остатков имеют различие в окончаниях: —ид, -ит и -ат.
Окончания эти говорят о многом:
- -ид (кроме -OH): фторид F(-), хлорид Cl(-), бромид Br(-), йодид J(-), cульфид (-2):
- кислотный остаток состоит из одного элемента;
- этот элемент находится в минимальной степени окисления ( = № группы-8);
Поэтому даже если какого-то кислотного остатка нет в табличке, но у него окончание -ид, мы можем легко написать его формулу.
Например, нитрид алюминия : нитрид, значит, состоит из одного элемента — N, степень окисления минимальная=-3, значит, формула будет AlN .
- —ит: cульфит SO3(-2):
- кислотный остаток состоит из элемента и кислорода;
- элемент находится в средней степени окисления (в данном примере у серы S степень окисления +4)
Например, кислотного остатка нитрита в нашей таблице нет, но окончание -ит, значит это азот и кислород NO, промежуточная степень окисления азота= +3, кислотный оксид будет N2O3, прибавим воду: N2O3 + H2O = 2HNO2, значит, кислотный остаток — NO2(-) .
- -ат: сульфат SO4(-2), карбонат CO3(-2), силикат SiO3(-2), фосфат PO4(-3), ацетат CH3COO(-):
- кислотный остаток состоит из элемента и кислорода;
- этот элемент находится в максимальной степени окисления ( = № группы);
Например, кислотный остаток хлорат . Два элемента ClO. Максимальная степень окисления хлора Cl= +5. Кислотный оксид будет иметь вид Cl2O5. Кислота: Cl2O5 + H2O = 2HClO3. Кислотный остаток — ClO3(-) .
Как видите, все можно вывести, но стоит ли тратить на это время? Но, бывает, что в заданиях попадаются кислотные остатки, которых нет в таблице растворимости или просто вы их не знаете. Что делать тогда? Выводить их формулу по указанной логике.
Кислотные остатки тоже оказались «говорящими»!
Источник
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
В периодической таблице элементы расположены в порядке увеличения атомного заряда, группируются в «строки и столбцы» — периоды и группы.
Период — ряд горизонтально расположенных химических элементов. 1, 2 и 3 периоды называются малыми, они состоят из одного ряда элементов. 4, 5, 6 — называются большими периодами, они состоят из двух рядов химических элементов.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
В группе радиус атома увеличивается с увеличением заряда атомных ядер — сверху вниз «↓». Чем больше период, тем больше электронных орбиталей вокруг атома, соответственно, и больше его радиус.
С уменьшением заряда атома в группе радиус атома уменьшается — снизу вверх «↑». Это связано с уменьшением количества электронных орбиталей вокруг атома. Для примера возьмем атомы бора и алюминия, элементов, расположенных в одной группе.
Период, группа и электронная конфигурация
Обратите внимание еще раз на важную деталь: элементы, находящиеся в одной группе (главной подгруппе!), имеют сходную конфигурацию внешнего уровня. Так у бора на внешнем уровне расположены 3 электрона, у алюминия — тоже 3. Оба они в III группе.
Такая закономерность иногда может сильно облегчить жизнь, однако у элементов побочных подгрупп она отсутствует — там нужно считать электроны «вручную», располагая их на электронных орбиталях.
Раз уж мы повели речь об электронных конфигурациях, давайте запишем их для бора и алюминия, чтобы лучше представлять их внешний уровень и увидеть то самое «сходство»:
- B5 — 1s 2 2s 2 2p 1
- Al13 — 1s 2 2s 2 2p 6 3s 2 3p 1
Общую электронную конфигурацию для элементов III группы главной подгруппы можно записать ns 2 np 1 . Это будет работать для бора, внешний уровень которого 2s 2 2p 1 , алюминия — 3s 2 3p 1 , галия — 4s 2 4p 1 , индия — 5s 2 5p 1 и таллия — 6s 2 6p 1 . За «n» мы принимаем номер периода.
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Вам остается только распределить известное число электронов по s и p ячейкам, а затем подставить номер периода — и вот быстро получена конфигурация внешнего уровня. Предлагаю посмотреть на примере ниже 🙂
Очень надеюсь, что теперь вы знаете: только глядя на положение элемента в периодической таблице, на группу и период, в которых он расположен, вы уже можете составить конфигурацию его внешнего уровня. Безусловно, это для элементов главных подгрупп. Повторюсь: у побочных — только «вручную».
Длина связи
Длина связи — расстояние между атомами химически связанных элементов. Очевидно, что понятия длины связи и атомного радиуса взаимосвязаны напрямую. Чем больше радиус атома, тем больше длина связи.
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
В периоде с увеличением заряда атома металлические свойства ослабевают, неметаллические — усиливаются (слева направо «→»). В группе с увеличением заряда атома металлические свойства усиливаются, а неметаллические — ослабевают (сверху вниз «↓»).
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Таким образом, самые сильные металлические свойства проявляет рубидий, но с другой стороны — у него самые слабые неметаллические свойства. Сера обладает самыми слабыми металлическими свойствами, но, если посмотреть по-другому, сера — самый сильный неметалл.
Распределение металлов и неметаллов в периодической таблице также является наглядным отображением этого правила. Если провести условную линию, проходящую от бора до астата, то справа окажутся неметаллы, а слева — металлы.
Основные и кислотные свойства
Основные свойства в периоде с увеличением заряда атома уменьшаются, кислотные — возрастают. В группе с увеличением заряда атома основные свойства усиливаются, а кислотные — ослабевают.
Кислотные и основные свойства противопоставлены друг другу, как противопоставлены металлические и неметаллические. Где первые усиливаются, вторые — убывают. Все аналогично, поэтому смело ассоциируйте одни с другими, так будет гораздо легче запомнить.
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Это можно объяснить в темах диссоциации и химических связей. Когда мы дойдем до соответствующей темы, я напомню про HF и водородные связи между молекулами, которые делают эту кислоту самой слабой. Сейчас воспринимайте это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.
Восстановительные и окислительные свойства
Восстановительные свойства в периоде с увеличением заряда атома ослабевают, окислительные — усиливаются. В группе с увеличением заряда атома восстановительные свойства усиливаются, а окислительные — ослабевают.
Ассоциируйте восстановительные свойства с металлическими и основными, а окислительные — с неметаллическими и кислотными. Так гораздо проще запомнить 😉
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Электроотрицательность — способность атома, связанного с другими, приобретать отрицательный заряд (притягивать к себе электроны). Мы уже касались ее в статье, посвященной степени окисления. Это важное свойство, ведь более ЭО-ый атом притягивает к себе электроны и уходит в отрицательную степень окисления со знаком минус «-«.
Все перечисленные в подзаголовке свойства вместе с ЭО усиливаются в периоде с увеличением заряда атома, в группе с увеличением заряда атома они ослабевают. Таким образом, самый электроотрицательный элемент расположен справа вверху таблицы Д.И. Менделеева — это фтор.
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Понятию ЭО-ости «синонимичны» также понятия сродства к электрону — энергии, выделяющейся при присоединении электрона к атому, и энергии ионизации — количеству энергии, которое необходимо для отщепления электрона от атома. И то, и другое возрастают с увеличением электроотрицательности.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
В таблице видно, что для VIa группы формула высшего оксида RO3, а, к примеру, для IIIa группы — R2O3. Напишем высшие оксиды для веществ из VIa : SO3, SeO3, TeO3 и IIIa группы: B2O3, Al2O3, Ga2O3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
ЛВС характерны для IV, V, VI и VII группы. Элементы этих групп более электроотрицательны, чем водород, поэтому ходят в «-» отрицательную СО. Минимальная степень окисления для элементов главных подгрупп, начиная с IV группы, может быть рассчитана так: номер группы — 8.
Например, для углерода минимальная СО = 4-8 = -4; для азота 5-8 = -3; для кислорода 6-8 = -2; для фтора 7-8 = -1. Для того, чтобы запомнить ЛВС, вы должны ассоциировать IV, V, VI и VII группы с хорошо известными вам веществами: метаном, аммиаком, водой и фтороводородом.
Так как общее строение ЛВС в пределах одной группы сходно, то, вспомнив например H2O для кислорода в VI группе, вы легко найдете формулы других ЛВС VI группы: серы — H2S, H2Se, H2Te, H2Po.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Источник
При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Главная / Химия / Таблица кислот и кислотных остатков
Таблица кислот и кислотных остатков
| Формула кислоты | Название кислоты | Формула кислотного остатка |
Название кислотного остатка |
| HNO2 | Азотистая | NO2- | Нитрит |
| HNO3 | Азотная | NO3- | Нитрат |
| HBr | Бромоводород (Бромистоводородная кислота) | Br– | Бромид |
| HVO3 | Ванадиевая | Ванадаты | |
| H2WO4 | Вольфрамовая | Вольфраматы | |
| H4P2O7 | Дифосфорная | Пирофосфаты или дифосфаты (по номенклатуре IUPAC) |
|
| H2Cr2O7 | Дихромовая | Cr2O72- | Дихромат |
| H2SiO3 | Кремниевая | SiO32- | Силикат |
| HMnO4 | Марганцовая | MnO4– | Перманганат |
| HCOOH | Метановая, Муравьиная | HCOO– | Формиат |
| H3AsO4 | Мышьяковая (Ортомышьяковая) | AsO43- | Арсенат |
| H3BO3 | Ортоборная (Борная кислота) | Бораты | |
| H3PO4 | Ортофосфорная (Фосфорная кислота) | PO43- | Фосфат |
| HNCS | Роданистоводородная (тиоциановая) | Тиоцианаты | |
| C7H6O3 | Салициловая | Салицилаты | |
| H2S | Сероводород (Сероводородная кислота) | S2- | Сульфид |
| H2SO3S | Тиосерная | Тиосульфаты | |
| HF | Фтороводород (Плавиковая кислота) | F– | Фторид |
| HCl | Хлороводород (Соляная кислота) | Cl– | Хлорид |
| HI | Йодоводород (Йодоводородная кислота) | I– | Йодид |
| HCN | Циановодород (Синильная кислота) | CN– | Цианид |
| H2SO3 | Сернистая | SO32- | Сульфит |
| H2SO4 | Серная | SO42- | Сульфат |
| H2CO3 | Угольная | CO32- | Карбонат |
| H2CrO4 | Хромовая | CrO42- | Хромат |
| HClO | Хлорноватистая | ClO- | Гипохлорит |
| HClO2 | Хлористая | ClO2– | Хлорит |
| HClO3 | Хлорноватая | ClO3– | Хлорат |
| HClO4 | Хлорная | ClO4– | Перхлорат |
| CH3COOH | Этановая, Уксусная | CH3COO– | Ацетат |
| H2C2O4 | Этандиовая, Щавельная | C2O42- | Оксалат |
| C4H6O5 | Яблочная (оксиянтарная, гидроксибутандиовая) | Малаты |
4 октября 2018
133163 просмотра
Комментарии
0
Азамат
#
16 сентября 2019 в 14:41
0
Гулина
#
8 января 2020 в 10:02
0
Алексей
#
6 сентября 2020 в 07:05
HCl Хлороводород (Соляная кислота) Cl- Хлорид
0
we
#
14 сентября 2020 в 14:50
0
Лиза
#
1 апреля 2021 в 15:08
0
Карина
#
14 апреля 2021 в 16:05
0
Капуста
#
2 мая 2021 в 09:59
0
Артём
#
5 июля 2021 в 17:57
А где дифосфорная, тиосерная и тиоциановая
Капуста:
Ванадиевая кислота?
Артём:
А где дифосфорная, тиосерная и тиоциановая
Добавили
0
Виктор
#
8 июля 2021 в 17:49
у вас нет:
марганцевистая – H2MnO4
цинковая – H2ZnO2
метафосфорная – HPO3
молибденовая – H2MoO4
ортокремнивая – H4SiO4
0
1
#
1 августа 2021 в 11:08
А возможно ли скачать таблицу?
0
Айдар кот
#
11 марта 2022 в 18:14
Где метафосфорная кислота?
0
Ваня Балда
#
1 ноября 2022 в 05:59
А можно ли скачать таблиицу?