При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Кислотами называют сложные вещества, состоящие из атомов водорода, способных замещаться металлами, и кислотных остатков.
Кислотным остатком называют часть молекулы кислоты, соединённую с атомами водорода.
При замещении водорода в кислотах металлами в состав образующихся солей кислотные остатки переходят в неизменном виде. Если кислотный остаток в кислоте соединён с одним атомом водорода, то он одновалентен, если с двумя — двухвалентен, если с тремя — трёхвалентен и т. д.
Валентность кислотного остатка определяется количеством атомов водорода, способных замещаться металлами.
Формулы и названия некоторых кислот приведены в таблице.
Важнейшие неорганические кислоты
|
Название кислоты |
Формула кислоты |
Формула кислотного остатка |
Название соли этой кислоты |
| Фтороводородная (плавиковая) |
HF |
−F |
Фторид |
| Хлороводородная (соляная) |
HCl |
−Cl |
Хлорид |
| Бромоводородная |
HBr |
−Br |
Бромид |
| Угольная |
H2CO3 |
=CO3 |
Карбонат |
| Кремниевая |
H2SiO3 |
=SiO3 |
Силикат |
| Азотная |
HNO3 |
−NO3 |
Нитрат |
|
Ортофосфорная (фосфорная) |
H3PO4 |
≡PO4 |
Ортофосфат (фосфат) |
| Серная |
H2SO4 |
=SO4 |
Сульфат |
| Сернистая |
H2SO3 |
=SO3 |
Сульфит |
| Сероводородная |
H2S |
=S |
Сульфид |
Представителем органических кислот является уксусная кислота
CH3COOH.
Хотя в молекуле этой кислоты — четыре атома водорода, только один из них (входящий в состав группы СООН) может быть замещён металлом. Поэтому кислотный остаток уксусной кислоты является одновалентным.

Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
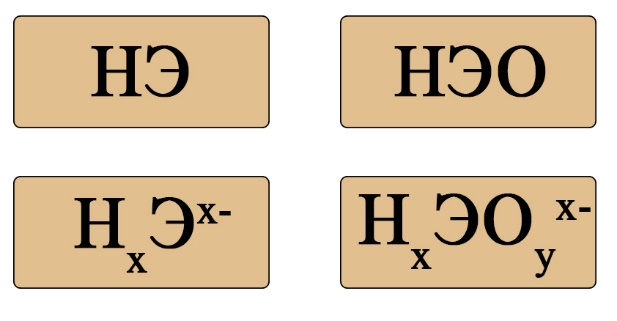
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором – сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
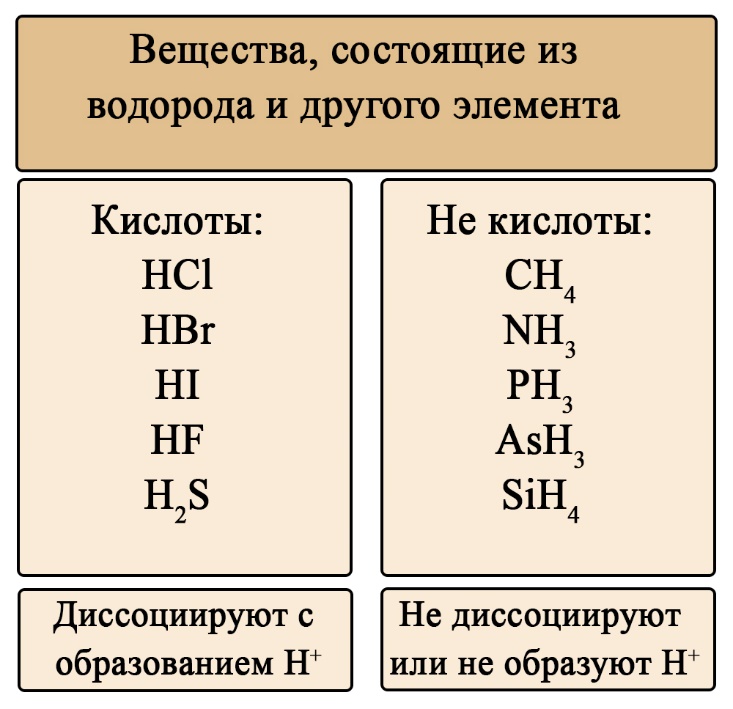
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие – содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
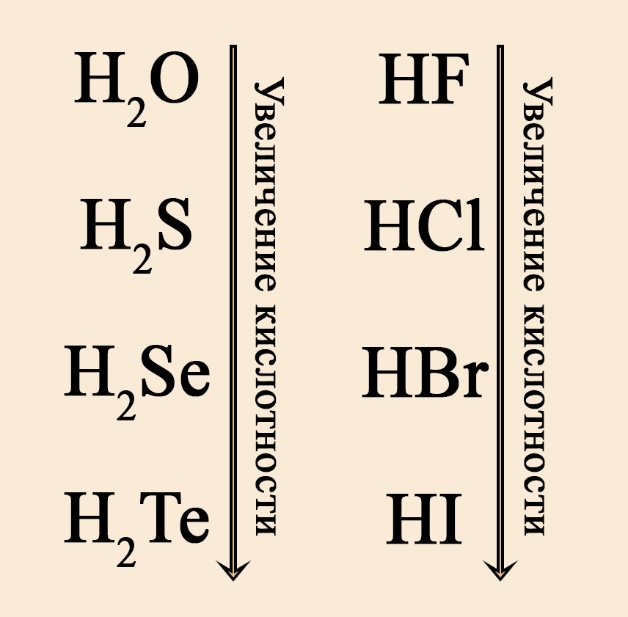
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
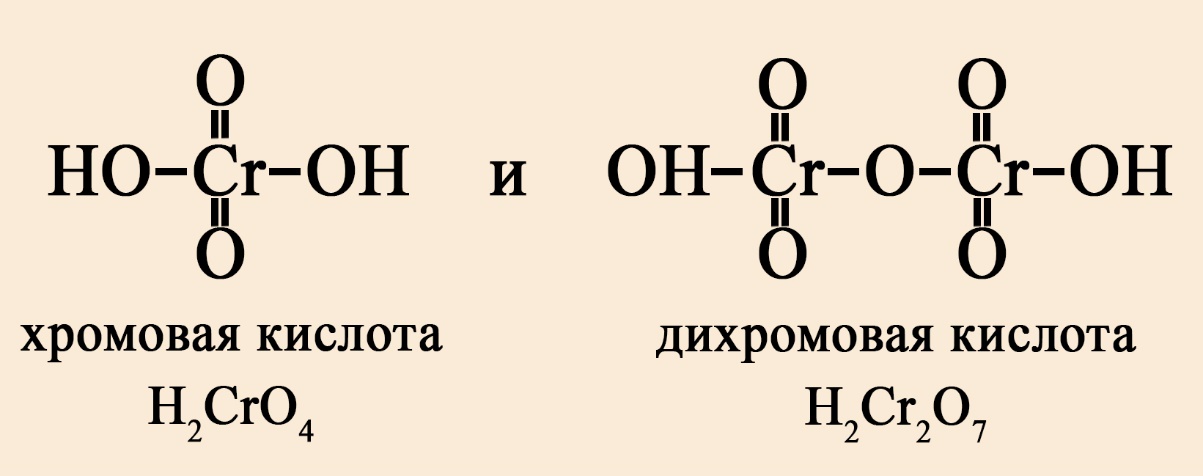
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
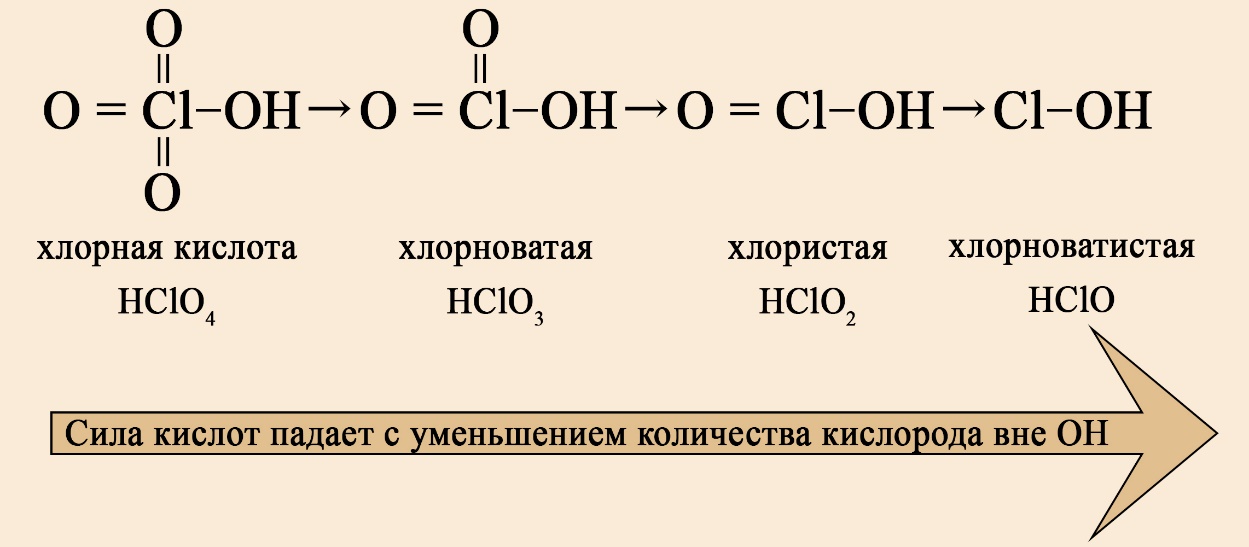
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
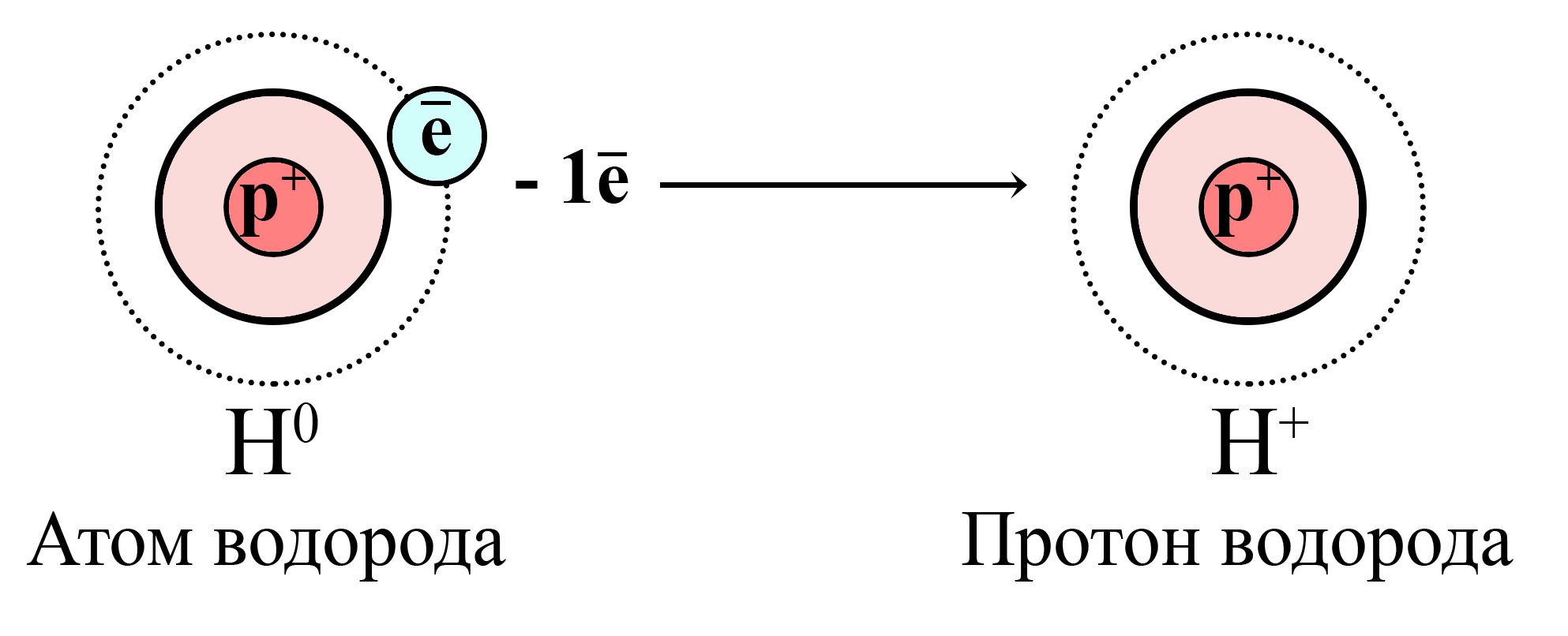
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
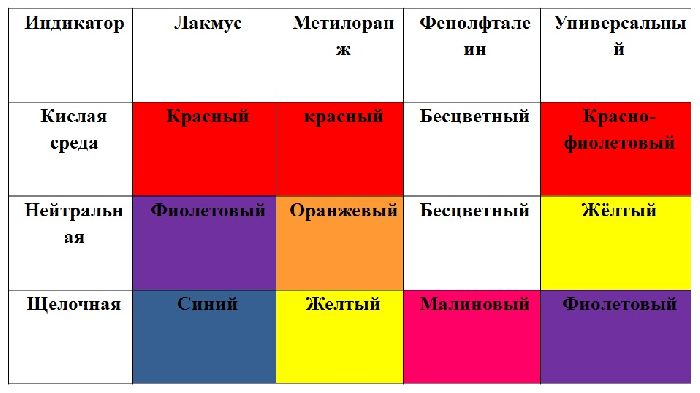
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
Классификация кислот


4.8
Средняя оценка: 4.8
Всего получено оценок: 326.
4.8
Средняя оценка: 4.8
Всего получено оценок: 326.
Кислоты – активные соединения, способные взаимодействовать с различными веществами. Классификация кислот зависит от кислотного остатка.
Что такое кислоты?
Кислота образована атомами водорода и кислотным остатком, который чаще всего состоит из неметаллов или их оксидов. Общая формула кислот – HnAc, где Н – водород, n – количество атомов водорода, Ac – кислотный остаток. Например, во фтороводородной кислоте (HF) один атом водорода, а кислотный остаток состоит из фтора. В угольной кислоте (H2CO3) два атома водорода, а кислотный остаток – оксид углерода.

Свойства растворов кислот определяют активные ионы водорода (H+). Водород могут замещать металлы, в результате чего образуются кислые соли (кислотный остаток остаётся неизменным).
Основные свойства кислот:
- прозрачные жидкости, редко – твёрдые вещества (HPO3, H3BO3);
- растворимы в воде (исключение – H2SiO3);
- имеют кислый вкус;
- изменяют окраску индикаторов на красный цвет (фенолфталеин становится бесцветным);
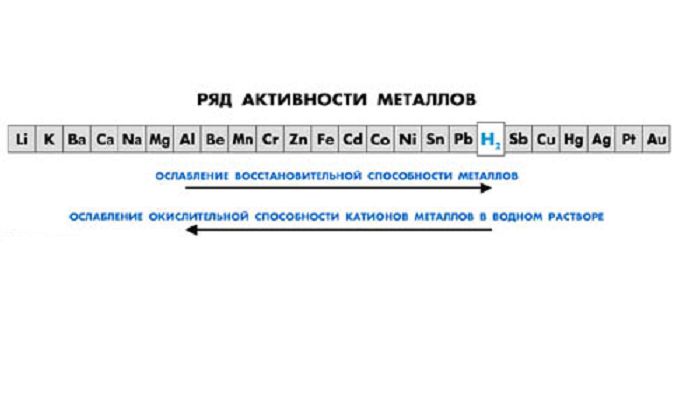
- взаимодействуют с металлами в ряде активности до водорода.
Кислоты образуются следующими способами:
- при взаимодействии неметаллов с водородом (H2 + Cl2 → 2HCl);
- в результате реакции оксидов с водой (SO3 + H2O → H2SO4);
- при взаимодействии оксидов с водой (P2O5 + 3H2O → 2H3PO4);
- в результате реакции твёрдых солей с кислотами (2NaCl + H2SO4 → Na2SO4 + 2HCl).
Кислоты относятся к электролитам. Это значит, что при растворении в воде они распадаются на катионы и анионы. Кислоты с сильной степенью диссоциации считаются сильными кислотами (H2SO4, HCl). Электролиты со слабой диссоциацией относятся к слабым кислотам (H2S, H2SO3).
Виды
Кислоты можно разделить на две большие группы:
- по наличию или отсутствию кислорода;
- по количеству атомов водорода.
Подробная классификация и свойства кислот приведены в таблице.
|
Вид |
Особенности |
Примеры |
|
Бескислородные |
Не содержат кислорода. В состав входят только водород и кислотный остаток, образованный неметаллами |
HCl, HBr, HI, HF, H2S, HCN |
|
Кислородсодержащие |
В состав кислотного остатка входит кислород |
HNO3, H2SO4, HMnO4, HNO2, H2SO3, H3PO4, H2CO3, H2SiO3 |
|
Одноосновные |
Кислота содержит только один атом водорода |
HNO3, HCl, HMnO4 |
|
Двухосновные |
Соединение содержит два атома водорода |
H2SO4, H2CO3, H2SiO3 |
|
Трёхосновные |
В состав входит три атома водорода |
H3PO4 |
Одни и те же кислоты можно классифицироваться по-разному. Например, азотная кислота (HNO3) относится как к кислородсодержащему, так и к одноосновному виду.

Что мы узнали?
Из урока 8 класса узнали, что такое кислоты, какие свойства они имеют, как получаются. Кислоты состоят из водорода, который может замещаться металлом при взаимодействии с солями, оксидами, свободными элементами, и кислотного остатка. Классифицируются кислоты по двум признакам – наличию кислорода и количеству атомов водорода. Кислород входит в состав кислотного остатка и соединён с неметаллом (исключение – HMnO4). Количество атомов водорода может варьировать от одного до трёх. Одни и те же кислоты могут относиться к разным типам.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Сергей Ефремов
4/5
Оценка доклада
4.8
Средняя оценка: 4.8
Всего получено оценок: 326.
А какая ваша оценка?
Кислоты: классификация, номенклатура, физические и химические свойства
Из материалов урока Вы познакомитесь с разными способами классификации кислот, расширите свои знания о физических и химических свойствах кислот.
I. Посмотрите видео-презентацию
Кислоты – сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.
 Состав кислот отражен в их названии. Например, у бескислородных кислот название всегда включает название элемента и слово «водородная»:
Состав кислот отражен в их названии. Например, у бескислородных кислот название всегда включает название элемента и слово «водородная»:
HCl – хлороводородная, H2S – сероводородная.
Названия кислородсодержащих кислот тоже подчиняются определенным правилам. К названию химического элемента прибавляется суффикс н или ов(ев) и окончание –ая, если число атомов кислорода в молекуле кислоты наибольшее:
H2SO4 – серная
HNO3 – азотная
H2SiO3 – кремниевая
Если в молекуле кислоты число атомов кислорода меньше максимального, то часто в названии используют суффикс ист:
H2SO3 – сернистая
HNO2 – азотистая
Это интересно
Всегда ли кислоты называли кислотами?
Названия неорганических кислот долгое время никак не были связаны с присущим им кислым вкусом. Так, серную кислоту называли купоросным маслом или купоросным спиртом, хлороводородную (соляную) кислоту — соляным спиртом или кислым спиртом, азотную кислоту — селитряной дымистой водкой или крепкой водкой; смесь азотной и хлороводородной кислот называли царской водкой. Названия эти пришли из языка алхимиков и не отражали особенностей строения кислот.
II. Классификация кислот
1. По числу атомов водорода: число атомов водорода (n) определяет основность кислот:
n = 1 одноосновная
n = 2 двухосновная
n = 3 трехосновная
2. По составу:
а) Таблица кислород содержащих кислот, кислотных остатков и соответствующих кислотных оксидов:
|
Кислота (НnА) |
Кислотный остаток (А) |
Соответствующий кислотный оксид |
|
HClO4 хлорная |
ClO4 (I) перхлорат |
Cl2O7 оксид хлора (VII ) |
|
H2SO4 серная |
SO4 (II) сульфат |
SO3 оксид серы (VI ), серный ангидрид |
|
HNO3 азотная |
NO3 (I) нитрат |
N2O5 оксид азота ( V ) |
|
HMnO4 марганцовая |
MnO4 (I) перманганат |
Mn2O7 оксид марганца (VII ) |
|
H2SO3 сернистая |
SO3 (II) сульфит |
SO2 оксид серы (IV ) |
|
H3PO4 ортофосфорная |
PO4 (III) ортофосфат |
P2O5 оксид фосфора (V ) |
|
HNO2 азотистая |
NO2 (I) нитрит |
N2O3 оксид азота (III ) |
|
H2CO3 угольная |
CO3 (II) карбонат |
CO2 оксид углерода ( IV), углекислый газ |
|
H2SiO3 кремниевая |
SiO3 (II) силикат |
SiO2 оксид кремния (IV) |
б) Таблица бескислородных кислот
|
Кислота (НnА) |
Кислотный остаток (А) |
|
HCl соляная, хлороводородная |
Cl (I) хлорид |
|
H2S сероводородная |
S(II) сульфид |
|
HBr бромоводородная |
Br (I) бромид |
|
HI йодоводородная |
I(I) йодид |
|
HF фтороводородная, плавиковая |
F(I) фторид |
III. Физические свойства кислот
Многие кислоты, например серная, азотная, соляная – это бесцветные жидкости. известны также твёрдые кислоты: ортофосфорная, метафосфорная HPO3, борная H3BO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: лимонная, яблочная и т.д.



H2SO3 HClO4 HNO3
IV. Способы получения кислот
|
Бескислородные |
Кислородсодержащие |
|
HCl, HBr, HI, HF, H2S |
HNO3, H2SO4 и другие |
|
ПОЛУЧЕНИЕ |
|
|
1. Прямое взаимодействие неметаллов H2 + Cl2 = 2 HCl |
1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 |
|
2. Реакция обмена между солью и менее летучей кислотой 2 NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl |
V. Химические свойства кислот
1. Изменяют окраску индикаторов
|
Название индикатора |
Нейтральная среда |
Кислая среда |
|
Лакмус |
Фиолетовый |
Красный |
|
Фенолфталеин |
Бесцветный |
Бесцветный |
|
Метилоранж |
Оранжевый |
Красный |
|
Универсальная индикаторная бумага |
Оранжевая |
Красная |
2.Реагируют с металлами в ряду активности до H2 (искл. HNO3 –азотная кислота)
Видео: “Взаимодействие кислот с металлами”
Ме + КИСЛОТА =СОЛЬ + H2↑ (р. замещения)

Zn + 2 HCl = ZnCl2 + H2
3. С основными (амфотерными) оксидами – оксидами металлов
Видео: “Взаимодействие оксидов металлов с кислотами”
МехОу + КИСЛОТА= СОЛЬ + Н2О (р. обмена)
CuO + H2SO4 = Cu SO4 + H2O
4. Реагируют с основаниями – реакция нейтрализации
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H2O ( р. обмена)
H3PO4 + 3NaOH = Na3PO4 + 3H2O
5. Реагируют с солями слабых, летучих кислот – если образуется кислота, выпадающая в осадок или выделяется газ:
2NaCl (тв.) + H2SO4(конц.) = Na2SO4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO4 > HBr > HCl > H2SO4 > HNO3 > HMnO4 > H2SO3 > H3PO4 > HF > HNO2>H2CO3 > H2S > H2SiO3 .
Каждая предыдущая кислота может вытеснить из соли последующую
Видео: “Взаимодействие кислот с солями”
6. Разложение кислородсодержащих кислот при нагревании ( искл. H2SO4; H3PO4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду:
H2CO3 ↔ H2O + CO2↑
H2SO3 ↔ H2O + SO2↑
Сероводородная кислота в продуктах выделяется в виде газа: СаS + 2HCl = H2S↑ + CaCl2
Видео: “Химические свойства соляной кислоты”
VI. Значение кислот
Роль кислот в нашей жизни трудно не заметить. Во-первых, в желудочном соке человека и животных содержится слабый раствор соляной кислоты. Муравьиная кислота, которая относится к группе органических кислот, содержится в жидкости, выделяемой муравьями, и ожог от крапивы обусловлен действием на кожу именно этой кислоты.


Рис. 1. Кислоты в природе (в лимонном соке содержится лимонная кислота; в жидкости, выделяемой муравьями – муравьиная кислота)
На этикетке многих газированных фруктовых напитков написано, что в их состав входит фосфорная кислота. Азотная кислота используется в производстве минеральных удобрений и взрывчатых веществ. Серную кислоту применяют в производстве аккумуляторных батарей.
VII. Техника безопасности приработе с кислотами
Анимация: Оказание первой помощи при попадании кислот на кожу
Анимация: Правила техники безопасности при работе с кислотами
Анимация: Правило разбавления концентрированной серной кислоты водой
VIII. Задания для закрепления
Задание №1. Распределите химические формулы кислот в таблицу. Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI, HClO4, HBr, CaCl2, Na2O, HCl, H2SO4, HNO3, HMnO4, Ca(OH)2, SiO2, H2SO3, Zn(OH)2, H3PO4, HF, HNO2,H2CO3, N2O, NaNO3, H2S, H2SiO3
|
Кислоты |
||||||
|
Бескислородные |
Кислородосодержащие |
Растворимые |
Нерастворимые |
Одноосновные |
Двухосновные |
Трёхосновные |
Задание №2. Составьте уравнения реакций:
Ca + HCl =
Na + H2SO4 =
Al + H2S =
Ca + H3PO4 =
Назовите продукты реакции.
Задание №3. Составьте уравнения реакций, назовите продукты:
Na2O + H2CO3 =
ZnO + HCl =
CaO + HNO3 =
Fe2O3 + H2SO4 =
Задание №4. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
KOH + HNO3 =
NaOH + H2SO3 =
Ca(OH)2 + H2S =
Al(OH)3 + HF =
HCl + Na2SiO3 =
H2SO4 + K2CO3 =
HNO3 + CaCO3 =
Назовите продукты реакции.
IX. Тренажеры
Тренажёр №1. “Формулы и названия кислот”
Тренажёр №2. ” Установление соответствия: формула кислоты – формула оксида”
Тренажёр №3. “Действие кислот на индикаторы”
Тренажёр №4. “Классификация кислот по наличию кислорода в кислотном остатке”
Тренажёр №5. “Классификация кислот по основности”
Тренажёр №6. “Классификация кислот по растворимости в воде”
Тренажёр №7. “Классификация кислот по стабильности”
Интерактивное задание LearningApps.org по теме: “Химические свойства кислот и оснований”
Выполните тест
Выполните итоговый контроль по теме: “Кислоты”
ЦОРы
Видео-презентация: “Кислоты”
Видео-опыт: “Действие кислот на индикаторы”
Видео-опыт: “Взаимодействие кислот с металлами”
Видео-опыт: “Взаимодействие оксидов металлов с кислотами”
Практическая работа: “Реакция обмена между оксидом меди (II) и серной кислотой”
Видео-опыт: “Реакция нейтрализации”
Видео-опыт: “Взаимодействие кислот с солями”
Видео-опыт: “Химические свойства соляной кислоты”
Анимация: “Оказание первой помощи при попадании кислот на кожу”
Анимация: “Правила техники безопасности при работе с кислотами”
Анимация: “Правило разбавления концентрированной серной кислоты водой”
