Как определить кислоту
Чаще всего кислота – это прозрачная жидкость, не обладающая запахом. Как же определить, какая кислота стоит перед нами? Ответ на этот вопрос нам поможет найти аналитическая химия. В качестве примера рассмотрим, как же распознать наиболее часто встречающиеся кислоты: азотную, серную и соляную.

Вам понадобится
- Для определения кислоты нам в первую очередь необходима таблица растворимости кислот, а также реактивы.
Инструкция
Итак, перед нами стоят три одинаковые пробирки с кислотами. Чтобы понять, в какой пробирке какая кислота находится, обратимся к таблице растворимости и подберем реакции, сопровождаемые выпадением осадка, изменением цвета раствора, либо выделением газа, характерные только для одной исследуемой кислоты.
Мы видим, что серная кислота выпадает в осадок при взаимодействии с ионами бария, а остальные две кислоты – нет. Отливаем по несколько миллилитров исследуемых кислот в чистые пробирки. Добавляем к ним несколько миллилитров основания бария Ba(OH)2. В одной из пробирок выпадает белый мутный осадок. Отлично, мы определили, где находится серная кислота!
Изучаем таблицу дальше. Как мы видим, хлорид серебра дает осадок, а нитрат – нет. Отливаем еще несколько миллилитров исследуемых кислот в чистые пробирки. В каждую пробирку добавляем немного AgNO3. В пробирке, где находилась соляная кислота, начинает образовываться осадок белого цвета, в дальнейшем застывая в виде полупрозрачного налета, называемого роговым серебром. В пробирке с азотной кислотой не происходит никаких изменений.
Видео по теме
Полезный совет
Таким образом, пользуясь таблицей растворимости кислот, можно придумать способ, как определить любую кислоту.
Источники:
- хлорид серебра
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Как пользоваться таблицей растворимости в химии
Содержание:
- Функции таблицы растворимости
- Растворимость веществ
-
Полная таблица растворимости
- Школьная таблица растворимости
- Полная таблица растворимости
- Условные обозначения
- Как применять таблицу
Функции таблицы растворимости
Таблица Менделеева — не единственный помощник в работе химика. Не менее важным инструментом для решения химических уравнений является таблица растворимости веществ. Прежде всего она помогает определить, растворяется ли вещество в воде. Если оно не растворяется, можно узнать каким будет осадок и решить ионное уравнение.
Растворимость веществ
Если вещество может образовать с другим однородное соединение, значит оно растворимо. Степень растворимости у всех веществ разная. В зависимости от этого все вещества делят на группы:
- растворимые — в 100 г воды растворяется больше 10 г (например, соль, спирт, аммиак);
- малорастворимые — в 100 г воды растворяется менее 1 г (кислород, бензол, алебастр);
- нерастворимые — в 100 г воды растворяется менее 0,01 г (стекло, бензин, гелий).
Каждое вещество имеет коэффициент растворимости, показывающий величину массы, которую оно может растворить. На растворение зачастую влияет температура и давление, при которых происходит реакция.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Полная таблица растворимости
В школьном курсе химии используется упрощенная таблица растворимости. Для более высокого уровня изучения или работы необходима полная, где приводятся данные о большем количестве реакций и включено больше химических элементов и соединений.
Школьная таблица растворимости
Полная таблица растворимости
Условные обозначения
В таблице указаны названия химических элементов и соединений, а также условные обозначения, говорящие о степени растворимости. Часть обозначений действительна и для школьной. В полной таблице учтена способность веществ растворяться в кислотах.
- Катионы — положительно заряженные частицы и соединения.
- Анионы — отрицательно заряженные соединения.
- Р — растворимое.
- М — малорастворимое.
- Н — нерастворимое в воде.
- РК — растворимое только в неорганических кислотах.
- НК — нерастворимое ни в воде, ни в кислотах.
- Г — не существует в контакте с водой, гидролизуется.
- «-» — не существует.
Как применять таблицу
Пользоваться пособием не сложно. Достаточно посмотреть на то, какое значение находится на пересечении строчек двух частей интересующего соединения. Например, чтобы узнать, образуется ли раствор соли MgSo4 (сульфат магния), необходимо найти столбик Mg2+ и опуститься по нему до строки SO42-. Там, где строки пересекаются, написано Р, то есть соединение растворимо.
Если посмотреть на результат реакции металла серебра с бромом – AgBr – можно увидеть, что бромид серебра не растворяется в воде или кислотах, так как в таблице на пересечении этих элементов стоит НК.
Насколько полезной была для вас статья?
Рейтинг: 2.78 (Голосов: 37)
Выделите текст и нажмите одновременно клавиши «Ctrl» и «Enter»
Текст с ошибкой:
Расскажите, что не так
Поиск по содержимому
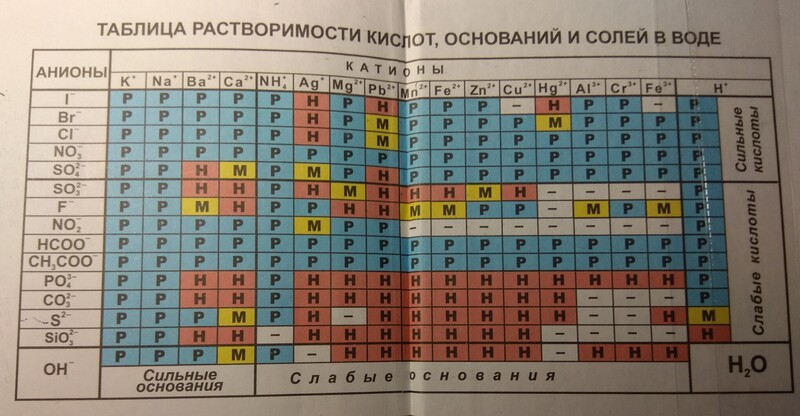
Таблица растворимости солей, кислот и оснований
Растворимость – это способность одного вещества взаимодействовать с другими веществами, образуя при этом однородные растворы.
На сегодняшний день существует таблица способная помочь в определении растворимости химического соединения.
Чтобы пользоваться таблицей не обязательно иметь специальных навыков. Для определения растворимости какого-либо химического вещества, достаточно в таблице провести перпендикуляр от выбранного вещества начиная от крайней левой колонки до химического вещества в верхней колонке. Точка пересечения и укажет нам насколько растворимы выбранные вещества.
Рассмотрим на примере, как пользоваться таблицей растворимости солей, кислот и оснований:
В левой колонке выберем вещество Ba2+, проводим линию до 3-й колонки с веществом F–, на пересечении видим символы «РК». Это означает, что соединение нерастворимо в воде и растворяется только в сильных неорганических кислотах.
Таблица условных обозначений
| Р | растворимо в воде (больше 1 грамма вещества на 100 грамм воды) |
| М | малорастворимо в воде (от 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| Н | нерастворимо в воде, но хорошо растворимо в слабых кислотах (меньше 0,001 грамма до 1 грамма вещества в 100 граммах воды) |
| РК | нерастворимо в воде, но растворимо в сильных неорганических кислотах |
| НК | химическое вещество не растворимо ни в воде, ни в любых кислотах |
| Г | химическое вещество подвергается гидролизу |
| – | данные о растворимости химического вещества отсутствуют |
Таблица растворимости солей, кислот и оснований по химии
| Катионы |
Анионы | ||||||||||
| OH– | F– | Cl– | Br– | I– | S2- | NO3– | CO32- | SiO32- | SO42- | PO43- | |
| H+ | Р | Р | Р | Р | Р | М | Р | – | Н | Р | Р |
| Na+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| K+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NH4+ | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| Mg2+ | Н | РК | Р | Р | Р | М | Р | Н | РК | Р | РК |
| Ca2+ | М | НК | Р | Р | Р | М | Р | Н | РК | М | РК |
| Sr2+ | М | НК | Р | Р | Р | Р | Р | Н | РК | РК | РК |
| Ba2+ | Р | РК | Р | Р | Р | Р | Р | Н | РК | НК | РК |
| Sn2+ | Н | Р | Р | Р | М | РК | Р | Н | Н | Р | Н |
| Pb2+ | Н | Н | М | М | М | РК | Р | Н | Н | Н | Н |
| Al3+ | Н | М | Р | Р | Р | Г | Р | Г | НК | Р | РК |
| Cr3+ | Н | Р | Р | Р | Р | Г | Р | Г | Н | Р | РК |
| Mn2+ | Н | Р | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Fe3+ | Н | Р | Р | Р | – | – | Р | Г | Н | Р | РК |
| Co2+ | Н | М | Р | Р | Р | Н | Р | Н | Н | Р | Н |
| Ni2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cu2+ | Н | М | Р | Р | – | Н | Р | Н | Н | Р | Н |
| Zn2+ | Н | М | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Cd2+ | Н | Р | Р | Р | Р | РК | Р | Н | Н | Р | Н |
| Hg2+ | Н | Р | Р | М | НК | НК | Р | Н | Н | Р | Н |
| Hg22+ | Н | Р | НК | НК | НК | РК | Р | Н | Н | М | Н |
| Ag+ | Н | Р | НК | НК | НК | НК | Р | Н | Н | М | Н |
Таблица растворимости веществ (кислот и солей) по химии
Игорь Борисович Львов
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Таблица растворимости химических элементов — это таблица с растворимостями в воде наиболее известных неорганических кислот, оснований и солей.
Определение 1
В таблице растворимости по химии представлена растворимость при 20 °С, с увеличением температуры растворимость увеличивается.
Вещество растворимо в воде, если его растворимость больше чем 1 г в 100 г воды и нерастворимо, если менее 0,1 г/100 г.
Например, найдя в таблице растворимости по химии литий, можно убедиться, что практически все его соли образуют растворы.
На рис. 1 и рис. 2 представлены фото полной таблицы растворимости по химии с названиями кислотных остатков.
Рисунок 1. Фото таблица растворимости по химии 2018-2019
Сделаем домашку
с вашим ребенком за 380 ₽
Уделите время себе, а мы сделаем всю домашку с вашим ребенком в режиме online
Бесплатное пробное занятие
*количество мест ограничено
Рисунок 2. Таблица по химии кислотами и кислотными остатками
Чтобы составить название соли, необходимо воспользоваться таблицей Менделеева и растворимости. К названию кислотного остатка прибавляется название металла из таблицы Менделеева, например:
$mathrm{Zn_3(PO_4)_2}$ — фосфат цинка;
$mathrm{FeSO_4}$ — сульфат железа (II) .
В скобках с текстовым названием необходимо указать валентность металла, если их несколько. В случае с железом также существует соль $mathrm{Fe_2(SO_4)_3}$ — сульфат железа (III).
Что можно узнать, используя таблицу растворимости в химии
Таблицу растворимости веществ по химии с осадками используют для определения возможности протекания какой-либо реакции, так как для необратимого протекания реакции необходимо образование осадка или газа.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 26.11.2022
См. также материалы по теме: Растворы, Виды растворов, Растворимость.
Таблица растворимости кислот, солей и оснований
Для того, чтобы проверить растворимость химического соединения в воде, составляем его из пересечения столбца и строки, и читаем символ на их пересечении.
Обозначения в таблице растворимости:
“пустая клетка” – это и есть вода, она в таблице одна
“-“ – соединения не существует (выделено клетками желтого цвета)
“Р” – растворимо (обозначено клетками белого цвета)
“М“ – малорастворимо (выделено клетками голубого цвета)
“Н“ – нерастворимо (обозначено клетками красного цвета)
Как пользоваться таблицей растворимости солей, кислот и оснований в воде
Пример:
Выясним растворимость Ca(NO₃)2 в воде. Для этого найдем в таблице растворимости столбец Ca²⁺ и опустимся по нему до пересечения со строкой NO₃¯ и считаем на их пересечении символ Р. Значит – соединение растворимо.
| РАСТВОРИМОСТЬ КИСЛОТ, СОЛЕЙ, ОСНОВАНИЙ В ВОДЕ | |||||||||||||||||||||
| Ионы | H⁺ | Li⁺ | NH₄⁺ | K⁺ | Na⁺ | Ag⁺ | Ba²⁺ | Ca²⁺ | Mg²⁺ | Mn²⁺ | Zn²⁺ | Ni²⁺ | Sn²⁺ | Pb²⁺ | Cu²⁺ | Hg²⁺ | Hg₂²⁺ | Fe²⁺ | Fe³⁺ | Al³⁺ | Cr³⁺ |
| OH¯ | P | P | P | P | – | P | M | M | H | H | H | H | H | H | – | – | H | H | H | H | |
| NO₃¯ | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | – | P | P | P | P |
| F¯ | P | M | P | P | P | P | M | H | M | P | M | P | P | M | P | – | M | M | H | M | M |
| Cl¯ | P | P | P | P | P | H | P | P | P | P | P | P | P | M | P | P | H | P | P | P | P |
| Br¯ | P | P | P | P | P | H | P | P | P | P | P | P | P | M | P | M | H | P | P | P | P |
| I¯ | P | P | P | P | P | H | P | P | P | P | P | P | P | H | – | H | H | H | – | P | P |
| S²¯ | P | P | P | P | P | H | – | – | – | H | H | H | H | H | H | H | H | H | H | – | – |
| SO₃²¯ | P | P | P | P | P | M | M | M | M | H | M | H | – | H | – | – | – | M | – | – | – |
| SO₄²¯ | P | P | P | P | P | M | H | M | P | P | P | P | P | H | P | P | M | P | P | P | P |
| CO₃²¯ | P | P | P | P | P | H | H | H | H | H | H | – | – | H | – | – | H | H | – | – | – |
| SiO₃²¯ | H | – | – | P | P | H | H | H | H | H | H | H | – | H | – | – | – | H | – | – | – |
| PO₄³¯ | P | H | P | P | P | H | H | H | H | H | H | H | H | H | H | H | H | H | H | H | H |
| CH₃COO¯ | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | P | M | P | P | P | P |
Почему растворимость указывают таким “странным” способом (растворимо, малорастворимо, нерастворимо)? Дело в том, что на сегодняшний момент пока не существует четкого стандарта на обозначение качественных характеристик растворимости химических соединений. А вот количественные характеристики доступны и измеримы.
Примечание. Растворимость веществ сильно изменяется, в зависимости от температуры, давления, а также от наличия в растворе других веществ. Поэтому следует принять во внимание, что информация в таблице приведена для, так называемых, “нормальных условий”
0
Растворимость. Розчинність |
Описание курса
| Валентность. Валентність



