И транскрипция, и трансляция относятся к матричным биосинтезам. Матричным биосинтезом называется синтез
биополимеров (нуклеиновых кислот, белков) на матрице – нуклеиновой кислоте ДНК или РНК. Процессы матричного биосинтеза относятся к пластическому обмену: клетка расходует энергию АТФ.
Матричный синтез можно представить как создание копии исходной информации на несколько другом или новом
“генетическом языке”. Скоро вы все поймете – мы научимся достраивать по одной цепи ДНК другую, переводить РНК в ДНК
и наоборот, синтезировать белок с иРНК на рибосоме. В данной статье вас ждут подробные примеры решения задач, генетический словарик пригодится – перерисуйте его себе 🙂

Возьмем 3 абстрактных нуклеотида ДНК (триплет) – АТЦ. На иРНК этим нуклеотидам будут соответствовать – УАГ (кодон иРНК).
тРНК, комплементарная иРНК, будет иметь запись – АУЦ (антикодон тРНК). Три нуклеотида в зависимости от своего расположения
будут называться по-разному: триплет, кодон и антикодон. Обратите на это особое внимание.
Репликация ДНК – удвоение, дупликация (лат. replicatio — возобновление, лат. duplicatio – удвоение)
Процесс синтеза дочерней молекулы ДНК по матрице родительской ДНК. Нуклеотиды достраивает фермент ДНК-полимераза по
принципу комплементарности. Переводя действия данного фермента на наш язык, он следует следующему правилу: А (аденин) переводит в Т (тимин), Г (гуанин) – в Ц (цитозин).
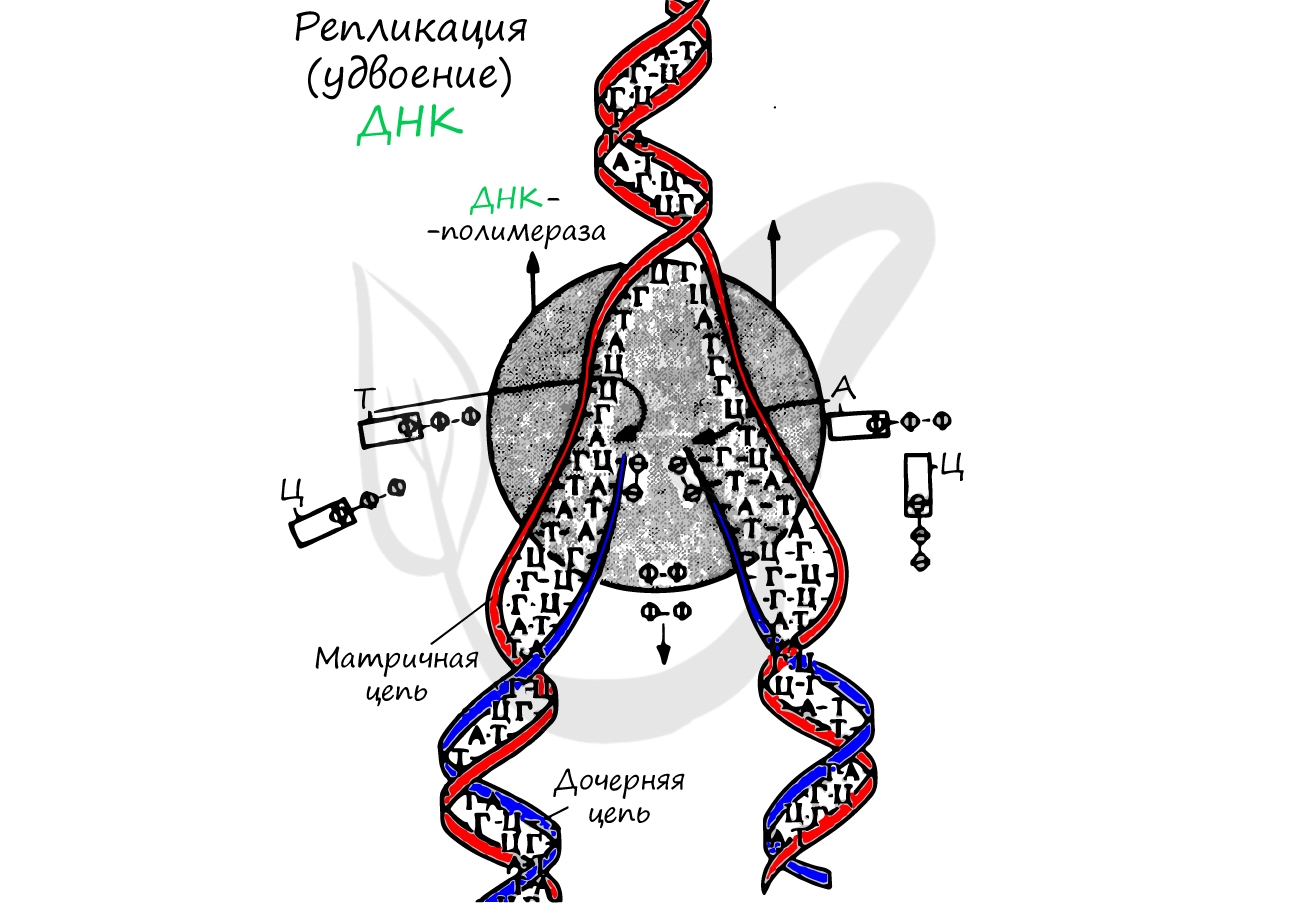
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них
содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между
дочерними клетками.
Транскрипция (лат. transcriptio — переписывание)
Транскрипция представляет собой синтез информационной РНК (иРНК) по матрице ДНК. Несомненно, транскрипция происходит
в соответствии с принципом комплементарности азотистых оснований: А – У, Т – А, Г – Ц, Ц – Г (загляните в “генетический словарик”
выше).
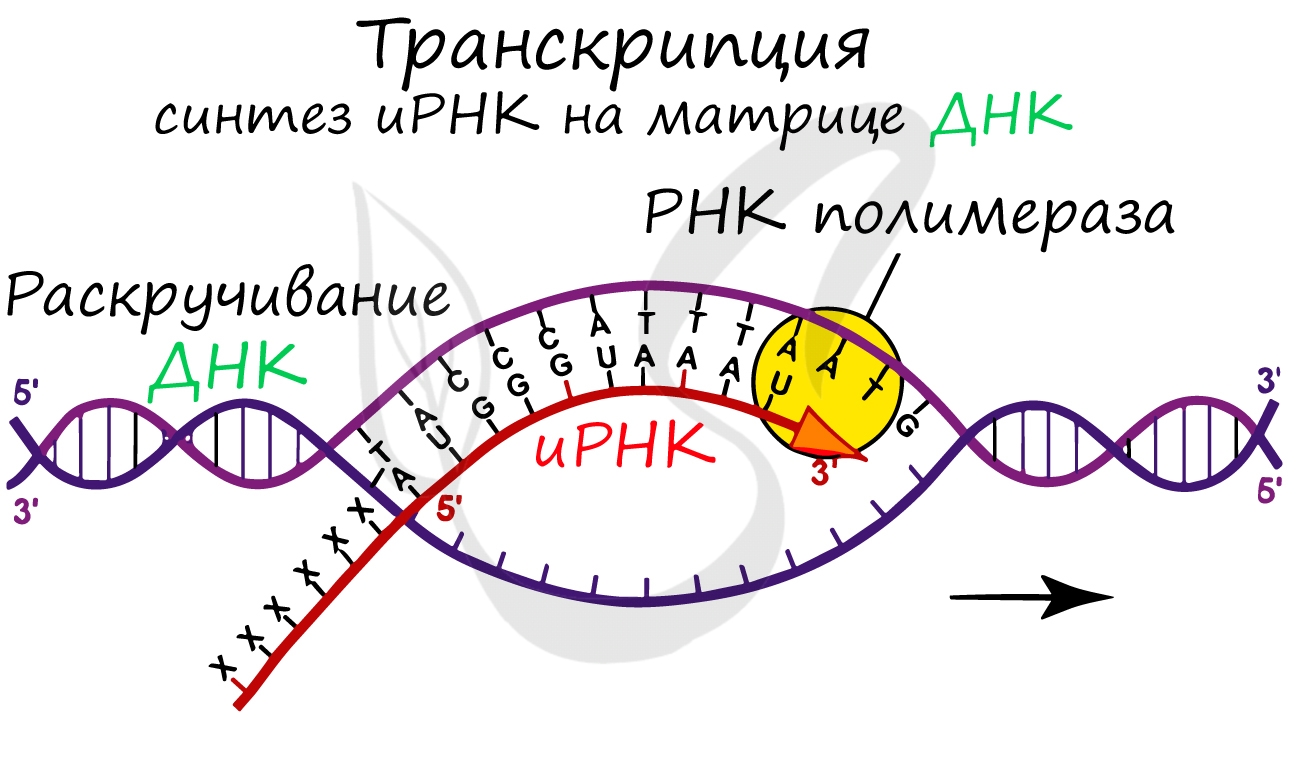
До начала непосредственно транскрипции происходит подготовительный этап: фермент РНК-полимераза узнает особый участок молекулы ДНК – промотор и связывается с ним. После связывания с промотором происходит раскручивание молекулы ДНК, состоящей из двух
цепей: транскрибируемой и смысловой. В процессе транскрипции принимает участие только транскрибируемая цепь ДНК.
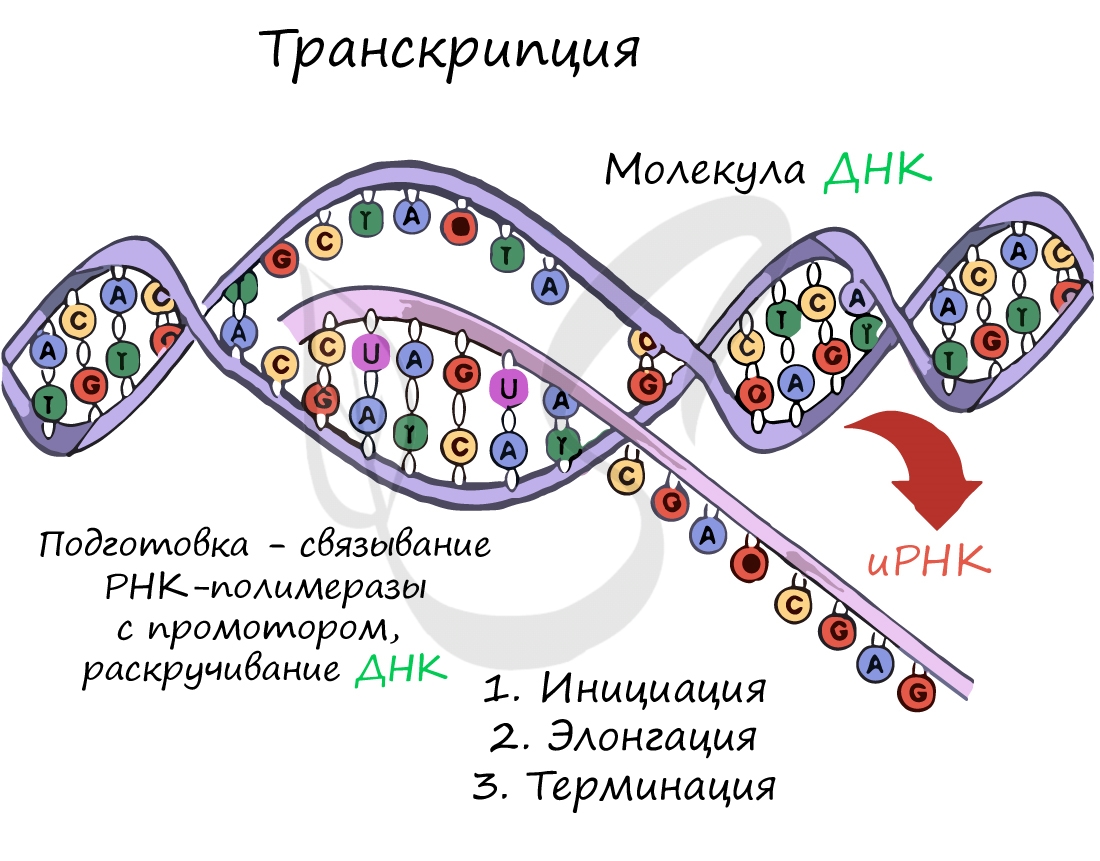
Транскрипция осуществляется в несколько этапов:
- Инициация (лат. injicere — вызывать)
- Элонгация (лат. elongare — удлинять)
- Терминация (лат. terminalis — заключительный)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК
быстро растет.
Достигая особого участка цепи ДНК – терминатора, РНК-полимераза получает сигнал к прекращению синтеза иРНК. Транскрипция завершается. Синтезированная иРНК направляется из ядра в цитоплазму.
Трансляция (от лат. translatio — перенос, перемещение)
Куда же отправляется новосинтезированная иРНК в процессе транскрипции? На следующую ступень – в процесс трансляции.
Он заключается в синтезе белка на рибосоме по матрице иРНК. Последовательность кодонов иРНК переводится в последовательность
аминокислот.
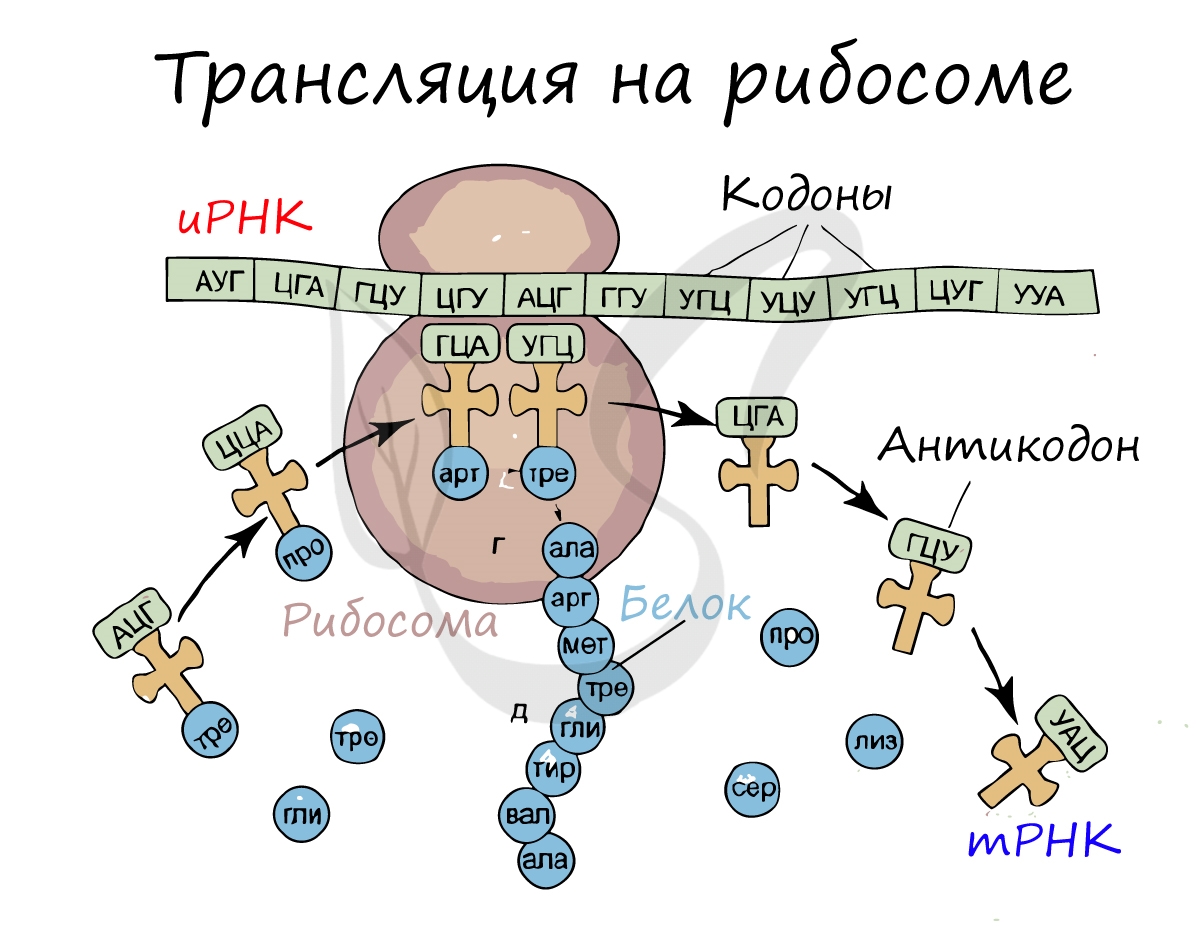
Перед процессом трансляции происходит подготовительный этап, на котором аминокислоты присоединяются к соответствующим молекулам тРНК. Трансляцию можно разделить на несколько стадий:
- Инициация
- Элонгация
- Терминация
Информационная РНК (иРНК, синоним – мРНК (матричная РНК)) присоединяется к рибосоме, состоящей из двух субъединиц.
Замечу, что вне процесса трансляции субъединицы рибосом находятся в разобранном состоянии.
Первый кодон иРНК, старт-кодон, АУГ оказывается в центре рибосомы, после чего тРНК приносит аминокислоту,
соответствующую кодону АУГ – метионин.
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз.
Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Доставка нужных аминокислот осуществляется благодаря точному соответствию 3 нуклеотидов (кодона) иРНК 3 нуклеотидам (антикодону) тРНК. Язык перевода между иРНК и тРНК выглядит как: А (аденин) – У (урацил), Г (гуанин) – Ц (цитозин).
В основе этого также лежит принцип комплементарности.
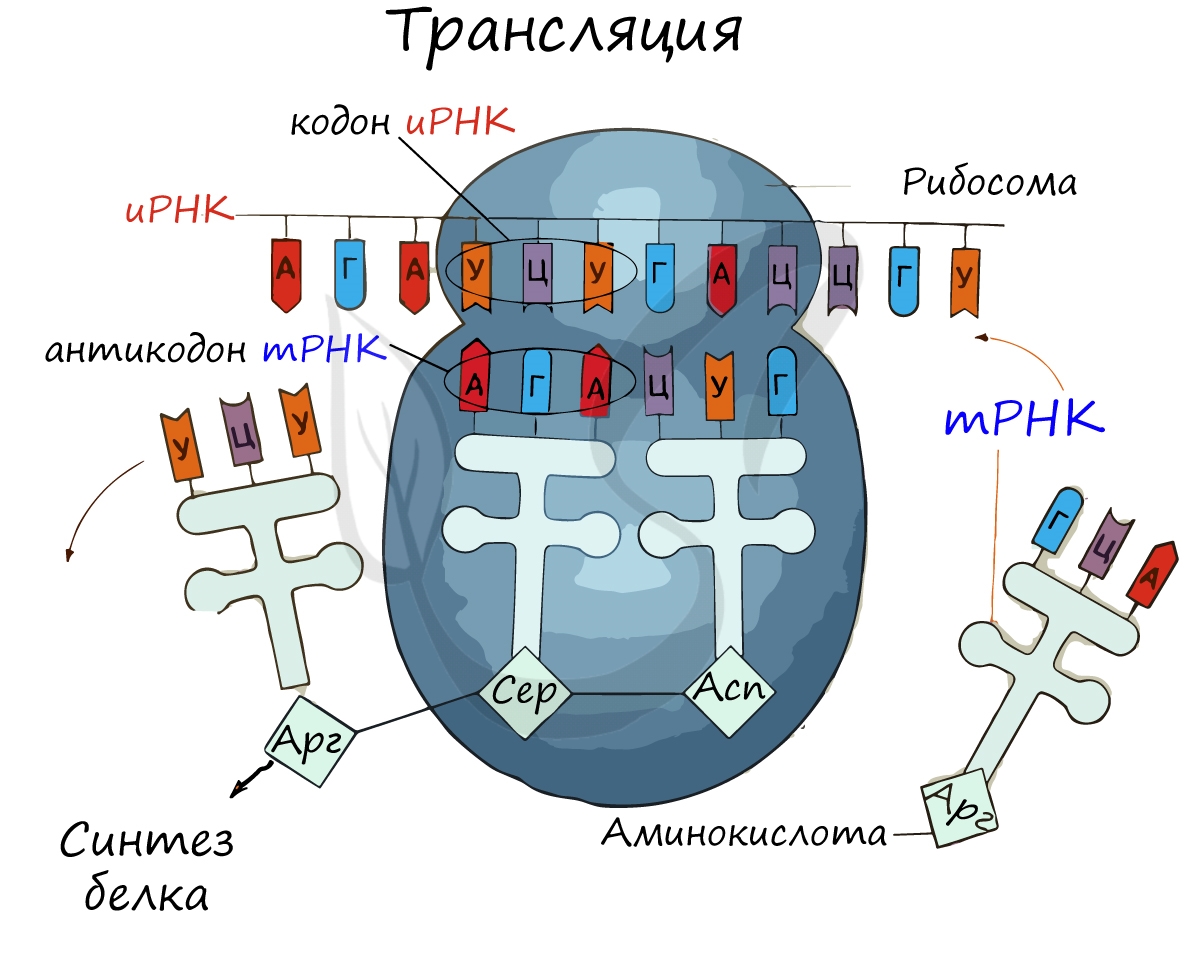
Движение рибосомы вдоль молекулы иРНК называется транслокация. Нередко в клетке множество рибосом садятся на одну молекулу
иРНК одновременно – образующаяся при этом структура называется полирибосома (полисома). В результате происходит одновременный синтез множества одинаковых белков.
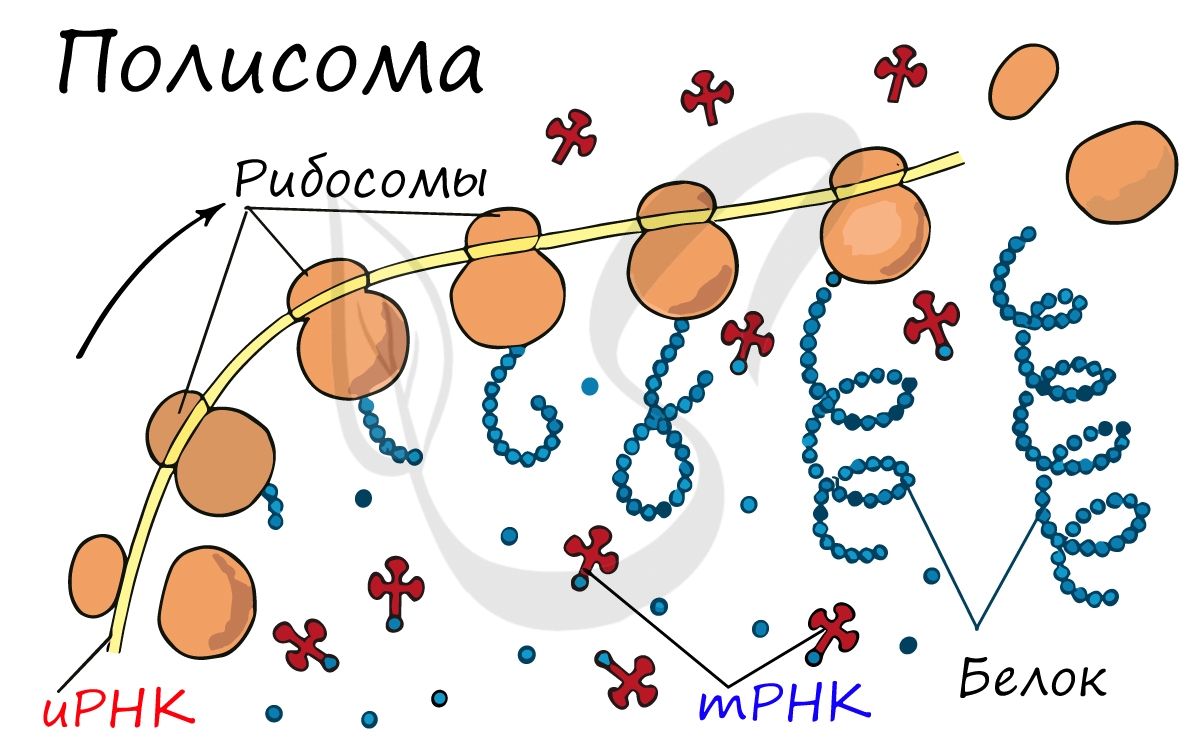
Синтез белка – полипептидной цепи из аминокислот – в определенный момент завершатся. Сигналом к этому служит попадание
в центр рибосомы одного из так называемых стоп-кодонов: УАГ, УГА, УАА. Они относятся к нонсенс-кодонам (бессмысленным), которые не кодируют ни одну аминокислоту. Их функция – завершить синтез белка.
Существует специальная таблица для перевода кодонов иРНК в аминокислоты. Пользоваться ей очень просто, если вы запомните, что
кодон состоит из 3 нуклеотидов. Первый нуклеотид берется из левого вертикального столбика, второй – из верхнего горизонтального,
третий – из правого вертикального столбика. На пересечении всех линий, идущих от них, и находится нужная вам аминокислота 🙂
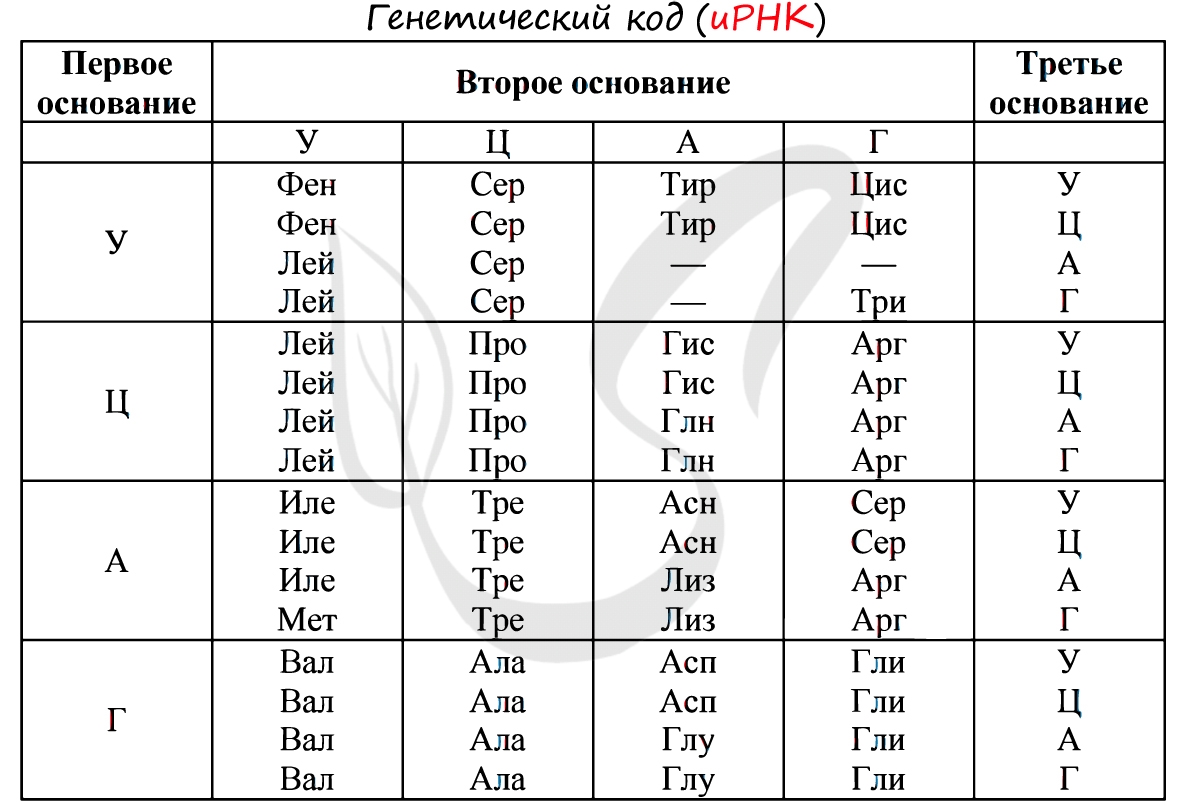
Давайте потренируемся: кодону ЦАЦ соответствует аминокислота Гис, кодону ЦАА – Глн. Попробуйте самостоятельно найти
аминокислоты, которые кодируют кодоны ГЦУ, ААА, УАА.
Кодону ГЦУ соответствует аминокислота – Ала, ААА – Лиз. Напротив кодона УАА в таблице вы должны были обнаружить прочерк:
это один из трех нонсенс-кодонов, завершающих синтез белка.
Примеры решения задачи №1
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК),
приведенной вверху.
“Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов
во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны
соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода”

Объяснение:
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити
ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК:
А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК:
А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что
тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
“Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет
следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется
на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону
тРНК”

Обратите свое пристальное внимание на слова “Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой
синтезируется участок центральной петли тРНК “. Эта фраза кардинально меняет ход решения задачи: мы получаем право напрямую и сразу
синтезировать с ДНК фрагмент тРНК – другой подход здесь будет считаться ошибкой.
Итак, синтезируем напрямую с ДНК фрагмент молекулы тРНК: АУЦ-ГУУ-УГЦ-ЦГА-УГГ. Это не отдельные молекулы тРНК (как было
в предыдущей задаче), поэтому не следует разделять их запятой – мы записываем их линейно через тире.
Третий триплет ДНК – АЦГ соответствует антикодону тРНК – УГЦ. Однако мы пользуемся таблицей генетического кода по иРНК,
так что переведем антикодон тРНК – УГЦ в кодон иРНК – АЦГ. Теперь очевидно, что аминокислота кодируемая АЦГ – Тре.
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и
аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной
молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.

Один триплет ДНК состоит из 3 нуклеотидов, следовательно, 150 нуклеотидов составляют 50 триплетов ДНК (150 / 3). Каждый триплет ДНК
соответствует одному кодону иРНК, который в свою очередь соответствует одному антикодону тРНК – так что их тоже по 50.
По правилу Чаргаффа: количество аденина = количеству тимина, цитозина = гуанина. Аденина 20%, значит и тимина также 20%.
100% – (20%+20%) = 60% – столько приходится на оставшиеся цитозин и гуанин. Поскольку их процент содержания равен, то
на каждый приходится по 30%.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 🙂
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Скачать материал
без ожидания

Скачать материал
без ожидания


- Сейчас обучается 20 человек из 9 регионов


- Сейчас обучается 26 человек из 19 регионов


- Сейчас обучается 28 человек из 22 регионов


Описание презентации по отдельным слайдам:
-

1 слайд
Решение задач с использованием таблицы генетического кода
-

2 слайд
Повторение:
Какие процессы описаны в данной схеме? Как они взаимосвязаны? -

3 слайд
В одной цепи молекулы ДНК следующая последовательность нуклеотидов: ТТАААЦЦАТТТГ.
Используя принцип комплементарности, постройте вторую цепь и и-РНК, комплементарную ей.
-Т – Т – А – А- А – Ц – Ц- А- Т- Т – Т – Г –
I I I I I I I I I I I I
-А – А – Т – Т – Т- Г – Г – Т – А – А – А – Ц-
(ДНК)-У – У – А –А – А –Ц – Ц – А – У – У –У – Г-
(и- РНК) -

4 слайд
Таблица генетического кода (и-РНК)
-

5 слайд
Основные типы задач, решение которых предполагает использование таблицы генетического кода
Построение молекулы и-РНК, антикодонов т-РНК и последовательности аминокислот в белкеОпределение структуры т-РНК и переносимой ею аминокислоты
Определение аминокислотной последовательности в белке до и после изменений в ДНК
Краткая теория
Задача 1
Задача 2
Задача 3
Задача 4
Задача 5
Задача 6
Задача 8
Задача 7
Завершить работу
Краткая теория
Информационные источники
самостоятельно:
самостоятельно: -

6 слайд
нуклеотиды и-РНК комплементарны нуклеотидам ДНК;
вместо тимина ДНК во всех видах РНК записывается урацил;
нуклеотиды и-РНК пишутся подряд, без запятых, т. к. имеется в виду одна молекула;
кодон и-РНК комплементарен антикодону т-РНК
антикодоны т-РНК пишутся через запятую, т. к. каждый антикодон принадлежит отдельной молекуле т-РНК;
Основной теоретический материал
Построение молекулы и-РНК, антикодонов т-РНК и последовательности аминокислот в белке -

7 слайд
аминокислоты находим по таблице генетического кода;
аминокислоты в белке пишутся через дефис, т. к. имеется в виду, что они уже соединились и образовали первичную структуру белка;
3 нуклеотида =1 триплет (кодон) = 1 аминокислота = 1 т-РНКОсновной теоретический материал
Построение молекулы и-РНК, антикодонов т-РНК и последовательности аминокислот в белке -

8 слайд
аминокислоты находим по таблице генетического кода;
аминокислоты в белке пишутся через дефис, т. к. имеется в виду, что они уже соединились и образовали первичную структуру белка;
3 нуклеотида =1 триплет (кодон) = 1 аминокислота = 1 т-РНКОсновной теоретический материал
Построение молекулы и-РНК, антикодонов т-РНК и последовательности аминокислот в белке -

9 слайд
Задача 1.
Фрагмент цепи ДНК имеет последовательность
А-Ц-Г-Т-Т-Г-Ц-Ц-Ц-А-А-Т.
Определите последовательность нуклеотидов и-РНК, антикодоны т-РНК и последовательность аминокислот в синтезируемом белке. -

10 слайд
и-РНК строим комплементарно ДНК;
антикодоны т-РНК комплементарны кодонам и-РНК;
аминокислоты находим по кодонам и-РНК, используя таблицу генетического кода.
Основные этапы решения задачи. План рассуждений. -

11 слайд
фрагмент цепи ДНК:
А-Ц-Г-Т-Т-Г-Ц-Ц-Ц-А-А-Т
кодоны и-РНК:
У-Г-Ц-А-А-Ц-Г-Г-Г-У-У-А
антикодоны т-РНК
А-Ц-Г,У-У-Г,Ц-Ц-Ц,А-А-У
Основные этапы решения задачи. Оформление. -

12 слайд
фрагмент цепи ДНК:
АЦГ-ТТГ-ЦЦЦ-ААТ
кодоны и-РНК:
УГЦ-ААЦ-ГГГ-УУА
антикодоны т-РНК
АЦГ,УУГ,ЦЦЦ, ААУ
Основные этапы решения задачи. Краткое оформление. -

13 слайд
кодоны и-РНК: УГЦ-ААЦ-ГГГ-УУА
-

14 слайд
Таблица генетического кода (и-РНК)
-

15 слайд
последовательность аминокислот в белке:
цис-асн-гли-лей
(кодоны и-РНК:
УГЦ-ААЦ-ГГГ-УУА)Основные этапы решения задачи. Определение аминокислот по таблице генетического кода.
-

16 слайд
Задача 2.
Последовательность аминокислот во фрагменте молекулы белка фен-глу-мет.
Определите, пользуясь таблицей генетического кода, возможные триплеты ДНК, которые кодируют этот фрагмент белка -

17 слайд
Триплеты и-РНК: Фен-Глу-Мет
Фен – УУУ или УУЦ
Глу – ГАА или ГАГ
Мет – АУГ
Находим триплеты ДНК:
Фен – ААА или ААГ
Глу – ЦТТ или ЦТЦ
Мет – ТАЦ
Основные этапы решения задачи. Решение задачи. Оформление. -

18 слайд
Триплеты и-РНК: Фен-Глу-Мет
Фен – УУУ или УУЦ
Глу – ГАА или ГАГ
Мет – АУГ
Находим триплеты ДНК:
Фен – ААА или ААГ
Глу – ЦТТ или ЦТЦ
Мет – ТАЦ
Основные этапы решения задачи. Решение задачи. Оформление. -

19 слайд
Задача 3.
В биосинтезе белка участвовали т-РНК с антикодонами
УУА, ГГЦ, ЦГЦ, АУА, ЦГУ.
Определите структуру двухцепочечного участка молекулы ДНК, несущего информацию о синтезируемом полипептиде, и последовательность аминокислот в нем. -

20 слайд
Ответы на задачу № 3
-

21 слайд
Задача 4.
Матрицей для синтеза белка послужил фрагмент и-РНК, имеющий последовательность
АУГ-ГЦУ-ААА-ЦЦГ.
Определите антикодоны т-РНК, участвовавшие в трансляции, первичную структуру синтезированного белка и последовательность нуклеотидов в гене, кодирующем данный белок. -

22 слайд
Ответы на задачу № 4
-

23 слайд
т-РНК синтезируются прямо на матрице ДНК по принципу комплементарности и без участия и-РНК (обычно это указывается в условии задачи);
чтобы узнать, какую аминокислоту переносит т-РНК, необходимо построить кодон и-РНК;
по кодону и-РНК с помощью таблицы генетического кода определяем аминокислоту;
указанный в условии триплет т-РНК является антикодоном.Определение структуры т-РНК и переносимой ею аминокислоты
-

24 слайд
т-РНК синтезируются прямо на матрице ДНК по принципу комплементарности и без участия и-РНК (обычно это указывается в условии задачи);
чтобы узнать, какую аминокислоту переносит т-РНК, необходимо построить кодон и-РНК;
по кодону и-РНК с помощью таблицы генетического кода определяем аминокислоту;
указанный в условии триплет т-РНК является антикодоном.Определение структуры т-РНК и переносимой ею аминокислоты
-

25 слайд
Задача 5.
Известно, что все виды РНК синтезируются на ДНК – матрице. Фрагмент молекулы ДНК, на которой синтезировался участок центральной петли т-РНК, имеет следующую последовательность нуклеотидов:
ЦГЦ-ГАЦ-ГТГ-ГТЦ-ГАА.
Установите нуклеотидную последовательность участка т-РНК, который синтезируется на данном фрагменте, и аминокислоту, которую будет переносить эта т-РНК в процессе биосинтеза белка, если третий триплет соответствует антикодону т-РНК.
Ответ поясните. -

26 слайд
1) Находим последовательность нуклеотидов участка центральной петли т-РНК:
участок ДНК: ЦГЦ-ГАЦ-ГТГ-ГТЦ-ГАА
т-РНК: ГЦГ-ЦУГ-ЦАЦ-ЦАГ-ЦУУ
2) Подчеркнутый триплет по условию задачи соответствует антикодону. Антикодон
т-РНК: ЦАЦ. Ему соответствует кодон
и-РНК: ГУГ.
3) По таблице генетического кода находим аминокислоту: вал.
Основные этапы решения задачи. План рассуждений. Оформление. -

27 слайд
1) Находим последовательность нуклеотидов участка центральной петли т-РНК:
участок ДНК: ЦГЦ-ГАЦ-ГТГ-ГТЦ-ГАА
т-РНК: ГЦГ-ЦУГ-ЦАЦ-ЦАГ-ЦУУ
2) Подчеркнутый триплет по условию задачи соответствует антикодону. Антикодон
т-РНК: ЦАЦ. Ему соответствует кодон
и-РНК: ГУГ.
3) По таблице генетического кода находим аминокислоту: вал.
Основные этапы решения задачи. План рассуждений. Оформление. -

28 слайд
Задача 6.
Известно, что все виды РНК синтезируются на ДНК – матрице. Фрагмент молекулы ДНК, на которой синтезировался участок центральной петли т-РНК, имеет следующую последовательность нуклеотидов:
АТАГЦТГАА- ЦГГ-АЦТ.
Установите нуклеотидную последовательность участка т-РНК, который синтезируется на данном фрагменте, и аминокислоту, которую будет переносить эта т-РНК в процессе биосинтеза белка, если третий триплет соответствует антикодону т-РНК.
Ответ поясните. -

29 слайд
Ответ:
1) нуклеотидная последовательность участка тРНК:
УАУ-ЦГА-ЦУУ-ГЦЦ-УГА;
2) нуклеотидная последовательность антикодона ЦУУ (третий триплет) соответствует кодону на и-РНК: ГАА;
3) по таблице генетического кода этому кодону соответствует аминокислота глу, которую будет переносить данная т-РНК
Условие: Известно, что все виды РНК синтезируются на ДНК – матрице. Фрагмент молекулы ДНК, на которой синтезировался участок центральной петли т-РНК, имеет следующую последовательность нуклеотидов: АТАГЦТГАА- ЦГГ-АЦТ -

30 слайд
Ответ:
1) нуклеотидная последовательность участка тРНК:
УАУ-ЦГА-ЦУУ-ГЦЦ-УГА;
2) нуклеотидная последовательность антикодона ЦУУ (третий триплет) соответствует кодону на и-РНК: ГАА;
3) по таблице генетического кода этому кодону соответствует аминокислота глу, которую будет переносить данная т-РНК
Условие: Известно, что все виды РНК синтезируются на ДНК – матрице. Фрагмент молекулы ДНК, на которой синтезировался участок центральной петли т-РНК, имеет следующую последовательность нуклеотидов: АТАГЦТГАА- ЦГГ-АЦТ -

31 слайд
Оцените себя:
0 ошибок – 3 балла
1 ошибка – 2 балла
2 ошибки – 1 балл -

32 слайд
Задача 7.
С какой последовательности аминокислот начинается белок, если он закодирован такой последовательностью нуклеотидов: ГАЦ-ЦГА-ТГТ-АТГ-АГА.
Каким станет начало цепочки, если под влиянием облучения четвертый нуклеотид окажется выбитым из молекулы ДНК?
Как это отразится на свойствах синтезируемого белка? -

33 слайд
1) Исходная ДНК:
ГАЦ-ЦГА-ТГТ-АТГ-АГА
и-РНК:
ЦУГ-ГЦУ-АЦА-УАЦ-УЦУ
последовательность аминокислот:
лей-ала-тре-тир-сер
Основные этапы решения задачи. План рассуждений. Оформление. -

34 слайд
2) Оставшаяся последовательность будет на один нуклеотид короче, поэтому последний триплет будет неполным. Значит, и последовательность аминокислот будет короче на одну аминокислоту.
Измененная (мутантная) ДНК:
ГАЦ-ГАТ-ГТА-ТГА-ГА
и- РНК: ЦУГ-ЦУА-ЦАУ-АЦУ-ЦУ
последовательность аминокислот:
лей-лей-гис-тре-…
Основные этапы решения задачи. План рассуждений. Оформление. -

35 слайд
3)Первичная структура белка изменилась (изменилось число аминокислот и их последовательность), что отразится на пространственной структуре молекулы, а значит, и на ее свойствах и функциях.
Основные этапы решения задачи. План рассуждений. Оформление. -

36 слайд
Задача 8.
В результате мутации во фрагменте молекулы белка аминокислота треонин (тре) заменилась на глутамин (глн).
Определите аминокислотный состав фрагмента молекулы нормального и мутированного белка и фрагмент мутированной и-РНК, если в норме и-РНК имеет последовательность:
ГУЦ-АЦАГЦГ-АУЦ-ААУ.
Ответ поясните. Для решения задания используйте таблицу генетического кода. -

37 слайд
1) и-РНК: ГУЦ−АЦА-ГЦГ- АУЦ-ААУ;
нормальный белок: ……………………………………..;
2) После мутации фрагмент молекулы белка будет иметь состав: ………………………………..;
3) Глутамин кодируется двумя кодонами …… и ……., следовательно, мутированная и-РНК будет …………………..….. или …………………….……..
Скорее всего произошла …………………………………
………………………., т.е. ….поменялись с …. — триплет …….. превратился в ……. и тогда мутированная и-РНК будет:………………………
Основные этапы решения задачи. План рассуждений. -

38 слайд
1) и-РНК: ГУЦ−АЦА-ГЦГ- АУЦ-ААУ;
нормальный белок: вал-тре-ала-иле-асн;
2) После мутации фрагмент молекулы белка будет иметь состав: вал-глн-ала-иле-асн;
3) Глутамин кодируется двумя кодонами ЦАА и ЦАГ, следовательно, мутированная и-РНК будет ГУЦ−ЦАА−ГЦГ−АУЦ−ААУ или . ГУЦ−ЦАГ−ГЦГ−АУЦ−ААУ
Скорее всего произошла инверсия — поворот нуклеотидов на 180°, т.е. А поменялись с Ц — триплет АЦА превратился в ЦАА и тогда мутированная и-РНК будет: ГУЦ−ЦАА−ГЦГ−АУЦ−ААУ -

39 слайд
1) и-РНК: ГУЦ−АЦА-ГЦГ- АУЦ-ААУ;
нормальный белок: вал-тре-ала-иле-асн;
2) После мутации фрагмент молекулы белка будет иметь состав: вал-глн-ала-иле-асн;
3) Глутамин кодируется двумя кодонами ЦАА и ЦАГ, следовательно, мутированная и-РНК будет ГУЦ−ЦАА−ГЦГ−АУЦ−ААУ или . ГУЦ−ЦАГ−ГЦГ−АУЦ−ААУ
Скорее всего произошла инверсия — поворот нуклеотидов на 180°, т.е. А поменялись с Ц — триплет АЦА превратился в ЦАА и тогда мутированная и-РНК будет: ГУЦ−ЦАА−ГЦГ−АУЦ−ААУ -

40 слайд
Оцените себя:
0 ошибок – 3 балла
1 ошибка – 2 балла
2 ошибки – 1 балл -

41 слайд
Таблица генетического кода (и-РНК)
-

42 слайд
Список использованных источников
https://ru.wikipedia.org/wiki – Таблица генетического кода;
http://bio.reshuege.ru – Задачи по цитологии С5;
http://ege-study.ru/materialy-ege/podborka-zadanij-po-citologii – Д. А. Соловков, ЕГЭ по биологии, задача С5. Подборка заданий по цитологии;
http://keramikos.ru/table.php?ap=table1000304 – Задание С5. Решение задач по цитологии на применение знаний в новой;
http://www.myshared.ru/slide/357298 – Решение задач части С5.
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
6 251 546 материалов в базе
- Выберите категорию:
- Выберите учебник и тему
- Выберите класс:
-
Тип материала:
-
Все материалы
-
Статьи
-
Научные работы
-
Видеоуроки
-
Презентации
-
Конспекты
-
Тесты
-
Рабочие программы
-
Другие методич. материалы
-
Найти материалы
Другие материалы
- 23.11.2016
- 1208
- 0
- 23.11.2016
- 11805
- 124
- 23.11.2016
- 9936
- 9
- 23.11.2016
- 706
- 0
- 23.11.2016
- 1546
- 1
- 23.11.2016
- 3125
- 32
- 23.11.2016
- 1018
- 6
Вам будут интересны эти курсы:
-
Курс повышения квалификации «Организация и руководство учебно-исследовательскими проектами учащихся по предмету «Биология» в рамках реализации ФГОС»
-
Курс повышения квалификации «ФГОС общего образования: формирование универсальных учебных действий на уроке биологии»
-
Курс повышения квалификации «Медико-биологические основы безопасности жизнедеятельности»
-
Курс повышения квалификации «Методические аспекты реализации элективного курса «Антропология и этнопсихология» в условиях реализации ФГОС»
-
Курс повышения квалификации «Государственная итоговая аттестация как средство проверки и оценки компетенций учащихся по биологии»
-
Курс повышения квалификации «Нанотехнологии и наноматериалы в биологии. Нанобиотехнологическая продукция»
-
Курс повышения квалификации «Основы биоэтических знаний и их место в структуре компетенций ФГОС»
-
Курс повышения квалификации «Гендерные особенности воспитания мальчиков и девочек в рамках образовательных организаций и семейного воспитания»
-
Курс профессиональной переподготовки «Биология и химия: теория и методика преподавания в образовательной организации»
-
Курс профессиональной переподготовки «Организация производственно-технологической деятельности в области декоративного садоводства»
-
Курс повышения квалификации «Инновационные технологии обучения биологии как основа реализации ФГОС»
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2016 года; проверки требуют 37 правок.


Сначала ген из 4-символьного алфавита ДНК (A,T,G,C) переписывается с помощью процесса транскрипции в 4-символьный алфавит РНК (A,U,G,C), а из РНК могут быть переведены с помощью процесса трансляции в 20-символьный алфавит аминокислот синтезируемого белка.
Кодо́н (кодирующий тринуклеотид) — единица генетического кода, тройка нуклеотидных остатков (триплет) в ДНК или РНК, обычно кодирующих включение одной аминокислоты. Последовательность кодонов в гене определяет последовательность аминокислот в полипептидной цепи белка, кодируемого этим геном.
Классификация[править | править код]
Поскольку существует 4 различных азотистых основания (аденин, гуанин, цитозин, тимин), а аминокислоты кодируются кодоном, состоящим из комбинаций трёх нуклеотидов, то по законам комбинаторики общее число кодонов равно числу размещений с повторениями: 

Стартовым кодоном у эукариотических организмов является триплет AUG в мРНК, кодирующий метионин, с которого начинается образование полипептидной цепи в процессе трансляции.
У некоторых прокариот стартовыми кодонами также являются GUG, AUU, CUG, UUG.
Так как в процессе биосинтеза белка в полипептидную цепь участвует всего 20 аминокислот, то различные кодоны могут кодировать одинаковые аминокислоты, такие кодоны принято называть изоакцепторными кодонами.
Таблица кодонов РНК[править | править код]
| неполярный | полярный | основный | кислотный | (стоп-кодон) |
| 1-е основание |
2-е основание | 3-е основание |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| U | C | A | G | ||||||
| U | UUU | (Phe/F) Фенилаланин | UCU | (Ser/S) Серин | UAU | (Tyr/Y) Тирозин | UGU | (Cys/C) Цистеин | U |
| UUC | UCC | UAC | UGC | C | |||||
| UUA | (Leu/L) Лейцин | UCA | UAA | Стоп (Охра) | UGA | Стоп (Опал) | A | ||
| UUG | UCG | UAG | Стоп (Янтарь) | UGG | (Trp/W) Триптофан | G | |||
| C | CUU | CCU | (Pro/P) Пролин | CAU | (His/H) Гистидин | CGU | (Arg/R) Аргинин | U | |
| CUC | CCC | CAC | CGC | C | |||||
| CUA | CCA | CAA | (Gln/Q) Глутамин | CGA | A | ||||
| CUG | CCG | CAG | CGG | G | |||||
| A | AUU | (Ile/I) Изолейцин | ACU | (Thr/T) Треонин | AAU | (Asn/N) Аспарагин | AGU | (Ser/S) Серин | U |
| AUC | ACC | AAC | AGC | C | |||||
| AUA | ACA | AAA | (Lys/K) Лизин | AGA | (Arg/R) Аргинин | A | |||
| AUG[A] | (Met/M) Метионин | ACG | AAG | AGG | G | ||||
| G | GUU | (Val/V) Валин | GCU | (Ala/A) Аланин | GAU | (Asp/D) Аспарагиновая кислота | GGU | (Gly/G) Глицин | U |
| GUC | GCC | GAC | GGC | C | |||||
| GUA | GCA | GAA | (Glu/E) Глутаминовая кислота | GGA | A | ||||
| GUG | GCG | GAG | GGG | G |
- A Кодон AUG кодирует метионин и одновременно является сайтом инициации трансляции: первый кодон AUG в кодирующей области мРНК служит началом синтеза белка[1].
Расшифровка завершена в 1966 году[2].
Неканонические значения кодонов[править | править код]
По крайней мере у 16 типов организмов генетический код отличается от канонического. Например многие виды зелёных водорослей Acetabularia транслируют стандартные стоп-кодоны UAG и UAA в аминокислоту глицин, а гриб Candida интерпретирует РНК-кодон CUG не как лейцин, а как серин. А у митохондрий пекарских дрожжей (Saccharomyces cerevisiae) четыре из шести кодонов, обычно транслирующихся в лейцин, кодируют треонин.
Существование таких вариаций свидетельствует о возможной эволюции генетического кода.
Представители всех трёх доменов живых организмов иногда прочитывают стандартный стоп-кодон UGA как 21-ю аминокислоту селеноцистеин, не относящуюся к 20 стандартным. Селеноцистеин образуется при химической модификации серина на стадии, когда последний ещё не отсоединился от тРНК в составе рибосомы.
Аналогично у представителей двух доменов (архебактерий и бактерий) стоп-кодон UAG прочитывается как 22-я аминокислота пирролизин.
Отличия от универсального кода имеются и в митохондриальной ДНК (см. раздел Особенности).
См. также[править | править код]
- Антикодон
- Терминаторный кодон
Примечания[править | править код]
- ↑ Nakamoto T. Evolution and the universality of the mechanism of initiation of protein synthesis. (англ.) // Gene. — 2009. — 1 March (vol. 432, no. 1-2). — P. 1—6. — doi:10.1016/j.gene.2008.11.001. — PMID 19056476. [исправить]
- ↑ Айала Ф. Д. Современная генетика. 1987.
![]()
From Wikipedia, the free encyclopedia

The standard RNA codon table organized in a wheel
A codon table can be used to translate a genetic code into a sequence of amino acids.[1][2] The standard genetic code is traditionally represented as an RNA codon table, because when proteins are made in a cell by ribosomes, it is messenger RNA (mRNA) that directs protein synthesis.[2][3] The mRNA sequence is determined by the sequence of genomic DNA.[4] In this context, the standard genetic code is referred to as translation table 1.[3] It can also be represented in a DNA codon table. The DNA codons in such tables occur on the sense DNA strand and are arranged in a 5′-to-3′ direction. Different tables with alternate codons are used depending on the source of the genetic code, such as from a cell nucleus, mitochondrion, plastid, or hydrogenosome.[5]
There are 64 different codons in the genetic code and the below tables; most specify an amino acid.[6] Three sequences, UAG, UGA, and UAA, known as stop codons,[note 1] do not code for an amino acid but instead signal the release of the nascent polypeptide from the ribosome.[7] In the standard code, the sequence AUG—read as methionine—can serve as a start codon and, along with sequences such as an initiation factor, initiates translation.[3][8][9] In rare instances, start codons in the standard code may also include GUG or UUG; these codons normally represent valine and leucine, respectively, but as start codons they are translated as methionine or formylmethionine.[3][9]
The first table—the standard table—can be used to translate nucleotide triplets into the corresponding amino acid or appropriate signal if it is a start or stop codon. The second table, appropriately called the inverse, does the opposite: it can be used to deduce a possible triplet code if the amino acid is known. As multiple codons can code for the same amino acid, the International Union of Pure and Applied Chemistry’s (IUPAC) nucleic acid notation is given in some instances.
Translation table 1[edit]
Standard RNA codon table[edit]
| Amino-acid biochemical properties | Nonpolar |
Polar |
Basic |
Acidic ↓ | Termination: stop codon * | Initiation: possible start codon |
| 1st base |
2nd base | 3rd base |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| U | C | A | G | ||||||
| U | UUU | (Phe/F) Phenylalanine |
UCU | (Ser/S) Serine |
UAU | (Tyr/Y) Tyrosine |
UGU | (Cys/C) Cysteine |
U |
| UUC | UCC | UAC | UGC | C | |||||
| UUA | (Leu/L) Leucine |
UCA | UAA | Stop (Ochre) *[note 2] | UGA | Stop (Opal) *[note 2] | A | ||
| UUG |
UCG | UAG | Stop (Amber) *[note 2] | UGG | (Trp/W) Tryptophan |
G | |||
| C | CUU | CCU | (Pro/P) Proline |
CAU | (His/H) Histidine |
CGU | (Arg/R) Arginine |
U | |
| CUC | CCC | CAC | CGC | C | |||||
| CUA | CCA | CAA | (Gln/Q) Glutamine |
CGA | A | ||||
| CUG | CCG | CAG | CGG | G | |||||
| A | AUU | (Ile/I) Isoleucine |
ACU | (Thr/T) Threonine |
AAU | (Asn/N) Asparagine |
AGU | (Ser/S) Serine |
U |
| AUC | ACC | AAC | AGC | C | |||||
| AUA | ACA | AAA | (Lys/K) Lysine |
AGA | (Arg/R) Arginine |
A | |||
| AUG |
(Met/M) Methionine |
ACG | AAG | AGG | G | ||||
| G | GUU | (Val/V) Valine |
GCU | (Ala/A) Alanine |
GAU | (Asp/D) Aspartic acid ↓ | GGU | (Gly/G) Glycine |
U |
| GUC | GCC | GAC | GGC | C | |||||
| GUA | GCA | GAA | (Glu/E) Glutamic acid ↓ | GGA | A | ||||
| GUG |
GCG | GAG | GGG | G |
Inverse RNA codon table[edit]
| Amino acid | RNA codons | Compressed | Amino acid | RNA codons | Compressed | |
|---|---|---|---|---|---|---|
| Ala, A | GCU, GCC, GCA, GCG | GCN | Ile, I | AUU, AUC, AUA | AUH | |
| Arg, R | CGU, CGC, CGA, CGG; AGA, AGG | CGN, AGR; or CGY, MGR |
Leu, L | CUU, CUC, CUA, CUG; UUA, UUG | CUN, UUR; or CUY, YUR |
|
| Asn, N | AAU, AAC | AAY | Lys, K | AAA, AAG | AAR | |
| Asp, D | GAU, GAC | GAY | Met, M | AUG | ||
| Asn or Asp, B | AAU, AAC; GAU, GAC | RAY | Phe, F | UUU, UUC | UUY | |
| Cys, C | UGU, UGC | UGY | Pro, P | CCU, CCC, CCA, CCG | CCN | |
| Gln, Q | CAA, CAG | CAR | Ser, S | UCU, UCC, UCA, UCG; AGU, AGC | UCN, AGY | |
| Glu, E | GAA, GAG | GAR | Thr, T | ACU, ACC, ACA, ACG | ACN | |
| Gln or Glu, Z | CAA, CAG; GAA, GAG | SAR | Trp, W | UGG | ||
| Gly, G | GGU, GGC, GGA, GGG | GGN | Tyr, Y | UAU, UAC | UAY | |
| His, H | CAU, CAC | CAY | Val, V | GUU, GUC, GUA, GUG | GUN | |
| START | AUG | STOP | UAA, UGA, UAG | URA, UAR |
Standard DNA codon table[edit]
| Amino-acid biochemical properties | Nonpolar |
Polar |
Basic |
Acidic ↓ | Termination: stop codon * | Initiation: possible start codon |
| 1st base |
2nd base | 3rd base |
|||||||
|---|---|---|---|---|---|---|---|---|---|
| T | C | A | G | ||||||
| T | TTT | (Phe/F) Phenylalanine |
TCT | (Ser/S) Serine |
TAT | (Tyr/Y) Tyrosine |
TGT | (Cys/C) Cysteine |
T |
| TTC | TCC | TAC | TGC | C | |||||
| TTA | (Leu/L) Leucine |
TCA | TAA | Stop (Ochre) *[note 2] | TGA | Stop (Opal) *[note 2] | A | ||
| TTG |
TCG | TAG | Stop (Amber) *[note 2] | TGG | (Trp/W) Tryptophan |
G | |||
| C | CTT | CCT | (Pro/P) Proline |
CAT | (His/H) Histidine |
CGT | (Arg/R) Arginine |
T | |
| CTC | CCC | CAC | CGC | C | |||||
| CTA | CCA | CAA | (Gln/Q) Glutamine |
CGA | A | ||||
| CTG | CCG | CAG | CGG | G | |||||
| A | ATT | (Ile/I) Isoleucine |
ACT | (Thr/T) Threonine |
AAT | (Asn/N) Asparagine |
AGT | (Ser/S) Serine |
T |
| ATC | ACC | AAC | AGC | C | |||||
| ATA | ACA | AAA | (Lys/K) Lysine |
AGA | (Arg/R) Arginine |
A | |||
| ATG |
(Met/M) Methionine |
ACG | AAG | AGG | G | ||||
| G | GTT | (Val/V) Valine |
GCT | (Ala/A) Alanine |
GAT | (Asp/D) Aspartic acid ↓ | GGT | (Gly/G) Glycine |
T |
| GTC | GCC | GAC | GGC | C | |||||
| GTA | GCA | GAA | (Glu/E) Glutamic acid ↓ | GGA | A | ||||
| GTG |
GCG | GAG | GGG | G |
Inverse DNA codon table[edit]
| Amino acid | DNA codons | Compressed | Amino acid | DNA codons | Compressed | |
|---|---|---|---|---|---|---|
| Ala, A | GCT, GCC, GCA, GCG | GCN | Ile, I | ATT, ATC, ATA | ATH | |
| Arg, R | CGT, CGC, CGA, CGG; AGA, AGG | CGN, AGR; or CGY, MGR |
Leu, L | CTT, CTC, CTA, CTG; TTA, TTG | CTN, TTR; or CTY, YTR |
|
| Asn, N | AAT, AAC | AAY | Lys, K | AAA, AAG | AAR | |
| Asp, D | GAT, GAC | GAY | Met, M | ATG | ||
| Asn or Asp, B | AAT, AAC; GAT, GAC | RAY | Phe, F | TTT, TTC | TTY | |
| Cys, C | TGT, TGC | TGY | Pro, P | CCT, CCC, CCA, CCG | CCN | |
| Gln, Q | CAA, CAG | CAR | Ser, S | TCT, TCC, TCA, TCG; AGT, AGC | TCN, AGY | |
| Glu, E | GAA, GAG | GAR | Thr, T | ACT, ACC, ACA, ACG | ACN | |
| Gln or Glu, Z | CAA, CAG; GAA, GAG | SAR | Trp, W | TGG | ||
| Gly, G | GGT, GGC, GGA, GGG | GGN | Tyr, Y | TAT, TAC | TAY | |
| His, H | CAT, CAC | CAY | Val, V | GTT, GTC, GTA, GTG | GTN | |
| START | ATG | STOP | TAA, TGA, TAG | TRA, TAR |
Alternative codons in other translation tables[edit]
The genetic code was once believed to be universal:[16] a codon would code for the same amino acid regardless of the organism or source. However, it is now agreed that the genetic code evolves,[17] resulting in discrepancies in how a codon is translated depending on the genetic source.[16][17] For example, in 1981, it was discovered that the use of codons AUA, UGA, AGA and AGG by the coding system in mammalian mitochondria differed from the universal code.[16] Stop codons can also be affected: in ciliated protozoa, the universal stop codons UAA and UAG code for glutamine.[17][note 4] The following table displays these alternative codons.
| Amino-acid biochemical properties | Nonpolar |
Polar |
Basic |
Acidic ↓ | Termination: stop codon * |
| Code | Translation table |
DNA codon involved | RNA codon involved | Translation with this code |
Standard translation | Notes | ||
|---|---|---|---|---|---|---|---|---|
| Standard | 1 | Includes translation table 8 (plant chloroplasts). | ||||||
| Vertebrate mitochondrial | 2 | AGA | AGA | Stop * | Arg (R) |
|||
| AGG | AGG | Stop * | Arg (R) |
|||||
| ATA | AUA | Met (M) |
Ile (I) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Yeast mitochondrial | 3 | ATA | AUA | Met (M) |
Ile (I) |
|||
| CTT | CUU | Thr (T) |
Leu (L) |
|||||
| CTC | CUC | Thr (T) |
Leu (L) |
|||||
| CTA | CUA | Thr (T) |
Leu (L) |
|||||
| CTG | CUG | Thr (T) |
Leu (L) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| CGA | CGA | absent | Arg (R) |
|||||
| CGC | CGC | absent | Arg (R) |
|||||
| Mold, protozoan, and coelenterate mitochondrial + Mycoplasma / Spiroplasma | 4 | TGA | UGA | Trp (W) |
Stop * | Includes the translation table 7 (kinetoplasts). | ||
| Invertebrate mitochondrial | 5 | AGA | AGA | Ser (S) |
Arg (R) |
|||
| AGG | AGG | Ser (S) |
Arg (R) |
|||||
| ATA | AUA | Met (M) |
Ile (I) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Ciliate, dasycladacean and Hexamita nuclear | 6 | TAA | UAA | Gln (Q) |
Stop * | |||
| TAG | UAG | Gln (Q) |
Stop * | |||||
| Echinoderm and flatworm mitochondrial | 9 | AAA | AAA | Asn (N) |
Lys (K) |
|||
| AGA | AGA | Ser (S) |
Arg (R) |
|||||
| AGG | AGG | Ser (S) |
Arg (R) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Euplotid nuclear | 10 | TGA | UGA | Cys (C) |
Stop * | |||
| Bacterial, archaeal and plant plastid | 11 | See translation table 1. | ||||||
| Alternative yeast nuclear | 12 | CTG | CUG | Ser (S) |
Leu (L) |
|||
| Ascidian mitochondrial | 13 | AGA | AGA | Gly (G) |
Arg (R) |
|||
| AGG | AGG | Gly (G) |
Arg (R) |
|||||
| ATA | AUA | Met (M) |
Ile (I) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Alternative flatworm mitochondrial | 14 | AAA | AAA | Asn (N) |
Lys (K) |
|||
| AGA | AGA | Ser (S) |
Arg (R) |
|||||
| AGG | AGG | Ser (S) |
Arg (R) |
|||||
| TAA | UAA | Tyr (Y) |
Stop * | |||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Blepharisma nuclear | 15 | TAG | UAG | Gln (Q) |
Stop * | As of Nov. 18, 2016: absent from the NCBI update. Similar to translation table 6. | ||
| Chlorophycean mitochondrial | 16 | TAG | UAG | Leu (L) |
Stop * | |||
| Trematode mitochondrial | 21 | TGA | UGA | Trp (W) |
Stop * | |||
| ATA | AUA | Met (M) |
Ile (I) |
|||||
| AGA | AGA | Ser (S) | Arg (R) |
|||||
| AGG | AGG | Ser (S) |
Arg (R) |
|||||
| AAA | AAA | Asn (N) |
Lys (K) |
|||||
| Scenedesmus obliquus mitochondrial | 22 | TCA | UCA | Stop * | Ser (S) |
|||
| TAG | UAG | Leu (L) |
Stop * | |||||
| Thraustochytrium mitochondrial | 23 | TTA | UUA | Stop * | Leu (L) |
Similar to translation table 11. | ||
| Pterobranchia mitochondrial | 24 | AGA | AGA | Ser (S) |
Arg (R) |
|||
| AGG | AGG | Lys (K) |
Arg (R) |
|||||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Candidate division SR1 and Gracilibacteria | 25 | TGA | UGA | Gly (G) |
Stop * | |||
| Pachysolen tannophilus nuclear | 26 | CTG | CUG | Ala (A) |
Leu (L) |
|||
| Karyorelict nuclear | 27 | TAA | UAA | Gln (Q) |
Stop * | |||
| TAG | UAG | Gln (Q) |
Stop * | |||||
| TG | UGA | Stop * | or | Trp (W) |
Stop * | |||
| Condylostoma nuclear | 28 | TAA | UAA | Stop * | or | Gln (Q) |
Stop * | |
| TAG | UAG | Stop * | or | Gln (Q) |
Stop * | |||
| TGA | UGA | Stop * | or | Trp (W) |
Stop * | |||
| Mesodinium nuclear | 29 | TAA | UAA | Tyr (Y) |
Stop * | |||
| TAG | UAG | Tyr (Y) |
Stop * | |||||
| Peritrich nuclear | 30 | TA | UAA | Glu (E) ↓ | Stop * | |||
| TAG | UAG | Glu (E) ↓ | Stop * | |||||
| Blastocrithidia nuclear | 31 | TAA | UAA | Stop * | or | Glu (E) ↓ | Stop * | |
| TAG | UAG | Stop * | or | Glu (E) ↓ | Stop * | |||
| TGA | UGA | Trp (W) |
Stop * | |||||
| Cephalodiscidae mitochondrial code | 33 | AGA | AGA | Ser (S) |
Arg (R) |
Similar to translation table 24. | ||
| AGG | AGG | Lys (K) |
Arg (R) |
|||||
| TAA | UAA | Tyr (Y) |
Stop * | |||||
| TGA | UGA | Trp (W) |
Stop * |
See also[edit]
- Bioinformatics
- List of genetic codes
Notes[edit]
- ^ Each stop codon has a specific name: UAG is amber, UGA is opal or umber, and UAA is ochre.[7] In DNA, these stop codons are TAG, TGA, and TAA, respectively.
- ^ a b c d e f The historical basis for designating the stop codons as amber, ochre and opal is described in the autobiography of Sydney Brenner[11] and in a historical article by Bob Edgar.[12]
- ^ The major difference between DNA and RNA is that thymine (T) is only found in the former. In RNA, it is replaced with uracil (U).[15] This is the only difference between the standard RNA codon table and the standard DNA codon table.
- ^ Euplotes octacarinatus is an exception.[17]
References[edit]
- ^ a b “Amino Acid Translation Table”. Oregon State University. Archived from the original on 29 May 2020. Retrieved 2 December 2020.
- ^ a b Bartee, Lisa; Brook, Jack. MHCC Biology 112: Biology for Health Professions. Open Oregon. p. 42. Archived from the original on 6 December 2020. Retrieved 6 December 2020.
- ^ a b c d e Elzanowski A, Ostell J (7 January 2019). “The Genetic Codes”. National Center for Biotechnology Information. Archived from the original on 9 October 2020. Retrieved 21 February 2019.
- ^ “RNA Functions”. Scitable. Nature Education. Archived from the original on 18 October 2008. Retrieved 5 January 2021.
- ^ “The Genetic Codes”. National Center for Biotechnology Information. Archived from the original on 13 May 2011. Retrieved 2 December 2020.
- ^ “Codon”. National Human Genome Research Institute. Archived from the original on 22 October 2020. Retrieved 10 October 2020.
- ^ a b Maloy S. (29 November 2003). “How nonsense mutations got their names”. Microbial Genetics Course. San Diego State University. Archived from the original on 23 September 2020. Retrieved 10 October 2020.
- ^ Hinnebusch AG (2011). “Molecular Mechanism of Scanning and Start Codon Selection in Eukaryotes”. Microbiology and Molecular Biology Reviews. 75 (3): 434–467. doi:10.1128/MMBR.00008-11. PMC 3165540. PMID 21885680.
- ^ a b Touriol C, Bornes S, Bonnal S, Audigier S, Prats H, Prats AC, Vagner S (2003). “Generation of protein isoform diversity by alternative initiation of translation at non-AUG codons”. Biology of the Cell. 95 (3–4): 169–78. doi:10.1016/S0248-4900(03)00033-9. PMID 12867081.
- ^ “The Information in DNA Determines Cellular Function via Translation”. Scitable. Nature Education. Archived from the original on 23 September 2017. Retrieved 5 December 2020.
- ^ Brenner, Sydney; Wolpert, Lewis (2001). A Life in Science. Biomed Central Limited. pp. 101–104. ISBN 9780954027803.
- ^ Edgar B (2004). “The genome of bacteriophage T4: an archeological dig”. Genetics. 168 (2): 575–82. doi:10.1093/genetics/168.2.575. PMC 1448817. PMID 15514035. see pages 580–581
- ^ a b IUPAC—IUB Commission on Biochemical Nomenclature. “Abbreviations and Symbols for Nucleic Acids, Polynucleotides and Their Constituents” (PDF). International Union of Pure and Applied Chemistry. Retrieved 5 December 2020.
- ^ “What does DNA do?”. Your Genome. Welcome Genome Campus. Archived from the original on 29 November 2020. Retrieved 12 January 2021.
- ^ “Genes”. DNA, Genetics, and Evolution. Boston University. Archived from the original on 28 April 2020. Retrieved 10 December 2020.
- ^ a b c Osawa, A (November 1993). “Evolutionary changes in the genetic code”. Comparative Biochemistry and Physiology. 106 (2): 489–94. doi:10.1016/0305-0491(93)90122-l. PMID 8281749.
- ^ a b c d Osawa S, Jukes TH, Watanabe K, Muto A (March 1992). “Recent evidence for evolution of the genetic code”. Microbiological Reviews. 56 (1): 229–64. doi:10.1128/MR.56.1.229-264.1992. PMC 372862. PMID 1579111.
Further reading[edit]
- Chevance FV, Hughes KT (2 May 2017). “Case for the genetic code as a triplet of triplets”. Proceedings of the National Academy of Sciences of the United States of America. 114 (18): 4745–4750. doi:10.1073/pnas.1614896114. JSTOR 26481868. PMC 5422812. PMID 28416671.
- Dever TE (29 June 2012). “A New Start for Protein Synthesis”. Science. American Association for the Advancement of Science. 336 (6089): 1645–1646. Bibcode:2012Sci…336.1645D. doi:10.1126/science.1224439. JSTOR 41585146. PMID 22745408. S2CID 44326947. Retrieved 17 October 2020.
- Gardner RS, Wahba AJ, Basilio C, Miller RS, Lengyel P, Speyer JF (December 1962). “Synthetic polynucleotides and the amino acid code. VII”. Proceedings of the National Academy of Sciences of the United States of America. 48 (12): 2087–2094. Bibcode:1962PNAS…48.2087G. doi:10.1073/pnas.48.12.2087. PMC 221128. PMID 13946552.
- Nakamoto T (March 2009). “Evolution and the universality of the mechanism of initiation of protein synthesis”. Gene. 432 (1–2): 1–6. doi:10.1016/j.gene.2008.11.001. PMID 19056476.
- Wahba AJ, Gardner RS, Basilio C, Miller RS, Speyer JF, Lengyel P (January 1963). “Synthetic polynucleotides and the amino acid code. VIII”. Proceedings of the National Academy of Sciences of the United States of America. 49 (1): 116–122. Bibcode:1963PNAS…49..116W. doi:10.1073/pnas.49.1.116. PMC 300638. PMID 13998282.
- Yanofsky C (9 March 2007). “Establishing the Triplet Nature of the Genetic Code”. Cell. 128 (5): 815–818. doi:10.1016/j.cell.2007.02.029. PMID 17350564. S2CID 14249277.
- Zaneveld J, Hamady M, Sueoka N, Knight R (28 February 2009). “CodonExplorer: An Interactive Online Database for the Analysis of Codon Usage and Sequence Composition”. Bioinformatics for DNA Sequence Analysis. Methods in Molecular Biology. Vol. 537. pp. 207–232. doi:10.1007/978-1-59745-251-9_10. ISBN 978-1-58829-910-9. PMC 2953947. PMID 19378146.
External links[edit]
- DNA codon chart organized in a wheel
