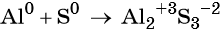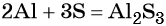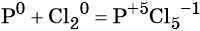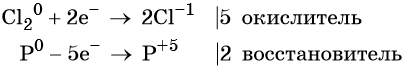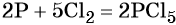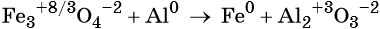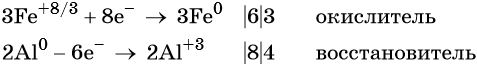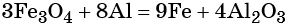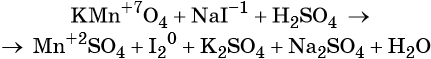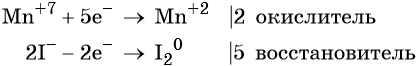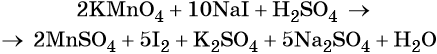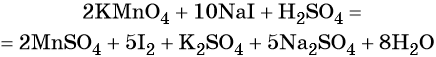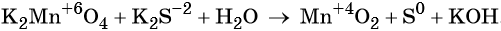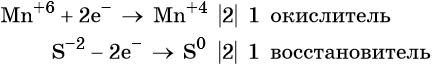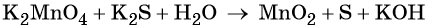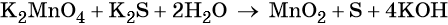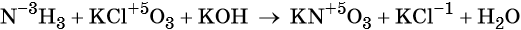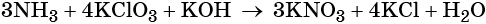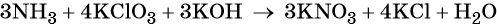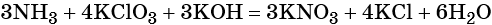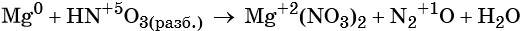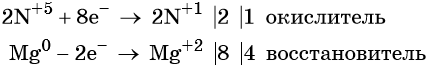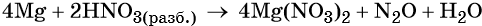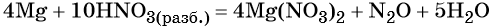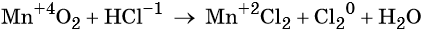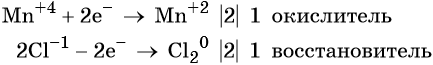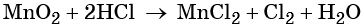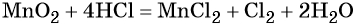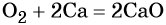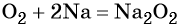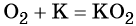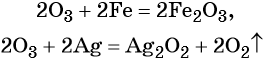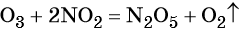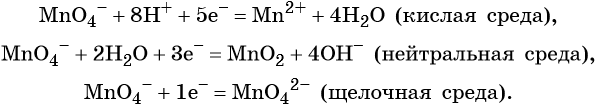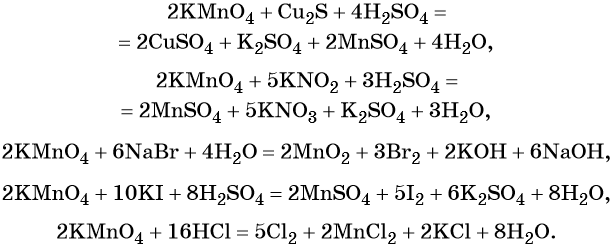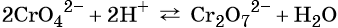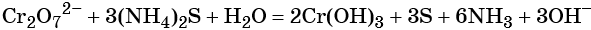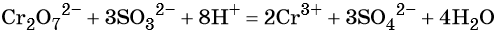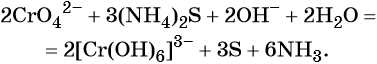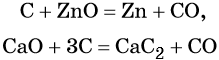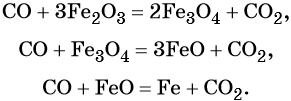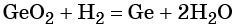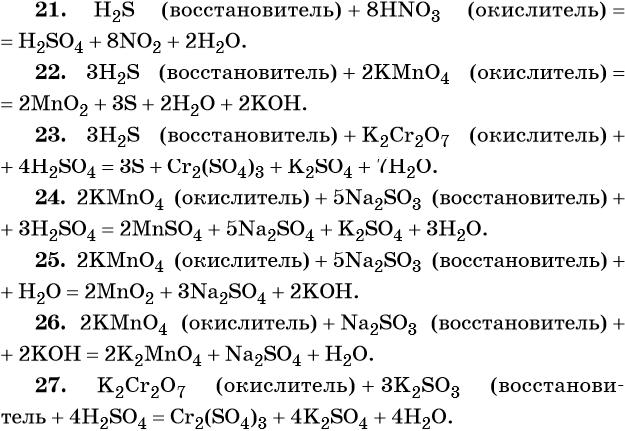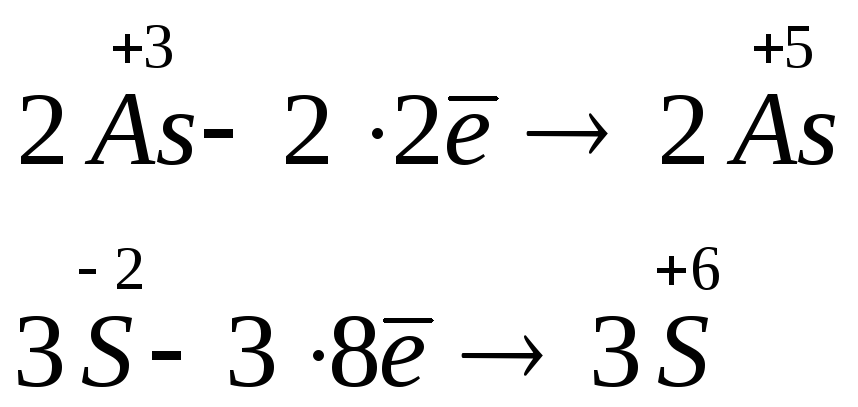Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
в реакции меди с разбавленной азотной кислотой кислота расходуется на ОВР и на образование нитрата:
HNO3¯+Cu→Cu(NO3)2¯+NO¯+H2O.
1.
HN¯O3+5+Cu¯0→Cu¯(NO3)2+2+N¯O+4+H2O.
2. Составим электронный баланс:
Cu0−2e_→Cu+2|2|×3−окисление;N+5+3e_→N+2|3|×2−восстановление.
3. Переносим полученные коэффициенты в схему реакции: (3) — перед формулами меди и нитрата меди((II)), (2) — перед формулой оксида азота, (2 + 6 = 8) — перед формулой азотной кислоты ((6) молекул кислоты необходимы для образования соли):
8HNO3+3Cu→3Cu(NO3)2+2NO+H2O.
4. Определяем коэффициент перед формулой воды:
8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O.
1. Окислители и восстановители
2. Классификация окислительно–восстановительных реакций
3. Основные правила составления ОВР
4. Общие закономерности протекания ОВР
5. Основные схемы ОВР
5.1. Схема восстановления перманганатов
5.2. Схема восстановления хроматов/бихроматов
5.3. Разложение нитратов
5.4. Окислительные свойства азотной кислоты
5.5. Взаимодействие металлов с серной кислотой
5.6. Пероксид водорода
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионы металлов или неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2–, (НР+3O3)2–, в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители:
-
перманганат калия (KMnO4);
-
дихромат калия (K2Cr2O7);
-
азотная кислота (HNO3);
-
концентрированная серная кислота (H2SO4);
-
пероксид водорода (H2O2);
-
оксиды марганца (IV) и свинца (IV) (MnO2, PbO2);
-
расплавленный нитрат калия (KNO3) и расплавы некоторых других нитратов .
К восстановителям, которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления.
2Al0 + Fe+32O3 → Al+32O3 + 2Fe0,
C0 + 4HN+5O3(конц) = C+4O2 ↑ + 4N+4O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых элемент-окислитель и элемент-восстановитель входят в состав одного вещества:
(N-3H4)2Cr+62O7 → N20 ↑+ Cr+32O3 + 4 H2O,
2 NaN+5O-23 → 2 NaN+3O2 + O02↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2S-2 + S+4O2 = 3S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается, а восстановитель окисляется.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K+2S-2 + 2K+Mn+7O-24 = 2K+2Mn+6O-24 + S0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S-2 -2e = S0
Mn+7 + 1e = Mn+6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn+7 в кислой среде восстанавливается до Mn+2, а в щелочной — до Mn+6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N+5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N+5.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2+. Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны. В нейтральном растворе марганец восстанавливается до степени окисления +4, с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6. Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S + 2 KMnO4 + 8 H2SO4 = 5 S + 2 MnSO4 + 6 K2SO4 + 8 H2O,
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
K2S + 2 KMnO4 –(KOH)= 2 K2MnO4 + S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P-3, As-3= P+5, As+5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде.
Восстанавливаются соединения хрома (VI) до соединений хрома (III). Соединения хрома Cr+3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3, и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6].
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As+5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О-2). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2.
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород.
Например:
2NaNO3 → 2NaNO2 + O2.
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь), то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород. Оксид металла образует также при разложении нитрат лития.
Например, разложение нитрата цинка:
2Zn(NO3)2 → 2ZnО + 4NO2 + O2.
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов, расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N+5, участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород.
Например, разложение нитрата серебра:
2AgNO3 → 2Ag + 2NO2 + O2.
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония:
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 оС образуется оксид азота (I) («веселящий газ») и вода:
NH4NO3 → N2O + 2H2O
Это пример реакции контрдиспропорционирования.
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород:
2NH4NO3 → 2N2 + O2 + 4H2O
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N+3 и восстановителя N-3
NH4NO2 → N2 + 2H2O
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Mn(NO3)2 = MnO2 + 2NO2
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
2Fe(NO3)2 → 2FeO + 4NO2 + O2 при 60°C
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2 при >60°C
Нитрат никеля (II) разлагается до нитрита при нагревании до 150оС под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород, в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N+4); оксид азота (II) NO (N+2); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3. Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются.
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например, взаимодействие цинка с очень разбавленной азотной кислотой:
4Zn + 10HNO3 = 4Zn(NO3)2 + NH4NO3 + 3H2O
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe. При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами и металлами средней активности азотная кислота восстанавливается до оксида азота (IV) NO2;
Например, окисление меди концентрированной азотной кислотой:
Cu+ 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота (I) N2O;
Например, окисление натрия концентрированной азотной кислотой:
8Na+ 10HNO3 = 8NaNO3 + N2O + 5H2O
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
NO2; NO; N2O; N2; NH4NO3
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например, взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H+, которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например:
Fe + H2SO4(разб) = FeSO4 + H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S+4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 + 2H2S+6O4(конц) = Cu+2SO4 + S+4O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 + 5H2S+6O4(конц) → 4Na2+SO4 + H2S—2 + 4H2O
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
S+4O2 + H2O2-1 → H2S+6O4-2
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например:
2KMn+7O4 + 5H2O2-1 + 3H2SO4 → 5O20 + 2Mn+2SO4 + K2SO4 + 8H2O
Метод электронного баланса и ионно-электронный метод (метод полуреакций)
Спецификой многих ОВР является то, что при составлении их уравнений подбор коэффициентов вызывает затруднение.
Для облегчения подбора коэффициентов чаще всего используют метод электронного баланса и ионно-электронный метод (метод полуреакций). Рассмотрим применение каждого из этих методов на примерах.
Метод электронного баланса
В его основе метода электронного баланса лежит следующее правило: общее число электронов, отдаваемое атомами-восстановителями, должно совпадать с общим числом электронов, которые принимают атомы-окислители .
В качестве примера составления ОВР рассмотрим процесс взаимодействия сульфита натрия с перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции, учитывая, что в кислой среде MnO4 — восстанавливается до Mn 2+ (см. схему):
Найдем степень окисления элементов:
Из приведенной схемы понятно, что в процессе реакции происходит увеличение степени окисления серы с +4 до +6. S +4 отдает 2 электрона и является восстановителем. Степень окисления марганца уменьшилась от +7 до +2, т.е. Mn +7 принимает 5 электронов и является окислителем.
3) Составить электронные уравнения и найти коэффициенты при окислителе и восстановителе.
S +4 – 2e — = S +6 | 5 восстановитель, процесс окисления
Mn +7 +5e — = Mn +2 | 2 окислитель, процесс восстановления
Чтобы число электронов, отданных восстановителем, было равно числу электронов, принятых восстановителем, необходимо:
- Число электронов, отданных восстановителем, поставить коэффициентом перед окислителем.
- Число электронов, принятых окислителем, поставить коэффициентом перед восстановителем.
Таким образом, 5 электронов, принимаемых окислителем Mn +7 , ставим коэффициентом перед восстановителем, а 2 электрона, отдаваемых восстановителем S +4 коэффициентом перед окислителем:
4) Уравнять количества атомов элементов, не изменяющих степень окисления
Соблюдаем последовательность: число атомов металлов, кислотных остатков, количество молекул среды (кислоты или щелочи). В последнюю очередь подсчитывают количество молекул образовавшейся воды.
Итак, в нашем случае число атомов металлов в правой и левой частях совпадают.
По числу кислотных остатков в правой части уравнения найдем коэффициент для кислоты.
В результате реакции образуется 8 кислотных остатков SO4 2- , из которых 5 – за счет превращения 5SO3 2- → 5SO4 2- , а 3 – за счет молекул серной кислоты 8SO4 2- — 5SO4 2- = 3SO4 2- .
Таким образом, серной кислоты надо взять 3 молекулы:
Аналогично, находим коэффициент для воды по числу ионов водорода, во взятом количестве кислоты
6H + + 3O -2 = 3H2O
Окончательный вид уравнения следующий:
Признаком того, что коэффициенты расставлены правильно является равное количество атомов каждого из элементов в обеих частях уравнения.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные уравнения ОВР более наглядно отражают сущность реакций окисления-восстановления.
При написании ионно-молекулярных уравнений, сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы записывают в виде молекул (в недиссоциированном виде).
При написании полуреакций в ионной схеме указывают частицы, подвергающиеся изменению их степеней окисления, а также характеризующие среду, частицы:
H + — кислая среда, OH — — щелочная среда и H2O – нейтральная среда.
Пример 1.
Рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в кислой среде.
1) Составить схему реакции:
Записать исходные вещества и продукты реакции:
2) Записать уравнение в ионном виде
В уравнении сократим те ионы, которые не принимают участие в процессе окисления-восстановления:
SO3 2- + MnO4 — + 2H + = Mn 2+ + SO4 2- + H2O
3) Определить окислитель и восстановитель и составить полуреакции процессов восстановления и окисления.
В приведенной реакции окислитель — MnO4 — принимает 5 электронов восстанавливаясь в кислой среде до Mn 2+ . При этом освобождается кислород, входящий в состав MnO4 — , который, соединяясь с H + образует воду:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O
Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона. Как видно образовавшийся ион SO4 2- содержит больше кислорода, чем исходный SO3 2- . Недостаток кислорода восполняется за счет молекул воды и в результате этого происходит выделение 2H + :
SO3 2- + H2O — 2e — = SO4 2- + 2H +
4) Найти коэффициенты для окислителя и восстановителя
Необходимо учесть, что окислитель присоединяет столько электронов, сколько отдает восстановитель в процессе окисления-восстановления:
MnO4 — + 8H + + 5e — = Mn 2+ + 4H2O |2 окислитель, процесс восстановления
SO3 2- + H2O — 2e — = SO4 2- + 2H + |5 восстановитель, процесс окисления
5) Просуммировать обе полуреакции
Предварительно умножая на найденные коэффициенты, получаем:
2MnO4 — + 16H + + 5SO3 2- + 5H2O = 2Mn 2+ + 8H2O + 5SO4 2- + 10H +
Сократив подобные члены, находим ионное уравнение:
2MnO4 — + 5SO3 2- + 6H + = 2Mn 2+ + 5SO4 2- + 3H2O
6) Записать молекулярное уравнение
Молекулярное уравнение имеет следующий вид:
Пример 2.
Далее рассмотрим пример составления уравнения реакции между сульфитом натрия и перманганатом калия в нейтральной среде.
В ионном виде уравнение принимает вид:
Также, как и предыдущем примере, окислителем является MnO4 — , а восстановителем SO3 2- .
В нейтральной и слабощелочной среде MnO4 — принимает 3 электрона и восстанавливается до MnО2. SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + 2H2O + 3e — = MnО2 + 4OH — |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |3 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Пример 3.
Составление уравнения реакции между сульфитом натрия и перманганатом калия в щелочной среде.
В ионном виде уравнение принимает вид:
В щелочной среде окислитель MnO4 — принимает 1 электрон и восстанавливается до MnО4 2- . Восстановитель SO3 2- — окисляется до SO4 2- , отдав 2 электрона.
Полуреакции имеют следующий вид:
MnO4 — + e — = MnО2 |2 окислитель, процесс восстановления
SO3 2- + 2OH — — 2e — = SO4 2- + H2O |1 восстановитель, процесс окисления
Запишем ионное и молекулярное уравнения, учитывая коэффициенты при окислителе и восстановителе:
Необходимо отметить, что не всегда при наличии окислителя и восстановителя, возможно самопроизвольное протекание ОВР. Поэтому для количественной характеристики силы окислителя и восстановителя и для определения направления реакции пользуются значениями окислительно-восстановительных потенциалов.
Еще больше примеров составления окислительно-восстановительных реакций приведены в разделе Задачи к разделу Окислительно-восстановительные реакции. Также в разделе тест Окислительно-восстановительные реакции
Метод электронного баланса
Составляя любое уравнение химической реакции, следует соблюдать закон сохранения масс веществ – кол-во атомов в исходных веществах (левая часть уравнения) и в продуктах реакции (правая часть уравнения) должны совпадать.
Составляя уравнения окислительно-восстановительных реакций, следует также следить за суммой зарядов, которые у исходных веществ и в продуктах реакции должны быть равны.
В уравнениях ОВР в левой части обычно указывают первым вещество-восстановитель (отдает электроны), а затем – вещество-окислитель (принимает электроны); в правой части уравнения первым указывают продукт окисления, затем восстановления, а потом другие вещества, если они имеются.
Главное требование, которое необходимо соблюдать при составлении уравнений окислительно-восстановительных реакций, – кол-во электронов, которое отдал восстановитель, должно быть равно кол-ву электронов, принятых окислителем.
В основе метода электронного баланса лежит сравнение степеней окисления в исходных веществах и продуктах реакции, что подразумевает тот факт, что, составляющий уравнение ОВР методом электронного баланса, должен знать, какие вещества образуются в ходе реакции.
Примеры составления уравнений ОВР методом электронного баланса
1. Составить уравнение реакции алюминия с углеродом.
- Al+C → Al4C3
- В первую очередь, определяются элементы, меняющие свои степени окисления:
Al 0 +C 0 → Al4 +3 C3 -4 - Атом алюминия в ходе реакции отдает 3 электрона, меняя свою степень окисления с 0 на +3
Al 0 → Al +3
1Al 0 -3e – → 1Al +3 - Атом углерода принимает 4 электрона, меняя свою степень окисления с 0 на -4
C 0 → C +4
1C 0 +4e – → 1C -4 - Поскольку, число отданных и принятых электронов между атомами должно совпадать, следует сбалансировать уравнение, подобрав множители, для этого кол-во отданных алюминием электронов, записывают в схему реакции углерода, а кол-во электронов, принятых углеродом – в схему реакции алюминия:
- В итоге, алюминий отдает 4·3=12 электронов;
- углерод принимает 3·4=12 электронов
- Осталось определить стехиометрические коэффициенты, которые необходимо проставить перед формулами веществ, чтобы уравнять кол-во их атомов в левой и правой части уравнения;
- Кол-во атомов алюминия, вступающих в реакцию:
4·1Al 0 =4Al 0 - Кол-во атомов углерода, вступающих в реакцию:
3·1C 0 =3C 0 - Окончательный вид уравнения:
4Al 0 +3C 0 = Al4 +3 C3 -4
2. Составить уравнение реакции азотной кислоты с йодом.
- Схема реакции:
HNO3+I2 → HIO3+NO+H2O - Определяем элементы, меняющие свои степени окисления:
HN +5 O3+I2 0 → HI +5 O3+N +2 O+H2O - Азот меняет степень окисления с +5 на +2 – принимает 3 электрона, и является окислителем:
N +5 → N +2
N +5 +3e – → N +2 - Йод меняет степень окисления с 0 на +5 – отдает 5 электронов, и является восстановителем, но, поскольку молекула йода двухатомна, то в схеме она записывается в молекулярном виде, а кол-во отдаваемых электронов соответственно удваивается:
I2 0 → 2I +5
I2 0 -10e – → 2I +5 - Уравниваем заряды:
- Было до реакции 10·1N +5 =10N +5 , после реакции образовалось: 10·1N +2 =10N +2
- В реакцию вступило всего 6 атомов йода (3·2) или три молекулы 3I2, после реакции образовалось 3·2I +5 =6I +5 ;
- Расставляем найденные коэффициенты:
10HNO3+3I2 = 6HIO3+10NO+2H2O
3. Составить уравнение реакции соляной кислоты (концентрированной) с оксидом марганца (IV).
- HCl+MnO2 → Cl2+MnCl2+H2O
- HCl -1 +Mn +4 O2 → Cl2 0 +Mn +2 Cl2+H2O
- Соляная кислота является восстановителем, оксид марганца – окислителем.
- Атом хлора отдает свой электрон, но в правой части нулевой заряд имеет молекула хлора, состоящая из двух атомов, поэтому, для ее получения нужны 2 электрона от двух атомов хлора:
Cl -1 → Cl2 0
2Cl – -2e – → Cl2 0 - Атом марганца получает 2 электрона, снижая свою степень окисления с +4 до +2:
Mn +4 → Mn +2
Mn +4 +2e – → Mn +2 - Поскольку, хлор отдает два электрона, а марганец эти же два электрона принимает, оба коэффициента будут равны 2, и их можно сократить:
- Получаем уравнение, отличающееся от исходного только стехиометрическим коэффициентом 2, который стоит перед формулой соляной кислоты (два атома хлора отдают по одному электрону):
2HCl+MnO2 → Cl2+MnCl2+H2O - Осталось найти стехиометрические коэффициенты для остальных веществ, чтобы уравнять левую и правую части уравнения.
- В левой части уравнения 2 атома хлора, в правой – 4, чтобы уравнять атомы хлора, перед формулой соляной кислоты ставим 4, но, теперь в правой части уравнения получается на 2 атома водорода меньше, чтобы уравнять атомы водорода, перед молекулой воды ставим коэффициент 2 – теперь кол-во всех атомов в левой части и в правой части уравнения одинаково:
4HCl+MnO2 → Cl2+MnCl2+2H2O - Ионное уравнение реакции:
4H + +4Cl – +MnO2 = Cl2+Mn 2+ +2Cl – +2H2O
4. Составить уравнение реакции сероводорода с раствором калия перманганата в кислой среде.
- Схема реакции:
H2S+KMnO4+H2SO4 → S+MnSO4+K2SO4+H2O - Определяем элементы, меняющие свои степени окисления:
H2S -2 +KMn +7 O4+H2SO4 → S 0 +Mn +2 SO4+K2SO4+H2O - Сера меняет свою степень окисления с -2 до 0, т.е., отдает 2 электрона (сероводород – восстановитель):
S -2 → S 0
S -2 -2e – → S 0 - Марганец меняет свою степень окисления с +7 до +2, т.е., принимает 5 электронов (калия перманганат – окислитель):
Mn +7 → Mn +2
Mn +7 +5e – → Mn +2 - Электронные уравнения:
- 5H2S+2KMnO4+H2SO4 = S+MnSO4+K2SO4+H2O
- 5H2S+2KMnO4+3H2SO4 = 5S+2MnSO4+K2SO4+8H2O
- Ионное уравнение:
5H2S+2MnO4 – +6H + = 5S+2Mn 2+ +8H2O
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Алгоритм расстановки коэффициентов методом электронного баланса
учебно-методический материал по химии (9 класс) по теме
Алгоритм расстановки коэффициентов методом электронного баланса.
Скачать:
| Вложение | Размер |
|---|---|
| algoritm_rasstanovki_koeffitsientov_metodom_elektronnogo_balansa.docx | 17.99 КБ |
Предварительный просмотр:
Алгоритм расстановки коэффициентов в уравнениях
методом электронного баланса.
Запишите схему реакции (формулы исходных веществ и продуктов реакции).
NH 3 +CuO → N 2 +Cu+H 2 O
Определите и сравните степени окисления элементов до и после реакции.
N H 3 + Cu O → N 2 + Cu +H 2 O
Выбрать (подчеркнуть) элементы, степени, окисления которых изменяются.
N H 3 + Cu O → N 2 + Cu +H 2 O
Выписать эти элементы (простые вещества выписываются с индексами).
N H 3 + Cu O → N 2 + Cu +H 2 O
Определить отдал или принял элемент электроны и их количество (помнить, что электроны заряжены отрицательно).
Количество электронов с участием простых веществ умножается на индекс, а перед ионом выставляется коэффициент, равный индексу.
N H 3 + Cu O → N 2 + Cu +H 2 O
Определите окислитель и восстановитель
(окислитель всегда принимает электроны – степень окисления понижается, восстановитель их отдает – степень окисления повышается).
N H 3 + Cu O → N 2 + Cu +H 2 O
Выписать то количество электронов, которое определили. Найти для этих чисел наименьшее кратное.
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6
Определить коэффициенты (разделив поочередно наименьшее кратное на количество электронов).
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1
Cu +2 +2℮ → Cu 0 2 3
Определить процесс окисления или восстановления (окислитель в процессе реакции восстанавливается , восстановитель окисляется ).
N H 3 + Cu O → N 2 + Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Расставьте коэффициенты перед формулами восстановителя и окислителя методом электронного баланса.
Полученные коэффициенты поставить в правой части уравнения (после стрелки) перед теми элементами, напротив которых они стоят в окислительно-восстановительном балансе. Если атомы одного и того же элемента разных реагентов в результате их окисления и восстановления получают одинаковую степень окисления, дополнительные множители проставляют вначале в левую часть уравнения (в последнем уравнении для кислорода).
N H 3 + Cu O → N 2 +3 Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Число отданных электронов
Число принятых электронов
Уравнять правую и левую части уравнения (проверить по кислороду, количество атомов кислорода справа и слева должно быть одинаковым).
2N H 3 +3 Cu O → N 2 +3 Cu +H 2 O
2N -3 – 6℮ → N 2 0 6 1 окисление
Cu +2 +2℮ → Cu 0 2 3 восстановление
Устно проверьте правильность составленного уравнения.
Число молей атомов каждого химического элемента в правой и левой частях уравнения – одинаково.
По теме: методические разработки, презентации и конспекты
Уравнивание окислительно-восстановительных реакций с участием органических веществ методом электронного баланса.
В статье обсуждается возможность описания ОВР с участием органических веществ с помощью метода электронного баланса. Также даны рекомендации по составлению уравнений реакций.
Презентация “Упражнение в расстановке коэффициентов методом электронного баланса”
В презентации представлен алгоритм расстановки коэффициентов методом электронного баланса, а также 18 схем реакций для упражнений в расстановке коэффициентов с проверкой.
Алгоритм расстановки коэффициентов в химическом уравнении.
Может быть использована как раздаточный материал.
разработка ЦОРа по теме “Метод электронного баланса”
расстановка коэффициентов с применением метода электронного баланса.
Алгоритм расстановки коэффициентов в химических уравнениях
Алгоритм расстановки коэффициентов в химических уравнениях.
Составление уравнений ОВР методом электронного баланса
Составления ОВР методом электронного баланса. Тест на ОВР.
Алгоритм уравнивания с помощью электронного баланса
Не секрет уравнивание уравнений окислительно-восстановительных реакций у учащихся вызывает особое затруднение. Даже, если всё понял на первых порах нужна подсказка в виде алгоритма. Этот алгорит.
Метод электронного баланса – правила и алгоритмы уравнивания реакций
Общие понятия
Взаимодействие исходных веществ с образованием новых, при котором ядра атомов остаются неизменными, называют химическими реакциями. Для них характерно перераспределение электронов. Исходные вещества называют реагентами, а прореагирующие — продуктами реакции. Превращение может происходить как сложных, так и простых элементов. Описываются они химическими уравнениями, состоящими из двух частей. Стрелка, разделяющая их, указывает направление протекания реакции.
Числа, стоящие перед веществами, участвующими в превращении, называют коэффициентами. Они указывают на количественную часть веществ. Любая реакция может происходить как с поглощением энергии, так и её выделением. В первом случае химическое уравнение называют эндотермическим, а во втором — экзотермическим.
Окислительно-восстановительными реакциями (ОВР) называют встречно-параллельные превращения с изменением степени окисления. Протекают они методом перераспределения электронов между акцептором — атомом окислителем и донором — восстановителем. Для составления уравнений, описывающих такого типа процесс, используют метод электронного баланса.
Примеры заданий предполагают, что в любой реакции, которую можно описать способом баланса, участвуют две сопряжённые окислительно-восстановительные пары. В итоге фактически возникают две полуреакции. Одна характеризуется увеличением электронов, а другая их отдачей. Таким образом, процессы окисления и восстановления не могут протекать друг без друга и не изменять степень окисления элементов.
Ионы или атомы, забирающие электроны называют окислителями, а отдающие — их восстановителями. Сложность записи таких уравнений заключается в правильном подборе количества молей возникающих соединений. Уравнивающие коэффициенты могут принимать только целые значения. Конкурентом метода баланса в химии является способ полуреакций. Первый отличается простотой и используется в том случае, когда реакция происходит в газообразной среде. Второй же более подходит для реакций, проходящих в жидкости.
Суть метода
Способ электронного баланса предназначен для облегчения решения заданий по уравниванию двух частей уравнения. В его сути лежит возможность расстановки коэффициентов для окислительно-восстановительной реакции с использованием степени окисления. Впервые с объяснением способа знакомят в восьмом классе на уроке неорганической химии.
В школьных учебниках часто приводится следующая последовательность действий для установления балансировки в ОВР:
- В уравнении определяют сложные и простые степени окисления.
- Реакцию переписывают с расстановкой степени окисления. При этом вещества, в которых изменяется степень во всех связях, выделяют любым способом, например, подчёркиванием.
- Находят окислитель, восстановитель, и в случае присутствия, нейтральный элемент.
- Составляют уравнение баланса с выделением внутренних коэффициентов.
- Определяют наименьшее общее кратное.
- Подставляют вычисленные коэффициенты в уравнение.
Классический способ, с помощью которого можно уравнять химические выражения, основан на законе сохранения массы, когда методом подбора находятся коэффициенты до начала реакции и после её окончания. Но для ОВР их подобрать очень сложно или невозможно. Поэтому и используют способ электронного баланса, который подходит как для простых, так и сложных реакций.
Степени окисления
Определение коэффициентов методом баланса непосредственно связано с расстановкой валентности. Не зная, как правильно выполнить эту операцию, уравнять ОВР будет невозможно. Под окислением элемента понимается значение заряда его атома. Этот ион может быть условным или реальным.
Существует несколько видов химических связей. Одними из них могут быть ковалентная и ионная. И в том, и другом случае между атомами образовывается пара. В первом случае пара смещается в сторону отрицательно заряженного атома, а во втором полностью переходит к более электроотрицательной частице. Поэтому под реальным зарядом понимается процесс, характеризующийся ионной связью, а условным — возникновение заряда при ковалентной.
Например, ионное соединение NaCl = Na 1+ + Cl 1- . Атом натрия имеет один электрон, который в ионном соединении полностью переходит к более отрицательному атому. То есть, электрон натрия отдаётся полностью атому хлора. При этом атом, утратив один ион, приобретает заряд равный один плюс. Хлор же, получая дополнительный электрон, меняет заряд на один минус.
В химии принято заряды обозначать сначала цифрой, а после ставить знак, а степень окисления наоборот. Поэтому правильной записью с указанием валентности для рассматриваемого примера будет выражение вида: Na +1 Cl -1 .
Для ковалентной полярной связи, например, молекулы HCl, общая электронная пара лишь смещается в сторону хлора. На атомах возникают частичные дельта-плюс и минус заряды. Но при расстановке значений на это внимания не обращают. Атом водорода полностью отдаёт свой электрон атому хлора. Соответственно, степень будет выглядеть как H +1 Cl -1 .
Следует помнить, что существуют элементы, которые всегда имеют постоянную валентность:
- Первую — щелочные металлы и фтор.
- Вторую — металлы II группы, главной подгруппы и кислород.
- Третью — алюминий.
Остальные же вещества характеризуются переменной валентностью. При описании реакции характерно выделение и гидроксильной группы. Для соединения ОН значение ионов указывается единым. Например, Na +1 (OH) -1 . Проверку правильности расстановки зарядов можно выполнить по правилу электронейтральности, согласно которому сумма положительных электронов должна быть равна сумме отрицательных.
Простой расчёт
Разобраться в сути способа поможет простой пример. Пусть необходимо расставить коэффициенты в реакции соединения оксида меди с азотной кислотой. Первым делом необходимо записать схему сложения: CuO + NH3 = Cu + N2 +H2O. Теперь нужно расставить валентность для каждого элемента. Делать это следует внимательно, ведь от того, насколько верно будет указана валентность, зависит правильность дальнейших действий.
Опираясь на таблицу Менделеева можно утверждать, что правильная степень окисления будет выглядеть для рассматриваемого выражения следующим образом: Cu +2 O -2 + N -3 H +1 3 = Cu 0 + N 0 2 +H +1 2O -2 . Теперь нужно отметить те элементы, которые поменяли свою валентность. Это медь, была +2, а стала 0, и азот, изменивший своё значение с -3 до 0.
На третьем шаге выписывают схемы уравнений полуреакций, изменивших окисление:
- Cu +2 — Cu 0 . Эта запись говорит, что два электрона были приняты медью и она стала нулевой. Обозначают этот процесс записью вида +2 e.
- 2N -3 — N 0 2. Тут следует обратить внимание на то, что при составлении полуреакций для молекул простых веществ обязательно следует указывать индексы. В рассматриваемом случае это двойка. Соответственно, такие выражения следует тоже уравнять. Поэтому в левой части ставится коэффициент два. Анализируя полуреакцию, можно прийти к выводу, что было -6 атомов, а стало ноль. То есть азот отдал шесть электронов. Записывается это как -6 e.
Закон сохранения заряда говорит о том, что электроны не могут взяться ниоткуда и пропасть никуда. Иными словами, какое их количество отдал восстановитель, то же их число должно быть принято окислителем.
В рассматриваемом примере получается, что два электрона были приняты, а шесть отданы. Так не бывает, поэтому нужно найти, где же потерялась разница. Для полученных чисел ищется наименьший общий знаменатель. Без остатка на них делится шесть. Выполнив действие, получают два опорных коэффициента: три и один. Таким образом, перед медью нужно поставить тройку, а азотом единицу: 3Cu +2 O -2 + 2N -3 H +1 3 = 3Cu 0 + N 0 2 +H +1 2O -2 .
Опираясь на полученные значения, проводят стандартную процедуру уравнивания: 3Cu +2 O -2 +2N -3 H +1 3 = 3Cu 0 + N 0 2 + 3H +1 2O -2 . Задача считается выполненной. Пожалуй, ещё можно указать, что медь в уравнении является окислителем, а азот — восстановителем.
Пример сложного соединения
Научившись решать простые задания можно переходить к формулам и сложнее. Например, соединению бромида и перманганата калия с серной кислотой. Схема реакции будет выглядеть следующим образом: KBr + KMnO4 + H2SO4 → MnSO4 + Br2 + K2SO4 + H2O.
Согласно правилу, нужно расставить ионны для каждого элемента: K +1Br+1 + K +1 Mn +7 O -2 4 + H +1 2S +6 O -2 4 → Mn +2 S +6 O -2 4 + Br02 + K +1 2 S +6 O -2 4 + H +1 2O -2 . В уравнении только два элемента изменили степень. Это марганец, который был +7, а стал +2, и бром, поменявший свою валентность с -1 до нуля.
Составляя уравнения полуреакций, проводят анализ. Марганец до реакции был + 7, то есть до нулевого значения ему не хватало семь единиц. После реакции же он стал +2, а значит, до нуля стало не хватать два электрона. Исходя из этого, можно утверждать, что марганец принял пять электронов: +5e.
Вторая полуреакция состоит из брома. Был он в степени -1, а стал в нулевой. При этом индекс у него стал два. Значит, первоначально в реакцию должны были вступить два атома брома. Следовательно, в исходном состоянии было 2*(-1) = -2 электрона, а после стало ноль. То есть бром отдал два электрона: — 2e.
Интересной особенностью метода является закономерность, что при составлении полуреакций в обязательном порядке в одной из них будут отдаваться электроны, а в другой забираться. Полученные уравнения будут иметь следующий вид:
Mn +7 — Mn +2 |+5e |5.
2Br -1 — Br 0 2 |-2e |2.
Для продолжения решения полученные цифры нужно привести к общему знаменателю. В качестве уравнителя здесь будет число десять. Разделив на него количество электронов, находят два опорных коэффициента. Для марганца это будет двойка, а брома — пятёрка.
Полученные числа подставляют в уравнение:
2KBr + 10KMnO4 + H2SO4 → 5 Br2 + 2MnSO4+ K2SO4 + H2O.
Перед бромом должна стоять пятёрка, а вот перед бромом два следует поставить уже десятку. Проверяем, в левой части десять ионов брома вступило в реакцию и десять получилось в прореагирующей части. Возле марганца ставим двойку, соответственно, изменяется и количество калия. В левой части получается 12 атомов, а в правой только два. Поэтому справа возле калия нужно поставить шесть. Аналогично уравнивают серу, водород и кислород.
В итоге полным правильным уравнением будет следующая химическая формула: 2KBr + 10KMnO4 + 8H2SO4 → 5 Br2 + 2MnSO4+ 6K2SO4 + 8H2O. Полученное выражение дальше править уже не нужно. Глядя на него можно утверждать, что марганец является окислителем, а бром восстановителем.
Использование онлайн-калькулятора
В интернете существуют сервисы, использование которых позволяет не только быстро выполнить уравнивание химических уравнений, но и получить нужные знания для самостоятельных вычислений. Называются они химическими онлайн-калькуляторами. Метод электронного баланса сам по себе несложен, но порой составление полуреакций может занять длительное время. Поэтому даже опытные пользователи прибегают к их помощи.
Эти порталы привлекательны тем, что решить поставленную задачу на них сможет даже тот, кто совершенно не разбирается в химии. Доступны онлайн-калькуляторы любому, кто имеет доступ к интернету.
От пользователя требуется загрузить сайт, ввести в предоставленную форму уравнение и кликнуть по меню «Рассчитать». Через две — три секунды система выдаст правильный ответ. При этом услуга предоставляется бесплатно и без ограничений.
[spoiler title=”источники:”]
http://prosto-o-slognom.ru/chimia_ovr/08_metod_elektronnogo_balansa.html
http://nsportal.ru/shkola/khimiya/library/2014/01/01/algoritm-rasstanovki-koeffitsientov-metodom-elektronnogo-balansa
http://nauka.club/khimiya/metod-elektronnogo-balansa.html
[/spoiler]
Алгоритм расстановки коэффициентов в уравнениях овр
Существует несколько
методов определения коэффициентов в
уравнениях окислительно-восстановительных
реакций. Мы используем метод электронного
баланса, при котором составление полного
уравнения ОВР проводится в следующей
последовательности:
1. Составляют схему
реакции, указав вещества, вступившие в
реакцию, и вещества, получившиеся в
результате реакции, например:
2. Определяют
степень окисления атомов и пишут ее
знак и величину над символами элементов,
отмечая элементы, степень окисления
которых изменилась:
3. Записывают
электронные уравнения реакций окисления
и восстановления, определяют число
электронов, отданных восстановителем
и принятых окислителем, и затем уравнивают
их, умножая на соответствующие
коэффициенты:
|
число |
Коэф-ты |
процесс |
|
|
|
2 |
3 |
окисление |
|
|
6 3 |
2 |
восстановление |
4. Полученные
коэффициенты, отвечающие электронному
балансу, переносят в основное уравнение:
5.Уравнивают
число атомов и ионов, не меняющих степени
окисления (в последовательности: металлы,
неметаллы, водород):
6.Проверяют
правильность подбора коэффициентов по
числу атомов кислорода в левой и правой
части уравнения реакции – они должны
быть равны (в этом уравнении 24 = 18 + 2 + 4,
24 = 24).
Рассмотрим более
сложный пример:
Определим степени
окисления атомов в молекулах:
Составим электронные
уравнения реакций окисления и
восстановления и уравняем число отданных
и принятых электронов:
|
Число |
Коэф-ты |
процесс |
|
|
|
28 84 |
3 |
окисление |
|
|
3 |
28 |
восстановл-е |
Перенесем
коэффициенты в основное уравнение:
Уравняем число
атомов, не меняющих степень окисления:
Подсчитав число
атомов кислорода в правой и левой части
уравнения, убедимся, что коэффициенты
подобраны правильно.
Важнейшие окислители и восстановители
Окислительно-восстановительные
свойства элементов зависят от строения
электронной оболочки атомов и определяются
их положением в периодической системе
Менделеева.
Металлы, имея на
внешнем энергетическом уровне 1-3
электрона, легко их отдают и проявляют
только восстановительные свойства.
Неметаллы (элементы IV-VII
групп) могут как отдавать, так и принимать
электроны, поэтому они могут проявлять
и восстановительные и окислительные
свойства. В периодах с увеличением
порядкового номера элемента
восстановительные свойства простых
веществ ослабевают, а окислительные
усиливаются. В группах с повышением
порядкового номера восстановительные
свойства усиливаются, а окислительные
ослабевают. Таким образом, из
простых веществ лучшими восстановителями
являются щелочные металлы, алюминий,
водород, углерод; лучшими окислителями
являются галогены и кислород.
Окислительно-восстановительные
свойства сложных веществ зависят от
степени окисления атомов, входящих в
их состав. Вещества,
содержащие атомы с низшей степенью
окисления, проявляют восстановительные
свойства.
Важнейшими восстановителями являются
оксид углерода
,
сероводород,
сульфат железа(II)
.
Вещества,
в состав которых входят атомы с высшей
степенью окисления, проявляют окислительные
свойства.
Важнейшими окислителями являются
перманганат калия
,
дихромат калия,
пероксид водорода,
азотная кислота,
концентрированная серная кислота.
Вещества,
содержащие атомы с промежуточной
степенью окисления, могут вести себя
как окислители или восстановители
в зависимости от свойств веществ, с
которыми они взаимодействуют, и условий
протекания реакции. Так в реакции с
сернистая кислота проявляет
восстановительные свойства:
,
а при взаимодействии
с сероводородом является окислителем:
Кроме того, для
таких веществ возможны реакции
самоокисления-самовосстановления,
протекающие с одновременным увеличением
и уменьшением степени окисления атомов
одного и того же элемента, например:
Сила многих
окислителей и восстановителей зависит
от рН среды. Например,
в щелочной среде восстанавливается до
,
в нейтральной до,
в присутствии серной кислоты — до.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #