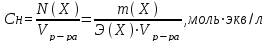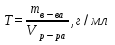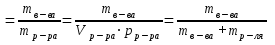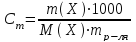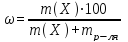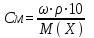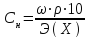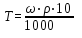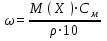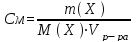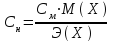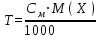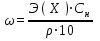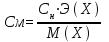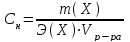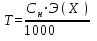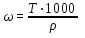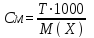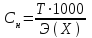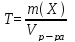Most chemical formulas involve subscripts that are numbers. While these numbers are not followed by units written in the formula, they are, in fact, quantities with units. Thus inherent in chemical formulas is the necessity of conversion factors, which are fractions that convert one unit to another when multiplied by a measurement. The process of using conversion factors is known as dimensional analysis, and it is vital to the study of chemical formulas and equations.
Moles of Compounds to Moles of Elements
A mole is a unit of measurement of amount. If a whole number appears as a subscript in a chemical formula, it represents the number of moles of the element immediately preceding the subscript in the formula. If the subscript follows a set of parentheses, it represents the number of moles of the group of atoms in parentheses. The mole is useful because it helps you understand the relative amount of each element in a compound, and these amounts are given by the subscripts in the formula. For example, the formula for water is H2O, where the two is the subscript for hydrogen. There is no subscript after oxygen, which is the same thing as having a subscript of one. Therefore, one mole of the compound H2O contains two moles of hydrogen and one mole of oxygen, and the conversion factors are (2 moles hydrogen/ 1 mole H2O) and (1 mole oxygen/ 1 mole H2O), respectively.
Moles to Atoms and Molecules
The unit of a mole is useful not only because it breaks a formula down into its chemical components, but also because of its relation to the number of atoms and molecules. One mole is 6.02 * 10^23 atoms or molecules, so the conversion factor is (6.02 * 10^23 atoms or molecules/ 1 mole). For example, one mole of carbon is equal to 6.02 * 10^23 atoms of carbon, and one mole of carbon dioxide is equal to 6.02 * 10^23 molecules of carbon dioxide. Since the formula of carbon dioxide is CO2, one mole of carbon and two moles of oxygen can be found in one mole of carbon dioxide. Thus 6.02 * 10^23 carbon atoms and 12.04 * 10^23 oxygen atoms exist in one mole of carbon dioxide.
Moles to Grams
While it is important to understand moles and the number of atoms and molecules, a more practical unit for experiments is the gram, which is a unit of mass. You cannot measure a mole of a substance in a laboratory, but you can measure its mass in grams on a balance. The conversion factor for converting moles to grams comes from the periodic table. The atomic mass, which is usually given below the atomic symbol and atomic number, is the number of grams per mole of that element. For example, the atomic mass of germanium is 72.61 g/ mol. Therefore, the conversion factor is (72.61 g Ge / 1 mol Ge). The conversion factor for each element is analogous; simply replace the atomic mass of germanium with the atomic mass of the element being studied.
Percents to Moles
Sometimes the subscripts in chemical formulas are not whole numbers but decimals. These are percents, and it is often necessary to convert percents to moles. For example, if you have a compound whose constituents are given in percents, like C0.2H0.6O0.2, then 20 percent of the moles of the compound are carbon, 60 percent are hydrogen and 20 percent are oxygen. To convert to moles, find the factor that multiply by the smallest percent to get a product of 100 percent. In this case the smallest percent is 20 percent, so that number is 5. Then multiply each percent by that number to get, in our case, the formula CH3O, since 20% * 5 = 100% = 1, and 60% * 5 = 300% = 3.
Содержание
- Пересчет концентраций растворов из одних единиц в другие
- Способы выражения концентрации растворов.
- Формулы для перерасчета концентраций.
- Приготовление рабочих растворов
Пересчет концентраций растворов из одних единиц в другие



При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная — на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с — процентная концентрация; M — молярная концентрация; N — нормальная концентрация; э — эквивалентная масса, r — плотность раствора; m — мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c · p · 10) / m
N = (c · p · 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
коэффициент растворимости ks – отношение массы безводного растворенного вещества к массе воды:
Существует много способов выражения концентрации растворов:
Массовая доля [править]
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
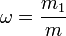
· m1 — масса растворённого вещества, г;
· m — общая масса раствора, г .
Массовое процентное содержание компонента, m%
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры,плотномеры), предназначенные для определения концентрации растворов веществ.
Объёмная доля [править]
Основная статья: Объёмная доля
Объёмная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в долях единицы или в процентах.

· V1 — объём растворённого вещества, л;
· V — общий объём раствора, л.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность (молярная объёмная концентрация) [править]
Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 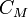
Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
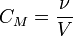
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л.
Нормальная концентрация (мольная концентрация эквивалента, или просто «нормальность») [править]
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
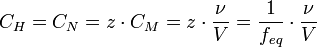
· ν — количество растворённого вещества, моль;
· V — общий объём раствора, л;
· z — число эквивалентности (фактор эквивалентности 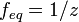
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная (молярная) доля [править]
Основная статья: Мольная доля
Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.

· νi — количество i-го компонента, моль;
· n — число компонентов;
Моляльность (молярная весовая концентрация, моляльная концентрация) [править]
Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.

· ν — количество растворённого вещества, моль;
· m2 — масса растворителя, кг.
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Титр раствора [править]
Основная статья: Титр раствора
Титр раствора — масса растворённого вещества в 1 мл раствора.
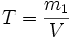
· m1 — масса растворённого вещества, г;
· V — общий объём раствора, мл;
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Весообъёмные проценты [править]
Соответствуют отношению массы одной части вещества (например, 1 г) к 100 частям объёма раствора (например, к 100 мл). [1] Этот способ выражения используют, например, вспектрофотометрии, если неизвестна молярная масса вещества или если неизвестен состав смеси, а также по традиции в фармакопейном анализе. [2]
РАСТВОРИМОСТЬ, способность вещества в смеси с одним или несколькими другими веществами образовывать растворы. Мера растворимости вещества в данном растворителе — концентрация его насыщенного раствора при данных температуре и давлении. Растворимость газов зависит от температуры и давления, растворимость жидких и твердых тел практически от давления не зависит.
Коэффициент растворимости это масса вещества, которая может расстворяется в 100 гр воды с образованием насыщенного раствора. Или максимальная масса вещества, которая смогла растворится в 100гр воды. Выражается в граммах.обозначается Лямбда. Находится пропорцией.
Классификация веществ по растворимости
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH 0 (и тем круче, чем больше DH), и убывает, если DраствH 0. Если мы берем ту же соль в безводном виде, но знаем, что она способна давать кристаллогидрат, то можно ожидать, что у нее преобладает второе слагаемое, и DраствH
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями: 


Источник
Способы выражения концентрации растворов.
Молярная концентрация См– отношение количества вещества в молях (n) к объему раствора в литрах:
Если вещество обозначить через Xто:
Нормальная концентрация или молярная концентрация эквивалента Сн – отношение количества эквивалентов вещества к объему раствора
Титр (Т) – часто используется на практике. Титр раствора –это масса вещества в граммах в 1 мл раствора (г/мл).
Если Т(HNO3) = 0,006354 г/мл, то это значит, что в 1 мл раствора содержится 0,006354 г азотной кислоты.
Титр раствора по определяемому веществу– это масса вещества в г, взаимодействующая с 1 мл титранта. Например, ТHCl/NaOHсоставляет 0,003954 г/мл, это означает, что 1 мл раствораHCl(титранта) реагирует с 0,003954 гNaOH(определяемого вещества).
Массовая доля вещества (ω)–– отношение массы растворенного вещества (mв-ва) к массе раствора(mр-ра). Массовая доля – величина безразмерная, ее представляют либо в долях, либо в процентах. Например, для 5%-го раствора хлорида кальция, широко применяемого в медицине, ω%(CaCl2) =5% или в долях ω=0,05. И это означает, что в 100 г раствора содержится 5 г хлорида кальция.
ω
где ρ – плотность раствора.
Моляльная концентрация Cm– отношение количества молей растворенного вещества к 1000 г растворителя, т.е. число молей растворенного в-ва в 1000 г растворителя.
Формулы для перерасчета концентраций.
(плотность (ρ) раствора дана в г/мл)
Приготовление рабочих растворов
Растворы титр, которых известен, называются титрованными. Титрованный раствор можно приготовить, если точную навеску растворить в мерной колбе. Например, навеску 0,2750 г Nа2SО4поместим в колбу на 200 мл и доведем объем дистиллированной водой до метки, то титр приготовленного раствора точно, конечно, известен:
Т= 0,2750/200 =0,0013750 г/мл
Вещества, из которых готовят растворы с известным титром, называются исходными (стандартными веществами). Исходные вещества должны удовлетворять следующим требованиям:
а) они должны быть химически чистыми (примеси не более 0,05-0,1 %);
б) состав должен строго соответствовать химической формуле;
в) устойчивы при хранении в растворе и в твердом состоянии;
г) величина эквивалента должна быть наибольшей.
Раствор, приготовленный таким образом, называется стандартными раствором с приготовленным титром. Способ приготовления титрованных растворов зависит от свойств вещества и агрегатного состояния
1. Из веществ кристаллических х.ч. готовят по точной навеске.
Например: приготовить 250 мл 0,1н раствораNa2CO3, М(Na2CO3) = 106 г/моль. Эквивалентная масса Э(Na2CO3) = 53 г/моль,
а) рассчитать навеску, необходимую для приготовления раствора:
б) отвесить навеску на аналитических весах,
в) навеску количественно перенести в мерную колбу на 250 мл, растворить в небольшом количестве дистиллированной воды и долить ею до метки, тщательно перемешивая.
2. Приготовление из фиксанала.Готовят раствор, сразу разбивая фиксанал в мерную колбу нужного объема, и вымывают из фиксанала все кристаллы дистиллированной водой и доводят раствор до метки.
3. Из кристаллических веществ, загрязненных, гигроскопичных, летучих и т.д.
Необходимо для приготовления;
а) рассчитать навеску,
б) отвесить ее на технических весах, перенести в любую склянку на 250 мл, растворить в дистиллированной воде и долить до метки,
в) установить точную концентрацию приготовленного раствора по исходному веществу (титрованному раствору). Растворы, титр которых находят не по точной навеске, а путем титрования титрованным раствором, называют растворы с установленным титром.
1. Приготовить400мл 0,05 н раствора буры из кристаллической.
Определить массу навески буры, она равна:
Отвешиваем на аналитических весах навеску, переносим в мерную колбу, тщательно растворяем и доводим до метки 400 мл.
2.Приготовить 100 мл0,15 н раствора из 3н раствора её.
Вопросы к задаче: а) в каких объемах реагируют растворы с одинаковой концентрацией? б) какая зависимость между объемами реагирующих веществ и нормальными концентрациями?
Данную задачу можно решить по формуле: Сн1∙V1= Сн2∙V2;
Сн1 и Сн2 — концентрации растворов моль/л;V1иV2 – объемы исходного и конечного раствора в мл,
Значит, для приготовления 100 мл 0,15 н раствора нужно взять 5 мл 3н раствора и довести до метки 100 мл дистиллированной водой.
3.Приготовить 100г 14% раствора,хлорида натрия из 22%- го и 10%-го растворов этой соли.
Весовое соотношение исходных растворов находим по правилу смешения (правило креста):
1
1
2
Из большего числа вычитаем меньшее: 22-14= 8 в.ч. 10%-го
14-10 = 4 в.ч. 22%-го
Получим 12 г 14% -го раствора
на 12 г 14%-го раствора нужно 8 г 10%-ного

на 12 г 14%-го раствора нужно 4 г 22%-ного
н
Измеряем ареометром плотность исходных растворов. Разделив массы растворов на плотность, получим объемы исходных растворов, необходимых для приготовления нужного раствора. Отмериваем их и переливаем в склянку для использования в работе.
Определить титр раствора хлорида натрия, если известно, что на титрование его 10 мл расходовалось 9,2 мл 0,1 н раствора нитрата серебра. Титр можно определить:
по закону эквивалентов: (Cн∙V)NaCl= (Cн∙V)AgNO3
Cн (NaCl) = (9,2∙0,1)/10 = 0,092 моль/л, Т = (58,5∙0,092)/1000 = 0,005382 г/мл
58,5 – это эквивалентная масса хлорида натрия.
ФИКСИРОВАНИЕ ТОЧКИ ЭКВИВАЛЕНТНОСТИ
Установление состояния эквивалентности является очень важным моментом в проведении анализа. Несоответствие момента прекращения титрования (точки эквивалентности) приводит к возникновению индикаторных ошибок титрования, к неправильным ответам, что чревато последствиями. В принципе, индикаторная ошибка неизбежна при любом определении, но при правильном определении точки конца реакции столь мала, что ею можно пренебречь. Точку эквивалентности можно определить химическими методами (применение индикаторов) и физико-химическими методами (потенциометрическими, кондуктометрическими, фотоколометрическими).
В некоторых случаях изменения в системе титрования столь заметны, что не требуется каких то заметных особых приемов для обнаружения конца реакции. Проблема выбора способа фиксирования точки эквивалентности всегда решается применительно к конкретной практике (методике исследования). Чаще всего используют индикаторы. Полученные результаты должны быть достоверны, т.е. должны быть подвергнуты статистической обработке. Методику статобработки см. в данном методическом руководстве.
Метод нейтрализации и его применение в медико-санитарной практике
Медико биологическое значение.
Метод кислотно-основного титрования позволяет определять количественно в исследуемых объектах кислые и основные продукты.
Так, в санитарно-гигиенической практике этим методом определяют кислотность и щелочность многих пищевых продуктов, питьевых и сточных вод.
В клинической практике кислотно-основное титрование используют для определения кислотности желудочного сока, буферной емкости крови, спинно-мозговой жидкости, мочи и других биологических жидкостей.
Этот метод широко используется в фармацевтической химии при анализе лекарственных веществ, установления доброкачественных продуктов питания (например,молока).
Большое значение имеет рассматриваемый метод и при санитарно гигиенической оценке объектов окружающей среды. Промышленные стоки могут содержать или кислые, или щелочные продукты. Закисление или защелачивание природных водоемов и почвы приводит порой к необратимым последствиям, в связи с чем контроль кислотно-основного баланса весьма важен.
Краткое описание метода нейтрализации сводится к следующим моментам:
В основе метода лежит реакция взаимодействия
б) Определяемые вещества:
кислоты: сильные и слабые
основания: сильные и слабые: соли, подвергающиеся гидролизу.
Сильные кислоты (соляная, серная) с концентрацией от 0,01 до 1,0 моль/л используются для определения концентрации оснований и солей, гидролизующихся по аниону.
Сильные основания: (NaOH, KOH) с концентрацией от 0,01 до 1,0 моль/л используются для определения концентрации кислот и солей, гидролизующихся по катиону.
Чаще всего титранты для метода нейтрализации готовят из фиксаналов. Иногда растворы сильных кислот готовят разбавлением концентрированного раствора кислоты, а растворы сильных оснований, растворением навески твердой щелочи. Последние способы приготовления растворов, требуют экспериментального уточнения концентрации приготовленного титранта с использованием установочных (исходных) веществ.
Для титрантов кислот, в качестве установочных веществ, используют соду Na2CO3 или буру Na2B4O7•10H2O.
Для титрантов щелочей — щавелевую кислоту (H2C2O4•2H2O).
Реакция между кислотами и основаниями не сопровождается, как правило, какими-либо внешними эффектами, поэтому для фиксирования точки эквивалентности приходится использовать специальные вещества-индикаторы. Кислотно-основные индикаторы это, слабые кислоты или основания, степень ионизации которых определяется концентрацией [H + ] ионов в растворе.
Чем больше концентрация H + ионов, тем меньше будет степень ионизации индикатора. Молекулярная HInd и ионная HInd формы индикатора имеют разные окраски. Таким образом, концентрация ионов H + влияет на соотношение концентраций HInd и Ind что, в свою очередь, определяет характер или яркость окраски.
Для характеристики кислотности растворов в химии широко пользуются водородным показателем, pH — отрицательный десятичный логарифм молярной концентрации [H + ].
В кислых растворах pH 7, в нейтральных
Все индикаторы изменяют свою окраску не скачкообразно, а плавно, т.е. в определенном интервале значений pH, называемом интервалом перехода.
Поскольку индикаторы как кислоты или основания отличаются друг от друга по силе, они имеют разные интервалы перехода (см. табл.1).
Источник
Вычисление аналитического множителя (фактор пересчета)
Задача 281
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество СаО; весовая форма СаСО3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (СаО) и гравиметрической (весовой) формы (СаСО3), то аналитический множитель будет иметь следующее значение:
f = МrСаО/MrСоСО3 = 56,078/100,078 = 0,5603,
где МrСаО = 56,078; MrСаСО3 = 100,078.
Ответ: f = 0,5603.
Задача 282
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Са; весовая форма СаСО3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Са) и гравиметрической (весовой) формы (СаСО3), то аналитический множитель будет иметь следующее значение:
f = АrСа/MrСоСО3 = 40,078/100,078 = 0,40047,
где АrСаО = 40,078; MrСаСО3 = 100,078.
Ответ: f = 0,40047.
Задача 283
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество FeSO4; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (FeSO4) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2МrFeSO4/MrFe2O3 = (2 . 151,911)/159,69 = 1,9026,
где МrFeSO4 = 56,078; MrFe2O3 = 159,69.
Ответ: f = 1,9026.
Задача 284
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Fе; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Fe) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2АrFe/MrFe2O3 = (2 . 55,845)/159,69 = 0,6994,
где АrFe = 56,078; MrFe2O3 = 159,69.
Ответ: f = 0,6994.
Задача 285
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Н3РО4; весовая форма Mg2P2O7.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (H3PO4) и гравиметрической (весовой) формы (Mg2P2O7), то аналитический множитель будет иметь следующее значение:
f = 2МrH3PO4/MrMg2P2O7 = (2 . 97,074)/222,558 = 0,8804,
где МrH3PO4 = 97,074; MrMg2P2O7 = 222,558.
Ответ: f = 0,8804.
<
Задача 286
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество FеО; весовая форма Fe2O3.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (FeО) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение:
f = 2МrFeО/MrFe2O3 = (2 . 71,845)/159,69 = 0,8998,
где МrFeО = 71,078; MrFe2O3 = 159,69.
Ответ: f = 0,8998.
Задача 287
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Са3(РО4)2; весовая форма СаО.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Са3(РО4)2) и гравиметрической (весовой) формы (СаО), то аналитический множитель будет иметь следующее значение:
f = МrСа3(РО4)2/3MrСаО = 312,948/(3 , 56,078) = 1,8574.
где МrСа3(РО4)2 = 312,948; MrСаО = 56,078.
Ответ: f = 1,8574.
Задача 288
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Na2S2O7; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества ( Na2S2O7) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = Мr Na2S2O7/2MrBaSO4 = 222,112/(2 , 233,393) = 0,4758.
где Мr Na2S2O7 = 222,112; MrBaSO4 = 233,393.
Ответ: f = 0,4758.
Задача 289
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество Ва; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Ва) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = АrВа/MrBaSO4 = 137,237/233,393 = 0,5884.
где АrВа = 137Ю327; MrBaSO4 = 233,393.
Ответ: f = 0,5884.
Задача 290
Вычислите аналитический множитель (фактор пересчета) для определения: определяемое вещество BaCl2 . 2H2O; весовая форма BaSO4.
Решение:
Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества BaCl2 . 2H2O) и гравиметрической (весовой) формы (BaSO4), то аналитический множитель будет иметь следующее значение:
f = МrBaCl2 . 2H2O /MrBaSO4 = 244,233/233,393 = 1,04645
где МrBaCl2 . 2H2O = 244,233; MrBaSO4 = 233,393.
Ответ: f = 1,04645.
Материальный
баланс ХТП является следствием закона
сохранения массы вещества (а точнее –
следствием сохранения элементов при
химических превращениях).
Это
означает, что масса веществ, поступивших
на технологическую операцию – приход,
равна массе полученных веществ – расходу.
Материальный баланс должен соблюдаться
для ХТП всех типов: синтеза, разделения,
очистки целевых продуктов. Данные о
материальном балансе позволяют дать
оценку целесообразности осуществления
процесса в заданных условиях. Эти данные
нужны как при проектировании новых, так
и при анализе работы существующих
производств. По данным материального
баланса рассчитывают технологические
показатели процесса: выход целевого
продукта, степень превращения сырья,
селективность процесса, расходные
коэффициенты по сырью и т.д. Материальный
баланс является необходимым элементом
при расчете энергетического и
эксергетического балансов.
Материальный
баланс сводят, пользуясь уравнениями
основной и побочных реакций. Когда
учитывают не все происходящие побочные
реакции и полученные побочные продукты,
а лишь наиболее важные из них, материальный
баланс имеет приблизительный характер.
Существуют три основные формы составления
материального баланса. В виде системы
уравнений, таблицы и поточной диаграммы.
Уравнение
материального баланса в общем виде:
GAO
+ GBO
+ … = GR
+ …+ GD
+…+
GA
+ GB
+
G,
где
GAO
,
GBO
– массы исходных реагентов (сырья).
GR –
масса целевого продукта,
GD
– масса побочного продукта,
GА
,
GВ
–
массы непрореагировавших веществ,
G –
невязка баланса.
Невязка
баланса является следствием потерь
сырья и продуктов при проведении
процесса, неточности эксперимента и
расчета, а также принятых допущений.
Чаще
всего материальный баланс процесса
представляют в виде таблицы:
|
Приход |
Расход |
||||
|
Наименование |
Масс. |
% |
Наименование |
Масс. |
% |
|
Реагент |
… |
… |
Целевой |
… |
… |
|
Реагент |
… |
… |
Побочный |
… |
… |
|
Реагент |
… |
… |
|||
|
Реагент |
… |
… |
|||
|
Невязка |
… |
… |
|||
|
Всего |
… |
100 |
Всего |
… |
100 |
В
таблицу материального баланса, кроме
обязательных масс и массовых процентов
введенных и получающихся веществ,
включают еще и объемы веществ, находящихся
в газовой фазе, приведенные к нормальным
условиям. Массовые проценты в столбце
“Расход” рассчитывают по отношению к
сумме масс введенных реагентов в столбце
“Приход”, т.е. массу всех введенных
реагентов принимают за 100%.
Может случиться, что из-за погрешностей
эксперимента и допущений, принятых при
расчете, масса полученных веществ
окажется больше массы введенных. Тогда
невязка баланса будет иметь отрицательное
значение. Материальный баланс составляют
на заданный базис. Обычно базисом
является масса сырья или целевого
продукта (кг,
т)
или продолжительность процесса (ч,
сутки).
В лабораторных исследованиях составляют
баланс за время проведения опыта.
В
дальнейшем производят пересчет на
заданный базис, пользуясь коэффициентом
пересчета. Коэффициент пересчета
показывает, во сколько раз нужно изменить
массы веществ, входящих в материальный
баланс, при переходе на другой базис.
Так, если в материальном балансе,
составленном за время проведения опыта,
получили GR
грамм целевого продукта, а заданный
базис расчета – 1000
г целевого продукта, коэффициент
пересчета равен 1000
/ GR.
В
названии таблицы материального баланса
указывают, для какого процесса и реактора
произведен расчет, а также принятый
базис расчета.
Поточная
диаграмма это блок-схема (рис.1.3).
Материальные потоки изображают в виде
полос, ширина которых пропорциональна
массе в выбранном масштабе. Основным
преимуществом данного способа изображения
является его наглядность.
Рис.1.3.
Поточная диаграмма колонны синтеза
аммиака:
1
– свежий газ;
2
– циркулирующий газ;
3
– жидкий аммиак и растворенные в нем
газы;
4
– отдувочные газы
1.2.8.
Расходные
коэффициенты по сырью.
К основным показателям ХТП относятся
расходные коэффициенты, характеризующие
затраты сырья, воды, топлива, электроэнергии,
пара на единицу массы целевого продукта.
В связи с большим вкладом затрат на
реагенты (сырье) в себестоимость продуктов
в химической технологии особое значение
имеют расходные коэффициенты по
реагентам. Различают теоретические и
практические расходные коэффициенты.
Теоретический расходный коэффициент
стех
рассчитывают,
пользуясь стехиометрическим уравнением,
описывающим химическое превращение
(1.18):

где
и
– массы реагента и продукта из уравнения
реакции
MA
и MP
– молекулярные массы реагента и продукта
а
и р
–
стехиометрические коэффициенты.
Теоретический
расходный коэффициент характеризует
минимальный расход сырья на получение
единицы массы продукта.
Практический
расходный коэффициент
отражает реальный расход поступившего
в процесс сырья на получение единицы
массы продукта, т.е. его рассчитывают
как отношение массы поступившего в
процесс сырья
к массе получившегося продукта GР:
Расходные
коэффициенты рассчитывают по всем
реагентам. Практические расходные
коэффициенты всегда больше стехиометрических
из-за неполноты превращения сырья, а
также из-за расходования сырья на
побочные реакции. Данные для расчета
практических расходных коэффициентов
берут из материального баланса процесса.
Практический расходный коэффициент по
реагенту можно найти, зная теоретический
расходный коэффициент и выход целевого
продукта по этому реагенту:
где
– выход Р
по реагенту А
в долях единицы.
Соседние файлы в папке методички митхт
- #
- #
- #
- #
- #
- #
- #
Большинство химических формул включают индексы, которые являются числами. Хотя за этими числами не следуют единицы, записанные в формуле, на самом деле они представляют собой количества с единицами. Таким образом, в химических формулах заложена необходимость в коэффициентах пересчета, которые представляют собой дроби, которые при умножении на измерение преобразуют одну единицу в другую. Процесс использования коэффициентов преобразования известен как размерный анализ, и он имеет жизненно важное значение для изучения химических формул и уравнений.
Моли Соединений в Моли Элементов
Моль – это единица измерения количества. Если целое число появляется в качестве индекса в химической формуле, оно представляет число молей элемента, непосредственно предшествующего нижнему индексу в формуле. Если индекс следует за набором скобок, он представляет число молей группы атомов в скобках. Моль полезна, потому что она помогает вам понять относительное количество каждого элемента в соединении, и эти количества даны индексами в формуле. Например, формула для воды – H2O, где два – индекс для водорода. Там нет индекса после кислорода, что то же самое, что иметь индекс один. Следовательно, один моль соединения H2O содержит два моля водорода и один моль кислорода, и коэффициенты конверсии составляют (2 моля водорода / 1 моль H2O) и (1 моля кислорода / 1 моль H2O) соответственно.
Родинки для атомов и молекул
Единица моль полезна не только потому, что она разбивает формулу на ее химические компоненты, но также и из-за ее отношения к числу атомов и молекул. Один моль составляет 6, 02 * 10 ^ 23 атомов или молекул, поэтому коэффициент преобразования равен (6, 02 * 10 ^ 23 атомов или молекул / 1 моль). Например, один моль углерода равен 6, 02 * 10 ^ 23 атомам углерода, а один моль диоксида углерода равен 6, 02 * 10 ^ 23 молекулам диоксида углерода. Поскольку формулой диоксида углерода является CO2, один моль углерода и два моля кислорода можно найти в одном моле диоксида углерода. Таким образом, в одном моле углекислого газа существует 6, 02 * 10 23 атомов углерода и 12, 04 * 10 23 атомов кислорода.
Родинки в граммы
Хотя важно понимать родинки и число атомов и молекул, более практичной единицей для экспериментов является грамм, который является единицей массы. Вы не можете измерить моль вещества в лаборатории, но вы можете измерить его массу в граммах на весах. Коэффициент пересчета числа родинок в граммы взят из периодической таблицы. Атомная масса, которая обычно указывается ниже атомного символа и атомного номера, представляет собой количество граммов на моль этого элемента. Например, атомная масса германия составляет 72, 61 г / моль. Следовательно, коэффициент пересчета составляет (72, 61 г Ge / 1 моль Ge). Коэффициент преобразования для каждого элемента аналогичен; просто замените атомную массу германия атомной массой изучаемого элемента.
Проценты в кроты
Иногда индексы в химических формулах являются не целыми числами, а десятичными. Это проценты, и часто необходимо пересчитать проценты в моли. Например, если у вас есть соединение, составляющие которого указаны в процентах, например, C0H2, 6O0, 2, то 20 процентов молей соединения составляют углерод, 60 процентов – водород, а 20 процентов – кислород. Чтобы преобразовать в родинки, найдите коэффициент, который умножается на наименьший процент, чтобы получить продукт, равный 100 процентам. В этом случае наименьший процент равен 20 процентам, поэтому это число равно 5. Затем умножьте каждый процент на это число, чтобы получить в нашем случае формулу CH3O, поскольку 20% * 5 = 100% = 1 и 60% * 5. = 300% = 3.