Предложите, как улучшить StudyLib
(Для жалоб на нарушения авторских прав, используйте
другую форму
)
Ваш е-мэйл
Заполните, если хотите получить ответ
Оцените наш проект
1
2
3
4
5
Селективность исэ
ИСЭ можно
охарактеризовать количественно,
используя уравнение Никольского. Оно
описывает зависимость потенциала
электрода от концентрации посторонних
ионов при помощи коэффициента
селективности. В случае одного постороннего
иона уравнение Никольского выглядит
так:
(1.8)
где аi
– активность
определяемого иона с зарядом zi;
аj
– активность определяемого иона с
зарядом zj;
Kpotij
– потенциометрический коэффициент
селективности.
В общем случае,
при наличии m
мешающих
ионов:
(1.9)
Коэффициент
селективности показывает, при каком
соотношении концентраций определяемого
и постороннего ионов последний начинает
оказывать мешающее влияние. Значения
коэффициентов селективности изменяются
от весьма малых величин, близких к нулю,
до единицы и более. Чем меньше величина
коэффициента селективности, тем выше
селективность электрода. Так, коэффициент
селективности, равный 1∙10-3,
означает, что чувствительности электрода
по отношению к определяемому и постороннему
ионам относятся как 1000 : 1.
Наиболее
предпочтительным способом определения
коэффициента селективности является
способ, основанный на исследовании
растворов, содержащих смеси определяемого
и постороннего иона. Для этого получают
серии градуировочных зависимостей
потенциала электрода от концентрации
определяемого иона, построенных в
присутствии различных концентраций
постороннего иона (рис. 2).
При больших
избытках посторонних ионов потенциал
электрода определяется вторым слагаемым
в уравнении Никольского. Он остается
постоянным и не зависит от концентрации
определяемого иона (горизонтальный
участок на градуировочной кривой). Из
абсциссы точки пересечения двух участков
градуировочной зависимости (горизонтального
и наклонного), равной ai
=Kijpot∙ajz(i)
/ z(j),
можно, зная
постоянную величину aj,
рассчитать
коэффициент селективности. Описанный
метод позволяет рассчитать коэффициент
селективности даже по одной градуировочной
зависимости, но для большей достоверности
надо использовать несколько.
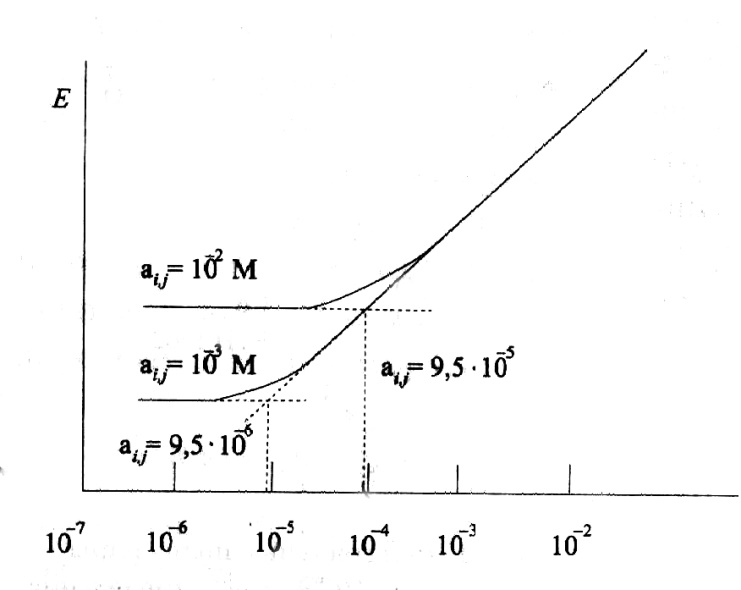
Рис. 2. Определение
коэффициента селективности ИСЭ из
градуировочных зависимрстей, построенных
в присутствии посторонних ионов с
концентрацией 10-2
М (верхний
график) и 10-3
М (нижний
график). В данном случае коэффициент
селективности равен 9.5 ∙ 10-3
Приемы,
используемые в прямой потенциометрии
(ионометрии)
Метод градуировочного
графика. Наиболее
часто применяют прием последовательного
разбавления исходного раствора
дистиллированной водой. Готовят таким
образом серию из 5–7 эталонных растворов
с известным содержанием определяемого
вещества. Концентрация определяемого
вещества и ионная сила в эталонных
растворах не должны сильно отличаться
от концентрации и ионной силы анализируемого
раствора: в этих условиях уменьшаются
ошибки определения. Ионную силу всех
растворов поддерживают постоянной
введением индифферентного электролита
(метод постоянной ионной силы). Эталонные
растворы последовательно вносят в
электрохимическую ячейку. Обычно эта
ячейка представляет собой стеклянный
химический стакан, в который помещают
электроды.
Измеряют ЭДС
эталонных растворов, тщательно промывая
дистиллированной водой электроды и
стакан перед заполнением ячейки каждым
эталонным раствором. По полученным
данным строят градуировочный график
в координатах Е(ЭДС)
– lg
c,
где с
– концентрация определяемого вещества
в эталонном растворе. (Метод постоянной
ионной силы позволяет перейти от
активностей к концентрациям). Затем в
электрохимическую ячейку вносят (после
промывания ячейки дистиллированной
водой) анализируемый раствор и измеряют
ЭДС ячейки. По градуировочному графику
находят lg
c(Х),
где c(Х)
– концентрация определяемого вещества
в анализируемом растворе.
По данным калибровки
ИСЭ определяют следующие электрохимические
характеристики.
1. Нернстовскую
область электродной функции – интервал
прямолинейной зависимости потенциала
от активности (концентрации)
потенциалопределяющих ионов.
2. Крутизну
электродной функции – угловой коэффициент
наклона градуировочного графика (Е
– раi,
Е – рci).
3. Предел обнаружения
потенциалопределяющего иона сmin.
Для этого экстраполируют прямолинейные
участки зависимости Е
– рci;
полученная точка пересечения соответствует
на оси абсцисс величине сmiт
.
4. Время отклика
ИСЭ – время достижения стационарного
потенциала.
5. Селективность
электрода относительно определяемого
иона в присутствии посторонних ионов.
Метод добавок
стандарта.
В электрохимическую ячейку вносят
известный объем V(X)
анализируемого раствора с концентрацией
c(Х)
и измеряют ЭДС ячейки. Затем в тот же
раствор прибавляют точно измеренный
небольшой объем стандартного раствора
V(st)
с известной (достаточно большой)
концентрацией с(st)
определяемого вещества и снова определяют
ЭДС ячейки (необходимо, чтобы ∆Е
≥ 30 мВ).
Рассчитывают
концентрацию с(Х)
определяемого вещества в анализируемом
растворе по формуле
,
(1.10)
где ∆Е
– наблюдаемое изменение потенциала в
мВ после добавки стандарта; S
= 0.059/n
– крутизна электродной функции, В.
Соседние файлы в папке Лекции
- #
- #
- #
- #
- #
- #
Unit Converter
Enter the retention factor of the second peak and the retention factor of the first peak into the Selectivity Factor Calculator. The calculator will evaluate the Selectivity Factor.
- Rate of Reaction Calculator
- Molar Concentration Calculator
- Concentration from Absorbance Calculator
Selectivity Factor Formula
The following two example problems outline the steps and information needed to calculate the Selectivity Factor.
a = K2/ K1
Variables:
- a is the Selectivity Factor ( )
- K2 is the retention factor of the second peak
- K1 is the retention factor of the first peak
How to Calculate Selectivity Factor?
The following steps outline how to calculate the Selectivity Factor.
- First, determine the retention factor of the second peak.
- Next, determine the retention factor of the first peak.
- Next, gather the formula from above = a = K2/ K1.
- Finally, calculate the Selectivity Factor.
- After inserting the variables and calculating the result, check your answer with the calculator above.
Example Problem :
Use the following variables as an example problem to test your knowledge.
retention factor of the second peak = 3
retention factor of the first peak = 2.5
a = K2/ K1 = ?
Коэффициент селективности
Селективность электрода зависит не только от подвижности иона, энергии ассоциации между ионами, но и от таких факторов , как ионная сила раствора и соотношение концентраций ионов.
Селективность электродов с жидкой мембраной имеет тенденцию к уменьшению по мере увеличения ионной силы.
Селективность электродов с твердой мембраной или не зависит от этого фактора, или эту зависимость надежно не установить.
Коэффициент селективности является количественной характеристикой влияния мешающих ионов на ЭДС электрода. Этот коэффициент показывает, на какую величину можно умножить активность мешающего иона, чтобы получить на индикаторном электроде такое же изменение потенциала, как и для определяемых ионов.
Это определение математически описывается уравнением Нернста.
Коэффициент селективности можно определить экспериментально.
При коэффициенте селективности меньше единицы, электрод избирателен по отношению к определяемому иону в присутствии мешающего иона. При равном единице одинаково чувствителен к обоим ионам; при большем единицы более чувствителен к мешающему иону по сравнению с определяемым.
Коэффициенты селективности для ИСЭ карнитина хлорида с ФМК и ФВК.
| Мешающие ионы | ||||
| К | Ca | Na | ||
| ФВК | 0.31 | 0.31 | 0.36 | |
| ФМК | 0.36 | 0.31 | 0.30 |
1.
План лекции
1. Кондуктометрия и электрофорез – методы исследования и контроля
состава растворов.
2. Диффузия электролита и диффузионный потенциал. Вывод основного
уравнения, количественные модели и расчет.
3. Диафрагма, мембрана, ИСЭ. Некоторые виды равновесий,
реализующихся на мембранах:
– потенциал Доннана, доннановское равновесие, доннановское
исключение электролитов
– равновесие и потенциал на границе двух несмешивающихся
жидких растворов
– потенциал на пористой ионообменной мембране (теория ТеореллаМейера-Сиверса)
– уравнение Гольдмана-Ходжкина-Каца для потенциала покоя
клеточной мембраны
4. Ионоселективные мембраны и электроды на их основе
– стеклянная мембрана. Простая и обобщенная теории стеклянного
электрода. Уравнение Никольского
1
5. Методы определения коэффициентов селективности
2.
Метод кондуктометрии
Метод позволяет изучать свойства растворов электролитов в любых
растворителях, в широком интервале температур, давлений и
концентраций.
Для обеспечения высокой точности измерений сопротивление
растворов должно измеряться с точностью не ниже 0,01%. Для этого
обеспечивают
1) регулирование температуры не ниже 0,1°; 2) устранение
поляризации электродов; 3) применение прецизионной аппаратуры;
Основное уравнение: æ= (1/R)·K
где æ – удельная электропроводность раствора, R – сопротивление,
К – постоянная ячейки.
Постоянную ячейки находят по растворам с известной величиной
электропроводности.
Применяется для прямого определения концентрации электролитов
2
и в варианте титрования.
3.
Удельная электропроводность растворов KCl
(для градуировки кондуктометра), Ом-1·м-1
Концентрация KCl, моль/л
t, °C
0,0100
0,100
1,00
0,00
0,07751
0,7154
6,543
18,00
0,12226
1,1191
9,820
20,00
0,12757
1,1667
10,202
25,00
0,14114
1,2886
11,173
3
4.
Примеры применения метода кондуктометрии
1. Определение удельной электропроводности воды и
растворителей
2. Определение
электролита
константы
диссоциации
3. Определение
соли
растворимости
слабого
труднорастворимой
4. Определение
константы
устойчивости
и
стехиометрического
состава
комплексных
соединений
5. Измерения в неводных средах
4
5.
Прямая кондуктометрия
Пример градуировочной зависимости
диапазоне концентраций 0 – 3,0 г/л
для
электролита
в
NaCl
Уд. эл-ть, мСм*см-1
6
5
y = 1,6414x
R² = 0,9997
4
3
2
1
0
0
0,5
1
1,5
2
2,5
3
3,5
С, г/л
1. Определение электропроводности природных и техногенных вод
2. Установление полноты определения ионного состава по макрокомпонентам
5
6.
Установление возможности ионизации комплексных соединений по величинам
эквивалентной электропроводности их растворов, См см2 моль-1
6
7.
Λ, См·см2·моль-1
Растворитель- вода
2 иона – 100;
3 иона – 230-260;
4 иона – 400
5 ионов – 500
Зависимость от числа ионов, находящихся во внешней сфере: 1 – Pt(NH3)6Cl4;
2 – Pt(NH3)5Cl3; 3 – Pt(NH3)4Cl2; 4 – K2PtCl6; 5 – Pt (NH3)4Cl2; 6 – K[NH3Cl5Pt];
7 – Pt (NH3)3Cl; 8 – Pt(H3)2(NH3); 9 – Pt(NH3)2Cl2; 10 – Pt(NH3)2Cl4 при разбавлении
V = 1000, кроме кривой 6, где V = 125.
7
8.
Примеры кондуктометрических кривых кислотноосновного титрования
æ
1
4
2
5
3
6
V, мл
1 и 4 – кислота и щелочь; 1 и 5 – титрант и продукт имеют низкую электропр.;
1 и 6 – титрант имеет низкую электропроводность; 2 и 4 – слабая кислота
сильным основанием; 3 и 4 – очень слабая кислота сильным основанием 8
9.
Гель-электрофорез
9
10.
Капиллярный электрофорез
10
11.
Схема движения потоков в капилляре
11
12.
Диффузионный потенциал
HCl
AgNO3
Cl-
H+
Cl-
H+
Cl-
H+
C1>C2
+
+
Ag+
NO3-
Ag+
NO3-
Ag+
NO3-
C1>C2
Диффузионный потенциал не является равновесным, т.к. поддерживается
направленно протекающим процессом диффузии.
13.
Будем рассматривать диффузионный слой
между растворами
Движение ионов по градиенту концентрации электролита (хим. потенциала)
С1
Переходный слой
+
_
+
_
С2
14.
Диффузия электролита и диффузионный потенциал
На фоне неравновесного процесса диффузии можно рассматривать
равновесный перенос заряженных частиц (квазитермостатическая
гипотеза).
Раствор 2
Раствор 1
0
d
По предложению Гиббса при оценке диффузионного потенциала
следует считать, что процесс идет в квазиравновесных условиях и его
движущей силой является разность химических потенциалов.
14
15.
Вывод уравнения для диффузионного потенциала
15
16.
Рассмотрим решения уравнения
1. Униполярная проводимость электролита
2. Электролит 1:1
3. Уравнение Гендерсона и его частные случаи
4. Элиминирование диффузионного
потенциала
16
17.
1. Униполярная проводимость электролита
После интегрирования получим
2. Электролит 1:1
После интегрирования получим
èëè äèôô.
( D D ) RT c2
ln
D z D z F
c1
17
18.
3. Модель непрерывного ряда смесей Гендерсона
1. Считаем концентрационный градиент линейным.
2. Разделим область между 2-мя растворами на тонкие слои dx, в каждом
из которых изменение активности считаем постоянным. Пусть k сортов
ионов с зарядами zi и числами переноса ti диффундируют из 1 в 2.
Ci,x = C’’I (1-x) + C’I x
Раствор 2
С’’ i
Раствор 1
С’ i
0
d
3. При решении уравнения переходим от интегрирования
концентрации к интегрированию по пространственной координате.
X
по
18
19.
диф
| zi | ui
[Ci ( ) Ci ( )]
RT i
zi
ln
F | zi | ui [Ci ( ) Ci ( )]
i
| z | u C ( )
| z | u C ( )]
i
i
i
i
i
i
i
i
19
20.
Сопоставление измеренных и рассчитанных по
ур. Гендерсона значений диф.
Раствор 1
диф.
Раствор2
Эксп.
Расчет
0,1М HCl
0,1М KCl
-26,78
-28,52
0,1М HCl
0,1М NaCl
-33,08
-33,38
0,1М KCl
0,1М NaCl
-6,42
-4,86
0,1М NaCl 0,1М NH4Cl
+4,21
+4,81
0,01М HCl 0,01М KCl
-25,73
-27,48
0,01М KCl 0,01М NaCl
-5,65
-4,54
20
21.
Частные случаи ур. Гендерсона
1. Контактируют 2 раствора одного электролита с разными концентрациями
2. Контактируют 2 раствора различных однозарядных электролитов с
одинаковой концентрацией и одним общим ионом (Уравнение ЛьюисаСаржента)
– молярная электропроводность электролита, и
разделяемые фазы. Знак «+» ставится при наличии
общего катиона, знак «-» при общем анионе.
21
22.
Элиминирование диффузионного потенциала
22
23.
1. Диффузионные потенциалы на жидкостной границе контакта растворов
электролитов:
– модель непрерывно изменяющейся смеси растворов (модель Гендерсона)
– модель с затрудненной диффузией электролита (модель Планка)
– модель свободной диффузии электролитов
2. Потенциалы на границе контакта растворов электролитов
– через диафрагму ограничивающую диффузию крупных ионов (модель
Доннана)
– несмешивающиеся друг с другом растворители (модель потенциала
распределения)
3. Мембранные потенциалы
– дискриминация переносу по размеру иона (простейший тип мембранных
равновесий)
– пористые ионообменные мембраны (Нафион и др.)
– «сплошные» мебраны
– стеклянные мембраны
– модель Никольского
– модель Никольского-Шульца
– жидкостные мембраны (пластифицированные мембраны)
– модель жидких ионообменников
– модель нейтральных переносчиков
23
– осадочные мембраны
24.
2. Диафрагмы, мембраны и ИСЭ. Термины и определения
История развития мембранных электродов связана с исследованиями
физиологических процессов. В середине ХIХ века физиологи
обнаружили возникновение между отдельными частицами организмов
разности электрических потенциалов. Для понимая действия сложных
биологических мембран химиками в конце ХIХ были созданы
простейшие модели мембран.
В 1890 году Оствальд воспользовался понятием полупроницаемой
мембраны для создания модели биологической мембраны и показал,
что значение разности потенциалов в такой мембране можно считать
предельным в случае жидкостного потенциала, когда подвижность
одного из ионов равна нулю.
В начале ХХ столетия была обнаружена способность стеклянной
мембраны реагировать на изменение концентрации ионов водорода.
Первые основные исследования потенциалов стеклянных мембран
проведены Кремером и Габером. Ими же созданы и первые прототипы
стеклянных и других электродов с твердыми и жидкими мембранами.
24
25.
Диафрагма – это перегородка между двумя растворами, которая
препятствует свободному перемешиванию растворов, ионы (частицы)
могут проникать через нее свободно.
Мембрана – это любая фаза, разделяющая две других и
препятствующая переносу массы между этими фазами, но
позволяющая переход с различными степенями ограничения одного
или нескольких сортов ионов (частиц).
Ионоселективные электроды (ИСЭ) – это датчики, которые содержат
мембрану, представляющую собой твердый электролит или жидкий
раствор, не смешивающийся с водой. Такая мембрана с обеих сторон
контактирует с водными растворами (иногда с одной). ИСЭ имеет
внутренний токоотводящий электрод, в некоторых случаях мембрана
контактирует с твердым электронным проводником (твердоконтактные
ИСЭ).
25
26. Некоторые виды мембранных равновесий: 1. Доннановское равновесие
Считаем растворы (1) и (2)
разбавленными, осмотическое
давление (p(1), p(2)) растворителя одинаковым
Проницаемыми через
диафрагму являются только
К+ и Х- . +
–
R+
Через мембрану не
проходят
(1)
– +
-+
–
+ -+ – +
+
– +
+
+
–
R
+
–
+
+
–
R
+
+
–
–
(2)
R
+
Равновесие устанавливается только для проницаемых ионов:
+
1) Равновесие для катионов К
26
26
27. 2) Равновесие для анионов (X-)
–
X-
3) Доннановское исключение электролитов
p (1) p ( 2 )
V
V
0; exp
1
RT
RT
4) Расчет доннановского потенциала из условий начального состояния системы
Начальное состояние
R+; AC1; C1
M+; AC2; C2
Конечное состояние
R+; A-; M+
C1; C1+x; x
M+; AC2-x; C2-x
27
28. Расчет доннановского потенциала из начальных условий мембранной системы
RT
C2
2 1
ln
F
C1 C2
Такая ситуация может иметь место и в твердых ионообменниках, в частности, в
стеклянной мембране. Проникновение анионов в поверхность стекла
регулируется равновесием Доннана.
H+
X-
Стекло
O -Si-O-
Si
XH+
H+ X-
X-
O -Si-OX-
H+
Водный раствор
H+
H+
H+
HX
X28
29. 2.2. Некоторые виды мембранных равновесий 2.2.1. Равновесие и потенциал на границе двух несмешивающихся растворов
29
30. Оценка потенциалов на границе двух несмешивающихся жидкостей из величин G0переноса
Оценка потенциалов на границе двух несмешивающихся
жидкостей из величин G0переноса
Разделение свободных энергий переноса электролитов на составляющие проводится
на основе различного рода нетермодинамических допущений, например:
30
31.
Раствор (1)
Раствор (2)
Мембрана
Межфазный 1
Внутримембранный
диффузионный
Межфазный 2
E = р-р 2 – р-р 1=( р-р 2 – м’’) + ( м’’- м’) + ( м’ – р-р1 )
= Дон’’ + Диф – Дон’
Дон’’ = р-р 2 – м’’
Дон’ = -( р-р 1 – м’)
31
32.
Теория Теорелла – Мейера – Сиверса для пористой
ионообменной мембраны
Для (например) отрицательно заряженной мембраны ЗДМ будет иметь вид:
( 2)
( M ”)
RT a ( M ”)
ln ( 2 ) V p ( M ”) p ( 2 )
F a
(
( 2)
( M ”)
(
(1)
( M ‘)
(1)
( M ‘)
( M ”)
RT a
)
ln ( 2 ) V p ( M ”) p ( 2 )
F a
( M ‘)
RT a
)
ln (1) V p (1) p ( M ‘)
F a
( M ‘)
RT a
ln (1) V p (1) p ( M ‘)
F a
– концентрация ионогенных групп в мембране; полагая
32
33.
Решением уравнения будет:
В предположении, что внутримембранный диффузионный потенциал
отождествляется с потенциалом жидкостного соединения с затрудненной
диффузией:
дифф. ( M ”) ( M ‘)
u u RT u m( M ‘) u m( M ‘)
ln
u u F
u m( M ”) u m( M ”)
Обозначив:
Получим:
33
34.
Следствия из уравнения:
1.
2.
Получаем уравнение Нернста
Дифф. потенциал между
растворами.
Нет чувствительности к
наличию ионообменных
групп в мембране
3.
Уравнение дает
оценку дифф.
потенциала в
мембранной фазе
34
35.
Механизмы внутренней активности биологических
организмов
Для биологических мембран по обе стороны клеточной мембраны
находятся растворы примерно равных концентраций С1=С2
(Вывод уравнения Гольдмана-Ходжкина-Каца)
35
35
36.
Допущения, принятые при выводе уравнения:
– Мембрана является гомогенной
– Электрическое поле в мембране постоянно, поэтому
трансмембранный потенциал внутри мембраны изменяется линейно
– Доступ ионов в мембрану как из внутреннего, так и внешнего
растворов осуществляется мгновенно
– Проницаемые ионы не взаимодействуют
– На поток ионов через мембрану влияют как концентрация, так и
разность потенциалов
36
37.
Вывод уравнения Гольдмана-Ходжкина-Каца
Сout
Em
(1)
y
(2)
Сin
z
x
х=0
x
х=L
jA – поток ионов А,
nA – заряд ионов
Интегрирование от x=0 (in) до x=L (out) приводит к результату:
37
38.
Безразмерный
параметр
Проницаемость
Переходим от потока к току (qA – заряд иона):
В предположении, что общий ток равен нулю и все ионы имеют заряд, равный
«+1» или «-1», то при приложенном потенциале E:
Решение дает:
38
39.
Если мембрана разделяет 2 раствора равных концентраций
:
Расчет величины потенциала в простейшем случае:
Для 37 С
39
40.
Для 37 С
41.
Основные типы ИСЭ
Ионоселективные электроды – это датчики на основе ионоселективных мембран,
позволяющие определять активность (концентрацию) потенциалопределяющих ионов.
Основные виды ионоселективных электродов:
1. Электроды
с
твердыми
стеклянными
или
кристаллическими
(поликристаллическими) мембранами
2. Электроды с жидкостными (пленочными) мембранами
Требования к материалу мембраны:
– Химическая инертность (отсутствие растворимости в ионогенных растворителях)
– Наличие собственной проводимости (электронной и/или ионной)
– Обратимость и относительно высокая скорость ионного обмена на границе раздела
фаз мембрана/раствор
– Технологичность в изготовлении электродов из материала мембран
41
42. Ионоселективные электроды (ИСЭ). Одним из первых был «открыт» стеклянный электрод около 1907 г.
42
43.
Современный вариант измерительной установки для определения рН
Комбинированный электрод
1- стеклянная мембрана
2- токоотводящий электрод
3- внутреннее заполнение электрода
4- осадок для создания нас. раствора
5- токоотводящий электрод эл. сравн.
6- внутреннее заполнение электрода
7- диафрагма
8- корпус электрода
43
44. Электродная функция
44
45. Предел обнаружения ИСЭ
45
46. Кислотная и щелочная ошибка стеклянного электрода
46
47. Принятая запись ячейки
47
47
48. Основная задача теории ИСЭ
Выразить в явной форме зависимость ЭДС ГЦ от состава внешнего (или
анализируемого) раствора, т.е. от активностей (концентрации)
электролитов в растворе.
Трудность в том, что имеем дело с термодинамически неопределенными
величинами: 1) межфазными разностями потенциалов и
2) диффузионным внутримембранным потенциалом.
Однако, при правильно поставленных условиях можно получить
термодинамически строгомое выражение.
Основные положения теории стеклянного электрода
1) Ионная природа проводимости (стекла);
2) При повышении рН стеклянный электрод приобретает
металлическую (натриевую) функцию.
Впервые объяснение поведения стеклянного электрода было сделано Б.П. Никольским в 1937 г.
Никольский Б.П. // ЖФХ. 1937. Т. 10. С. 495–504.
48
49.
Простая ионообменная теория стеклянного электрода
H стекло
H раствор
Hстекло Hраствор
Hстекло F стекло Hраствор F раствор
стекло
раствор
1 раствор, 0
RT aH
стекло, 0
( H
H
)
ln ст
F
F
aH
Naстекло
Naраствор
стекло
раствор
Na
Na
стекло
раствор
Na
F стекло Na
F раствор
стекло
раствор
1 раствор,0
RT aNa
стекло, 0
( Na
Na )
ln ст
F
F
aNa
50. Простая ионообменная теория стеклянного электрода
50
51. В простой теории принимаются следующие положения:
51
52. Уравнение Никольского в общем виде
Для стекол коэффициент селективности меняется в пределах 10-1↔10-15.
Уравнение Никольского в общем виде
52



