Как рассчитать температурный коэффициент реакции?
ХимияХимические реакцииХимические вещества
Анонимный вопрос
4 марта 2019 · 40,1 K
Подготовила к ЕГЭ по химии 5000 учеников. С любого уровня до 100 в режиме онлайн 🙂 · 19 апр 2019 ·
Что такое температурный коэффициент? 😊
🍉 Во-первых, при повышении температуры скорость реакции возрастает. Всё логично😅
🍉Значит, температурный коэффициент- это число, которое показывает, во сколько раз увеличилась скорость реакции, когда мы повысим температуру на 10 градусов🤯
🍉Вот такая страшная формула( но только на первый взгляд😉)
γ-это и есть наш температурный коэффициент🙂
🍉Следовательно, чтобы его расчитать, нужно знать
🔹2 скорости (до и после повышения температуры на 10 градусов)
🔹2 константы (у каждой реакции они свои. Обычно их пишут в условии задачи)
25,6 K
Комментировать ответ…Комментировать…
From Wikipedia, the free encyclopedia
A temperature coefficient describes the relative change of a physical property that is associated with a given change in temperature. For a property R that changes when the temperature changes by dT, the temperature coefficient α is defined by the following equation:
Here α has the dimension of an inverse temperature and can be expressed e.g. in 1/K or K−1.
If the temperature coefficient itself does not vary too much with temperature and 
where ΔT is the difference between T and T0.
For strongly temperature-dependent α, this approximation is only useful for small temperature differences ΔT.
Temperature coefficients are specified for various applications, including electric and magnetic properties of materials as well as reactivity. The temperature coefficient of most of the reactions lies between −2 and 3.
Negative temperature coefficient[edit]
Most ceramics exhibit negative temperature dependence of resistance behaviour. This effect is governed by an Arrhenius equation over a wide range of temperatures:
where R is resistance, A and B are constants, and T is absolute temperature (K).
The constant B is related to the energies required to form and move the charge carriers responsible for electrical conduction – hence, as the value of B increases, the material becomes insulating. Practical and commercial NTC resistors aim to combine modest resistance with a value of B that provides good sensitivity to temperature. Such is the importance of the B constant value, that it is possible to characterize NTC thermistors using the B parameter equation:
where 

Therefore, many materials that produce acceptable values of 
Materials with a negative temperature coefficient have been used in floor heating since 1971. The negative temperature coefficient avoids excessive local heating beneath carpets, bean bag chairs, mattresses, etc., which can damage wooden floors, and may infrequently cause fires.
Reversible temperature coefficient[edit]
Residual magnetic flux density or Br changes with temperature and it is one of the important characteristics of magnet performance. Some applications, such as inertial gyroscopes and traveling-wave tubes (TWTs), need to have constant field over a wide temperature range. The reversible temperature coefficient (RTC) of Br is defined as:
To address these requirements, temperature compensated magnets were developed in the late 1970s.[1] For conventional SmCo magnets, Br decreases as temperature increases. Conversely, for GdCo magnets, Br increases as temperature increases within certain temperature ranges. By combining samarium and gadolinium in the alloy, the temperature coefficient can be reduced to nearly zero.
Electrical resistance[edit]
The temperature dependence of electrical resistance and thus of electronic devices (wires, resistors) has to be taken into account when constructing devices and circuits. The temperature dependence of conductors is to a great degree linear and can be described by the approximation below.
where

That of a semiconductor is however exponential:
where 


For both, 
This property is used in devices such as thermistors.
Positive temperature coefficient of resistance[edit]
A positive temperature coefficient (PTC) refers to materials that experience an increase in electrical resistance when their temperature is raised. Materials which have useful engineering applications usually show a relatively rapid increase with temperature, i.e. a higher coefficient. The higher the coefficient, the greater an increase in electrical resistance for a given temperature increase. A PTC material can be designed to reach a maximum temperature for a given input voltage, since at some point any further increase in temperature would be met with greater electrical resistance. Unlike linear resistance heating or NTC materials, PTC materials are inherently self-limiting. On the other hand, NTC material may also be inherently self-limiting if constant current power source is used.
Some materials even have exponentially increasing temperature coefficient. Example of such a material is PTC rubber.
Negative temperature coefficient of resistance[edit]
A negative temperature coefficient (NTC) refers to materials that experience a decrease in electrical resistance when their temperature is raised. Materials which have useful engineering applications usually show a relatively rapid decrease with temperature, i.e. a lower coefficient. The lower the coefficient, the greater a decrease in electrical resistance for a given temperature increase. NTC materials are used to create inrush current limiters (because they present higher initial resistance until the current limiter reaches quiescent temperature), temperature sensors and thermistors.
Negative temperature coefficient of resistance of a semiconductor[edit]
An increase in the temperature of a semiconducting material results in an increase in charge-carrier concentration. This results in a higher number of charge carriers available for recombination, increasing the conductivity of the semiconductor. The increasing conductivity causes the resistivity of the semiconductor material to decrease with the rise in temperature, resulting in a negative temperature coefficient of resistance.
Temperature coefficient of elasticity[edit]
The elastic modulus of elastic materials varies with temperature, typically decreasing with higher temperature.
Temperature coefficient of reactivity[edit]
In nuclear engineering, the temperature coefficient of reactivity is a measure of the change in reactivity (resulting in a change in power), brought about by a change in temperature of the reactor components or the reactor coolant. This may be defined as
Where 



In water moderated nuclear reactors, the bulk of reactivity changes with respect to temperature are brought about by changes in the temperature of the water. However each element of the core has a specific temperature coefficient of reactivity (e.g. the fuel or cladding). The mechanisms which drive fuel temperature coefficients of reactivity are different from water temperature coefficients. While water expands as temperature increases, causing longer neutron travel times during moderation, fuel material will not expand appreciably. Changes in reactivity in fuel due to temperature stem from a phenomenon known as doppler broadening, where resonance absorption of fast neutrons in fuel filler material prevents those neutrons from thermalizing (slowing down).[5]
Mathematical derivation of temperature coefficient approximation[edit]
In its more general form, the temperature coefficient differential law is:
Where is defined:
And 

Integrating the temperature coefficient differential law:
Applying the Taylor series approximation at the first order, in the proximity of 
Units[edit]
The thermal coefficient of electrical circuit parts is sometimes specified as ppm/°C, or ppm/K. This specifies the fraction (expressed in parts per million) that its electrical characteristics will deviate when taken to a temperature above or below the operating temperature.
See also[edit]
- Microbolometer (used to measure TCRs)
References[edit]
- ^ “About Us”. Electron Energy Corporation. Archived from the original on October 29, 2009.
- ^ Kasap, S. O. (2006). Principles of Electronic Materials and Devices (Third ed.). Mc-Graw Hill. p. 126.
- ^ Alenitsyn, Alexander G.; Butikov, Eugene I.; Kondraryez, Alexander S. (1997). Concise Handbook of Mathematics and Physics. CRC Press. pp. 331–332. ISBN 0-8493-7745-5.
- ^ Duderstadt & Hamilton 1976, pp. 259–261
- ^ Duderstadt & Hamilton 1976, pp. 556–559
Bibliography[edit]
- Duderstadt, Jame J.; Hamilton, Louis J. (1976). Nuclear Reactor Analysis. Wiley. ISBN 0-471-22363-8.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Якоб Хендрик Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
Уравнение, которое описывает это правило, следующее:
где 




Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60—120 кДж/моль в температурном диапазоне 10—400 °C. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например, белки в биологических системах.
Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле
Температурный коэффициент скорости реакции
Возрастание
скорости реакции с ростом температуры
принято характеризовать температурным
коэффициентом скорости реакции , числом,
показывающим, во сколько раз возрастает
скорость данной реакции при повышении
температуры системы на 10°С. Температурный
коэффициент различных реакций различен.
При обычных температурах его значение
для большинства реакций находится в
пределах от 2… 4.
Температурный
коэффициент определяют в соответствии
с так называемым «правилом Вант-Гоффа»,
которое математически выражается
уравнением
v2/v1
=
(T2
–
T1)/10,
где
v1
и v2
–
скорости реакции при температурах Т1
и Т2;
температурный коэффициент реакции.
Так,
например, если
= 2, то при Т2
–
Т1
= 50°С v2/v1
= 25
= 32, т.е. реакция ускорилась в 32 раза,
причем это ускорение никак не зависит
от абсолютных величин Т1
и Т2,
а только от их разности.
Энергия
активации,
разность между значениями средней
энергии частиц (молекул, радикалов,
ионов и др.), вступающих в элементарный
акт химической реакции, и средней энергии
всех частиц, находящихся в реагирующей
системе. Для различных химических
реакций Э. а. изменяется в широких
пределах — от нескольких до ~ 10 дж./
моль. Для
одной и той же химической реакции
значение Э. а. зависит от вида функций
распределения молекул по энергиям их
поступательного движения и внутренним
степеням свободы (электронным,
колебательным, вращательным). Как
статистическую величину Э. а. следует
отличать от пороговой энергии, или
энергетического барьера, — минимальной
энергии, которой должна обладать одна
пара сталкивающихся частиц для протекания
данной элементарной реакции.
Аррениуса
уравнение,
температурная зависимость константы
скорости
к элементарной
хим. реакции:
где
A-предэкспоненциальныи множитель
(размерность совпадает с размерностью
к), Еа
-энергия
активации, обычно принимающая положит.
значения, Т-абс. температура, k-постоянная
Больцмана. Принято приводить Еа
в расчете не
на одну молекулу.
а на число частиц NA
= 6,02*1023
(постоянная Авогадро) и выражать в
кДж/моль; в этих случаях в уравнении
Аррениуса величину k
заменяют
газовой
постоянной
R. График
зависимости 1nк от 1/kT
(аррениусов
график) – прямая линия, отрицательный
наклон которой определяется энергией
активации
Еа
и
характеризует положит. температурную
зависимость к.
22
Скорость
химической реакции —
изменение количества одного из реагирующих
веществ за единицу времени в единице
реакционного пространства. Является
ключевым понятием химической
кинетики.
Скорость химической реакции —
величина всегда положительная, поэтому,
если она определяется по исходному
веществу (концентрация
которого убывает в процессе реакции),
то полученное значение домножается на
−1.
Например
для реакции:
выражение
для скорости будет выглядеть так:
.
Скорость
химической реакции в каждый момент
времени пропорциональна концентрациям
реагентов, возведенным в некоторые
степени.
Для
элементарных
реакций
показатель степени при значении
концентрации каждого вещества часто
равен его стехиометрическому коэффициенту,
для сложных реакций это правило не
соблюдается. Кроме концентрации на
скорость химической реакции оказывают
влияние следующие факторы:
-
природа
реагирующих веществ, -
наличие
катализатора, -
температура
(правило
Вант-Гоффа), -
давление,
-
площадь
поверхности реагирующих веществ.
Если
мы рассмотрим самую простую химическую
реакцию A + B → C, то мы заметим, что
мгновенная
скорость химической реакции величина
непостоянная.
Катализа́тор —
химическое
вещество,
ускоряющее
реакцию,
но не входящее в состав продуктов
реакции[1].
Количество катализатора, в отличие от
других реагентов, после реакции не
изменяется. Важно понимать, что катализатор
участвует в реакции. Обеспечивая более
быстрый путь для реакции, катализатор
реагирует с исходным веществом,
получившееся промежуточное соединение
подвергается превращениям и в конце
расщепляется на продукт и катализатор.
Затем катализатор снова реагирует с
исходным веществом, и этот каталитический
цикл многократно (до миллиона
раз)[источник?]
повторяется.
Катализаторы
подразделяются на гомогенные
и гетерогенные.
Гомогенный катализатор находится в
одной фазе
с реагирующими веществами, гетерогенный —
образует самостоятельную фазу, отделённую
границей раздела от фазы, в которой
находятся реагирующие вещества [1].
Типичными гомогенными катализаторами
являются кислоты и основания. В качестве
гетерогенных катализаторов применяются
металлы, их оксиды и сульфиды.
Реакции
одного и того же типа могут протекать
как с гомогенными, так и с гетерогенными
катализаторами. Так, наряду с растворами
кислот применяются имеющие кислотные
свойства твёрдые Al2O3,
TiO2,
ThO2,
алюмосиликаты, цеолиты. Гетерогенные
катализаторы с основными свойствами:
CaO, BaO, MgO [1].
Гетерогенные
катализаторы имеют, как правило, сильно
развитую поверхность, для чего их
распределяют на инертном носителе
(силикагель,
оксид
алюминия,
активированный
уголь
и др.).
Для
каждого типа реакций эффективны только
определённые катализаторы. Кроме уже
упомянутых кислотно-основных,
существуют катализаторы
окисления-восстановления;
для них характерно присутствие переходного
металла
или его соединения (Со+3,
V2O5+MoO3).
В этом случае катализ осуществляется
путём изменения степени окисления
переходного металла.
Много
реакций осуществлено при помощи
катализаторов, которые действуют через
координацию
реагентов у атома или иона переходного
металла (Ti,
Rh,
Ni).
Такой катализ называется координационным.
Если
катализатор обладает хиральными
свойствами, то из оптически неактивного
субстрата получается оптически активный
продукт.
В
современной науке и технике часто
применяют системы
из нескольких катализаторов,
каждый из которых ускоряет разные стадии
реакции [2][3].
Катализатор также может увеличивать
скорость одной из стадий каталитического
цикла, осуществляемого другим
катализатором. Здесь имеет место «катализ
катализа», или катализ
второго уровня
(Имянитов).
В
биохимических реакциях роль катализаторов
играют ферменты.
Катализаторы
следует отличать от инициаторов.
Например, перекиси
распадаются на свободные
радикалы,
которые могут инициировать радикальные
цепные
реакции.
Инициаторы расходуются в процессе
реакции, поэтому их нельзя считать
катализаторами.
Ингибиторы
иногда ошибочно считают отрицательными
катализаторами. Но ингибиторы, например,
цепных радикальных реакций, реагируют
со свободными радикалами и, в отличие
от катализаторов, не сохраняются. Другие
ингибиторы (каталитические яды)
связываются с катализатором и его
дезактивируют, здесь имеет место
подавление катализа, а не отрицательный
катализ. Отрицательный катализ в принципе
невозможен: он обеспечивал бы для реакции
более медленный путь, но реакция,
естественно, пойдёт по более быстрому,
в данном случае, не катализированному,
пути.
23
Диспе́рсная
систе́ма —
это образования
из двух или более числа
фаз (тел),
которые совершенно или практически не
смешиваются и не реагируют друг с другом
химически. Первое из веществ (дисперсная
фаза)
мелко распределено во втором (дисперсионная
среда).
Если фаз несколько, их можно отделить
друг от друга физическим способом
(центрифугировать, сепарировать и т. д.).
Обычно
дисперсные системы — это коллоидные
растворы,
золи.
К дисперсным системам относят также
случай твёрдой дисперсной среды, в
которой находится дисперсная фаза.
Наиболее
общая классификация дисперсных систем
основана на различии в агрегатном
состоянии дисперсионной
среды и дисперсной фазы. Сочетания трех
видов агрегатного состояния позволяют
выделить девять видов дисперсных систем.
Для краткости записи их принято обозначать
дробью, числитель которой указывает на
дисперсную фазу, а знаменатель на
дисперсионную среду, например для
системы «газ в жидкости» принято
обозначение Г/Ж.
-
Дисперсная
фазаДисперсионная
средаНазвание
и примерГазообразная
Газообразная
Дисперсная
система не образуетсяЖидкая
Газообразная
Аэрозоли:
туманы,
облакаТвёрдая
Газообразная
Аэрозоли
(пыли, дымы), порошкиГазообразная
Жидкая
Газовые
эмульсии и пеныЖидкая
Жидкая
Эмульсии:
нефть,
крем,
молокоТвёрдая
Жидкая
Суспензии
и золи: пульпа, ил,
взвесь,
пастаГазообразная
Твёрдая
Пористые
телаЖидкая
Твёрдая
Капиллярные
системы: жидкость в пористых телах,
грунт,
почваТвёрдая
Твёрдая
Твёрдые
гетерогенные системы: сплавы,
бетон,
ситаллы,
композиционные
материалы
Коллоидные
растворы. Коллоидное состояние характерно
для многих веществ, если их частицы
имеют размер от 1 до 500 нм. Легко показать,
что суммарная поверхность этих частиц
огромна. Если предположить, что частицы
имеют форму шара с диаметром 10 нм, то
при общем объеме этих частиц
1
см3
они будут иметь
площадь
поверхности порядка 10 м2. Как указывалось
ранее поверхностный слой характеризуется
поверхностной энергией и способностью
адсорбировать те или иные частицы, в
том числе ионы
из
раствора. Характерной особенностью
коллоидных частиц является наличие на
их поверхности заряда, обусловленного
избирательной адсорбцией ионов.
Коллоидная частица имеет сложное
строение. Она включает в себя ядро,
адсорбированные ионы, противоины и
растворитель. Существуют лиофильные
(гид.
роф
ильные) коллоиды, в которых растворитель
взаимодейстиует с ядрами частиц,
илнофобные (гидрофобные) коллоиды, в
которых растворитель не взаимодействует
с ядрами
частиц.
Растворитель входит в состав гидрофобных
частиц лишь как сольватная оболочка
адсорбированных ионов или при наличии
стабилизаторов (ПАВ), имеющих лиофобную
и лиофильные части.
Приведем
несколько примеров коллоидных частиц:
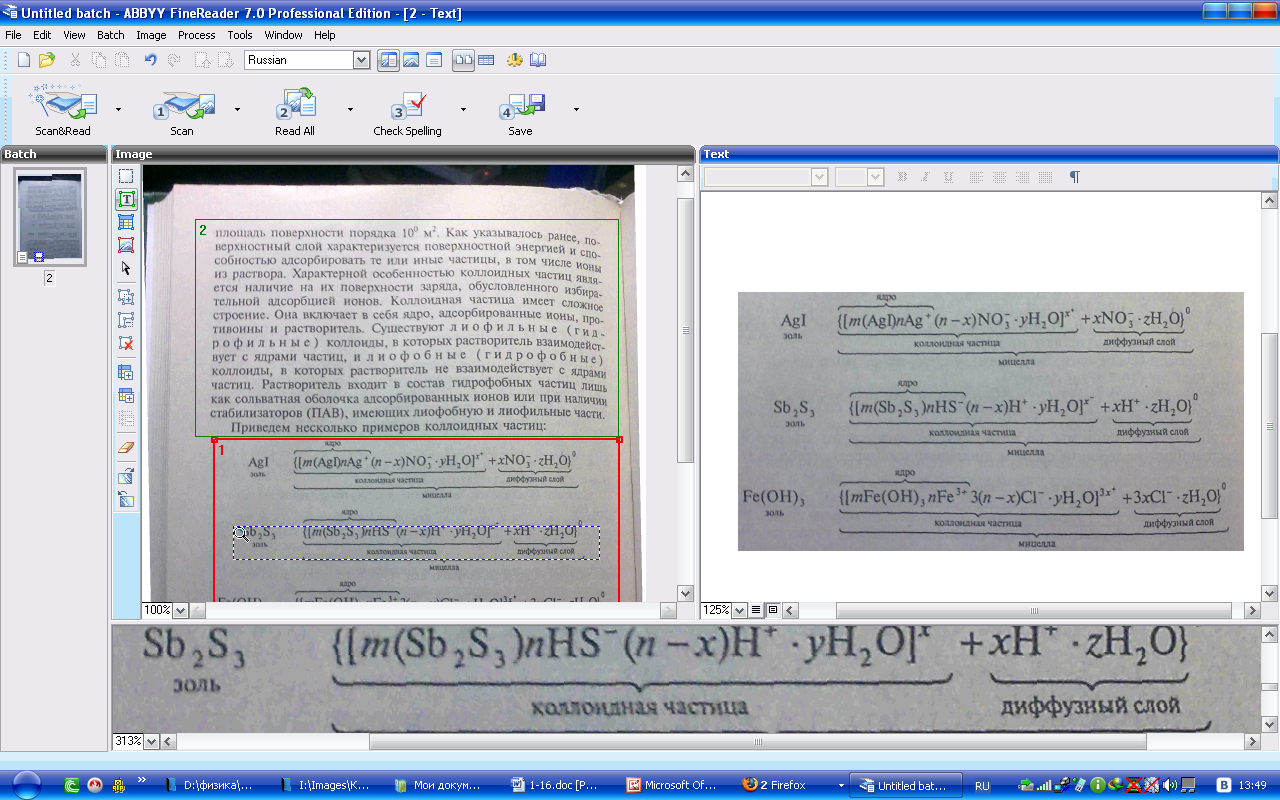
Как.
видно, ядро состоит из электронейтрального
агрегата частиц с адсорбированными
ионами элементов, входящих в состав
ядра (в данных примерах ионами Аg+,
НS-,
Fе3+).
Коллоидная час-шца кроме ядра имеет
противоионы и молекулы растворителя.
Адсорбированные ионы и противоионы
с растворителем образуют адсорбированный
слой. Суммарно заряд частицы равен
разности зарядов адсороированных
ионов и противоионов. Вокруг частиц
находится д и ф ф у з н ы й с л о и и о
н о в, заряд которых равен иряду коллоидной
частицы. Коллоидная частица и диффузный
слои образуют электронейтральную
мицеллу
Мицеллы (уменьшительное
от лат. mica —
частица, крупинка) — частицы в
коллоидных
системах,
состоят из нерастворимого в данной
среде ядра очень малого размера,
окруженного стабилизирующей оболочкой
адсорбированных
ионов
и молекул
растворителя.
Например, мицелла сульфида
мышьяка
имеет строение:
{(As2S3)m•nHS−•(n-x)H+}x-•хН+
Средний
размер мицелл от 10−5
до 10−7см.
Коагуляция
– разделение коллоидного раствора на
две фазы – растворитель и студнеобразную
массу, или загустевание раствора в
результате укрупнения частиц растворенного
вещества
Пептизация
— процесс перехода коллоидного осадка
или геля в коллоидный раствор под
действием жидкости или добавленных к
ней веществ, хорошо адсорбирующихся
осадком или гелем, называемых в этом
случае пептизаторами (например, пептизация
жиров под действием желчи).
Пептизация
— разъединение агрегатов частиц гелей
(студней) или рыхлых осадков под влиянием
определенных веществ — пептизаторов
после коагуляции коллоидных растворов.
В результате пептизации осадок (или
гель) переходит во взвешенное состояние.
24
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Растворимость,
способность вещества образовывать с
другим веществом (или веществами)
гомогенные смеси с дисперсным
распределением компонентов (см. Растворы).
Обычно растворителем
считают вещество, которое в чистом виде
существует в том же агрегатном состоянии,
что и образовавшийся раствор. Если до
растворения
оба вещества находились в одном и том
же агрегатном состоянии, растворителем
считается вещество, присутствующее в
смеси в существенно большем кол-ве.
Растворимость
определяется физическим и химическим
сродством молекул
растворителя и растворяемого вещества,
соотношением энергий взаимодействием
однородных и разнородных компонентов
раствора. Как правило, хорошо растворимы
друг в друге подобные по физ. и хим.
свойствам вещества (эмпирич. правило
“подобное растворяется в подобном”).
В частности, вещества, состоящие из
полярных
молекул,
и вещества с ионным типом связи хорошо
раств. в полярных растворителях (воде,
этаноле,
жидком аммиаке), а неполярные вещества
хорошо раств. в неполярных растворителях
(бензоле, сероуглероде).
Согласно
теории, предложенной Дж. Гильдебрандом
(1935), взаимная растворимость неэлектролитов
возрастает с уменьшением разности их
параметров растворимости
d=(Е/V)1/2,
где Е-теплота испарения,
V-полярный объем. Параметр растворимости
– одно из осн. понятий, определяющих
когезионные свойства веществ в конденсир.
состояниях; важная технол. характеристика
полимеров
и растворителей, лакокрасочных
материалов
и т.п. (см. Когезия). Р. мн. электролитов
возрастает пропорционально кубу
диэлектрич. проницаемости растворителя.
Обычно более растворимы электролиты
с большей склонностью к сольватации
растворителем; образование кристаллогидратов
обычно увеличивает растворимость солей.
Растворимость
данного вещества зависит от температуры
и давления
соответствует общему принципу смещения
равновесий (см. Ле Шателье-Брауна
принцип). Концентрация
насыщенного раствора при данных условиях
численно определяет Р. вещества в данном
растворителе и также наз. растворимостью.
Пересыщенные растворы содержат большее
кол-во растворенного вещества, чем это
соответствует его растворимости,
существование пересыщенных растворов
обусловлено кинетич. затруднениями
кристаллизации
(см. Зарождение новой фазы). Для
характеристики растворимости
малорастворимых веществ используют
произведение
активностей
ПА (для растворов, близких по своим
свойствам к идеальному – произведение
растворимости ПР).
Способы
выражения концентрации растворов.
1)
Массовая доля раствора ω (х). Выражается
отношением массы растворенного вещества
m(х) к массе раствора.
Является
величиной безразмерной или выражается
в процентах:
Например,
15%-ный раствор: массовая доля ω (х) = 0,15
2)
Молярная концентрация раствора С(х).
Выражается отношением количества
растворенного вещества n(x) к объему
раствора, выраженному в литрах.
Т.к.
количество вещества n(x) выражается
отношением массы вещества m(x) к его
молярной массе M(x), то молярную концентрацию
раствора удобно выразить как
25
РАСТВОРЫ,
однофазные
системы, состоящие из двух или более
компонентов. По своему агрегатному
состоянию растворы могут быть твердыми,
жидкими или газообразными.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
01.05.2015354.02 Кб230725259_F7873_baranenko_a_v_holodilnye_mashiny.pdf
- #
- #
- #
- #
01.05.20156.82 Mб301.doc
- #
- #
- #
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру. Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается.
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10оС.
Правило Вант-Гоффа звучит так: повышение температуры на 10оС приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ. Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например, для реакции образования аммиака:
N2 + 3H2 ↔ 2NH3
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления. При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается.
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
CaCO3 + SiO2 ↔ CaSiO3 + CO2↑
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором.
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
N2 + 3H2 ↔ 2NH3
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например, для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности. Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например, при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например, хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например, оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
493
Создан на
11 января, 2022 От Admin
Скорость химических реакций
Тренажер задания 18 ЕГЭ по химии
1 / 10
Из предложенного перечня выберите уравнения всех реакций, на скорость которых оказывает влияние измельчение простого вещества, участвующего в этой реакции.
1) Fe(тв.) + S(тв.) = FeS(тв.)
2) C(тв.) + O2(г) = CO2(г)
3) 3Br2(p-p) + 6KOH(p-p) = 5KBr(p-p) + KBrO3(p-p) + 3H2O(ж)
4) 4Mg(тв.) + 10HNO3(p-p) = 4Mg(NO3)2(p-p) + NH4NO3(p-p) + 3H2O(ж)
5) 2AgNO3(тв.) = 2Ag(тв.) + 2NO2(г) + O2(г)
2 / 10
Из предложенного перечня выберите два уравнения реакций, скорость которых увеличится при повышении давления.
1) H2(г) + S(тв.) = H2S(г)
2) CO(г) + 2H2(г) = CH3OH(r)
3) Fe(тв.) + H2SO4(p-p) = FeSO4(p-p) + H2(г)
4) CaCO3(тв.) + 2HCl(p-p) = CaCl2(p-p) + CO2(r) + H2O(ж)
5) PCl3(тв.) + 3H2O(ж) = H3PO3(p-p) + 3HCl(p-p)
Запишите в поле ответа номера выбранных реакций.
3 / 10
Из предложенного перечня выберите все внешние воздействия, которые оказывают влияние на скорость реакции оксида углерода(II) с водородом.
1) понижение давления
2) понижение температуры
3) увеличение концентрации воды
4) увеличение концентрации Н2
5) использование катализатора
Запишите номера выбранных ответов.
4 / 10
Из предложенного перечня выберите все внешние воздействия, которые приводят к увеличению скорости реакции хлора с водородом.
1) понижение давления
2) понижение температуры
3) увеличение концентрации Сl2
4) увеличение концентрации Н2
5) введение в систему хлороводорода
Запишите номера выбранных ответов.
5 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к увеличению скорости реакции:
C(тв.) + O2(г) = CO2(г)
1) повышение давления в системе
2) понижение температуры
3) понижение давления в системе
4) измельчение углерода
5) уменьшение концентрации кислорода
Запишите в поле ответа номера выбранных внешних воздействий.
6 / 10
Из предложенного перечня выберите все способы увеличить скорость пиролиза октана в газовой фазе
1) увеличение объёма реактора
2) увеличение концентрации октана
3) увеличение общего давления в системе
4) нагревание
5) уменьшение концентрации водорода
7 / 10
Из предложенного перечня выберите вое внешние воздействия, которые способствуют уменьшению скорости следующей химической реакции:
2NH3(г) = N2(г) + 3H2(г)
1) уменьшение концентрации аммиака
2) увеличение давления
3) увеличение температуры
4) добавление катализатора
5) уменьшение температуры
Запишите номера выбранных ответов.
8 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости химической реакции между цинком и раствором хлорида меди(II).
1) повышение давления в системе
2) понижение давления в системе
3) увеличение концентрации хлорида меди(II)
4) добавление воды
5) измельчение цинка
Запишите в поле ответа номера выбранных факторов
9 / 10
Из предложенного перечня выберите два фактора, которые приводят к увеличению скорости реакции, которую описывает сокращённое ионное уравнение:
CuO(тв) + 2Н+(р-р) = Cu2+(р-р) + H2O(ж)
1) повышение давления в системе
2) понижение давления в системе
3) повышение температуры
4) добавление воды
5) измельчение оксида меди(II)
Запишите в поле ответа номера выбранных факторов.
10 / 10
Из предложенного перечня выберите два внешних воздействия, которые приводят к уменьшению скорости реакции этилена с водородом.
1) понижение температуры
2) увеличение концентрации этилена
3) использование катализатора
4) уменьшение концентрации водорода
5) повышение давления в системе
Запишите номера выбранных ответов.
Ваша оценка
The average score is 39%





![{displaystyle operatorname {rho } (T)=rho _{0}left[1+alpha _{0}left(T-T_{0}right)right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6592d9ec18d3c1c33ee3448336a1565d9e83754)
![{displaystyle alpha _{0}={frac {1}{rho _{0}}}left[{frac {delta rho }{delta T}}right]_{T=T_{0}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/83381dbf76253a0bb27a4650c45381c6d49ef947)












