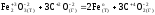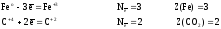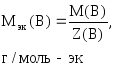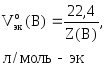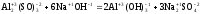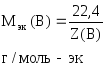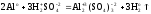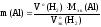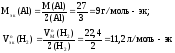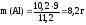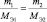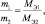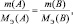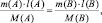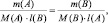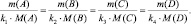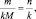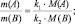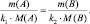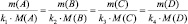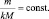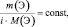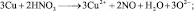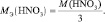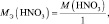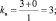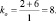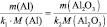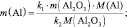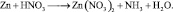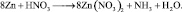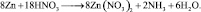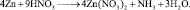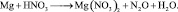Обозначение
nэк(В),
единицы измерения моль-эк.
Если известна масса вещества и молярная
масса эквивалентов, то количество
вещества эквивалентов рассчитывают по
формуле:
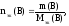
где
m(В)
– масса вещества, г;
Мэк(В)
– молярная масса эквивалентов вещества,
г/моль-эк.
Для
газообразных веществ можно рассчитать
nэк(В),
зная объем газа, который он имеет при
н.у.:
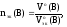
где
Vo(В)
– объем газа при н.у., л;
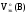
объем эквивалентов газа при н.у., л/моль-эк
Между
количеством вещества эквивалентов
nэк(В)
и количеством вещества n(В)
существует простая зависимость :
nэк(В)
= n(В)
· Z(В)
(23)
Пример.
Рассчитать Z(В),
Мэк(В) всех веществ, принимающих участие
в реакциях а) и б), а так же
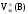
а)
Fe2O3
(т)
+ 3CO(г)
= 2Fe(т)
+ 3CO2(г)
б)
Al2(SO4)3
+ 6NaOH = 2Al(OH)3
+ 3Na2SO4
Решение.
Прежде всего необходимо определить к
какому типу реакций (обменная или
окислительно – восстановительная)
относится данная реакция, для чего
рассчитывают степени окисления атомов
или групп атомов в формульных единицах
всех веществ.
Реакция
а)
является
окислительно-восстановительной.
Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
а)
для реагентов
б)
для продуктов
Расчеты
всех величин приведены в таблице 5.
Таблица
5
|
ФЕ |
|
Z(B) |
M(B), |
|
|
|
Fe2O3 |
6 |
6 |
160,0 |
26,7 |
– |
|
CO |
2 |
2 |
28,0 |
14,0 |
11,2 |
|
Fe |
3 |
3 |
56,0 |
18,7 |
– |
|
CO2 |
2 |
2 |
44,0 |
22,0 |
11,2 |
Реакция
б)
является
обменной, т.к. степени окисления атомов
и групп атомов в ходе реакции не
изменяются. Далее необходимо выбрать
те части формульных единиц (положительно
или отрицательно заряженных) по которым
будет производится расчет суммарного
заряда замещающихся ионов, а далее –
Z(B)
и Мэк(В). Расчеты приведены в таблице 6.
Таблица
6.
|
ФЕ |
Замещаю- щиеся ионы |
qi |
Ni |
Z(В)= |
М(В), г/моль |
|
|
Al2(SO4)3 |
SO4–2 |
–2 |
3 |
3·2=6 |
342,0 |
57,0 |
|
NaOH |
Na+ |
+1 |
1 |
1·1=1 |
40,0 |
40,0 |
|
Al(OH)3 |
OH– |
–1 |
3 |
3·1=3 |
78,0 |
26,0 |
|
Na2SO4 |
Na+ |
+1 |
2 |
2·1=2 |
142,0 |
71,0 |
6. Закон эквивалентов.
Согласно
закону эквивалентов все
вещества реагируют и образуются в
эквивалентных количествах.
Например,
для реакции
2CO
+ O2
= 2CO2
(24)
nэк(CO)
= nэк(O2)=nэк(CO2)
(25)
Для
реакции в общем виде:
nAA
+ nBB
= nCC
+ nDD
, (26)
где
A,B
– реагенты;
C,D
– продукты реакции;
nA,nB,nC,nD
– стехиометрические коэффициенты,
закон
эквивалентов
имеет вид:
nэк(A)
= nэк(B)
= nэк(C)
= nэк(D)
(27)
Т.е.
количество вещества эквивалентов всех
участвующих в реакции (26) веществ
(реагентов А и В и образовавшихся
продуктов C
и D)
одинаковы. Поэтому, если количество
вещества эквивалентов одного из веществ
(реагента или продукта) известно по
условию задачи, то определены и nэк
всех остальных веществ, участвующих в
реакции, и необходимость их расчета
отпадает. В этом состоит преимущество
проведения расчетов по закону эквивалентов.
Для
любой химической реакции (см. уравнение
реакции в общем виде (26)) соблюдается
условие (27), которое также может быть
представлено следующим образом:
n(А)
· Z(A)=
n(В)
· Z(B)=
n(С)
· Z(C)=
n(D)
· Z(D)
(28)
Условие
(28) упрощает определение эквивалентного
числа в сложных реакциях.
Пример.
Определить Z(Cr2(SO4)3)
в обменной реакции, выраженной уравнением
Cr2(SO4)3
+ 12KOH = 2K3[Cr(OH)6]
+ 3K2SO4
Решение.
Для приведенной реакции запишем условие
(28):
n(
Cr2(SO4)3)
· Z(Cr2(SO4)3)=
n(
KOH) · Z(KOH)
Из
уравнения реакции:
n(
Cr2(SO4)3)
= 1 n(KOH)
= 12
Поскольку
Z(KOH)
= 1 (не может быть другим, см. табл. 2), то
Если
известны массы веществ, участвующих в
реакции, то используя уравнения (21) и
(27) можно записать:
(29)
или
(30)
Уравнение
(30) является математическим выражением
закона эквивалентов.
Если
одно из веществ уравнения (26), например
B,
находится в газообразном состоянии и
известен его объем при н.у., то количество
вещества эквивалентов этого газа можно
рассчитать по уравнению (22), а математическая
запись закона эквивалентов для веществ
A
и B
будет иметь вид:
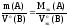
Пример.
Рассчитать массу алюминия, вступившего
в реакцию с разбавленной серной кислотой,
если в результате реакции образуется
10,2 л водорода (н.у.).
Решение.
Запишем уравнение реакции и укажем
степени окисления атомов и заряды ионов:
Реакция
окислительно-восстановительная. Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
Alo
–
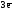
Al+3 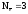
H2o
–
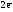
2H+1 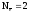
= 2
Согласно
закону эквивалентов:
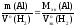
Отсюда
выражаем массу алюмиия:
Рассчитаем
Мэк(Al)
и
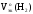
Подставив
полученные значения Мэк(Al)
и
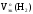
а так жеVo(H2),
рассчитаем массу алюминия:
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции 



Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число молей вещества, эквивалентное одному молю катионов водорода в рассматриваемой реакции.
Эквивалентная масса[править | править код]
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества[править | править код]
Молярная масса эквивалентов обычно обозначается как 

Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества:
Фактор эквивалентности[править | править код]
Отношение эквивалентной молярной массы к собственной молярной массе вещества называется фактором эквивалентности (обозначается обычно как 
Число эквивалентности[править | править код]
Число эквивалентности 


Например, в реакции
эквивалентом является мнимая частица 



| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |

|
число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |

|
характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
*Для инертных газов 
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Закон эквивалентов[править | править код]
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ IUPAC Gold Book internet edition: «equivalent entity».
- ↑ International Union of Pure and Applied Chemistry (1998). Compendium of Analytical Nomenclature (definitive rules 1997, 3rd. ed.). Oxford: Blackwell Science. ISBN 0-86542-6155. section 6.3.
Литература[править | править код]
- Кремлёв А. М. Эквиваленты химические // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
§ 2.1.3. Закон эквивалентов. Закон приведённого количества вещества
Закон эквивалентов гласит:
Вещества взаимодействуют друг с другом равными количествами молярных масс эквивалентов:
nЭ1 = nЭ2,
где nЭ1 – количество молярных масс эквивалента одного вещества; nЭ2 – количество молярных масс эквивалента другого вещества, взаимодействующего с первым. Действительно, если рассчитать количества молярных масс эквивалентов взаимодействующих веществ для любой из рассмотренных выше реакций, то они окажутся равными.
Последнее равенство можно представить иначе:
или
где m1 и m2 – массы реагирующих веществ; МЭ1 и МЭ2 – молярные массы их эквивалентов.
Все три последние равенства являются математическими формами записи закона эквивалентов.
Согласно закону эквивалентов для реакции:
k1А + k2B = k3C + k4D
должно выполняться
где m(A) и m(B) массы веществ А и В соответственно, МЭ(А) и МЭ(B) – молярные массы их эквивалентов. Или в соответствии с (2):
где M(A) и M(B) молярные массы веществ А и В, l(A) и l(B) количества активных связей в молекулах А и В соответственно.
После простейшего преобразования можно легко получить:
поскольку, в данном случае l(B) = k1; l(A) = k2, то:
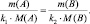
Так как последнее равенство справедливо для любой пары участвующих в реакции веществ (исходных и продуктов), то можно утверждать, что
То есть, в пределах любой одной и той же химической реакции
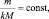
где 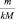
где n – количество вещества.
Приведённым количеством вещества называется отношение количества вещества к его стехиометрическому коэффициенту.
Равенства (2.3) и (2.4) представляют собой математические формы записи закона приведённого количества вещества, согласно которому
приведённые количества веществ участвующих в реакции (исходных и продуктов) равны между собой.
Закон приведённого количества вещества вытекает также из простого анализа привычных пропорций:
k1А + k2B = k3C + k4D;
В общем случае
или
Согласно следствию закона приведённого количества вещества
приведённые количества элементов одного и того же сложного вещества равны между собой
где m(Э) – масса или процентное содержание одного из элементов в данной навеске вещества; М(Э) – молярная масса этого элемента; i – индекс этого элемента в данном веществе, величина 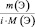
Иногда, в одной и той же реакции вещество может проявлять различные молярные массы эквивалента, что может некорректно восприниматься как нарушение закона эквивалентов. Например, при реакции разбавленной азотной кислоты с медью:
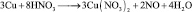
из восьми молекул азотной кислоты 2 молекулы являются окислителями, превращаясь в NO, а 6 молекул участвуют в процессе, не сопровождающемся изменением степени окисления. То есть, вся реакция делится на два взаимодействия:
Хотя, реально частица O2– не существует, однако, из приведённой схемы видно, что в первом взаимодействии.
А во втором взаимодействии
при этом, в обоих случаях закон эквивалентов выполняется – количества молярных масс эквивалентов всех взаимодействующих веществ и частиц равны шести.
При составлении уравнений окислительно-восстановительных реакций, стехиометрические коэффициенты перед восстановителем (kв), отдающим nв электронов, и перед окислителем (kо), принимающим nо электронов, можно рассчитывать с помощью следующих формул:
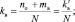
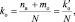
где mв – количество молекул восстановителя, не участвующих в восстановлении; mo – количество молекул окислителя, не принимающих участия в окислении; N – максимальное число, которому кратны все коэффициенты уравнения. Например, для реакции (2.5)
nо = 3; nв = 2; mo = 6; mв = 0; N = 1,
поэтому
Примеры решения задач
1. Пользуясь, следствиями закона эквивалентов, определить массу алюминия, израсходованного на получение 5,1 г оксида алюминия, если молярная масса алюминия 27 г/моль, молярная масса оксида алюминия 102 г/моль.
Прежде, чем приступить к решению подобной задачи целесообразно записать уравнение реакции
4Al + 3O2 = 2Al2O3.
|
Дано: m(Al2O3) = 5,1 г M(Al) = 27 г/моль М(Al2O3) = 102 г/моль k1 = 4 моль k2 = 2 моль |
Решение: Согласно следствию закона эквивалентов: или |
|
m(Al) – ? |
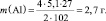
Ответ: m(Al) = 2,7 г.
2. Пользуясь равенствами 2.6 и 2.7 расставить коэффициенты в схеме реакции взаимодействия цинка с очень разбавленной азотной кислотой:
Решение
В данной реакции окислителем является азотная кислота, в которой атом азота принимает 8 электронов, то есть nо = 8. Поскольку mв = 0, то 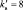
Из последней схемы видно, что mo = 16; nв = 2. Следовательно 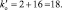
Все коэффициенты можно сократить на 2, то есть в данном случае N = 2. Поэтому, окончательно kв = 4; kо = 9
Задачи для самостоятельного решения
1. Пользуясь законом приведённого количества вещества, определить массу сульфита натрия, необходимую для полного превращения 0,2 моль перманганата калия в сульфат марганца по реакции:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O. (2.8)
Сколько грамм воды выделится в результате этой реакции?
2. Определить массу бихромата калия, необходимую для полного превращения 49,8 г. иодида калия в йод по реакции:
K2Cr2O7 + 7H2SO4 + 6KI = Cr2(SO4)3 + 4K2SO4 + 3I2 + 7H2O. (2.9)
Сколько грамм йода образуется в результате этой реакции?
Решить задачу двумя способами – пользуясь пропорциями и пользуясь законом приведёного количества вещества.
3. Пользуясь законом приведённого количества вещества, определить химическую формулу оксида меди, если в нём содержится 89 массовых процента меди, и 11 массовых процента кислорода.
4. Пользуясь равенствами (2.6) и (2.7) расставить коэффициенты в схеме реакции:
1. Сформулируйте закон эквивалентов и закон приведённого количества вещества.
2. Что такое приведённое количество вещества?
3. Выведите закон приведённого количества вещества из закона эквивалентов.