Массы атомов и молекул очень малы, и
использовать для численного выражения
их величин общепринятую единицу
измерения – килограмм –
неудобно. Поэтому для выражения масс
атомов и молекул используют другую
единицу измерения – атомную
единицу массы (а. е. м.).
Атомная единица массы (а. е. м.) –
единица измерения масс атомов, молекул
и элементарных частиц.
За атомную единицу массы принята 1 / 12
массы нуклида углерода 12C.
Масса этого нуклида в единицах СИ равна
1,9927 10–26 кг.
1 а. е. м. =
mc =
= 1,6606 10–27 кг.
Относительная атомная масса
(устаревший термин – атомный
вес) – масса атома, выраженная
в атомных единицах массы (а. е. м.).
Обозначается Ar .
Большинство
природных химических элементов
представляют собой смесь изотопов.
Поэтому за относительную атомную массу
элемента принимают среднее значение
относительной атомной массы природной
смеси его изотопов с учетом их содержания
в земных условиях. Именно эти значения
и приведены в Периодической системе.
Например, кислород имеет три изотопа
16O, 17O
и 18O, их атомные
массы и содержание в природной смеси
приведены в таблице 3.
Таблица 3
Изотопный
состав кислорода в природной смеси
|
Изотоп |
Содержание в % |
Атомная масса |
|
16O |
99,759 |
15,995 |
|
17O |
0,037 |
16,999 |
|
18O |
0,204 |
17,999 |
Среднее значение атомной массы с учетом
вклада каждого изотопа вычисляется по
следующей формуле:
Ar =
,
где Ar, j –
атомные массы соответствующих изотопов,
ni –
содержание их в природной смеси (в
мольных долях). Подставляя в эту формулу
соответствующие значения из таблицы
3 для атомной массы кислорода, получим:
Ar = 15,995 0,99759 + 16,999 0,00037 + 17,999 0,0024 =
= 15,999 а. е. м.
Обратите внимание на то, что атомная
масса и массовое число –
совершенно различные понятия: первое –
масса атома, выраженная в а. е. м.,
а второе – число нуклонов в
ядре. Атомная масса – дробная
величина (имеет целое значение только
для изотопа 12C), в
отличие от массового числа, которое
является всегда целым.
Численно эти величины очень близки;
например, для водорода атомная масса
равна 1,0078, а массовое число равно 1, для
гелия атомная масса равна 4,0026, а массовое
число – 4.
Относительные атомные массы имеют
дробные значения по следующим причинам:
1) большинство элементов, существующих
в природе, представляют смесь нескольких
изотопов, и в Периодической системе
указывается среднее значение относительной
атомной массы смеси природного изотопного
состава.
2) для моноизотопных элементов (например,
23Na) это значение
будет также дробным, т. к. масса
нуклонов, выраженная в а. е. м.,
не является целым числом (см. табл. 3)
и при образовании ядра часть массы
нуклонов переходит в энергию, в
соответствии с уравнением Eсвязи = m c2,
где c = 3 108 м/с –
скорость света в вакууме.
При образовании любой связи всегда
выделяется энергия, на что и расходуется
часть массы связывающихся частиц. В
случае образования химических связей
эта величина очень мала, поэтому
изменением массы здесь пренебрегают
и считают, что масса образовавшейся
частицы равна сумме масс частиц,
участвующих в ее образовании. При
образовании же ядра выделяется очень
большая энергия, и «дефект массы» хорошо
заметен.
Молекулярная масса –
масса молекулы, выраженная в а. е. м.
Масса молекулы практически равна сумме
относительных атомных масс входящих
в нее атомов.
Если же вещество состоит не из молекул,
а, например, из ионов (NaCl),
или является олигомером [(H2O)n],
то относительную молекулярную массу
указывают для формульной единицы
вещества. Под формульной единицей
вещества следует понимать химический
состав наименьшего количества данного
вещества.
Моль – единица измерения
количества вещества. Обозначается .
1 моль –
это такое количество вещества, в котором
содержится столько же структурных
единиц (атомов, молекул, ионов, радикалов),
сколько атомов содержится в 0,012 кг
изотопа углерода 12C,
а именно –
NA = 6,022 1023 моль–1 –
число Авогадро.
Молярная масса вещества (М)
равна отношению массы этого вещества
(m) к его количеству ():
M =
.
Прежнее определение: масса одного моля
вещества, численно равна его
молекулярной массе, но выражается в
единицах г/моль. Возможно, оно, на первых
порах, облегчит решение расчетных
задач.
Обратите внимание на различие в понятиях:
«молярная масса» и «молекулярная
масса», похожих по звучанию, но относящихся
к разному числу объектов: первое –
это масса одного моля вещества (т. е.
масса 6,022 1023
молекул), а второе – масса
одной молекулы, и выражены они в разных
единицах – г/моль и а. е. м.
соответственно.
Понятие «количество вещества» и,
соответственно, единица его измерения –
моль используются в большинстве
химических расчетов. Эта величина
однозначно связана с массой, числом
структурных единиц и объемом (если это
газ или пары) вещества. Если задано
количество вещества, то эти величины
легко рассчитать.
|
N = NA |
m = M |
|||
|
|
|
|||
|
|
||||
|
|
||||
|
|
Массовая доля вещества A
в системе – отношение его
массы к массе всей системы (часто эту
величину выражают в %):
A =
100%
Все задачи, связанные с расчетами по
массовым долям, следует решать, используя
эту формулу. Чтобы избежать досадных
технических ошибок, рекомендуем при
проведении расчетов сразу же % перевести
в доли.
Объемная доля компонента –
отношение объема компонента к объему
всей системы:
Мольная доля компонента –
отношение количества вещества (моль)
компонента A к общему
количеству молей всех компонентов
системы:
Закон сохранения энергии –
энергия не возникает из ничего и не
исчезает бесследно, но отдельные ее
виды могут переходить друг в друга по
строго определенным эквивалентным
соотношениям.
Так, если энергия химических связей в
продуктах реакции больше, чем в реагентах,
то освобожденная энергия выделяется
в виде тепла, света, либо за счет нее
произойдет работа (например, взрыв или
движение поршня).
Закон сохранения массы (М. В. Ломоносов,
1748 г.) – масса всех
веществ, вступивших в реакцию, равна
массе всех продуктов реакции.
С точки зрения атомно-молекулярного
учения закон сохранения массы объясняется
так: в результате химических реакций
атомы не исчезают и не возникают, а
происходит их перегруппировка.
Так как число атомов
до реакции и после остается
неизменным, то их общая масса также не
изменяется.
На основании этого закона проводятся
все расчеты по уравнениям химических
реакций.
Закон постоянства состава (Пруст,
1806 г.) – каждое
химическое соединение имеет вполне
определенный и постоянный состав.
Как следствие из этого закона вытекает,
что состав химического соединения не
зависит от способа его получения.
Вещества, состав которых подчиняется
этому закону, получили название
дальтониды. Вещества, состав которых
зависит от способа получения, называются
бертоллидами (например, оксиды
переходных металлов).
Закон кратных отношений (Дальтон) –
если два элемента образуют между
собой несколько соединений, то массовые
количества одного элемента, соединяющиеся
с одним и тем же массовым количеством
другого, относятся между собой как
небольшие целые числа.
Закон Авогадро (1811 г.) –
в равных объемах различных идеальных
газов при одинаковых условиях (температуре
и давлении) содержится одинаковое число
молекул.
Следствия из закона Авогадро
1. 1 моль
любого идеального газа при одинаковых
условиях (температуре и давлении)
занимает один и тот же объем.
При нормальных условиях (н. у.):
‑ t = 0C
(T = 273 K)
‑ p = 101325 Па = 101,325 кПа = 1 атм = 760 мм
рт. ст.
‑ молярный объем любого идеального
газа равен 22,4 л/моль
(22,4 10–2 м3).
2.
Плотности идеальных газов при одинаковых
условиях (температуре и давлении) прямо
пропорциональны их молярным массам:
=
=
= const M,
т. к. из закона
Авогадро следует, что при одинаковых
условиях ( p
и t) для любых идеальных газов
отношение / V = const.
Для газов вводят понятие относительной
плотности одного газа по другому.
DA(X) –
относительная плотность газа Х по газу
А:
DA(X) =
=
при рX = рA
и tX = tA.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Урок 14. Расчеты по уравнениям химических реакций
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
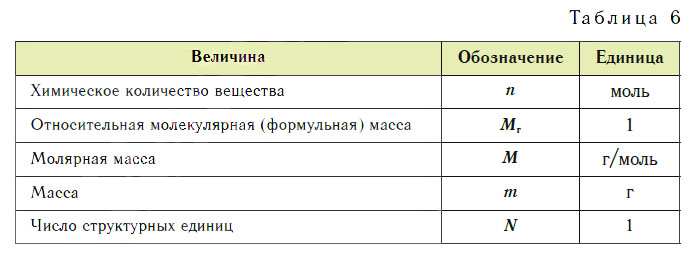
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо масс о й 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Инструктивная карта к уроку: “Количественные отношения в химии. Расчеты по химическим уравнениям” (занятие 3)
план-конспект урока по химии (8 класс) по теме
Материал предназначен для использования на уроках химии или на дополнительных занятиях (индивидуальных консультациях). Позволяет учащимся освоить тему: “Количественные отношения в химии” и научиться решать задачи по химическим уравнениям. Это первое занятие в цикле. Для каждого занятия разработана своя инструкционная карта на формирование умения решать определенный тип задач.
Скачать:
| Вложение | Размер |
|---|---|
| kopiya_urok_himii_3.doc | 34 КБ |
Предварительный просмотр:
Задачи для проверки материала прошлого урока
- Вычислите объем кислорода, требующегося для горения 13,5 г алюминия в кислороде, если процесс протекает по схеме: …Al + …O 2 = Al 2 O 3.
- По уравнению реакции 4Cu + O 2 = 2Cu 2 O вычислите объем кислорода, необходимого для реакции с медью массой 16 г.
Количественные соотношения в химии.
Расчеты по уравнению реакции
Итак, мы разобрали с Вами задачи, решение которых отвечает следующим схемам:
1) m(вещества 1) → n (вещества 1) → n (вещества 2) → m (вещества 2)
2) m(вещества 1) → n (вещества 1) → n (вещества 2) → V (вещества 2)
Если по условию задачи известен объем, а не масса, то мы также можем рассчитать количество. Тогда и схемы несколько изменятся:
V(вещества 1) → n (вещества 1) → n (вещества 2) → V (вещества 2)
Есть и ещё один вариант, когда нужно рассчитать массу вещества по известному объему:
V(вещества 1) → n (вещества 1) → n (вещества 2) → m (вещества 2)
Как решать задачи по химии. Расчет по уравнениям химических реакций.
Как решать задачи по химии? Как проводить простейшие расчеты по уравнениям химических реакций? Сколько выделяется газа, образуется воды, выпадает осадка или сколько получается конечного продукта реакций? Сейчас мы постараемся разобрать все нюансы и ответить на эти вопросы, которые очень часто возникают при изучении химии.
Решение задач в химии является неотъемлемой частью в изучении этой сложной, но очень интересной науки.
Алгоритм решения задач по химии
- Прочитать условия задачи (если они есть). Да, об этом все знают — как же решить задачу без условий — но все же, для полноты инструкции, мы не могли не указать этот пункт.
- Записать данные задачи. На этом пункте мы не будем заострять внимание, так как требования различных учебных заведений, учителей и преподавателей могут значительно отличаться.
- Записать уравнение реакции. Теперь начинается самое интересное! Здесь нужно быть внимательным! Обязательно необходимо верно расставить коэффициенты перед формулами веществ. Если вы забудете это сделать, то все наши усилия буду напрасны.
- Провести соответствующие расчеты по химическому уравнению. Далее рассмотрим, как же сделать эти самые расчеты.
Для этого у нас есть два пути, как решить задачу по химии. Условно, назовем их правильным (используя понятия количества вещества) и неправильным (используя пропорции). Конечно же, мы бы рекомендовали решать задачи правильным путем. Так как у неправильного пути имеется очень много противников. Как правило, учителя считают, что ученики, решающие задачи через пропорции, не понимают самой сути протекания процессов химических реакций и решают задачи просто математически.
Расчет по уравнениям химических реакций с использованием понятия количества вещества
Суть данного метода, состоит в том, что вещества реагируют друг с другом в строгом соотношении. И уравнение реакции, которое мы записали ранее, дает нам это соотношение. Коэффициенты перед формулами веществ дают нам нужные данные для расчетов.
Для примера, запишем простую реакцию нейтрализации серной кислоты и гидроксида натрия.
H_<2>SO_ <4>+ NaOH → Na_<2>SO_ <4>+ H_<2>O
H_<2>SO_ <4>+ 2NaOH → Na_<2>SO_ <4>+ 2H_<2>O
Исходя из этого уравнения, мы видим, что одна молекула серной кислоты взаимодействует с двумя молекулами гидроксида натрия. И в результате этой реакции получается одна молекула сульфата натрия и две молекулы воды.
Сейчас мы немного отступим от разбора задач, чтобы познакомиться с основными понятиями, которые пригодятся нам в решении задач по химии.
Рассчитывать количество молекул, например в 98 граммах серной кислоты — это не самое удобное занятие. Числа будут получаться огромными ( ≈ 6,022140857⋅10 23 молекул в 98 граммах серной кислоты) . Для этого в химии ввели понятие количества вещества (моль) и молярная масса.
1 Моль (единица измерения количества вещества) — это такое количество атомов, молекул или каких либо еще структурных единиц, которое содержится в 12 граммах изотопа углерода-12. Позднее выяснилось, что в 12 граммах вещества углерод-12 содержится 6,022140857⋅10 23 атомов. Соответственно, можно сказать, что 1 моль, это такая масса вещества, в которой содержится 6,022140857⋅10 23 атомов (или молекул) этого вещества.
Но ведь молекулы и атомы имеют различный состав и различное строение. Разные атомы содержат разное количество протонов и нейтронов. Соответственно 1 моль для разных веществ будет иметь разную массу, имея при это одинаковое количество молекул ( атомов). Эта масса называется молярной.
Молярная масса — это масса 1 моля вещества.
Используя данные понятия, можно сказать, что 1 моль серной кислоты реагирует с 2 молями гидроксида натрия, и в результате получается 1 моль сульфата натрия и 2 моль воды. Давайте запишем эти данные под уравнением реакции для наглядности.
beginH_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль end
Следом запишем молярные массы для этих веществ
begin H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Теперь, зная массу одного из веществ, мы можем рассчитать, сколько нам необходимо второго вещества для полного протекания реакции, и сколько образуется конечных продуктов.
Для примера, решим по этому же уравнению несколько задач.
Задача. Сколько грамм гидроксида натрия (NaOH) необходимо для того, чтобы 49 грамм серной кислоты (H2SO4) прореагировало полностью?
Итак, наши действия: записываем уравнение химической реакции, расставляем коэффициенты. Для наглядности, запишем данные задачи над уравнением реакции. Неизвестную величину примем за Х. Под уравнением записываем молярные массы, и количество молей веществ, согласно уравнению реакции:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г end
Записывать данные под каждым веществом — не обязательно. Достаточно это будет сделать для интересующих нас веществ, из условия задачи. Запись выше дана для примера.
Примерно так должны выглядеть данные, записанные по условиям задачи. Не претендуем на единственно правильное оформление, требования у всех разные. Но так, как нам кажется, смотрится все довольно наглядно и информативно.
Первое наше действие — пересчитываем массу известного вещества в моли. Для этого разделим известную массу вещества (49 грамм) на молярную массу:
4998=0,5 моль серной кислоты
Как уже упоминалось ранее, по уравнению реакции 1 моль серной кислоты реагирует с 2 моль гидроксида натрия. Соответственно с 0,5 моль серной кислоты прореагирует 1 моль гидроксида натрия.
n(NaOH)=0.5*2=1 моль гидроксида натрия
Найдем массу гидроксида натрия, умножив количество вещества на молярную массу:
1 моль * 40 г/моль = 40 грамм гидроксида натрия.
Ответ: 40 грамм NaOH
Как видите, в решении задачи по уравнению реакции нет ничего сложного. Задача решается в 2-3 действия, с которыми справятся ученики начальных классов. Вам необходимо всего лишь запомнить несколько понятий.
Решение задач по химии через пропорцию
Ну и расскажем про второй способ вычислений по уравнениям химических реакций — вычисления через пропорцию. Этот способ может показаться немного легче, так как в некоторых случаях можно пропустить стадию перевода массы вещества в его количество. Чтобы было более понятно, объясню на том же примере.
Так же, как и в прошлом примере, запишем уравнение реакции, расставим коэффициенты и запишем над уравнением и под уравнением известные данные.
Для этого способа, нам так же понадобится записать под уравнением реакции, следом за молярной массой, массу вещества, соответствующую его количеству по уравнению. Если проще, то просто перемножить две строки под уравнением реакции, количество моль и молярную массу. Должно получиться так:
begin49 : г & & X : г & & & & \ H_<2>SO_ <4>& + & 2NaOH & → & Na_<2>SO_ <4>& + & 2H_<2>O \ 1 : моль & & 2 : моль & & 1 : моль & & 2 : моль \ 98 : г& & 40 : г & & 142 : г & & 18 : г \ 98 : г & & 80 : г & & 142 : г & & 36 : г end
А теперь внимание, начинается магия! Нас интересует строка данных над уравнением, и самая нижняя строка под уравнением. Составим из этих данных пропорцию.
Далее находим неизвестное значение Х из пропорции и радуемся полученному значению:
Х=49*80/98=40 грамм
Как видим, получается тот же результат. Прежде всего, при решении задач в химии, главное все же — понимание химических процессов. Тогда решение задачи не станет для вас проблемой!
[spoiler title=”источники:”]
http://nsportal.ru/shkola/khimiya/library/2013/03/21/instruktivnaya-karta-k-uroku-kolichestvennye-otnosheniya-v-khimi-0
http://in-chemistry.ru/kak-reshat-zadachi-po-himii-raschet-po-uravneniyam-himicheskih-reaktsij
[/spoiler]
Описание презентации по отдельным слайдам:
-
1 слайд
Количественные отношения в химии
Ситникова Г.А., учитель химии
МКОУ Садовской СОШ №1
Аннинского района Воронежской области -
2 слайд
Количественные отношения в химии
Что?
Как?
Где?
Сколько?
В чем сложность количественных расчетов в химии? -
3 слайд
Физические величины, количественно характеризующие вещество:
Агрегатные состояния веществ
Тело – это…
Вещество – это…
Вещество состоит из …
Масса m (кг)
Объем V (М3)
Плотность 𝒑 (кг/м3) -
4 слайд
Количество вещества – величина, характеризующая число порций вещества
Количество вещества обозначается буквой n (или ν)
Единица измерения количества вещества – 1 моль
1 моль – такая порция вещества, которая содержит 6∙1023 частиц вещества
Это число частиц получило название число Авогадро
n = 𝑁 𝑁𝑎
Na = 6∙1023 моль-1
(число Авогадро)
N= nNA -
5 слайд
Молярная масса – это масса 1 моля вещества
Обозначается М
Измеряется в г/мольn = 𝑚 𝑀
m= nM
M= 𝑚 𝑛 -
6 слайд
Молярный объем – это объем 1 моля газа
Обозначается Vm
Измеряется в л/моль
Vm= 𝑉 𝑛
V = nVm
n= 𝑉 𝑉𝑚 -
7 слайд
Мольные соотношения в химических уравнениях:
4А + 5В = 2АВ
4 моль 5 моль
n(A n(B) = 4 5
nA → nB
m (А)
m(B)
V (A)
V(B) -
8 слайд
Количество вещества n, моль
n = 𝑚 𝑀
Na = 6∙1023 моль-1n= 𝑉 𝑉𝑚
n = 𝑁 𝑁𝑎
Vm=22,4 л/моль -
9 слайд
Спасибо за внимание!
В уроке 14 «Расчеты по уравнениям химических реакций» из курса «Химия для чайников» мы научимся решать задачи, используя уравнения химических реакций.
Вещества вступают в химические реакции в определенных массовых и количественных соотношениях. Следовательно, при проведении реакций в лабораториях и на химических заводах расходуются определенные массы исходных веществ для получения заданной массы продуктов реакции.
Эти расчеты проводят по уравнениям реакций. Единицы величин, которыми пользуются в химии, представлены в таблице 6.
При проведении любого вычисления по уравнению реакции нужно внимательно прочитать условие задачи. Особое в нимание обратите на расстановку коэффициентов, так как соотношение числа структурных единиц реагирующих веществ и получающихся продуктов реакции выражается в уравнениях коэффициентами так же, как и мольные отношения.
Для решения расчетной задачи необходим определенный порядок действий. Рассмотрим его на нескольких примерах.
Пример 1. Железо массой 224 г полностью прореагировало с хлором. Рассчитайте массу образовавшегося вещества FeCl3.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 2. Определите массу алюминия, прореагировавшего с кислородом, если в результате реакции образовалось вещество Al2O3 химическим количеством 3,5 моль.
Спойлер
[свернуть]
Спойлер
[свернуть]
Пример 3. Рассчитайте объем (н. у.) кислорода, необходимого для полного сгорания фосфора массой 93 г.
Спойлер
[свернуть]
Надеюсь урок 14 «Расчеты по уравнениям химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Химические реакции».