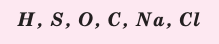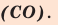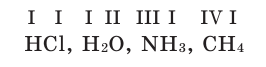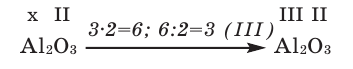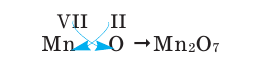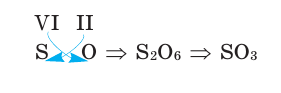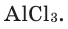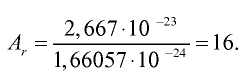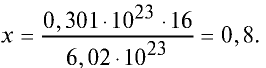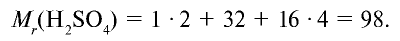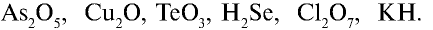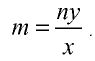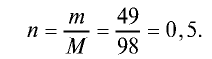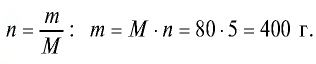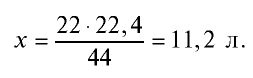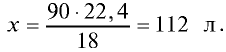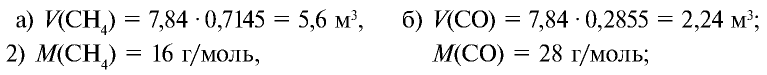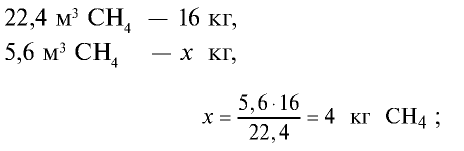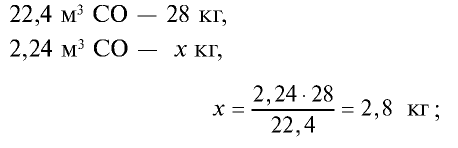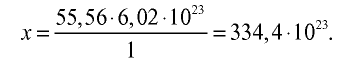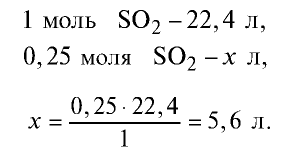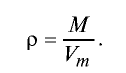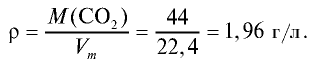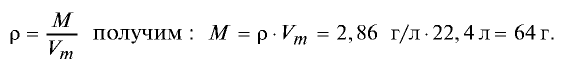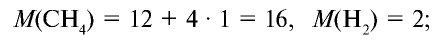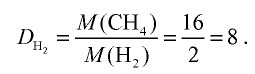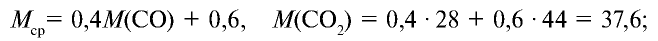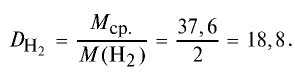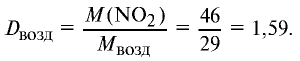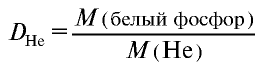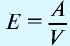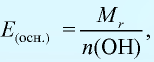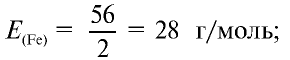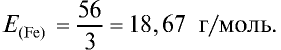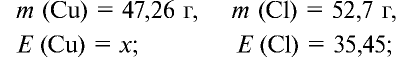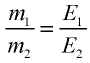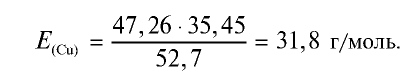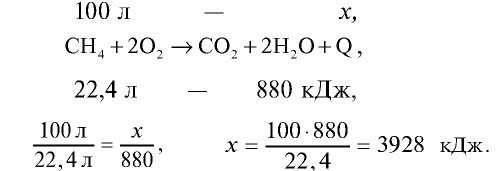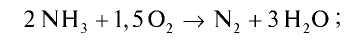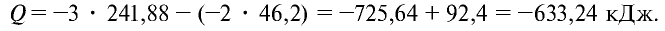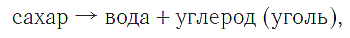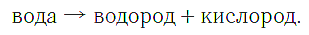Качественный
и количественный состав вещества с правилами и примерами.
Правило
№1.
Качественный
состав вещества определяют символами, входящими в химическую формулу. Он
показывает, из каких химических элементов состоит вещество, например:
|
№ |
Формула |
Качественный |
|
1 |
Mg(ОН)2 |
Вещество |
|
2 |
Li3 |
Вещество |
Правило
№2.
Количественный
состав вещества определяют по индексам (произведению индексов) в химической
формуле. Он показывает число атомов каждого химического элемента в 1 условной
молекуле вещества1, например:
К2
SiO3
– одна условная молекула вещества состоит из: 2
атомов К, 1 атома кремния , 3 атомов кислорода О.
Mg3
(PO4)2
– одна условная молекула вещества состоит из: 2 атомов магния Mg, 2
атомов Р и 8 атомов О.
Примеры
рассуждений при выполнении упражнений.
Определите
качественный и количественный состав вещества, формула которого Mg(НСО3 )2
Решение:
1.
Определите качественный и количественный
состав вещества (см. правило 1)
Для
этого посмотрите на формулу веществами определите, из каких химических
элементов оно состоит.
Вещество
Mg(НСО3 )2 состоит из атомов магния Mg, атомов водорода
Н, атомов углерода и атомов кислорода О.
2.
Для этого посмотрите на формулу вещества и
определите, из скольких атомов химических элементов состоит его условная
молекула.
Состав условной молекулы
Mg(НСО3 )2 следующий:
Mg(НСО3
)2 3*2= 6
атомов кислорода,
1*2= 2 атома углерода,
1*2= 2 атома водорода,
1 атом магния
Задания
для самостоятельной проверки знаний.
1.
Вещество, формула которого Al2
S3
состоит :
А)
из молекул алюминия и молекул серы;
Б)
из химических элементов алюминия и серы;
В)
из двух молекул алюминия и трех молекул серы;
Г)
из двух атомов алюминия и трех атомов серы.
2. Условная молекула вещества, формула которого Zn
(NO3
)2 имеет в своем составе атомов кислорода:
А)
6; Б) 2; В) 3; Г) 5.
3. Условная молекула вещества, формула которого Fe2
(NO3)3,
имеет в своем составе атомов железа и серы соответственно:
А)
2 и 3; Б) 2 и 1; В) 1 и 1; Г) 1 и 3; Д) 3 и 3.
4. Определите Качественный и количественный состав веществ, формулы которых:
N2
O3, Ag3 PO4, Cr(OH)3,
O3, H2SO4, K2CO3.
1
не все вещества имеют молекулярное строение, поэтому
здесь и далее используют термин «условная молекула»
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
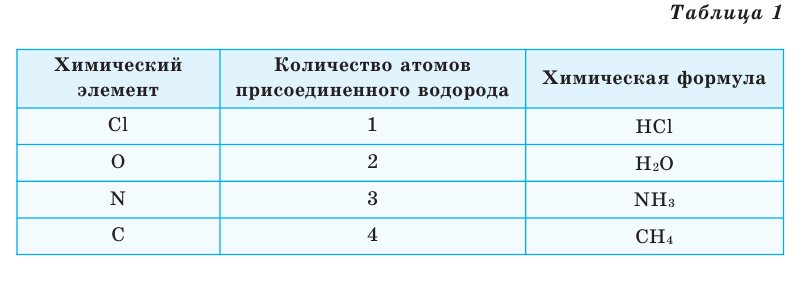
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 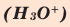
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
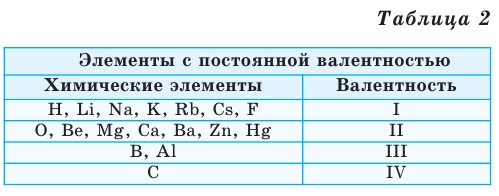
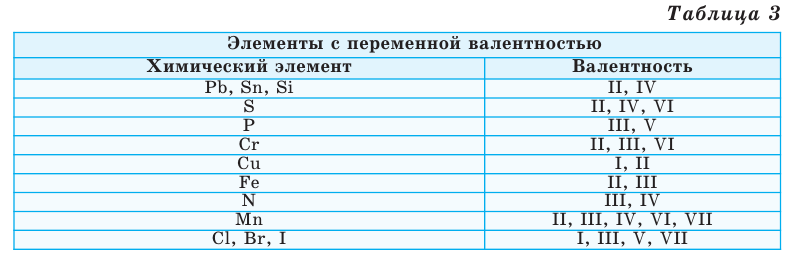
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 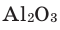
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
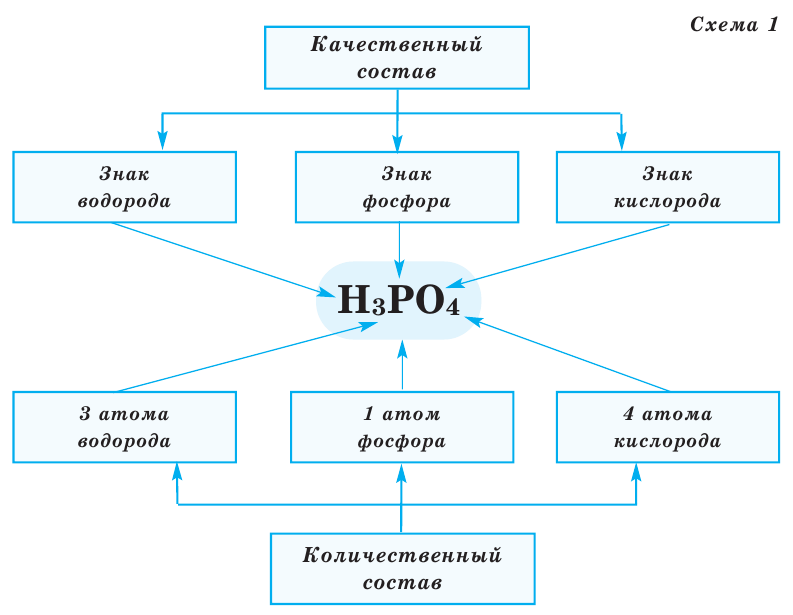
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
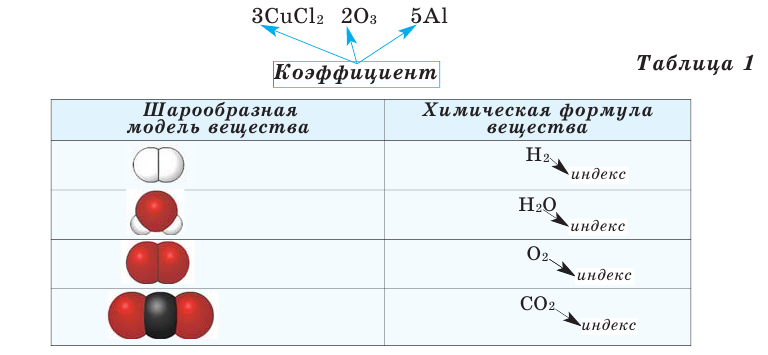
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
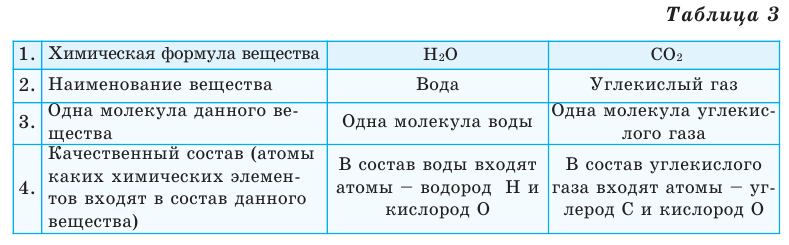
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза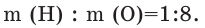
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 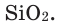
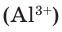

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•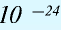

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 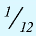
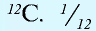
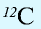

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
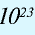
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 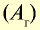 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 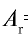
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 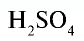
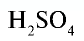
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (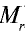
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (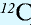
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 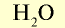 |
18 | 1 | 6,02• |
| Углекислый газ | 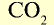 |
44 | 1 | 6,02• |
| Серная кислота | 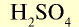 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 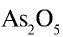
2) 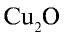
3) 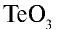
4) 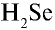
5) 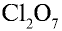
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 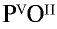
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 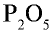
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 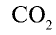
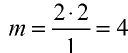
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 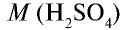
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество | 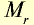 |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
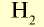 |
2 | 2 | 22,4 | 6,02• |
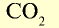 |
44 | 44 | 22,4 | 6,02• |
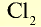 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 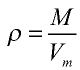
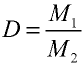
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 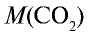
2) вычислим объем 22 г 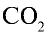
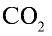
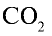
Ответ: 22 г 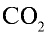
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
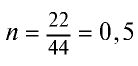
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(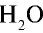
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 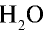
90г 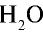
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{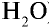
2) вычислим количество вещества в 1000 г воды:
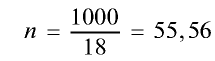
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
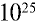
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 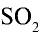
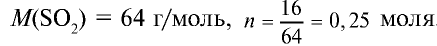
2) вычислим, какой объем займут 16 г (или 0,25 моля) 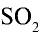
Ответ: 16 г 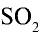
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(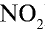
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 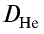
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 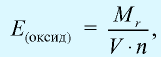
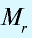
Эквивалентность оснований выражается формулой:
где 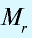
Эквивалентность кислот выражается формулой: 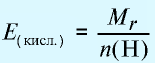
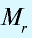
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 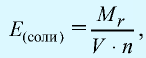
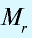
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 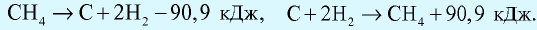
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
Химия!как определить качественный и количественный состав соединения?
Alexis
Ученик
(79),
закрыт
8 лет назад
1) B + O2 > B2O3
2) NaNO3 > NaNO2+O2
3)Ca + TiCl4 > CaCl2 + Ti
4) K + F2 > KF
!!!!У МЕНЯ МОЗГИ ПЛАВЯТСЯ!!!!
Алексей Дмитриев
Мыслитель
(8057)
13 лет назад
Качественный состав – это состав, показывающий из каких элементов состоит данное соединение. Например, HNO3 состоит из атомов водорода, азота и кислорода.
Количественный состав показывает, сколько ( число) атомов элементов содержится в одной молекуле. Например, одна молекула HNO3 состоит из 1 атома водорода, 1 атома азота и 3 атомов кислорода.
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Содержание
- Органические и неорганические вещества
- Органические вещества
- Неорганические вещества
- Качественный и количественный состав веществ
- Отличия между сложными веществами и смесями веществ
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
План урока:
Химическая формула
Массовая характеристика вещества
Количество вещества
Закон Авогадро и следствия с закона
Химическая формула
Химия – уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.

- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Представим перед собой два кубика одинакового объёма 1 см3, только один сделан из свинца, а второй – из алюминия. ρ(Al) = 2.7 г/см3, ρ(Pb) = 11,3 г/см3. Свинцовый кубик будет 4,2 раза тяжелее алюминиевого. С чем это связано?
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10−10м и масса m = 19.94∙10−27кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Как показывают числовые данные – масса и радиус очень малы, их достаточно трудно увидеть даже в современные оптические микроскопы. Именно по этой причине стали сравнивать атомные массы. На данный момент стандартом сравнения является химический элемент Углерод, а точнее 1/12 часть его массы.
Важно запомнить

Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Чему равно Ar элемента подскажет периодическая система. Достаточно часто порядковый номер принимают за Ar. Чтобы избежать путаницы, запомним, что порядковый номер – целое число, а Ar записывается десятичной дробью, которую в химических расчётах общепринято округлять до целых (исключение составляет только Хлор).
Например: Ar(Mg) = 24,305 ~ 24
Ar(Fe) = 55,847 ~ 56
Ar(Cl) = 35.453 ~ 35,5
Относительная молекулярная масса (ОММ)
Данная величина относится также к количественным характеристикам. Более точное название – относительная формульная масса, потому что строение веществ бывает разным (в зависимости от того, какими частицами оно образовано).
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.

Определим ОММ, например:
Сероводорода
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797 ~ 1) и S (32,064 ~ 32) и путём сложения вычисляем Mr(H2S).
Глюкозы
Mr (C6H12O6) = 6∙Ar(C) + 12∙Ar(H) + 6∙Ar(O) = 6∙12+12∙1 + 6∙16 = 180
Гашёной извести
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Фосфата кальция
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Состав:
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?

Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N – количество структурных единиц,
n – количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
(Источник)
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
(Источник)
Задача 7. Какую массу составляют 18.06 ∙1023 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(He) = 4
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна