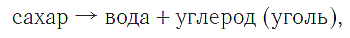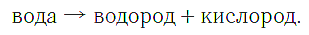В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Содержание
- Органические и неорганические вещества
- Органические вещества
- Неорганические вещества
- Качественный и количественный состав веществ
- Отличия между сложными веществами и смесями веществ
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.
- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 – mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Простые вещества– это вещества, образованные одним химическим элементом.
Сложные вещества– вещества, построенные двумя и более химическим элементами. Сложных веществ в природе гораздо больше.
Различают качественный и количественный состав вещества.
Качественный состав– это совокупность химических элементов и (или) групп атомов, составляющих данное химическое вещество.
Количественный состав– это величина, характеризующая число атомов того или иного химического элемента и (или) групп атомов, образующих данное химическое вещество.
Состав веществ отображают посредством химической символики.
Химические знаки (символы) несут значительную информацию. Они обозначают название элемента, один атом, один моль атомов этого элемента. По символы химического элемента можно определить его атомный номер и относительную атомную массу.
Химические формулы– это способ отображения химического состава вещества. Как и химический знак, химическая формула несет немалую информацию. Она обозначает название вещества, одну молекулу, один моль этого вещества. По химической формуле также можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в 1 моле вещества, его относительную молекулярную массу и молярную массу.
Широко используют несколько видов химических формул.
1. Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых находятся частицы, образующие данное вещество: атомы, ионы, группы атомов. Например, Простейшая формула пероксида водорода – НО.
2. Молекулярная (истинная) формула отражает качественный состав и число составляющих вещество частиц, но не показывает порядок связи частиц в веществе, т. е. его структуру.
3. Графическая формула отражает порядок соединения частиц, т. е. связи между ними, но не дает представления об их пространственном расположении:
Н—О—О—Н
4. Структурная формула отражает пространственное расположение частиц– геометрическую форму молекулы.
В 1961 году в химии и физике была принята единая углеродная атомная единица массы (а. е. м.), представляющая собой 1/12 массы атома углерода.
Относительная атомная масса химического элемента – это величина, показывающая отношение средней массы атома природной изотопной смеси к 1/12 массы атома углерода.
Относительная молекулярная масса равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.
Количество вещества характеризуют числом атомов, молекул или других формульных единиц данного вещества.
Моль– это количество вещества, содержащее столько же формульных единиц, сколько атомов углерода содержится в 0,012 кг изотопа углерода.
Число атомов или молекул, содержащихся в одном моде любого вещества, называют постоянной Авогадро.
Постоянная Авогадро–число атомов или молекул (или других формульных единиц), содержащихся в 1 моле вещества.
План урока:
Химическая формула
Массовая характеристика вещества
Количество вещества
Закон Авогадро и следствия с закона
Химическая формула
Химия – уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.
H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.

- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
Массовая характеристика вещества
Относительная атомная масса (ОАМ)
Представим перед собой два кубика одинакового объёма 1 см3, только один сделан из свинца, а второй – из алюминия. ρ(Al) = 2.7 г/см3, ρ(Pb) = 11,3 г/см3. Свинцовый кубик будет 4,2 раза тяжелее алюминиевого. С чем это связано?
Атомы отличаются между собой количеством протонов и электронов. Логично будет предположить, что отличие также будет в размере и массе частиц.
Атом очень мал, что его невозможно увидеть невооружённым глазом. Так, если представить в числах размер Углерода, то его радиус r = 1.5∙10−10м и масса m = 19.94∙10−27кг. Эти параметры достаточно сложно представить. Но если, к примеру, прочертить простым карандашом (стержень карандаша в химии это графит – одна из аллотропных форм Углерода) отрезок длиной 3 см. В данном отрезке будет содержаться около 1 млн. в ширину и 100 млн. атомов Углерода в длину.
Как показывают числовые данные – масса и радиус очень малы, их достаточно трудно увидеть даже в современные оптические микроскопы. Именно по этой причине стали сравнивать атомные массы. На данный момент стандартом сравнения является химический элемент Углерод, а точнее 1/12 часть его массы.
Важно запомнить

Иными словами, «всё познаётся в сравнении». Эталоном является двенадцатая часть атома Углерода. А ОАМ показывает ВО СКОЛЬКО РАЗ отличается масса элемента от эталона. Иначе можно объяснить: образцом сравнения является корзина, в которой содержится 12 яблок. Вся остальная численность, которая может содержаться в других корзинах (это может быть 10, 15, 5) будет сравниваться во сколько раз больше или меньше.
Закономерно также возникает вопрос, а какую размерность имеет ОАМ: граммы, миллиграммы? Поскольку это число, которое указывает сравнение, то это будет безразмерная величина.
Чему равно Ar элемента подскажет периодическая система. Достаточно часто порядковый номер принимают за Ar. Чтобы избежать путаницы, запомним, что порядковый номер – целое число, а Ar записывается десятичной дробью, которую в химических расчётах общепринято округлять до целых (исключение составляет только Хлор).
Например: Ar(Mg) = 24,305 ~ 24
Ar(Fe) = 55,847 ~ 56
Ar(Cl) = 35.453 ~ 35,5
Относительная молекулярная масса (ОММ)
Данная величина относится также к количественным характеристикам. Более точное название – относительная формульная масса, потому что строение веществ бывает разным (в зависимости от того, какими частицами оно образовано).
Вычисляют ОММ (Mr) путём сложения Ar каждого элемента, которые входят в состав молекулы с учётом их индексов.
Здесь нам на помощь придут математические знания, а именно правила сложения, умножения и внимательное раскрытие скобок.

Определим ОММ, например:
Сероводорода
Mr(H2S) = 2∙Ar(H) + Ar(S) = 2 ∙ 1 + 32 = 34
Так как в состав молекулы H2S входит 2 атома водорода, мы это учитываем выражением 2∙Ar(H) и один атом Серы Ar(S). В периодической таблице берём округлённое значение массы Н (1,00797 ~ 1) и S (32,064 ~ 32) и путём сложения вычисляем Mr(H2S).
Глюкозы
Mr (C6H12O6) = 6∙Ar(C) + 12∙Ar(H) + 6∙Ar(O) = 6∙12+12∙1 + 6∙16 = 180
Гашёной извести
Mr (Ca(OH)2) = Ar(Ca) + 2∙Ar(O) + 2∙Ar(H) = 40 + 2 ∙ 16 + 2 ∙ 1 = 74
Эта формула читается как кальций-о-аш-дважды. Что означает индекс два за скобками? Он показывает, что количество атомов H и O равно 2. Это будет равносильно, если раскрыть скобки и написать так: СаО2Н2.
Фосфата кальция
Mr(Ca3(PO4)2) = 3∙Ar(Ca) + 2∙Ar(P) + 8∙Ar(O) = 3 ∙ 40 + 2 ∙31 + 8 ∙ 16 = 310
Кальций-три-пе-о-четыре-дважды. В состав данного вещества входит 3 атома Кальция, два атома Фосфора (индекс 2 относится и к Фосфору и к Кислороду) и 8 атомов Кислорода (2 ∙ 4 = 8). Или, раскрыв скобки Са3Р2О8.
7 молекул угольной кислоты 7 ∙ Н2СО3
Mr (7 ∙ H2CO3) = 7 ∙ (2 ∙ Ar(H) + Ar(C) + 3 ∙ Ar(O)) = 14 ∙ Ar(H) + 7 ∙ Ar(C) + 21 ∙ Ar(O) = 14 ∙ 1 + 7 ∙ 12 + 21 ∙ 16 = 434
Следует обратить внимание, что в химии знак умножение между коэффициентом и формулой не ставится. Более корректная запись 7H2CO3, и действие умножение делается по умолчанию, т. е. раскрываются скобки.
Важно запомнить
Так как ОММ показывает во сколько раз молекула тяжелее 1/12 атома Углерода, то это безразмерная величина.
Не стоит путать с массой молекулы, которая имеет обозначение mM и имеет размерность а.е.м. (атомные единицы массы).
Благодаря химической формуле можно посчитать массовую долю элемента в сложном веществе.
Где n – число атомов элемента.
Сложное вещество можно очень условно сравнить с корзиной, в которой, допустим, находятся ягоды: малины, клубники и арбуз. Возьмём соединение ВаСО3.
Состав:
Mr(BaCO3) = Ar(Ba) + Ar(C) + 3∙Ar(O) = 137 + 12 + 3 ∙ 16 = 197
Не трудно догадаться, что арбузом будет атом бария, так как он занимает 69,6 % массы в корзинке фруктов.Проверить правильность решения можно, сложив доли элементов, в сумме должно получиться 100%.
Задача 1. Определите массовую долю Азота в натриевой селитре NaNO3
С помощью данных расчётов можно вычислить какая масса Азота, может быть получена из 1 кг натриевой селитры NaNO3.
m(N) = W (N) · m (NaNO3) = 0.1647 · 1 кг = 0,1647 кг или 164,7 г
Селитра применяется как азотное удобрение и с каждым кг растения получают 164,7 г азота.
Бывает так, что опытным путём определены массовые доли элементов и задача стоит в том, что необходимо определить количественный состав соединения. Такие задачи являются обратными идалее их.
Задача 2. Опытным путём установлено, что соединение состоит на 95,2% с Кальция и Водорода. Какова формула вещества?
Количество вещества
Как говорил Д. И. Менделеева «Наука начинается, когда начинают измерять». Но как можно измерить вещество? В порциях, штуках?

Порцию считаем в граммах, в штуках количество. Например, в магазине вы не покупаете 1000 штук зёрен риса или пшена, а просите взвесить определённый вес (1 кг, 10 кг) или берёте с полки уже расфасованный. Либо необходимо взять молочные продукты, мы берём пакеты объёмом 0,5 л или 1 л. Одинаковая по весу порция содержит примерно одинаковое количество зёрен. Этот принцип применяется и в химии. Порция атомов или молекул называется количеством вещества.
Размерность «моль» не сокращается, т. е. в отличие от литров (л), миллилитров (мл), сантиметров (см) на письме и при чтении указываем 4 моль, 5 сантиметров (5 см).
Если учесть, что атом Углерода имеет вес, (1.994 ∙ 10−23г), то не составит труда узнать, сколько атомов будет содержаться в порции 12 г.
Можно сделать вывод, что 1 моль любого вещества (воды, углекислого газа, поваренной соли, серной кислоты и т. д) будет содержать 6,02∙1023 структурных единиц.
Это число является одним из важнейших не только в химии, но и в физике – оно носит название постоянная Авогадро (NA).
С этого следует, что NA показывает, сколько частиц содержится в 1 моль вещества, в этом и состоит её физический смысл.
Но что делать, если, к примеру, вещество дано в количестве 2 моль, 10 моль или 0.5 моль. Приведём сравнение с математикой, в одной корзине содержится 5 яблок, сколько яблок содержится в трёх таких корзинах. Ответ будет 15 яблок, полученный путём умножения 5 ∙ 3 = 15. Аналогично и с количеством молекул. Чтобы найти эту величину, используем формулу:
N = n * NA
Где N – количество структурных единиц.
Важно: не путать эти две величины, оба эти параметра показывают количество, но:
N – количество структурных единиц,
n – количество вещества (моль)
Рассмотрим подробно данные выводы.
Задача 3. Какое количество вещества составляют 2.709 ∙ 1024 молекул хлора? 
Так, в корзине может содержаться 5 яблок, 10 груш и 8 слив, и наша задача посчитать: «Сколько содержится фруктов?» А сколько будет содержаться в 8 таких корзинах яблок? Эти примеры нам знакомы ещё с первого класса. Молекула может состоять из нескольких атомов, и иногда необходимо точно знать, сколько их штук.
Задача 4. Вычислите сколько атомов Кислорода содержатся в 5 моль глюкозы (C6H12O6)
Молярная масса
Помните вопрос с первого класса: «Что тяжелее 1 кг золота и 1 кг пуха?». Ответ был: одинаковый вес, ведь и золото, и пух весят по 1 кг. Но если спросить, что тяжелее 1 моль метана или 1 моль фруктозы? Чтобы дать ответ на данный вопрос, введём следующее понятие.
Масса 1 моля любого вещества называется молярной массой (размерность г/моль, обозначение М). Не стоит путать с Mr, хоть они численно равны, но отличаются в следующем. Молярная имеет размерность (г/моль).
Связь количества вещества и массы выражается в следующем виде:
m = n * M
Возьмём для примера метан, фруктозу и хлороводород количеством вещества 1 моль.
С расчётов делаем вывод, что масса 1 моль фруктозы тяжелее, в её состав входит большее количество атомов.
Задача 5. Какое количество вещества содержится в 61.5 г сернистой кислоты (H2SO3)?
Молярный объём газов
Вещества в газообразном состоянии, в отличие от жидких и твёрдых веществ, при одинаковых условиях (одинаковые давление и температура) будут занимать одинаковый объём.
Допустим, что имеем газ количеством вещества 1 моль. Как известно 1 моль любого соединения содержит 6,02 ∙ 1023 структурных единиц.
(Источник)
Опытным путём установлено, что 1 моль любого газа при н. у. занимает объём равный 22,4 л/моль.
Связь количества вещества и объёма выражается в следующем виде:
V = n * Vm
Задача 6. Какой объём (н. у.) будет занимать 0,25 моль ацетилена (С2Н2)?
Как можно увидеть, количество вещества связывает три величины:
Приравняв между собой три выражения, а именно:
Получаем следующую взаимосвязь
(Источник)
Задача 7. Какую массу составляют 18.06 ∙1023 молекул аммиака (NH3)?
Задача 8. Какой объём (н. у.) будет занимать 51 г сероводорода (H2S)?
Закон Авогадро и его следствия
Величина D – это относительная плотность газов. Зная Mr, легко вычислить относительную плотность газов. Приведём пример с шариками. Если один шарик наполнить гелием, а второй углекислым газом. Как вы думаете, какой полетит высоко в небо, а какой упадёт на пол? С детства вы знаете, что гелиевые шарики взлетают в небо, но почему так происходит? Это связано с относительной молекулярной массой.
Mr(He) = 4
Mr(CO2) = 12 + 2 ∙ 16 = 44
Воздух это смесь газов, его Mr = 29
Гелий легче воздуха, поэтому шарик, наполненный этим газом, взлетает высоко в небо. Шарик с углекислым газом остаётся лежать на земле, так как углекислый газ тяжелее воздуха.
Задача 9. Вычислите относительную плотность кислорода по воздуху
Относительная плотность кислорода по воздуху равна
Естествознание, 10 класс
Урок 32. Состав – структура – свойства
Перечень вопросов, рассматриваемых в теме:
- Какова структура вещества? Все ли вещества имеют молекулярную структуру?
- В чем причина многообразия веществ? Как структура молекул влияет на свойства веществ?
- Можно ли прогнозировать свойства вещества, зная его структуру (строение)?
Глоссарий по теме:
Генезис (греч. – genesis) – происхождение, становление и развитие, результатом которого является определенное состояние изучаемого объекта. Генезис природных и социальных явлений интересовал и интересует философию и науку с античности до наших дней (философский словарь).
Структу́ра (от лат. Structūra — «строение»), или строе́ние — внутреннее устройство чего-либо / Ожегов С.И. и Шведова Н.Ю. Толковый словарь русского языка. / Российская академия наук. Институт русского языка им. В.В.Виноградова. – М.:Азбуковник, 1999/.
Качественный состав – это перечень всех образующих вещество химических элементов.
Количественный состав – это число атомов каждого химического элемента в составе мельчайшей частицы вещества – его молекулы.
Запись, выражающая качественный и количественный состав вещества с помощью хими-ческих знаков, называется химической формулой.
Закон постоянства состава: Многие вещества, независимо от нахождения в природе или способа получения их в лаборатории, всегда имеют один и тот же состав.
Химическая связь – это совокупность сил, связывающих и удерживающих атомы или другие частицы в устойчивых структурах (молекулах и др.).
Гибридизация атомных орбиталей – это их перемешивание в пространстве с целью выравнивания и обеспечения наиболее полного перекрывания.
Аллотропия – это явление, при котором один и тот же химический элемент образует несколько простых веществ. Простые вещества, образованные одним элементом – это аллотропные модификации (видоизменения) этого элемента.
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Основная и дополнительная литература по теме урока:
Основные источники:
- Еремин В.В. Теоретическая и математическая химия для школьников. – М.: МЦНМО, 2007.
- Миттова И.Я., Самойлов А.М. История химии с древнейших времен до конца XX века: учебное пособие в 2-х томах. Т. 1. – Долгопрудный: ИД «Интеллект», 2009.
- Папулов Ю.Г, Левин В.П., Виноградова М.Г. Строение вещества в естественнонаучной картине мира: Молекулярные аспекты. Учебное пособие, 2-ое издание. Тверь: ТвГУ, 2005 – 208 с.
Дополнительные источники:
- Травень В. Ф. «Органическая химия», в 2-х томах. Москва, ИКЦ «Академкнига», 2004.
- Химия. Школьная энциклопедия. Гл. ред. Ю.А.Золотов. М.: Большая российская энциклопедия, 2003.
- Энциклопедия для детей. Том 17. Химия. Гл. ред. В.А.Володин. — М.: Аванта+, 2000.
Теоретический материал для самостоятельного изучения
Учение о молекуле лежит в основе всех
других обобщений, так что современную химию
можно по праву назвать молекулярной химией.
А. М. Бутлеров, (1828-1886), русский химик, создатель теории химического строения органических веществ, учёный-пчеловод и лепидоптеролог, общественный деятель
Установление взаимосвязи между свойствами веществ и строением молекул составляет фундаментальную научную проблему химии. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении порядка расположения атомов (связей) в исходных соединениях и характера изменений при образовании из них других соединений.
Мы знаем, что молекула представляет собой микрочастицу, образованную из атомов и способную к самостоятельному существованию, обладающую его главными химическими свойствами. Она имеет постоянный состав входящих в нее атомных ядер и фиксированное число электронов и обладает совокупностью свойств, позволяющих отличать молекулы одного вида от молекул другого. Число атомов в молекуле может быть различным: от двух до сотен тысяч. Молекулы простых веществ состоят из одинаковых атомов, сложных – из разных атомов. Существует большое количество соединений, молекулы которых состоят из многих тысяч атомов – макромолекулы.
Первые представления о структуре молекул основывались на химическом анализе. Со времен М.В. Ломоносова (1741), который высказал мысль, что свойства вещества зависят от рода, числа и расположения “элементов” (атомов), составляющих его “корпускулу” (молекулу), представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволило определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле, составленной на основе качественного и количественного анализа, а также закона постоянства состава (Ж.Пруст). В дальнейшем А.М. Бутлеров (1861) ввел понятие химического строения (как порядка связи атомов в молекуле) и показал, что свойства вещества определяются его составом и химическим строением. Стереохимическая гипотеза Я. Вант-Гоффа и Ле Беля (1874) расширила понятие строения. Оказалось, что свойства вещества зависят как от химического (в топологическом плане), так и пространственного строения молекул. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. В таблице 1 отражена зависимость пространственного строения веществ от типа гибридизации.
«Пространственное строение частиц в зависимости от типа гибридизации». Приведите свои примеры веществ.
|
Тип гибриди-зации центрального атома |
Пространственное строение частицы |
Условное изображение |
Примеры |
|
sp |
Линейное |
|
ВеС12, ZnCl2, С2Н2 |
|
sp2 |
Плоскостно-тригональное |
|
BCl3, N03–,CO32-, C2H4, C6H6 |
|
sp3 |
Тетраэдр |
|
CH4, NH4+, SO42-, CC14 |
|
sp3 |
Тригональная пирамида |
|
NH3, H30+ |
|
sp3 |
Угловое |
|
Н20 |
Чем различаются понятия «свойства молекулы» и «свойства вещества»?
Подсказка. Допустим, вы открыли химический справочник и в статье «Азот» прочитали: «N2 – газ без цвета и запаха, tкип = –196 °С, tпл = –210 °С, энергия химической связи 940 кДж/моль». Какие из этих характеристик относятся к свойствам молекулы азота, а какие к свойствам простого вещества?
В состав молекулы может входить различное число атомов. Так, молекулы благородных газов одноатомны, молекулы таких веществ, как водород, азот, — двухатомны, воды — трехатомны и т.д. Молекулы наиболее сложных веществ — высших белков и нуклеиновых кислот — построены их такого количества атомов, которое измеряется сотнями тысяч. При этом атомы могут соединяться друг с другом не только в различных соотношениях, но и различным образом. Поэтому при сравнительно небольшом числе химических элементов число различных веществ очень велико.
Все ли вещества состоят из молекул?
Подсказка. Для ответа на этот вопрос обратитесь к строению таких веществ как металлы, алмаз, графит, хлорид натрия.
Не во всех случаях частицы, образующие вещество, представляют собой молекулы.
Многие вещества в твердом и жидком состоянии, например, большинство солей, имеют не молекулярную, а ионную структуру. Некоторые вещества имеют атомное строение. В веществах, имеющих ионное или атомное строение, носителем химических свойств являются не молекулы, а те комбинации ионов или атомов, которые образуют данное вещество.
Вспомните, какие типы связей и кристаллических решеток существуют? Чем определяются свойства веществ?
В зависимости от природы частиц, образующих кристалл, различают атомные, молекулярные, ионные и металлические кристаллические решетки
Таблица 2 «Зависимость свойств веществ от типа связи и кристаллических решеток»
|
Тип кристаллической решетки |
Характерный вид химической связи |
Частицы, располагающиеся в узлах решетки |
Примеры веществ и их характерные свойства |
|
Атомная |
Ковалентная неполярная |
Атомы |
Некоторые неметаллы, оксиды и др. Чаще твердые вещества, обладающие высокой прочностью. Тугоплавки. Полупроводники и диэлектрики. |
|
Молекулярная |
Ковалентная неполярная и полярная |
Молекулы |
Неметаллы, оксиды, кислоты и др. Разнообразны по агрегатному состоянию и другим свойствам. Легко переходят из одного агрегатного состояния в другое. Летучи, легкоплавки. |
|
Ионная |
Ионная |
Ионы |
Соли, щелочи и др. Твердые вещества с высокими температурами плавления. Малолетучи. Хорошо растворяются в полярных растворителях. |
|
Металлическая |
Металлическая |
Атомы и катионы металла |
Металлы. Твердые вещества (кроме ртути) с металлическим блеском. Ковки, пластичны. Обладают тепловой и электрической проводимостью. |
В настоящее время известен не один десяток миллионов разнообразных веществ. При этом все они образованы значительно меньшим числом химических элементов (современной науке достоверно известно 112 химических элементов).
Как объяснить такое разнообразие веществ?
Что такое аллотропия?
Приведите примеры аллотропных модификаций известных вам химических элементов. Дайте сравнительную характеристику их свойств.
Явление аллотропии характерно для большинства неметаллов и многих металлов. При этом образуемые ими аллотропные модификации могут различаться по составу, строению и типу кристаллических решеток.
Между аллотропными модификациями одного элементы возможны взаимные переходы. При этом все они имеют разную устойчивость. Как правило, при одних и тех же условиях более стабильна лишь одна из модификаций, обладающая минимальным запасом энергии. Остальные модификации при этих же условиях будут неустойчивы и рано или поздно перейдут в более устойчивую форму.
Что такое изомерия?
Изомерия – это явление, при котором существуют вещества, имеющие одинаковый состав, но разное химическое строение, а потому и свойства. Вещества, имеющие одинаковый состав, но разное химическое строение, а потому и разные свойства, называются изомерами.
Приведите примеры известных вам изомеров. Укажите, в чем заключаются различия их строения и свойств.
Явление изомерии характерно и для неорганических, и для органических веществ. Однако особенно ярко оно проявляется среди органических соединений, являясь важнейшей причиной их многообразия.
Таблица Изомерия органических соединений
|
Виды изомерии органических соединений |
|||
|
Структурная изомерия |
|||
|
Углеродного скелета |
Положения функциональных групп |
Положения кратных связей |
Межклассовая |
|
Пространственная изомерия |
|||
|
Конформационная |
Геометрическая |
Оптическая |
Проиллюстрируйте указанные в таблице виды изомерии примерами.
Выводы:
- Молекулы — это очередной после атомов качественный уровень строения и эволюции вещества.
- Вещества имеют разный состав и строение.
- Свойства веществ определяются их строением: характером связей, типом кристаллической решетки, пространственным расположением, порядком соединения атомов.
- Зная строение вещества можно прогнозировать его свойства.
Примеры и разбор решения заданий тренировочного модуля:
Задание 1. Вещество, в узлах кристаллической решетки которого находятся ионы, это…
Тип вариантов ответов: (Текстовые, Графические, Комбинированные).
а) CaС12;
б) NH3;
в) I2;
г) C (графит).
Правильный вариант/варианты (или правильные комбинации вариантов): а
Подсказка: В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. К соединениям с ионной связью, образующим ионные решетки, относится большинство солей и небольшое число оксидов.
|
Задание 2. Соедините попарно прямоугольники с овалами так, чтобы каждому типу гибридизации атомных орбиталей углерода соответствовал пример молекулы.
|
|
Правильный вариант:
Подсказка: Тип гибридизации атомных орбиталей углерода определяется числом заместителей при этом атоме углерода:
|