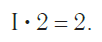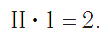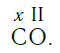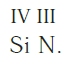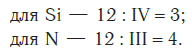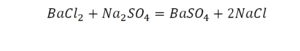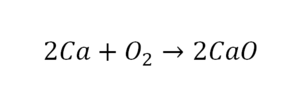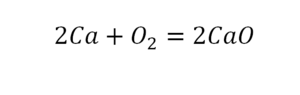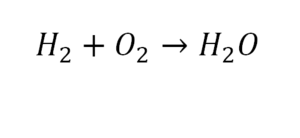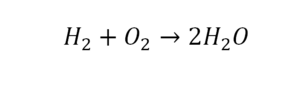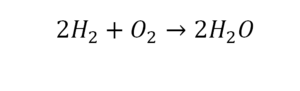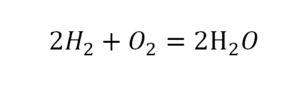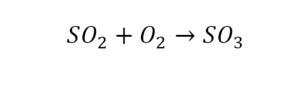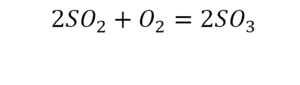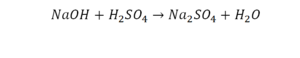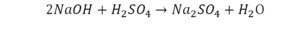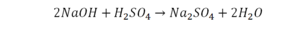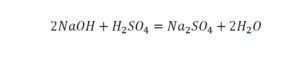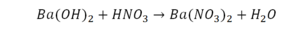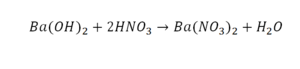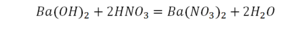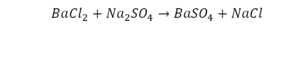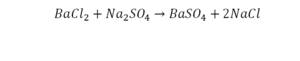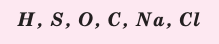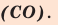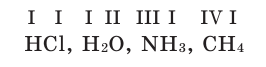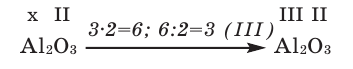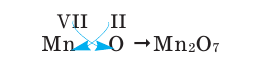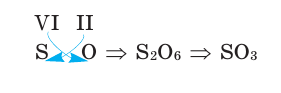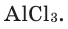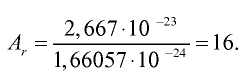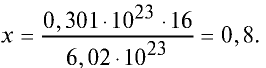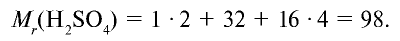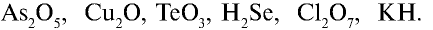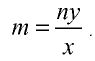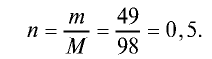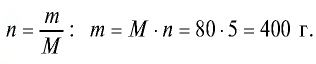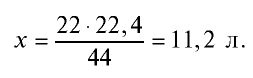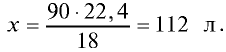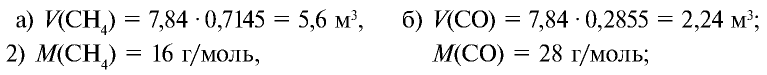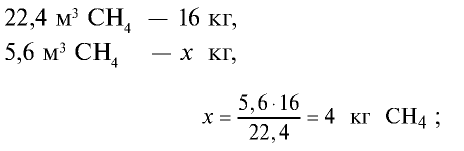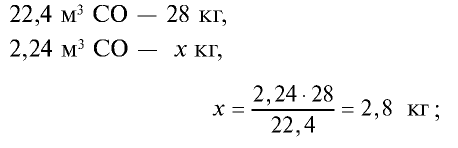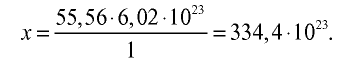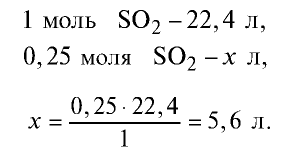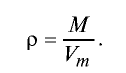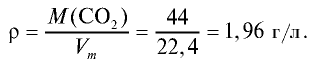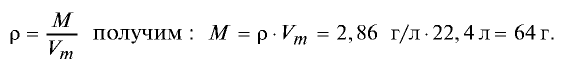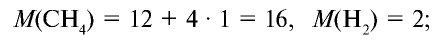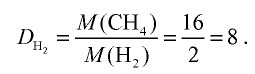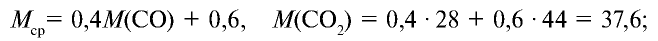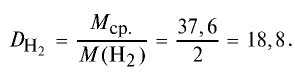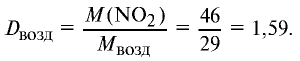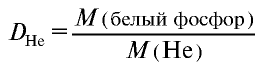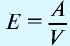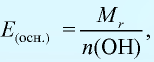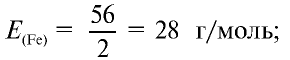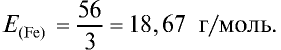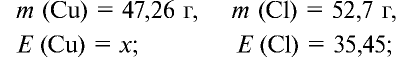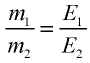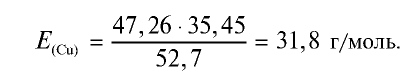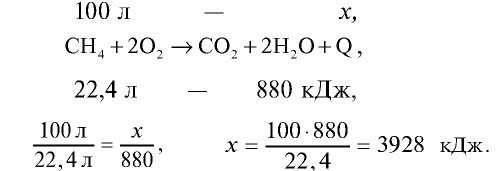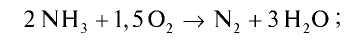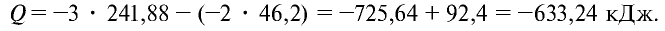Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
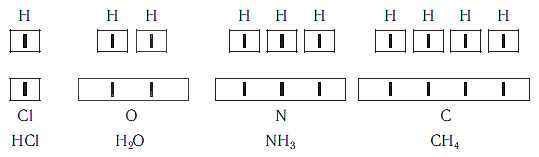
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
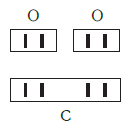
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
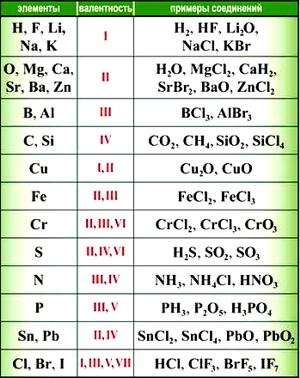
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
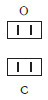
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
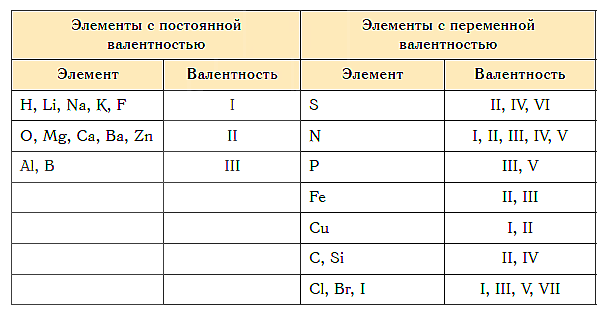
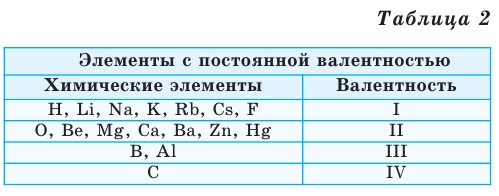
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Написание формулы по валентности
Валентность — способность атома присоединять то или иное число других атомов с образованием химической связи (см. «Что такое валентность»).
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: Fe III O II ;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe — 6:3=2;
- для O — 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать — группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа — на втором.
Составление формулы солей
В солях «роль» гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток — на втором.
В качестве примера составим формулу соли фосфата натрия.
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток — на втором.
В качестве примера составим формулу серной кислоты.
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
«Фишка» решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
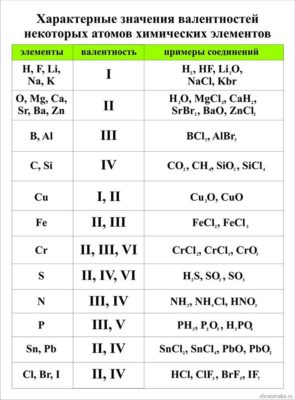
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять «сзади-наперёд».
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5 II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 — это и будет валентность неизвестного, в нашем случае, фосфора
- P2 V O5 II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода — определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 — это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2 III (S VI O4 II )3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://prosto-o-slognom.ru/chimia_primery/001-valentnost.html
Содержание:
Составление химических формул по валентности:
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
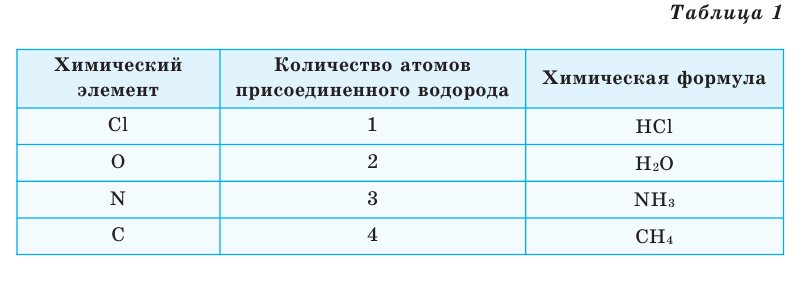
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.
Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 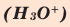
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
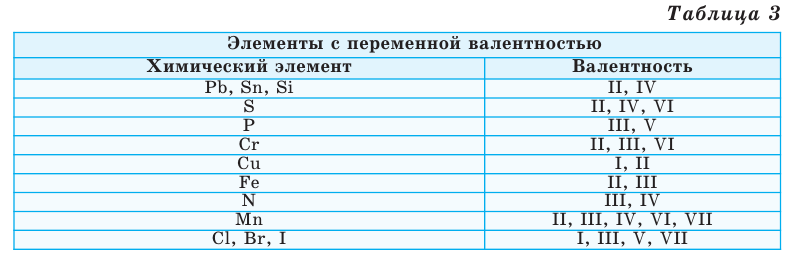
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 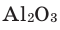
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
Химическая формула
Заполните таблицу. Как произносится химическая формула вещества?
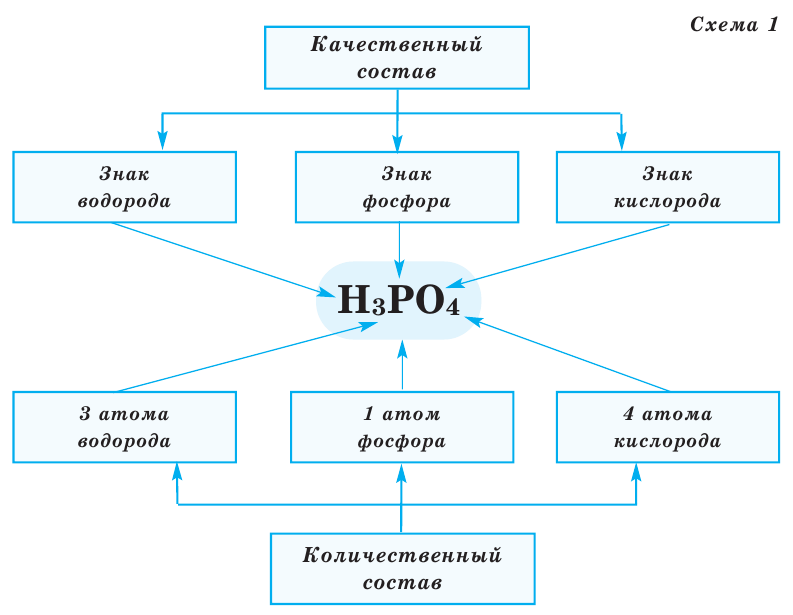
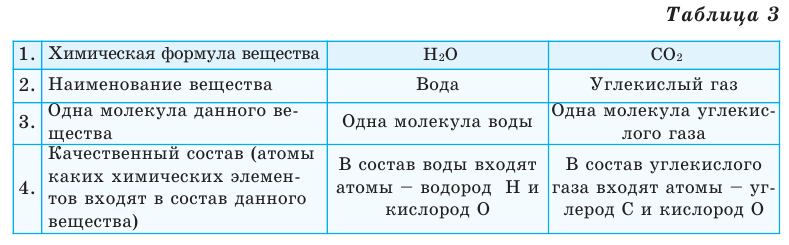
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
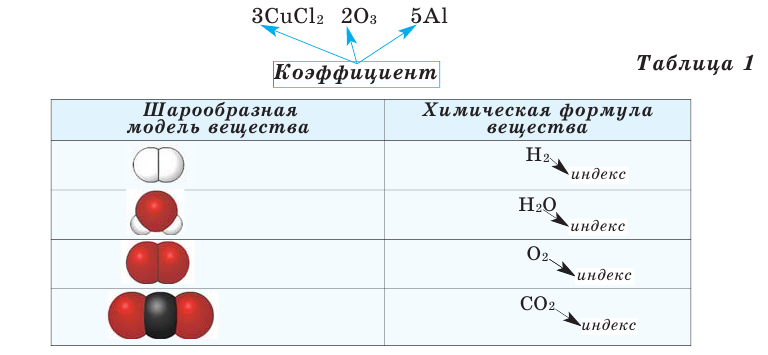
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).
Пользуясь краткими названиями химических элементов, можно прочитать формулы:
Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).
Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза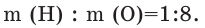
Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 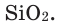

Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•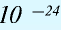

Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 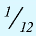
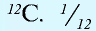
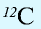

Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02•
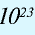
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 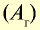 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ: 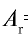
Пример №2
Какой будет масса (г) 0,301 • 
Решение. 6,02 •
Тогда, если 6,02 • 

Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 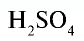
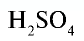
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (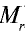
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (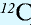
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 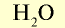 |
18 | 1 | 6,02• |
| Углекислый газ | 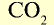 |
44 | 1 | 6,02• |
| Серная кислота | 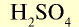 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность:
Решение.
1) 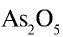
2) 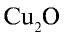
3) 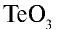
4) 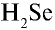
5) 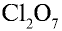
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 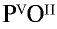
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 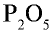
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
Например, валентность углерода в 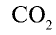
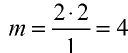
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 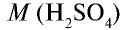
2) вычислим количество вещества n по формуле
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество |  |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
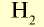 |
2 | 2 | 22,4 | 6,02• |
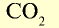 |
44 | 44 | 22,4 | 6,02• |
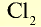 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 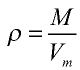
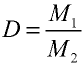
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 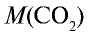
2) вычислим объем 22 г 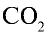
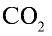
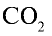
Ответ: 22 г 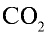
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
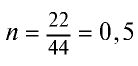
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(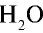
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 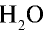
90г 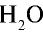
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{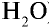
2) вычислим количество вещества в 1000 г воды:
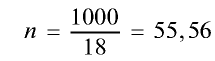
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02•
Ответ: в 1 л воды содержится 55,56 моля, 334,4 • 
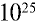
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г 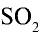
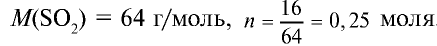
2) вычислим, какой объем займут 16 г (или 0,25 моля) 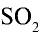
Ответ: 16 г 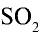
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
2) определим плотность метана относительно водорода:
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
2) вычислим плотность газовой смеси относительно водорода:
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(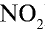
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
следует, что М(белый фосфор) = 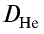
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента:
Эквивалентность оксида выражается формулой: 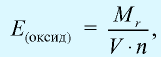
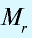
Эквивалентность оснований выражается формулой:
где 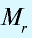
Эквивалентность кислот выражается формулой: 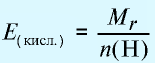
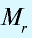
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 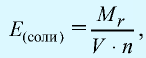
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
2) найдем эквивалентность железа в трехвалентных соединениях:
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
2) определим эквивалентность меди, пользуясь формулой
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 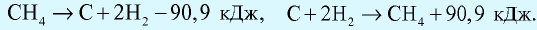
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования 
Решение.
Запишем реакцию горения аммиака:
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
Валентность химических элементов

4.5
Средняя оценка: 4.5
Всего получено оценок: 5196.
4.5
Средняя оценка: 4.5
Всего получено оценок: 5196.
При рассмотрении химических элементов можно заметить, что количество атомов у одного и того же элемента в разных веществах разнится. Каким же образом правильно записать формулу и не ошибиться в индексе химического элемента? Это легко сделать, если иметь представление, что такое валентность.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов
Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Рассмотрим другой пример: валентность углерода в метане равна четырем, валентность водорода – всегда единица. Следовательно, рядом с водородом следует поставить индекс 4. Таким образом формула метана выглядит так: CH4 .
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H2O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
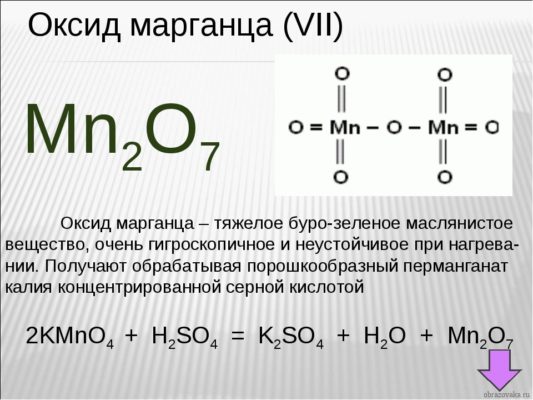
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn2O7
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
2*7=14
Получившееся число делим на количество атомов марганца в соединении. Получается:
14:2=7
7 (VII) – валентность марганца в данном соединении
Что мы узнали?
В данной теме раскрывается информация о том, что такое валентность. Валентность – способность образовывать химические соединения посредством присоединения к атомам одного элемента атомов другого элемента. Валентность бывает постоянная и переменная. Зная валентность того или иного элемента, можно легко научиться записывать формулы соединений.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Дмитрий Кравцов
10/10
-
Радмир Курманаев
10/10
-
Татьяна Никонова
7/10
-
Алёна Солдатова
8/10
-
Александр Котков
10/10
-
Вадим Квасов
10/10
-
Юлиана Сороко
9/10
-
Оксана Данилова
10/10
-
Василиса Трибунская
10/10
-
Елена Кудинова
7/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 5196.
А какая ваша оценка?
Вы знаете, чем простые вещества отличаются от сложных? Напомню, что молекулы простых веществ состоят из атомов одного вида (сера S, золото Au, кислород O2), а сложные – из атомов разных видов (вода Н2О, фосфорная кислота Н3РО4, этиловый спирт С2Н5ОН). Тут резонно задать вопросом, а почему атомы не соединятся один с одним, ведь так всё будет гораздо проще, мы получим вещества с формулами вида НО, HS, CaOH и так далее. Но это решительно невозможно потому, что в дело вступает валентность.
Напомню, что валентность – это способность атома образовывать химическую связь. Вот представьте, что атом водорода хочет соединиться с атомом кислорода (это будет вода). И тут проблема:
водород всегда имеет валентность I, а кислород всегда имеет валентность II.
Это означает, что один атом водорода может образовать только одну связь и не больше. А атому кислорода подавай две и не меньше! Как же быть? А давайте-ка одному предложим соединиться с двумя атомами водорода. Это будет выглядеть так: Н-О-Н. Здесь тире означает ту самую химическую связь. И, как видно из этой простой схемы, все счастливы: каждый атом водорода получил одну связь, а единственный атом кислорода радостно образовал две. Таким образом, формула воды Н2О.
Перед тем, как мы начнём тренироваться, нужно запомнить две принципиально важные вещи. Мы их рассмотрим на примере оксида алюминия:
1. Валентность пишется над знаком элемента и всегда римскими цифрами. Валентность никогда не может быть дробной, это всегда целое число. Просто потому, что атома связаны одной, двумя, тремя связями. Атомы не могут быть связаны полутора, двумя с половиной или тремя четвертями связей.
2. Рядом со знаком элемента внизу справа находится индекс. Это важно запомнить! Индекс (он пишется привычной арабской цифрой) показывает, сколько атомов данного вида входит в молекулу. В нашем примере мы видим, что в молекуле оксида алюминия имеется два атома алюминия (справа внизу от знака алюминия цифра 2) и три атома кислорода (справа внизу от знака кислорода цифра 3). Индекс всегда целое число! Потому что в молекулу не может входит половина атома или полтора атома. Представьте для наглядности, что молекула – это семья, где есть родственники. В семье же не может быть две с половиной бабушки или полтора брата. По крайней мере, я таких не видела.
А теперь тренировка
Учитель химии просит
составить формулу вещества, при этом валентность атомов известна.
Напомню, что некоторые атомы, склонные к постоянству, всегда имеют одинаковую валентность. Она определяется группой, в которой атом стоит в таблице Менделеева. Так, металлы основной подгруппы первой группы всегда имеют валентность I, второй – II, третьей – III. Элементы основной подгруппы седьмой группы имеют валентность I (пока просто запомните это). Итак, нам нужно составить формулу оксида натрия. Сразу понимаем, что молекула состоит из атомов натрия и кислорода. Записываем это: NaO. Теперь вспоминаем про валентность (без неё никак): натрий – элемент основной подгруппы первой группы, имеющий валентность I, кислород тоже постоянен в привычках и имеет валентность II. Записываем и это:
Обратите внимание, что пока индексы обозначены X и Y, ведь мы же их не знаем. Репетитор по химии расскажет, что нужно найти наименьшее кратное и будет говорить всякие другие страшные слова, но мы будем действовать проще. Поставьте валентность по диагонали, превратив их в арабские цифры:
Смотрите, что произошло. Валентность кислорода II. Мы превращаем её в арабскую 2 и переносим по диагонали к натрию. Валентность натрия I. Мы превращаем её в арабскую 1 и переносим к кислороду. Вы скажете, что справа внизу от кислорода нет никаких единиц, в чём дело? А дело в том, что если в молекуле уже есть атом, то понятно, что он есть и он один. Мы же в формуле указали, что кислород присутствует, значит, он и есть в единственном числе. Таким образом формула оксида натрия Na2О.
Другой случай. Нам нужна формула оксида цинка. Кислород с валентностью II встречается с цинком, который тоже всегда имеет валентность II. Это идеальная пара, смотрите:
Цинк образует две связи и кислород образует две связи, значит, им больше ничего не нужно, эти два атома свяжутся друг с другом с помощью двух связей. Не надо ничего переносить по диагонали, достаточно понять, что если валентности равны, то атомы соединяются один к одному, то есть формула оксида цинка ZnO.
Теперь разберём пример посложнее. В учебнике химии задание: составить формулу оксида железа (III). Обратите внимание, что тут указана валентность железа. Так пишут в случае, когда элемент может обладать разной валентность. Например, желез может быть двухвалентным или трёхвалентным. Чтобы было понятно, о каком именно идёт речь, валентность указывают в скобках. Итак, действуем привычным способом:
Что мы видим? Валентности, увы, разные, следовательно атомы не соединяются один к одному. Тогда без колебаний действуем как в первом примере: используем перенос по диагонали. Валентность железа III превращаем в арабскую 3 и приписываем справа внизу к кислороду. Валентность кислорода II превращаем в арабскую 2 и приписываем внизу справа к железу. Вуаля!
Вот так симпатично и выглядит оксид железа (III) Fe2О3!
Продолжаем. Хотите узнать формулу оксида серы (VI)? Это просто. Давайте сразу запишем:
Тут придётся слегка напрячься. По идее мы можем сделать перенос по диагонали и получить формулу S2О6. Но это неверно, будьте внимательны! Дело в том, что в такой куче получается слишком много атомов, а ведь их можно просто уменьшить в два раза, получив более простую (и правильную!) формулу SО3.
Ну и в заключение ещё один пример, который может встретиться в контрольной по химии. Как выглядит оксид азота (V)? Азот, кстати, тоже любит хулиганить и выступать с разной валентностью. Конкретно в этом случае у него валентность V. Думаю, теперь уже без заумных пояснений понятно, что формула будет такой:
Ура!
Но спешу вас немного огорчить: пока мы натренировались составлять формулы, если известна валентность. В следующий раз мы будет решать обратную задачу: зная формулу, будем определять валентность. Это уже гораздо проще, так что готовьте чай и печеньки.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.