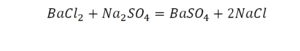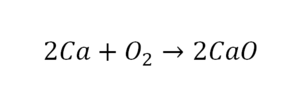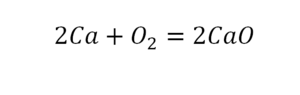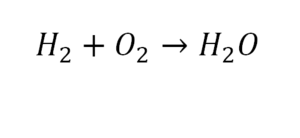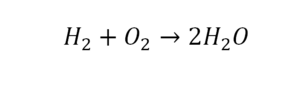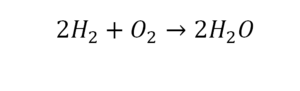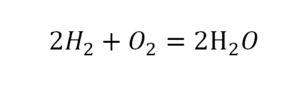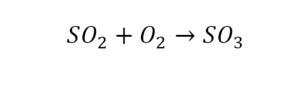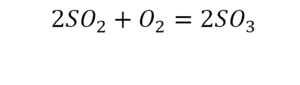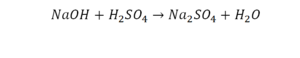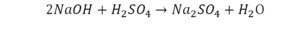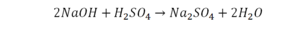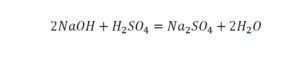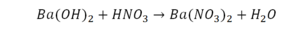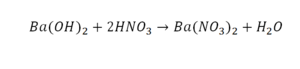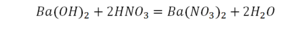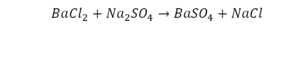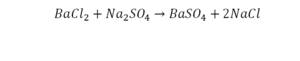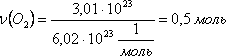Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Как определить количество атомов в молекуле?
Чтобы узнать число атомов в молекуле, достаточно знать молекулярную формулу вещества. После чего мы суммируем число всех атомов в молекуле. Число атомов конкретного химического элемента в веществе мы узнаем по нижнему индексу.
Среди простых веществ, в природе молекулы встречаются не так часто. Среди них: водород H2, азот N2, кислород O2, озон O3, йод I2. За исключением озона все эти молекулы содержат по 2 атома.
Примеры
Определить количество атомов в молекуле воды H2O.
Молекула воды содержит 2 атома водорода и 1 атом кислорода. Значит всего в молекуле содержится 3 атома.
Определить количество атомов в молекуле этана C2H6.
Молекула содержит 2 атома углерода и 6 атомов водорода. Всего в молекуле содержится 2 + 6 = 8 атомов.
Определить количество атомов в молекуле оксида азота (V) N2O5.
Молекула содержит 2 атома азота и 5 атомов кислорода. Всего в молекуле содержится 2 + 5 = 7 атомов.
Определить количество атомов в молекуле пищевой соды NaHCO3.
Молекула содержит 1 атом натрия, 1 атом водорода и 3 атома кислорода. Всего в молекуле содержится 1 + 1 + 3 = 5 атомов.
Определить число атомов в молекуле глюкозы C6H12O6.
Молекула содержит 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Всего в молекуле содержится 6 + 12 + 6 = 24 атома.
Определить число атомов в молекуле аспаргина (одна из аминокислот) C4H8O3N2.
Как видим, молекула аспаргина содержит 4 атома углерода, 8 атомов водорода, 3 атома кислорода и 2 атома азота. Всего молекула содержит 4 + 8 + 3 + 2 = 17 атомов.
Как видим, рассчитать общее число атомов в молекуле не такая уж и сложная задача.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один – справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой – нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после – всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Расчёты по уравнениям химических реакций.
Стехиометрия – количественные соотношения между вступающими в реакцию веществами.
Если реагенты вступают в химическое взаимодействие в строго определенных количествах, а в результате реакции образуются вещества, количество которых можно расчитать, то такие реакции называются стехиометрическими.
Законы стехиометрии:
Коэффициенты в химических уравнениях перед формулами химических соединений называются стехиометрическими.
Все расчёты по химическим уравнениям основаны на использовании стехиометрических коэффициентов и связаны с нахождением количеств вещества (чисел молей).
Количество вещества в уравнении реакции (число молей) = коэффициенту перед соответствующей молекулой.
Моль – это такое количество вещества, в котором содержится определённое число частиц (молекул, атомов, ионов), равное постоянной Авогадро:
Выход реакции η – отношение реальной массы продукта mp к теоретически возможной mт, выраженное в долях единицы или в процентах.
Если в условии выход продуктов реакции не указан, то в расчетах его принимают равным 100% (количественный выход).
Схема расчёта по уравнениям химических реакций:
- Составить уравнение химической реакции.
- Над химическими формулами веществ написать известные и неизвестные величины с единицами измерения.
- Под химическими формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
- Составить и решить пропорцию.
Пример. Вычислить массу и количество вещества оксида магния, образовавшегося при полном сгорании 24 г магния.
1. Составим уравнение химической реакции:
2. Под формулами веществ укажем количество вещества (число молей), которое соответствует стехиометрическим коэффициентам:
3. Определим молярную массу магния:
Относительная атомная масса магния Ar(Mg) = 24.
Т.к. значение молярной массы равно относительной атомной или молекулярной массе, то M(Mg) = 24 г/моль.
4. По массе вещества, заданной в условии, вычислим количество вещества:
5. Над химической формулой оксида магния MgO, масса которого неизвестна, ставим x моль, над формулой магния Mg пишем его молярную массу:
6. Составим пропорцию:
По правилам решения пропорции:
Количество оксида магния ν(MgO) = 1 моль.
[spoiler title=”источники:”]
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://www.calc.ru/Raschty-Po-Uravneniyam-Khimicheskikh-Reaktsiy.html
[/spoiler]
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Для
определения числа атомов (молекул) в
определенном количестве вещества
необходимо воспользоваться следующей
формулой: N = ν · NA,
где
N – число частиц (атомов или молекул).
Например,
определим количество атомов алюминия,
содержащиеся в 2 моль вещества алюминия:
N (Al) = ν (Al) · NA.
N
(Al) = 2 моль · 6,02 · 1023
= 12,04 · 1023
(атомов).
Кроме того, можно определить
количество вещества по известным числом
атомов (молекул):
.
Например,
определим количество вещества
молекулярного кислорода, которая
содержит 3,01 · 1023
молекул кислорода:.
.
.
Количество вещества определяется числом
структурных единиц (атомов, молекул,
ионов или других частиц) этого вещества.
Количество вещества обозначается
буквой.
9.
Уравнение Менделеева- Клайперона.
PV=(m/M)RT,
где R-
универсальная газовая постоянная,
равная 8,31 Дж/(К*моль)
10.
Эквивалент. Закон эквивалентов.
Эквивалент-
часть вещества, реагирующая без остатка
с одним эквивалентом водорода или вообще
с одним эквивалентом любого другого
вещества.
Закон
эквивалентов: «Вещества
взаимодействуют друг с другом в
эквивалентных количествах» , или «массы
реагирующих веществ пропорциональны
их эквивалентам либо эквивалентным
массам (объемам): m1/m2=
Э1/Э2».
11.
Значения эквивалентов водорода и
кислорода.
Эm(Н2)=1
г/экв
Эm(О2)=
8 г/экв
12.
Молярная масса эквивалента, молярный
объем эквивалента.
Молярная
масса эквивалента элемента в соединении
не является величиной постоянной,
зависит от валентности элемента в данном
соединении и выражается уравнением:

где
М – молярная масса элемента, г/моль; Z –
валентность элемента в данном соединении;
1/z – фактор эквивалентности
Эквивалентный
объем или объем моля эквивалента Vэ(X)
– это объем, который занимает один моль
эквивалентов газообразного вещества
при нормальных условиях (н.у.).
13.
Эквивалент кислоты, основания, соли.
Кислоты:
определяется отношением Mr
основания к числу атомов водорода в
формуле кислоты, способных заместиться
на металл (основность кислоты). Например
эквивалент серной кислоты Н2SO4=
98/2= 49 (1/2*М)
Основания:
определяется отношением Mr
основания к числу гидроксильтных групп
ОН в формуле основания, способных
заместиться на кислотный остаток
(кислотность основания). Например,
эквивалент едкого натра равен ЭNaOH=
40/1= 40, т.е. у этого вещества значения
эквивалента и молекулярной массы
совпадают. (1/3*М)
Соли:
определяется как частное от деления Mr
соли на суммарный заряд катионов. Так,
эквивалент сульфата аллюминия ЭAl2SO4=
342/6= 57. (М/ сумм. Заряд)
Оксида:
равен сумме эквивалентов кислорода и
элемента, образующего данный оксид.
Например, эквивалент оксида аллюминия
равен: Al2O3=
ЭAl+
ЭО. Поскольку алюминий трехвалентен,
то ЭAl=
ArAl/B=
27/3=9, следовательно, ЭAl2O3=
9+8=17. Тоже получим, разделив Mr
оксида на суммарный заряд катионов
металла: 102/6=17.
14.
Закон Авогадро. Следствия из закона
Авогадро.
Закон:
«В равных объемах любых газов при
одинаковых условиях содержится одинаковое
число молекул» .
Следствия:
–
одинаковое число молекул различных
газов при одинаковых условиях ( давлении
и температуре) занимает одинаковый
объем.
–
один моль любого газа при определенных
условиях занимает постоянный объем.
15.
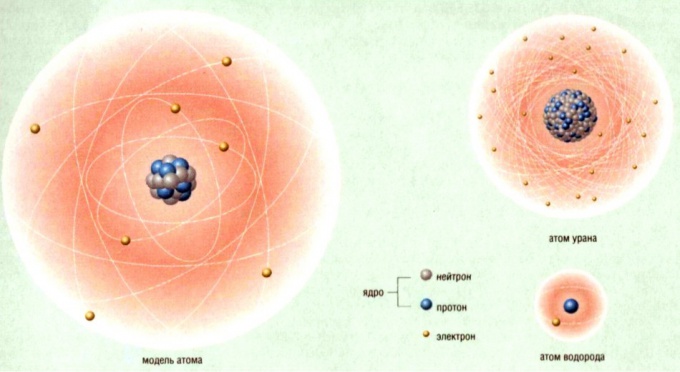
Строение атома: модель Томпсона.
В
атоме Томсона положительное электричество
«размазано» по сфере, в которую вкраплены,
как изюм в пудинг, электроны. В простейшем
атоме водорода электрон находится в
центре положительно заряженной сферы.
При смещении из центра на электрон
действует квазиупругая сила
электростатического притяжения, под
действием которой электрон совершает
колебания. Частота этих колебаний
определяется радиусом сферы, зарядом
и массой электрона, и если радиус сферы
имеет порядок радиуса атома, частота
этих колебаний совпадает с частотой
колебания спектральной линии атома. В
многоэлектронных атомах электроны
располагаются по устойчивым конфигурациям,
рассчитанным Томсоном. Томсон считал
каждую такую конфигурацию определяющей
химические свойства атомов. Он предпринял
попытку теоретически объяснить
периодическую систему элементов Д. И.
Менделеева. Эту попытку Бор позднее
назвал «знаменитой» и указал, что со
времени этой попытки «идея о разделении
электронов в атоме на группы сделалась
исходным пунктом и более новых воззрений».
Отметив, что теория Томсона оказалась
несовместимой с опытными фактами, Бор
тем не менее считал, что эта теория
«содержит много оригинальных мыслей и
оказала большое влияние на развитие
атомной теории».
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Молекулярно-кинетическая теория (МКТ) — раздел молекулярной физики, изучающий свойства вещества на основе представлений об их молекулярном строении и определенных законах взаимодействия между атомами (молекулами), из которых состоит вещество.
Основные положения МКТ
? Все вещества состоят из молекул
Это было подтверждено с помощью фотографий, полученных с использованием электронного микроскопа.
? Между молекулами есть промежутки
Существование промежутков доказывают разные объемы жидкостей до смешивания и после нее. Так, объем смеси воды и спирта меньше суммы объемов воды и спирта до их смешивания.
При нагревании промежутки между молекулами увеличиваются, а при охлаждении уменьшаются. Исключение составляет вода и резина. У воды промежутки между молекулами при охлаждении увеличиваются. У резины промежутки между молекулами при нагревании уменьшаются.
? Молекулы движутся
Движение молекул доказывает существование явления диффузии.
Определение
Диффузия — перемешивание веществ без постороннего воздействия.
Чем быстрее молекулы движутся, тем выше температура вещества. И наоборот. Поэтому скорость диффузии зависит от температуры вещества.
Броуновское движение — тепловое движение частиц под действием молекул вещества, в котором эти частицы взвешены.
?Молекулы взаимодействуют
Доказательством служит склеивание двух плоских стекол, смоченных водой. На расстоянии, сравнимых с размерами молекул, заметнее проявляется притяжение. При уменьшении расстояний заметнее проявляется отталкивание.
Свойства твердых, жидких и газообразных веществ
|
Агрегатное состояние вещества |
Сохраняет объем |
Сохраняет форму |
Особые свойства |
|
Твердое тело |
+ |
+ |
– |
|
Жидкость |
+ |
– |
Текучесть |
|
Газ |
– |
– |
Летучесть |
Строение твердых, жидких и газообразных веществ
|
Твердое тело |
Жидкость |
Газ |
|
|
Строение |
|
|
|
|
Расстояние между молекулами |
Сравнимо с размером молекул |
Чуть больше, чем в твердом состоянии |
Многократно превышает размеры молекул |
|
Характер движения |
Колебательное |
Скачкообразное |
Хаотическое |
|
Скорости молекул |
Малы |
Скорее малы |
Огромны |
|
Взаимодействие между молекулами |
Наибольшее |
Меньше, чем у твердых тел |
Наименьшее |
Важно! Химический состав молекул не зависит от агрегатного состояния.
Микроскопические параметры вещества
К микроскопическим параметрам вещества относят параметры одной частицы этого вещества.
Относительная атомная масса
Определение
Относительная атомная масса — значение массы атома, выраженное в атомных единицах массы (а.е.м.).
Относительная атомная масса обозначается Ar. Это безразмерная величина, определяющаяся как отношение массы атома данного элемента к 1⁄12 массе нейтрального атома изотопа углерода 12C:
Ar=m0112m0C
m0 — масса одного атома, m0С — масса атома углерода.
Внимание! Относительную атомную массу можно узнать из таблицы Менделеева.
Пример №1. Определить по таблице Менделеева относительную атомную массу хлора.
В таблице Менделеева относительная атомная масса указывается под названием химического элемента:
Видно, что Ar = 35,453 а.е.м. При решении задач это значение обычно округляют до 35,5 а.е.м.
Относительная молекулярная масса
Определение
Относительная молекулярная масса — масса молекулы, выраженная в а.е.м.
Относительная молекулярная масса обозначается Mr. Это безразмерная величина, равная сумме относительных масс атомов, входящих в состав молекулы:
Mr=∑Ar
Пример №2. Определить относительную молекулярную массу озона.
В молекуле озона содержится 3 атома кислорода. Следовательно:
Mr=3Ar=16·3=48 (а.е.м.)
Количество вещества
Определение
Количество вещества — физическая величина, отображающая количество молекул (атомов) в веществе.
Количество вещества обозначается как ν («ню»). Единица измерения — моль.
Моль — количество вещества, в котором содержится столько же молекул (атомов), сколько содержится атомов в 12 г углерода.
Количество вещества определяется формулой:
ν=NNA
N — количество молекул (атомов) в веществе, NA — количество частиц в одном моле вещества (постоянная Авогадро).
Единица измерения постоянной Авогадро — 1/моль, или моль–1. В 1 моле содержится 6∙1023 частиц вещества. Именно столько атомов содержит 1 моль (или 12 г) углерода.
Пример №3. В баллоне находится 3∙1025 молекул газа. Определите количество вещества в баллоне.
ν=NNA=3·10256·1023=0,5∙102=50 (моль)
Молярная масса
Определение
Молярная масса — масса одного моля вещества.
Молярная масса обозначается как M. Единица измерения — килограмм на моль (кг/моль, но можно использовать и грамм на моль!). Численно молярная масса равна произведению относительной молекулярной массы на 10–3 (только для килограмма!):
M=Mr•10−3
Пример №4. Определить молярную массу озона.
Относительная молекулярная масса озона равна 48 а.е.м. Поэтому:
M=Mr•10−3=48•10−3 (кгмоль)
Масса молекулы
Масса молекулы — масса одной молекулы вещества, выраженная в килограммах (кг).
Масса молекулы обозначается как m0. Численно она равна отношению молярной массы к количеству частиц вещества в одном моле (или отношению массы вещества к количеству частиц, содержащихся в нем):
m0=MNA=mN
Отсюда отношение количества молекул к постоянной Авогадро равно отношению массы вещества к его молярной массе. Следовательно, количество вещества можно определить также формулой:
ν=mM
Пример №5. Определить массу одной молекулы озона.
m0=MNA=486•1023=8•10−23 (кг)
Плотность, масса вещества и концентрация частиц
Определение
Плотность вещества — масса одного кубического метра вещества.
Плотность вещества обозначается как ρ. Единица измерения — килограммы на кубический метр (кг/м3). Численно плотность равна отношению массы вещества к объему, который оно занимает:
ρ=mV
m — масса вещества, которое занимает объем V.
Определение
Концентрация частиц — физическая величина, равная отношению числа частиц к объему, который они занимают.
Концентрация частиц обозначается как n. Единица измерения — 1/м3. Определяется формулой:
n=NV
Поэтому плотность можно выразить через объем, равный отношению числа частиц к концентрации этих частиц:
ρ=mV=mnN
При делении массы вещества на количество содержащихся в нем частиц мы получим массу одной частицы — m0. Поэтому плотность вещества также равна:
ρ=mnN=m0n
Отсюда концентрация вещества также равна:
n=ρm0
Масса вещества определяется произведением плотности вещества на его объем (или количеством вещества на молярную массу):
m=ρV=νM
Пример №6. Определить массу 5 молей озона.
m=νM=5•48•10−3=240•10−3=0,24 (кг)
Через массу вещества можно также выразить количество этого вещества:
ν=mM=ρVM
Количество атомов и молекул
Количество молекул N определяется произведением количества вещества на число частиц в одном моле или произведением концентрации частиц на объем вещества:
Nмол=νNA=nV
Количество атомов в веществе выражается формулой:
Nатом=kNмол
k — количество атомов в одной молекуле.
Пример №7. В баллоне находится 4 моль газа. Сколько примерно молекул газа находится в баллоне?
Nмол=νNA=4∙6∙1023=24∙1023 (молекул)
Подсказки к задачам
Если двухатомный газ перешел в одноатомное состояние, то 1 моль газа превращается в 2 моля:
ν2 = 2ν1
Но молярная масса при этом уменьшается вдвое:
M2 = 0,5M1
Чтобы перевести плотность из г/см3 в кг/м3, нужно умножить ее значение в г/см3 на 1000:
1 г/см3∙1000 = 1 кг/м3
Если 1 каплю масла объемом V вылить в воду, и она растечется, образовав пленку толщиной в 1 молекулу и площадью S, то диаметр молекулы d будет равен:
d=VS
Объем капли можно вычислить по формуле:
V=mρ
Площадь пятна:
S=πR2=πD24
Задание EF18524
Расстояние между молекулами вещества много больше размеров самих молекул. Двигаясь во всех направлениях, молекулы быстро распределяются по всему сосуду. В каком состоянии находится вещество?
Ответ:
а) в газообразном
б) в жидком
в) в твёрдом
г) в газообразном или жидком
Алгоритм решения
- Выделить из описания параметры, характер которых может указывать на вид агрегатного состояния вещества.
- Установить, какому агрегатному состоянию соответствуют указанные значения этих параметров.
Решение
В условиях задачи обозначается:
- расстояние между молекулами вещества;
- характер движения молекул;
- свойство вещества, связанное с характером заполнения им сосуда.
Если расстояние между молекулами намного больше размеров самих молекул, то вещество находится в газообразном состоянии. Это подтверждают хаотичное движение молекул и способность вещества заполнять весь предоставленный ему объем.
Ответ: а
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18208
Молекулы газов находятся в среднем на больших расстояниях друг от друга по сравнению с их размерами, силы взаимодействия между ними незначительны. Этим можно объяснить следующие свойства газов.
А. Газ не сохраняет своей формы.
Б. Газ не сохраняет своего объёма.
В. Газ имеет большую сжимаемость.
Какое(-ие) из утверждений правильно(-ы)?
Алгоритм решения
- Установить, как влияет большое расстояние между молекулами на свойства газов.
- Выбрать правильные варианты ответов и записать их в алфавитном порядке.
Решение
Так как между молекулами газа большое расстояние, они слабо взаимодействуют друг с другом. Практически полное отсутствие сил притяжения позволяет двигаться им хаотически, что способствует быстрому заполнению газом объема сосуда. Причем неважно, какой объем и какую форму имеет сосуд. Следовательно, верными ответами можно считать как А, так и Б.
Теперь проверим последний вариант. Газы действительно обладают большой сжимаемостью. Это можно объяснить тем, что отталкиваются молекулы при расстояниях, которые меньше размеров самих молекул. Но в газах это расстояние намного больше. Поэтому, прежде чем возникнет отталкивание, газ можно будет легко сжать в несколько раз. Следовательно, ответ В тоже верен.
Ответ: АБВ
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 4.7k