
Единицы измерения в химии
После изучения статьи Вы узнаете, сколько весят атомы, как вычислить количество атомов по массе вещества
и как прочитав этикетку узнать, сколько веществе находится в растворе
Сколько весит атом?
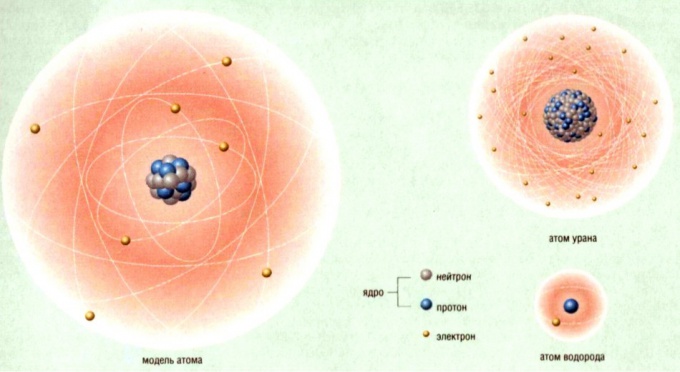
Атомная единица массы (а.е.м) [u] – единица измерения массы используемая в химии для выражения массы атомов,
например, атом водорода (1H) весит 1,00794u, атом ванадия (23V) – 50,9415u и так далее.
1 u ≈ 1.660 5402(10) × 10 −27 kg.
В расчётах не очень удобно использовать дальтоны, поэтому ввели относительную массу атома – атомная масса.
Атомная масса – это отношение массы атома к 1⁄12 массы атома углерода и величина безразмерная.
Атомная масса для каждого элемента записана в таблице Менделеева.
Сколько атомов в грамме вещества?
В одном грамме хлора содержится 93,03 × 1023 молекул, опять же для удобства расчётов была
введена единица измерения “моль”. Моль – это 6,022 140 857(74) × 1023 единиц. В молях можно измерять что
угодно, 1 моль людей – это 6,022 140 857(74) × 1023 людей. Данное число называется числом Авогадро,
оно было рассчитано как количество атомов в 12 граммах углерода.
Поскольку а.е.м. и моль были рассчитаны исходя из массы углерода, следует запомнить следующие соотношения:
- 1 а.е.м. = 1⁄12 массы углерода в граммах
- 1 моль = количество атомов в 12 граммах углерода
Как можно использовать данные соотношения? Если мы возьмём атомную массу любого элемента, отношение грамм/моль будет
численно равно данному числу: масса серы – 32,066 а.е.м., значит один моль серы весит 32,066 грамм.
Концентрация
Концентрацией называют количество/массу/объём вещества растворённого в воде или другом растворе. Для расчётов
используют различные отношения: г/моль, моль/л, моль/кг и другие. Наиболее популярные – это ppm (частей на
миллион), моляльность – моль/кг и молярность – моль/л. Необходимо запомнить, что концентрация считается
как доля/масса/объём растворённого вещества к доле/массе/объёму всего раствора. Например “Раствор хлорида натрия 0,9%”
означает, что в 991 граммах воды размешали 9 грамм хлорида натрия. “Раствор пероксида водорода 3%” (перекись
водорода) означает, что в 97 граммах воды растворено 3 грамма пероксида водорода.
Вам понравилась статья?
/
Просмотров: 10 399
Грамм атом и грамм молекула
Грамм-атом и грамм-молекула являются химическими мерами веса, широко применяющимися в расчетах.
Грамм-атомом (г-атом) называется количество граммов элемента, численно равное его атомному весу. Например, если атомный вес кислорода равен 16 у.е., то грамм-атом кислорода равен 16 г. Если атомный вес серы равен 32 у.е., то ее грамм-атом равен 32 г. Грамм-атом водорода равен 1 г.
Если сравнить между собой грамм-атомы различных элементов, то нетрудна прийти к выводу, что в них содержится одинаковое число атомов. Например, возьмем 1 г водорода и 1 г кислорода. Если сравнить между собой атомы кислорода и водорода по весу, то атом кислорода в 16 раз тяжелее атома водорода, поэтому в 1 г водорода будет содержаться в 16 раз больше атомов, чем в 1 г кислорода, а чтобы иметь столько же атомов кислорода, сколько имеется атомов водорода в 1 г водорода, надо взять 16 г кислорода.
На 1г водорода — это грамм-атом водорода, а 16 г кислорода — это грамм-атом кислорода. Следовательно, в грамм-атомах водорода и кислорода содержится одинаковое количество атомов. Так как подобное рассуждение можно провести для любого элемента, то ясно, что в грамм-атоме любого элемента содержится одно и то же число атомов.
Грамм-молекулой (или молем) называется количество граммов вещества, численно равное его молекулярному весу. Например, 1 моль Н2O равен 18 г.
В 1 моле любого вещества содержится одно и то же число молекул. Это число, равное количеству атомов в грамм-атоме и высчитанное итальянским химиком Авогадро, равно 6,02-1023 частиц. Оно получило название числа Авогадро.
Если нужно вычислить, в каком количестве едкого натра NaOH содержится столько же молекул, сколько в 9 г воды, то поступают так:
1 моль NaOH = 23 + 16 + 1 = 40г 1 моль Н2О = 2+16=18г
Далее подсчитывают, какую долю грамм-молекулы воды составляют 9 г:
9:18 = 0,5 моля.
Так как в 1 моле любого вещества содержится одинаковое число молекул, то в равных долях грамм-молекул разных веществ также содержится одно и то же число молекул. Очевидно, чтобы иметь столько же молекул NaOH, сколько их содержится в 0,5 моля воды, мы должны взять 0,5 моля NaOH, т. е. 40 · 0,5 = 20 г едкого натра.
■ 1. Что такое грамм-атом? (См. Ответ)
2. Что такое грамм-молекула?
3. Правильно ли сказать: а) что 1 г кислорода и 1 грамм-атом кисло-
рода — это одно и то же; б) что 1 г водорода и 1 грамм-атом водорода — это одно и то же? Почему?
4. Как доказать, что в 1 грамм-атоме любого элемента содержится
одно и то же число атомов?
5. Что такое число Авогадро?
6. В каком количестве меди Си содержится столько же атомов, сколько их находится в 16 г серы S? (См. Ответ)
7. Сколько нужно взять серной кислоты H2SO4 чтобы иметь столько же молекул, сколько их содержится в 9 г воды? (См. Ответ)
2. Расчеты по формулам
Пользуясь понятием о грамм-атоме и грамм-молекуле, можно производить простейшие расчеты.
Пример 1. Рассчитайте, сколько железа Fe содержится в 116 г магнитной окиси железа Fe3O4.
Дано: 116 г Fe3O4
Найти: Fe (г) ?
Решение:
Атомный вес железа равен 56 у.е.; 1 грамм-атом = 56 г. Атомный вес кислорода равен 16 у.е.; 1 грамм-атом О = 16 г. Молекулярный вес магнитной окиси железа равен
56 · 3+ 16 · 4 = 232 у. е.
1 моль Fe3O4 = 232 г. Далее рассуждаем так: в 232 г Fe3O4 содержится 56-3 = 168 г Fe » 116 » Fe3O4 » х » Fe,
где за х принимается неизвестное количество железа, содержащееся в 116 г.
Составим и решим пропорцию: 232:116 = 168 : x
x = (168 · 116) : 232 = 84 г Fe
Ответ: в 116 г магнитной окиси железа содержится 84 г железа.
Пример 2. В каком количестве окиси ртути HgO содержится 100 г ртути Hg.
Дано: 100 г Hg
Найти: HgO (г) ?
Решение:
Атомный вес ртути равен 200 у.е.; 1 грамм-атом Hg = 200 г.
Атомный.вес кислорода равен 16 у.е.; 1 грамм-атом О = 16 г. Молекулярный вес окиси ртути равен 200 + 16 = 216 у.е.; 1 моль HgO = 216 г.
Примем неизвестное количество окиси ртути за х. Далее рассуждаем так: в 216 г HgO содержится 200 г Hg » x » HgO » 100 » Hg
Составим и решим пропорцию:
216 : x = 200:100
x = (100 · 216) : 200 = 108 г HgO
Ответ: 100 г ртути содержится в 108 г окиси ртути.
Пример 3. Сколько грамм-атомов железа Fe содержится в 4 молях сульфида железа FeS?
Дано: 4 моля FeS
Найти: Fe (г-атом)?
Решение:
Примем неизвестное количество грамм-атомов железа за х. Далее рассуждаем так.
В 1 молекуле сернистого железа содержится 1 атом железа.
Следовательно, в 1 моле FeS содержится 1 грамм-атом железа. Но у нас не один, а 4 моля FeS. В данном случае и без пропорции ясно, что в 4 молях FeS содержится 4 грамм-атома железа.
Пример 4. В каком количестве грамм-молекул медного купороса CuSO4 содержится 2 грамм-атома кислорода?
Дано: 2 грамм-атома О
Найти: CuSO4 (моль) ?
Решение:
Примем неизвестное количество грамм-молекул медного купороса за х. Далее рассуждаем так: в 1 молекуле CuSO4 содержится 4 атома О. Следовательно, в 1 моле CuSO4 содержится 4 грамм-атома О, а в х молях CuSO4 содержится 2 грамм-атома О.
Составим и решим пропорцию: 1 : x = 4 : 2;
x = (2 · 1) : 4 = 0,5 моля CuSO4
Ответ: в 0,5 моля медного купороса содержится 2 грамм-атома кислорода.
Пример 5. Сколько граммов натрия Na содержится в 6 молях поваренной соли NaCl?
Дано: 6 молей NaCl
Найти: Na (г) ?
Решение:
В 1 молекуле NaCl содержится 1 а том Na, а в 1 моле NaCl содержится 1 грамм-атом Na. Соответственно в 6 молях NaCl содержится 6 грамм-атомов Na.
Итак, мы определили количество натрия, но только в грамм-атомах, а нам требуется определить его в граммах. Для этого нужно проделать несложный расчет, чтобы перевести грамм-атомы в граммы. Атомный вес Na23 у.е.; 1 грамм-атом Na = 23 г, а у нас 6 грамм-атомов Na. Их вес 23 · 6 = 138 г.
Ответ: в 6 молях поваренной соли содержится 138 г натрия.
Пример 6. Сколько грамм-атомов железа Fe содержится в 304 г железного купороса FeSO4?
Дано: 304 г FeSO4
Найти: Fe (г-атом) ?
Решение:
Рассчитаем сначала, какое количество граммов железа содержится в 304 г FeSO4. Атомный вес железа равен 56 у.е.; 1 грамм-атом Fe равен 56 г.
Атомный вес серы равен 32 у.е.; 1 грамм-атом S равен 32 г. Атомный вес кислорода равен 16 у.е.; 1 грамм-атом кислорода равен 16 г.
Грамм-молекула FeSO4 равна 56 + 32 + 16 · 4 = 152 г.
в 152 г FeSO4 содержится 56 г Fe » 304 » FeSO4 » х » Fe
Составим и решим пропорцию: 152 : 304 = 56 : x.
x = (304 · 56) : 152 = 112 г Fe.
Теперь надо перевести граммы железа в грамм-атомы. 1 грамм-атом Fe = 56 г, следовательно, 112 г составляют 2 грамм-атома Fe.
Ответ: в 304 г железного купороса содержится 2 грамм-атома железа.
■ 8. Сколько граммов железа содержится в 44 г сульфида железа FeS? (См. Ответ)
9. В каком количестве карбоната меди CuCO3 содержится 32 г меди Сu?
10. Сколько грамм-атомов кислорода содержится в 5 молях воды?
11. Сколько граммов серебра содержится в 7 молях нитрата серебра AgNO3?
12. Сколько грамм-атомов ртути содержится в 434 г окиси ртути HgO? (См. Ответ)
3. Расчеты по уравнениям реакций
Пользуясь понятиями «грамм-атом» и «грамм-молекула», можно производить расчеты по уравнениям реакций.
По уравнениям реакций можно рассчитать количество образующегося продукта реакции или количество сырья, необходимого для получения того или иного продукта.
Пример 1. Определите, какое количество ртути Hg образуется при разложении 21,6 г окиси ртути HgO.
Дано: 21,6 г HgO
Найти: Hg (г) ?
Решение:
При решении таких задач прежде всего необходимо написать уравнение реакции:
2HgO = 2Hg + O2
Вещество, количество которого нам дано, мы подчеркнем одной чертой, а то вещество, которое требуется определить,— двумя чертами и под ними поставим грамм-молекулярный вес этих соединений. Если имеется коэффициент, грамм-молекулярный вес на него умножается:
2HgO : (216 · 2) = 2Hg : (200 · 2) + O2
Затем производим расчет. По нашему уравнению из 432 г HgO получается 400 r Hg, а из 21,6 г HgO получается х г Hg
x = (21,6 · 400) : 432 = 20 г Hg
Ответ. Из 21,6г HgO можно получить 20 г Hg.
Пример 2. Какое количество железа потребуется для вытеснения 0,5 грамм-атома меди Сu из медного купороса CuSO4?
Дано: 0,5 г-атома Сu
Найти: Fe (г) ?
Решение:
Последовательность решения совершенно такая же, как и в предыдущей задаче. Разница лишь в том, что в первой задаче нужно было определить вес продукта реакции по исходному веществу, а здесь, наоборот, определяется количество исходного вещества по продукту реакции. Составляем уравнение реакции и подчеркиваем нужные нам вещества:
Fe : (56г) + CuSO4 = FeSO4 + Cu : (64г)
Здесь за х мы примем неизвестное количество железа. Рассуждаем следующим образом. По уравнению реакции для вытеснения 1 грамм-атома меди требуется 1 грамм-атом железа. Соответственно для вытеснения 0,5 грамм-атома меди необходимо 0,5 грамм-атома железа, которые составляют 56 · 0,5 = 28 г.
Ответ: для вытеснения 0,5 грамм-атома меди требуется 28 г железа.
■ 13. Какое количество жженой магнезии MgO образуется при сжигании магния Mg в 5 молях кислорода O2? (См. Ответ)
14. Сколько алюминия Аl потребуется для получения 51 г окиси алюминия Аl2O3 при окислении алюминия кислородом воздуха?
15. Сколько сульфида ртути HgS получится при растирании с серой 2 г ртути Hg?
16. Сколько грамм-молекул воды получится при сжигании в кислороде 7 грамм-молекул водорода Н2? (См. Ответ)
Статья на тему Грамм атом грамм-молекула
Атомы чрезвычайно малы относительно масштаба человеческой жизни. Ученые используют единицу, называемую кротом, для описания большого количества атомов и других мелких вещей. Один моль равен 6, 022 х 10 ^ 23 частиц. Этот номер называется номером Авогадро. Эти частицы могут быть отдельными атомами, молекулами соединения или любой другой наблюдаемой частицей. Чтобы рассчитать количество атомов в одном граммовом образце любого вещества, вы должны рассчитать число молей этого вещества на основе его молярной массы. Затем вы можете использовать число Авогадро для расчета количества частиц.
Реальное приложение
Реальное применение числа Авоградо применимо к знаковому примеру исследования плотности того, что весит больше: тонны пера или тонны чего-то очень тяжелого, например, кирпича или металлических гирь. Более легкие перья требуют большего количества, чтобы создать ту же плотность, что и более тяжелые объекты.
Найти атомную массу
Прежде чем определять атомную массу, вам нужно посмотреть элементы в периодической таблице и отметить их атомные массовые числа под химическим символом элемента. Чистые элементы имеют атомную массу, которая также является молярной массой или количеством граммов на моль.
Добавить атомную массу
Сначала добавьте атомную массу каждого атома в соединении. Атомная масса элемента – это масса одного моля этого элемента. Атомные массы даны в атомных единицах массы. Одна атомная единица массы равна одному грамму на моль. Когда вы сложите их вместе для соединения, вы получите молярную массу этого соединения. Например, диоксид кремния состоит из одного атома кремния и двух атомов кислорода. Атомная масса кремния составляет 28 грамм, а атомная масса кислорода составляет 16 грамм. Следовательно, общая масса одного моля диоксида кремния составляет 60 грамм.
Разделите число родинок
Разделите один грамм на молярную массу соединения. Это дает количество молей соединения в одном граммовом образце. Например, один грамм диоксида кремния, разделенный на 60 грамм на моль, дает около 0, 0167 моля диоксида кремния.
Умножьте на число Авогадро
Затем умножьте количество родинок на число Авогадро. Эта формула дает количество молекул в одном грамме. Например, 0, 0167 моль диоксида кремния, умноженное на 6, 022 × 10 23, соответствует примерно 1 × 10 22 молекулам диоксида кремния.
Умножить на номер атома
Наконец, умножьте на количество атомов в одной молекуле. Например, каждая молекула диоксида кремния содержит три атома. Следовательно, в одном грамме диоксида кремния содержится около 3 х 10 ^ 22 атомов.
Как найти количество атомов в веществе
Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023.
Вам понадобится
- Для определения количества атомов в веществе возьмите точные весы (рычажные или электронные), таблицу Менделеева, манометр, термометр.
Инструкция
Определение количества атомов в чистом веществе
Взвесьте образец исследуемого вещества на точных весах, результат получите в граммах. Убедитесь, что оно состоит из одноатомных молекул. Затем, используя таблицу Менделеева, найдите молярную массу исследуемого вещества, выраженную в граммах на моль. Для этого найдите элемент, соответствующий веществу, из которого состоит тело, и запишите его молекулярную массу. Она и будет равна молярной массе, выраженной в граммах на моль. Например, для железа (Fe) это 55,845 г/моль. Если же точно известен изотоп, например железо 55, то можно брать целое число, правда, чистые изотопы зачастую радиоактивны. Затем массу вещества поделите на его молярную массу, а результат умножьте на 6,022*10^23. Это и будет количество атомов в данной массе вещества.
Количество атомов в сложном веществе
Если вещество состоит из многоатомных молекул, например, вода, молекула которой состоит из одного атома кислорода и двух атомов водорода, сделайте следующую последовательность действий. С помощью весов найдите массу образца. Затем запишите его химическую формулу, и с помощью таблицы Менделеева найдите молярную массу каждого из атомов, из которых состоит молекула. В случае с водой это будет водород – 1 грамм на моль, и кислород – 16 грамм на моль. Поскольку водорода 2 атома, умножьте молярную массу на это число, в результате получите общую молярную массу 18 грамм на моль. Затем массу в граммах делим на молярную массу в граммах на моль и умножаем на 6,022*10^23. Результатом будет количество молекул в веществе, это число умножьте на количество атомов в одной молекуле (для воды оно равно 3).
Количество атомов в смесях и сплавах
Если вещество представляет собой смесь нескольких веществ с известными массовыми долями, измерьте его общую массу. Затем найдите массы чистых веществ, умножив массу на соответствующие доли. Например, если бронза содержит 70% меди и 30 % олова, но для получения массы меди умножьте массу образца на 0,7, а для получения массы олова умножите массу образца на 0,3. Далее действуйте, как описано в предыдущих пунктах.
Количество атомов в газе
Если газ находится в нормальных условиях (давление 760 мм рт. ст. и температура 00С), определите объем этого газа геометрическими методами (например, чтобы найти объем газа в комнате, представляющей собой параллелепипед, перемножьте длину, ширину и высоту), выразив его в кубических метрах. Полученное число поделите на 0,0224 и умножьте на 6,022*10^23. Если молекула газа двухатомная, умножьте результат на 2.
Если известны давление, объем и температура газа (давление измеряется манометром, а температура термометром), то найдите произведение давления в Паскалях на объем в куб. метрах, поделите на значение температуры в Кельвинах, и число 8,31. Полученный результат умножьте на 6,022*10^23 и количество атомов в молекуле газа.
Видео по теме
Обратите внимание
Как найти количество атомов в веществе. Чтобы найти количество атомов в веществе, определите, что это за вещество. Затем найдите его массу и молярную массу. После чего отношение массы и молярной массы умножьте на число Авогадро, которое равно 6,022*1023. Вам понадобится.
Полезный совет
Метод основан на связи между атомной (или молекулярной) массой кристаллического вещества, его плотностью, числом Авогадро и неким коэффициентом, который определяют из расстояний между атомами в кристаллической решетке. Зная это число, можно различными способами, которые и были испробованы в 1908-1910 гг., найти число N. Можно собрать α-частицы в цилиндре Фарадея, измерить их заряд и, разделив его на число частиц, получить заряд каждой из них; половина его дает нам элементарный заряд, по которому уже определяется число N…
Источники:
- как определить количество атомов
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
An atom is an element. The two words are synonymous, so if you’re looking for the number of atoms in an element, the answer is always one, and only one. Scientists know of 118 different elements, which they categorize in the periodic table, a diagram that arranges them in increasing order according to the number of protons in their nuclei. This arrangement allows you to answer a significant question at a glance: “What is the number of protons in a particular element?” To answer that, you simply need to look at the place the element occupies in the chart. The place number corresponds to the number of protons.
TL;DR (Too Long; Didn’t Read)
If you have a sample that contains atoms of a single element, you can find the number of atoms by weighing it.
Elements That Form Diatomic Molecules
Some atoms can form covalent bonds with other atoms of the same element to form diatomic molecules. The best known is oxygen (O). A single oxygen atom is highly reactive, but when it forms a bond with another oxygen atom to form O2, the combination is more stable. This is the form in which oxygen exists in the earth’s atmosphere. Four other elements can combine in this way at standard temperature and pressure. They include nitrogen (N), which is the most abundant element in the atmosphere, hydrogen (H), chlorine (Cl) and fluorine (F). Two other elements, bromine (Br) and iodine (I), can form diatomic molecules at higher temperatures. All diatomic molecules contain two atoms.
Noble Gases and Metals
Some atoms, such as sodium and phosphorous, are so reactive that they are never found free in nature. However, two groups of elements, the noble gases and noble metals, are stable and can exist in samples that contain only non-bound atoms of that element. For example, a container full of argon gas (Ar) contains only argon atoms, and a bar of pure gold contains only gold (Au) atoms. If you have a large sample of a noble gas or metal, you can calculate how many atoms it contains by weighing it.
In addition to these gases and metals, carbon (C) can also exist in the free state. Diamond and graphite are the two most common forms. Among non-metals, carbon is unique in its ability to exist in this way.
Counting Atoms
To calculate the number of atoms in a sample, you need to find how many moles of the element the sample contains. A mole is a unit chemists use. It’s equal to Avogadro’s number (6.02 X 1023) of atoms. By definition, the weight of one mole of an element (its molar mass) is equal to its atomic weight in grams. The atomic weight for each element is on the periodic table right under the element’s symbol. The atomic weight of carbon is 12 atomic mass units (amu), so the weight of one mole is 12 grams.
If you have a sample that contains only atoms of a particular element, weigh the sample in grams and divide by the atomic weight of the element. The quotient tells you the number of moles. Multiply that by Avogadro’s number, and you’ll find out how many atoms the sample contains.
Examples
1. How many atoms are there in one ounce of pure gold?
An ounce is 28 grams, and the atomic weight of gold is 197. The sample contains 28 ÷ 197 = 0.14 moles. Multiplying this by Avogadro’s number tells you the number of atoms in the sample = 8.43 x 1022 atoms.
2. How many oxygen atoms are there in a gas sample that weighs 20 grams?
The same procedure applies to finding the number of atoms in a diatomic gas, even though the atoms have combined to form molecules. The atomic weight of oxygen is 16, so one mole weighs 16 grams. The sample weighs 20 grams, which is equal to 1.25 moles. Therefore, the number of atoms is 7.53 x 1023.
