Загрузить PDF
Загрузить PDF
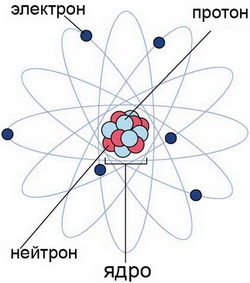
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 950 363 раза.
Была ли эта статья полезной?
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
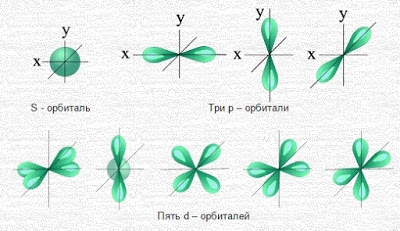
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
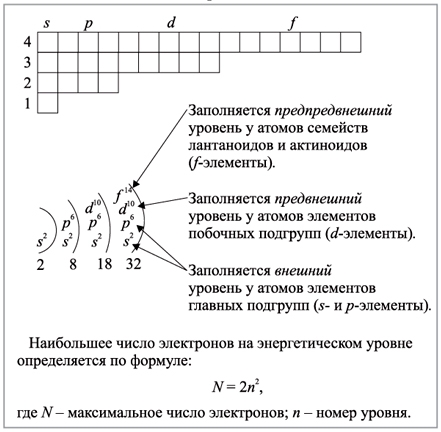
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
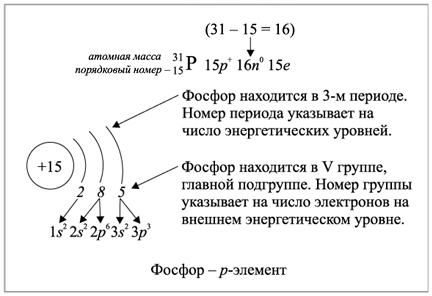
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A – Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n – номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2 * 1^2), на втором (n = 2) уровне — 8 (так как N = 2 * 2^2), на третьем (n = 3) уровне — 18 (так как N = 2 * 3^2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)
Как определить общее число электронов в атоме?
Вам важно запомнить 2 вещи:
- Атом всегда электрически нейтрален (не имеет заряда).
- Заряд ядра атома равен его порядковому номеру в периодической таблице.
Исходя из этого несложно вывести формулу числа электронов в атоме:
N (e) = N (p) = Z
Где N(e) – число электронов в атоме химического элемента, а N (p) – число протонов в ядре атома, Z – заряд ядра его атома, который равен порядковому номеру этого элемента.
Т.е. можно упростить до следующего утверждения: общее число электронов в атоме равно порядковому номеру химического элемента в периодической таблице Д. И. Менделеева.
Примеры
Общее число электронов в атоме водорода (№1) равно 1.
N(e) = N(p) = Z = 1
Общее число электронов в атоме лития (№3) равно 3.
N(e) = N(p) = Z = 3
Общее число электронов в атоме бора (№5) равно 5.
N(e) = N(p) = Z = 5
Общее число электронов в атоме углерода (№6) равно 6.
N(e) = N(p) = Z = 6
Общее число электронов в атоме азота (№7) равно 7.
N(e) = N(p) = Z = 7
Общее число электронов в атоме кислорода (№8) равно 8.
N(e) = N(p) = Z = 8
Общее число электронов в атоме фтора (№9) равно 9.
N(e) = N(p) = Z = 9
Общее число электронов в атоме натрия (№11) равно 11.
N(e) = N(p) = Z = 11
Общее число электронов в атоме магния (№12) равно 12.
N(e) = N(p) = Z = 12
Общее число электронов в атоме алюминия (№13) равно 13.
N(e) = N(p) = Z = 13
Общее число электронов в атоме кремния (№14) равно 14.
N(e) = N(p) = Z = 14
Общее число электронов в атоме фосфора (№15) равно 15.
N(e) = N(p) = Z = 15
Общее число электронов в атоме серы (№16) равно 16.
N(e) = N(p) = Z = 16
Общее число электронов в атоме хлора (№17) равно 17.
N(e) = N(p) = Z = 17
Общее число электронов в атоме аргона (№18) равно 18.
N(e) = N(p) = Z = 18
Общее число электронов в атоме калия (№19) равно 19.
N(e) = N(p) = Z = 19
Общее число электронов в хрома (№24) равно 24.
N(e) = N(p) = Z = 24
Общее число электронов в атоме марганца (№25) равно 25.
N(e) = N(p) = Z = 25
Общее число электронов в атоме железа (№26) равно 26.
N(e) = N(p) = Z = 26
Общее число электронов в мышьяка (№33) равно 33.
N(e) = N(p) = Z = 33
Общее число электронов в атоме брома (№35) равно 35.
N(e) = N(p) = Z = 35
Общее число электронов в атоме золота (№79) равно 79.
N(e) = N(p) = Z = 79
Думаю, из приведенных примеров понятно, как определять общее число электронов в атоме. Самое главное не путать такие вещи как атом/молекула/ион и общее число электронов/число электронов на внешнем энергетическом уровне.
Похожие вопросы:
– Как определить число протонов и нейтронов в атоме?
– Какие атомы имеют одинаковое число нейтронов?

Вам понадобится.
- – бумага;
- – ручка;
- – периодическая система Менделеева.
ИнструкцияЧтобы определить количество электронов, воспользуйтесь периодической системой Д.И. Менделеева. В этой таблице элементы расположены в определенной последовательности, которая тесно связана с их атомным строением. Зная, что положительный зарядатома всегда равен порядковому номеру элемента, вы легко найдете количество отрицательных частиц. Ведь известно – атом в целом нейтрален, а значит, число электронов будет равно числу протонов и номеру элемента в таблице. Например, порядковый номералюминия равен 13. Следовательно, количество электронов у него будет 13, у натрия – 11, у железа – 26 и т.д.
Если вам необходимо найти количество электронов на энергетических уровнях, сначала повторите принцип Пауля и правило Хунда. Потом распределите отрицательные частицы по уровням и подуровням с помощью все той же периодической системы, а точнее ее периодов и групп. Так номер горизонтального ряда (периода) указывает на количество энергетических слоев, а вертикального (группы) – на число электронов на внешнем уровне.
Не забывайте о том, что количество внешних электронов равно номеру группы только у элементов, которые находятся в главных подгруппах. У элементов побочных подгрупп количество отрицательно заряженных частиц на последнем энергетическом уровне не может быть больше двух. Например, у скандия (Sc), находящегося в 4 периоде, в 3 группе, побочной подгруппе, их 2. В то время как у галия (Ga), который находится в том же периоде и той же группе, но в главной подгруппе, внешних электронов 3.
При подсчете электронов в атоме, учтите, что последние образуют молекулы. При этом атомы могут принимать, отдавать отрицательно заряженные частицы или образовывать общую пару. Например, в молекуле водорода (H2) общая пара электронов. Другой случай: в молекуле фторида натрия (NaF) общая сумма электронов будет равна 20. Но в ходе химической реакции атом натрия отдает свой электрон и у него остается 10, а фтор принимает – получается тоже 10.
None Источники:
- a так как атом то номер элемента
Вам понадобится.
- Периодическая система химических элементов Д.И. Менделеева.
ИнструкцияБлагодаря умению правильно вычислять количество
протоновнейтронов
или электронов, можно определить валентность химического элемента, а также составить электронную формулу. Для этого потребуется только периодическая система химических элементов Д.И. Менделеева, которая является обязательным справочным материалом.
Таблица Д. И. Менделеева разделена на группы (располагаются вертикально), которых всего восемь, а также на периоды, расположенные горизонтально.
Каждый химический элемент имеет свой порядковый номер и относительную атомную массу, что указано в каждой клетке периодической таблицы. Количество протонов (р) и электронов (ē) численно совпадает с порядковым номером элемента. Для определения числа нейтронов (n) необходимо из относительной атомной массы (Ar) вычесть номер химического элемента.
Пример № 1. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 7. Химический элемент № 7 – это азот (N).
Сначала определите количество протонов (р). Если порядковый номер 7, значит, будет 7 протонов. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 7.
Для определения числа нейтронов (n) из относительной атомной массы (Ar (N) = 14) вычтите порядковый номер азота (№ 7). Следовательно, 14 – 7 = 7. В общем виде вся информация выглядит таким образом:р = +7;ē = -7;n = 14-7 = 7.
Пример № 2. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 20. Химический элемент № 20 – это кальций (Са).
Сначала определите количество протонов (р). Если порядковый номер 20, следовательно, будет 20 протонов. Зная, что это число совпадает с количеством отрицательно заряженных частиц, значит электронов (ē) тоже будет 20.
Для определения числа нейтронов (n) из относительной атомной массы (Ar (Са) = 40) вычтите порядковый номер кальция (№ 20). Следовательно, 40 – 20 = 20. В общем виде вся информация выглядит таким образом:р = +20;ē = -20;n = 40-20 = 20.
Пример № 3. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 33. Химический элемент № 33 – это мышьяк (As).
Сначала определите количество протонов (р). Если порядковый номер 33, значит, будет 33 протона. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 33.
Для определения числа нейтронов (n) из относительной атомной массы (Ar (As) = 75) вычтите порядковый номер азота (№ 33). Следовательно, 75 – 33 = 42. В общем виде вся информация выглядит таким образом:р = +33;ē = -33;n = 75 -33 = 42.
None Источники:
- протон и нейтроны составляют ответ
Данное количество вычисляется по формуле:
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным. Сформулировано Фридрихом Хундом в 1925 году.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
Другая формулировка: Ниже по энергии лежит тот атомный терм, для которого выполняются два условия. -Мультиплетность максимальна -При совпадении мультиплетностей суммарный орбитальный момент L максимален.
Разберём это правило на примере заполнения орбиталей p-подуровня p-элементов второго периода (то есть от бора до неона (в приведённой ниже схеме горизонтальными чёрточками обозначены орбитали, вертикальными стрелками — электроны, причём направление стрелки обозначает ориентацию спина):
Как видно, сначала появляется один электрон на 2px-орбитали, затем один электрон на 2py-орбитали, после этого один электрон на 2pz-орбитали, затем появляются парные электроны на 2px-, 2py– и 2pz-орбиталях.
21. Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
Когда энергия бомбардирующих анод электронов становится достаточной для вырывания электронов из внутренних оболочек атома, на фоне тормозного излучения появляются резкие линии характеристического излучения. Частоты этих линий зависят от природы вещества анода, поэтому их и назвали характеристическими.
Состояние атома с вакансией во внутренней оболочке неустойчиво. Электрон одной из внешних оболочек может заполнить эту вакансию, и атом при этом испускает избыток энергии в виде фотона характеристического излучения: Все переходы на k-оболочку образуют K-серию, соответственно, на l- и m-оболочки – L- и M-серии (рис. 2.8). Английский физик Генри Мозли в 1913 году установил закон, названный его именем, связывающий частоты линий рентгеновского спектра с атомным номером испускающего их элемента Z:
Здесь , постоянная Ридберга; σ – постоянная, учитывающая экранирующую роль окружающих ядро электронов. Чем дальше электрон от ядра, тем σ больше.
На рис. 2.9 показана графическая зависимость закона.
Закон Мозли позволил по измерению длин волн λ рентгеновских лучей точно установить атомный номер элемента. Он сыграл большую роль при размещение элементов в таблице Менделеева.
22. Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. PQ– и R-ветви.
Молекула — частица, образованная двумя или большим количеством атомов, характеризующаяся определённым количеством входящих в неё атомных ядер и электронов, а также определённой структурой.
Энергия свободной молекулы состоит из энергии поступательного движения молекулы как единого целого, энергии колебания атомов внутри молекулы, энергии вращения целой молекулы и ее частей относительно друг друга, энергии электронного возбуждения молекулы (энергия движения электронов в молекуле) и внутриядерной энергии:
Е=Епост +Евр+Екол +Еэл +Еяд.
Молекулярные спектры – спектры испускания и поглощения электромагнитного излучения и комбинацию рассеяния света, принадлежащие свободным или слабо связанным молекулам. Имеют вид совокупности полос (линий) в рентгеновской, УФ – видимой, ИК и радиоволновой областях спектра. Положение полос (линий) в спектрах испускания и поглощения характеризуется частотами v и волновыми числами υ; оно определяется разностью энергий Е’ и Е: тех состояний молекулы, между которыми происходит квантовый переход: 23. Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Фермионы и бозоны.
КРОНИГА – ПЕННИ МОДЕЛЬ – одномерная, точно решаемая модель движения электронов в периодич. поле, иллюстрирующая природу возникновения энергетич. зон в кристалле (см. Зонная теория). Предложена Р. Кронигом (R. Kronig) и У. Дж. Пенни (W.G. Penney) в 1931. В К–П. м. потенциал V(x), создаваемый кристаллич. решёткой, аппроксимируется периодич. последовательностью прямоугольных потенц. ям глубиной V и шириной а, разделённых потенц. барьерами шириной Ь, так что постоянная решётки равна а+Ь (рис. 1). Решение ур-ния Шрёдингера с потенциалом V(x)имеет вид плоской волны, модулированной с периодом решётки:
В основе зонной теории лежит так называемое адиабатическое приближение. Кван-тово-механическая система разделяется на тяжелые и легкие частицы – ядра и электроны. Поскольку массы и скорости этих частиц значительно различаются, можно считать, что движение электронов происходит в поле неподвижных ядер, а медленно движущиеся ядра находятся в усредненном поле всех электронов. Принимая, что ядра в узлах кристаллической решетки неподвижны, движение электрона рассматривается в постоянном периодическом поле ядер.
Далее используется приближение самосогласованного поля. Взаимодействие данного электрона со всеми другими электронами заменяется действием на него стационарного электрического поля, обладающего периодичностью кристаллической решетки. Это поле создается усредненным в пространстве зарядом всех других электронов и всех ядер. Таким образом, в рамках зонной теории многоэлектронная задача сводится к задаче о движении одного электрона во внешнем периодическом поле – усредненном и согласованном поле всех ядер и электронов.
Фермио́н — частица (или квазичастица) с полуцелым значением спина. Своё название получили в честь физика Энрико Ферми.
Примеры фермионов: кварки (они формируют протоны и нейтроны, которые также являются фермионами), лептоны (электроны, мюоны, тау-лептоны, нейтрино), дырки (квазичастицы в полупроводнике)[1].
Фермионы подчиняются статистике Ферми — Дирака: в одном квантовом состоянии может находиться не более одной частицы (принцип Паули). Принцип запрета Паули ответственен за стабильность электронных оболочек атомов, делая возможным существование сложных химических элементов. Он также позволяет существовать вырожденной материи под действием высоких давлений (нейтронные звёзды). Волновая функция системы одинаковых фермионов антисимметрична относительно перестановки двух любых фермионов. Квантовая система, состоящая из нечётного числа фермионов, сама является фермионом (например, ядро с нечётным массовым числом A; атом или ион с нечётной суммой A и числа электронов).
Бозо́н (от фамилии физика Бозе) — частица с целым значением спина. Бозоны, в отличие от фермионов, подчиняются статистике Бозе — Эйнштейна, которая допускает, чтобы в одном квантовом состоянии могло находиться неограниченное количество одинаковых частиц. Системы из многих бозонов описываются симметричными относительно перестановок частиц волновыми функциями.
24. Расщепление энергетических уровней и образование зон. Различие между металлами, полупроводниками и диэлектриками в зонной теории.
Несмотря на то, что метод сильной связи применим для электронов глубоких энергетических уровней, он хорошо иллюстрирует общие закономерности образования энергетических зон при сближении изолированных атомов и образования из них кристаллической решетки. Рассмотрим качественно картину возникновения энергетических зон на примере образования кристаллической решетки из изолированных атомов натрия. Электронная структура Na (1s2s2p3s): всего в атоме 11 электронов, по два электрона на 1s и 2s уровнях, 6 электронов на уровне 2р, последний заполненный уровень в атоме натрия – 3s, на котором находится один валентный электрон. Поскольку в приближении сильной связи предполагается, что состояние электрона в кристалле незначительно отличается от его состояния в изолированном атоме, будем в оценке влияния на это состояние кристаллического поля соседних атомов исходить из энергетической структуры изолированного атома. На рис. 2.1,а показаны схематически энергетические уровни и распределение электронов на них для атомов натрия, находящихся на достаточно большом расстоянии друг от друга так, что потенциальные кривые электронов не перекрываются (взаимодействие между атомами пренебрежимо мало). Состояния электронов в этом случае описываются волновыми функциями изолированного атома, разрешенные уровни энергии дискретны и определяются квантовыми числами n, l, m – главным, орбитальным, магнитным соответственно. На каждом невырожденном по энергии уровне могут находиться с учетом спина по два электрона, а на каждом вырожденном по орбитальному квантовому числу уровне 2(2l +1) электронов.
Различие между металлами и диэлектриками с точки зрения зонной теории состоит в том, что при 0 К в зоне проводимости металлов имеются электроны, а в зоне проводимости диэлектриков они отсутствуют. Различие же между диэлектриками и полупроводниками определяется шириной запрещенных зон: для диэлектриков она довольно широка (например, для NaCl DЕ=6 эВ), для полупроводников — достаточно узка (например, для германия DЕ=0,72 эВ). При температурах, близких к 0 К, полупроводники ведут себя как диэлектрики, так как переброса электронов в зону проводимости не происходит. С повышением температуры у полупроводников растет число электронов, которые вследствие теплового возбуждения переходят в зону проводимости, т. е. электрическая проводимость проводников в этом случае увеличивается.
25. Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
26. Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
Силы, действующие между нуклонами в ядре и обеспечивающие существование устойчивых ядер, называются ядерными силами. Ядерные силы обладают рядом особых свойств:
1) Эти силы не относятся ни к одному из типов сил, известных в классической физике. 2) Ядерные силы – силы короткодействующие. Расстояние r , на котором действуют ядерные силы, называются радиусом действия ядерных сил ( r = 2*10-15 м).
3) Они обладают свойством зарядовой независимости. 4) У них имеется свойство насыщения: каждый нуклон взаимодействует только с ограниченным числом ближайших к нему нуклонов, а не со всеми нуклонами ядра.
5) Ядерные силы не являются центральными силами, в отличие от кулоновских и гравитационных сил.
6) Ядерные силы имеют обменный характер. Это проявляется в том, что силы, действующие между двумя ядерными частицами, рассматриваются как результат обмена между ними некоторой промежуточной частицей( Pi – мезоном) Ядерные силы детально не изучены до сих пор. Законченной теории ядерных сил не существует. Плодотворным методом изучения различных свойств атомного ядра является метод моделей ядра, основанной на внешней аналогии свойств атомных ядер со свойствами других систем, хорошо изученных в физике.
В капельной модели ядро рассматривается как сферическая капля несжимаемой заряженной ядерной жидкости радиуса R = rA. То есть в энергии связи ядра учитываются объемная, поверхностная и кулоновская энергии. Дополнительно учитываются выходящие за рамки чисто капельных представлений энергия симметрии и энергия спаривания. В рамках этой модели можно получить полуэмпирическую формулу Вайцзеккера для энергии связи ядра.
Eсв(A,Z) = aA – aA – aZ/A – a(A/2 – Z)/A + aA.
Первое слагаемое в энергии связи ядра, подобного жидкой капле, пропорционально массовому числу A и описывает примерное постоянство удельной энергии связи ядер. Второе слагаемое – поверхностная энергия ядра уменьшает полную энергию связи, так как нуклоны, находящиеся на поверхности имеют меньше связей, чем частицы внутри ядра. Это аналог поверхностного натяжения. Третье слагаемое в энергии связи обусловлено кулоновским взаимодействием протонов. В капельной модели предполагается, что электрический заряд протонов равномерно распределен внутри сферы радиуса R = r0A1/3.
Четвертое слагаемое – энергия симметрии ядра отражает тенденцию к стабильности ядер с N = Z. Пятое слагаемое – энергия спаривания учитывает повышенную стабильность основных состояний ядер с четным числом протонов и/или нейтронов. Входящие в формулу коэффициенты a1, a2, a3, a4 и a5 оцениваются из экспериментальных данных по знергиям связи ядер, что дает
| Экспериментальные значения удельной энергии связи и расчет по формуле Вейцзеккера |
a = 15.75 МэВ; a = 17.8 МэВ; a = 0.71 МэВ; a = 94.8 МэВ;
На рисунке показаны экспериментальные значения удельной энергии связи = Eсв/A и расчет по формуле Вайцзеккера (плавная кривая). Формула Вайцзеккера позволяет по заданным значениям A и Z вычислять энергию связи ядра с погрешностью ~10 МэВ. При A 100 это дает относительную ошибку ~10-2. Наибольшее расхождение между эспериментально измеренными величинами энергии связи ядра и расчетами по формуле Вайцзеккера наблюдается в области магических чисел. Это объясняется тем, что в капельной модели не учитываются неоднородности распределения ядерной материи, обусловленные оболочечной структурой атомных ядер.
27. Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
Нет такого эксперимента, хотя есть много экспериментов, где количество электронов в атоме измеряется как побочный эффект. Мы знаем, что атомы электрически нейтральны, поэтому должно быть одинаковое количество электронов и протонов. Мы знаем, что последовательные элементы в периодической таблице создаются путем увеличения числа протонов, поэтому мы знаем, сколько электронов должно иметь атомы. Так, например, мы знаем, что атом углерода имеет шесть протонов, поэтому он должен иметь шесть электронов. Возможно, это только перемещает проблему назад на один шаг. Тогда возникает вопрос: откуда у атома углерода шесть протонов? В наши дни это невероятно просто, поскольку мы просто очень точно измеряем массу углеродного ядра и, поскольку мы знаем массы протонов и нейтронов, мы можем сказать, сколько в нем протонов и нейтронов. Исторически атомный номер был получен в основном путем дедукции, а не прямого измерения. Я сказал, что были эксперименты, которые измеряют количество электронов как побочный эффект. В течение многих лет эксперименты на коллайдере проводились с атомными ядрами. В настоящее время это делается в RHIC и эксперименте LHC ALICE, но это было сделано задолго до этого. Атомы лишены электронов при прохождении через углеродную пленку, и их ядерный заряд затем измеряется как побочный эффект их ускорения. Для ядра углерода мы измеряем заряд 6 6 следовательно, нейтральный атом углерода должен иметь шесть электронов. easymoden00b должен ли атом иметь шесть делимых электронов? Или это больше электронная пленка (с различными областями плотности), которая имеет общее значение -6? jamesqf @ easymoden00b: Да, а потом снова нет. Короткий ответ: это квант. Длинный ответ, вероятно, требует ученой степени по физике 🙂 Джон Ренни @ easymoden00b: электроны в атоме делокализованы, т.е. у них нет позиции. Это не значит, что они разложены в фильме, это означает, что у квантовых объектов просто нет позиции. Таким образом, атом углерода всегда имеет шесть электронов, но в нем нет шести маленьких точек электрона. Андалуз Итак, поскольку мы знаем массы протонов, нейтронов и электронов, мы можем вывести из этих данных количество этих частиц? Я просто не могу это проглотить. При всем моем уважении (и извините за отсутствие знаний), но я не могу понять, как вы можете подсчитать количество частиц, просто измеряя их массу. А что вы имеете в виду, отрывая электроны от атома? Все ли электроны полосаты или как внешняя оболочка?
Источники:
- www.kakprosto.ru
- www.kakprosto.ru
- cyberpedia.su
- askentire.net