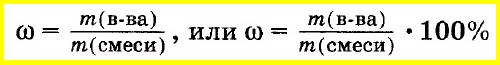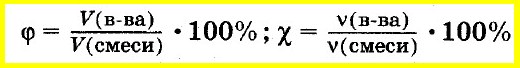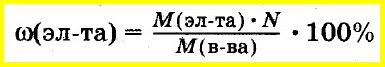Задачи на определение количественного состава смеси – частые гости на экзаменах или контрольных любых уровней и классов. Многие из этих задач имеют схожую идею решения, поэтому, поняв основные принципы и методы, можно с легкостью решить задачу любой сложности на эту тематику.
Воздействие на смесь химическими реактивами
Первой идеей, или типом задач, являются те, где на смесь действуют определенными химическими реактивами. Эти вещества взаимодействуют только с одним компонентов смеси, что позволяет рассчитать его массу. Необходимым для решения являются знания характерных химических реакций, ведь без этого, попросту нереально написать соответствующие уравнения реакций. Рассмотрим это на таком примере.
Пример 1
Смесь, масса которой 41,8 г, которая содержит натрий карбонат, натрий нитрат и натрий сульфат, поместили в раствор H2SO4, масса которого равна 98 г, а массовая часть кислоты – 10%, и нагрели. Выделилось 2,24 л газа. К полученному раствору добавили избыток барий хлорида и получили 46,6 г осадка. Определите массовую часть натрий нитрата в исходной смеси.
Решение
Итак, первое, что нужно определить: какой газ выделяется при растворении в сульфатной кислоте? Это только карбонат натрия, другие компоненты не взаимодействуют с сульфатной кислотой. Тогда:
Na2CO3 + H2SO4 →rightarrow Na2SO4 + CO2 ↑uparrow + H2O
Тогда найдем количество моль газа и карбоната натрия:
nCO2=V/V0=2,24/22,4=0,1 моль
Далее в раствор добавляют хлорид бария. Как известно, ионы бария взаимодействую с сульфат-ионами и выпадает осадок сульфата бария.
Ba2+ + SO42- →rightarrow BaSO4
Стоит быть внимательным, т.к. в растворе есть два источника сульфат-ионов – сульфат натрия и сульфатная кислота. Можем найти, сколько было сульфата натрия:
nBaSO4=m/Mr=46,6/(233)=0,2 моль
nH2SO4=m/Mr=mр-ра ⋅cdot W/Mr=98 ⋅cdot 0,1/98=0,1 моль
Таким образом, nNa2SO4=nBaSO4 – nH2SO4 = 0,2 – 0,1=0,1 моль
Теперь, зная сколько было натрий сульфата и карбоната, можем найти массу натрий нитрата:
mNa2SO4=n ⋅cdot Mr=0,1 ⋅cdot 142=14,2 г
mNa2CO3=n ⋅cdot Mr=0,1 ⋅cdot 106=10,6 г
mNaNO3=m- mNa2CO3 – mNa2SO4=41,8-14,2-10,6=17 г
WNaNO3=mNaNO3/m=17/41,8 ⋅cdot 100%=40,67%
Нахождение состава смеси по плотности
Другим типом задач является нахождение состава смеси по известной плотности. Для решения таких задач требуется умение составления и решения несложных уравнений. Рассмотрим этот тип задач на таком примере
Пример 2
Смесь водорода и аммиака имеет плотность в 12,57 раза меньше плотности углекислого газа. Определите объемную часть водорода в смеси.
Решение
Сначала найдем, какую плотность имеет смесь. Как известно, плотность прямо пропорциональна молярной массе, поэтому молярная масса смеси
Mrсмеси=MrCO2/12,57=44/12,57=3,5 г/моль
Далее, пусть x – объемная доля водорода в смеси, тогда (1-х) – объемная доля аммиака. Тогда, составим такое уравнение:
MrH2 ⋅cdot x+MrNH3 ⋅cdot (1-x)=Mrсмеси
2 ⋅cdot x + 17 ⋅cdot (1-x)=3,5
15x=13,5
x=0,9
Или 90% водорода в смеси.
Взаимодействие реагента с обоими компонентами смеси
Далее рассмотрим тип задач, в которых реагент взаимодействует с обоими компонентами смеси. Для решения таких задач нужно составить уравнение. Рассмотрим такой пример.
Пример 3
На 25 г смеси алюминия и меди подействовали концентрированной азотной кислотой и нагрели. Получили 33,6 л газа. Определите массовую часть алюминия в смеси.
Решение
Первое, что нужно сделать – написать уравнения реакций:
Cu + 4HNO3 →rightarrow Cu(NO3)2 + 2NO2 + 2H2O
Al + 6HNO3 →rightarrow Al(NO3)3 + 3NO2 + 3H2O
Стоит отметить, что здесь азотная кислота реагирует с алюминием, поскольку взята горячая кислота.
Заметим, что на один моль меди приходится 2 моль газа, а на 1 моль алюминия – 3 моль газа.
Найдем количество газа:
n=V/V0=33,6/22,4=1,5 моль
Далее составим такой уравнение:
Пусть x г – масса алюминия в смеси, тогда (25-х) г – масса меди.
Тогда:
(nAl) ⋅cdot 3+(nCu) ⋅cdot 2=0,5
Или x/MrAl ⋅cdot 3+(25-x)/MrCu ⋅cdot 2=1,5
(x/27) ⋅cdot 3+(25-x) ⋅cdot 2/64=1,5
Решая, получаем х=9 г
Или W=m/mсмеси=9/25 ⋅cdot 100%=36%
В итоге, имеем, что для успешной борьбы с задачами на определение количественного состава смеси, важно иметь знания как в химии, так и обладать определенными математическими навыками.
Решение задач с долей вещества в смеси, в соединении
Ключевые слова конспекта: массовая доля вещества в смеси или растворе, молярная доля вещества, объемная доля вещества, массовая доля элемента в соединении, масса элемента, массовая доля элемента.
Массовую долю вещества в смеси или растворе вычисляют как отношение массы вещества, входящего в состав смеси, к массе всей смеси. Массовую долю часто выражают в процентах. Для этого отношение массы вещества к массе смеси умножают на 100%:
Аналогично объемную долю вещества вычисляют как отношение объема вещества к объему смеси, а молярную долю вещества — как отношение количества вещества одного из компонентов смеси к сумме количеств веществ всех компонентов смеси:
Массовую долю элемента в соединении вычисляют как отношение массы элемента, входящего в состав данного соединения, к массе всего соединения:
Зная молекулярную формулу соединения, массу элемента, входящего в его состав, вычисляют как произведение молярной массы элемента на число атомов этого элемента в соединении.
В этом случае массовую долю элемента в соединении рассчитывают как отношение этой величины к молярной массе всего соединения:
Цитаты из пособия «Задачи по химии 8-9 кл.» (авт. О.С. Габриелян и др.) использованы в учебных целях. Ссылка на покупку книги указана в конце конспекта.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача № 1.
25 г оксида магния смешали с 35 г оксида алюминия. Определите массовую долю оксида магния в данной смеси.
Ответ. ω(MgO) = 0,417, или 41,7%.
Задача № 2.
Вычислите объемную долю азота в смеси газов, содержащей 32 л азота, 48 л углекислого газа, 36 л гелия и 14 л водорода.
Ответ. φ(N2) = 0,246, или 24,6%.
Задача № 3.
Вычислите молярную и массовую долю (в %) оксида углерода (II) в смеси, содержащей 16,8 л (н. у.) оксида углерода (II) и 13,44 л (н. у.) оксида углерода (IV).
Ответ. χ(СО) = 55,56%, ω(СО) = 44,3%.
Задача № 4.
В воде растворили 15 г хлорида натрия. Вычислите массу полученного раствора, если массовая доля соли в нем равна 5%.
Ответ: m(р-ра) = 300 г.
Задача № 5.
Образец сплава меди с цинком имеет массу 75 г. Массовая доля меди в этом сплаве равна 64%. Определите массу цинка в данном образце.
Ответ. m(Zn) = 27 г.
[highlight]Задача № 6.[/highlight] Объемная доля аммиака в смеси с кислородом равна 40%. Вычислите плотность данной смеси по воздуху.
Посмотреть РЕШЕНИЕ
Ответ. Dвозд(смеси) = 0,896.
Задача № 7.
Найдите массовую долю кислорода в фосфате натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω (O) = 39%.
[highlight]Задача № 8.[/highlight] Определите массовую долю фосфора в смеси, содержащей 55 г фосфата натрия и 70 г дигидрофосфата натрия.
Посмотреть РЕШЕНИЕ
Ответ. ω(Р) = 22,77%
[highlight]Задача № 9.[/highlight] Массовая доля серы в техническом сульфате натрия равна 20,48%. Рассчитайте массовую долю примесей в данном продукте (в %).
Посмотреть РЕШЕНИЕ
Ответ. ω (примесей) = 9,12%.
Задача № 10.
Плотность смеси оксида азота (II) и оксида азота (IV) по водороду равна 17,8. Найдите массовую долю оксида азота (IV) в данной смеси.
Посмотреть РЕШЕНИЕ
Ответ. ω(NO2) = 45,2%.
Решение задач с долей вещества в смеси, в соединении. Выберите дальнейшие действия:
- Перейти к следующей теме: Решение задач на вывод формул соединений
- Вернуться к списку конспектов по Химии.
- Проверить знания по Химии.
- Купить книгу Задачи по химии и способы их решения. 8-9 кл. / О.С. Габриелян и др. — М.: Дрофа.
1.Находим
количество вещества газовой смеси: υ(смеси)= =14/22,4=0,625(моль)
2.Вычисляем среднюю молярную массу смеси: М(смеси) = = 25,5:0,625= 40,8(г/моль)
3.
Находим объемную долю азота в смеси: Пусть x—объемная доля
азота в смеси, φ(N2)=x, тогда
(1-x)—объемная
доля оксида углерода(IV) в
смеси, φ (CO2)= 1-x
по формуле М(смеси)= φ(N2) × М(N2) + φ (CO2) × М(CO2)
40,8= x×28 +
(1-x) ×
44 откуда x=0,2
или x=20%
φ(N2)=20%
φ (CO2)=1-0,2=0,8
или 80%
4.
Определяем мольную долю азота в смеси. По закону Авогадро объемная доля газа
в смеси равна его мольной доле, поэтому φ(N2)= χ(N2)=0,2
или 20%
5.
Вычисляем массовую долю азота в смеси, на основе формулы χ(N2)= υ(N2)/ υ(смеси)
находим
количество вещества азота
υ(N2) = χ(N2) × υ(смеси)=0,2×0,625=0,125
(моль), тогда m(N2)= υ(N2) × M(N2)=
0,125×28=3,5(г)
ω(N2)= = 3,5/25,5=0,137 или 13,7%
Все эти
действия можно объединить одной формулой ω(N2)= = 0,2 × 0,625 × 28/25,5=0,137
или
ω(N2)= = 0,2 × 28/40,8 = 0,137 или 13,7%
Ответ:
φ(N2)=20%
; χ(N2)=20%
ω(N2)=13,7%
Здравствуйте, уважаемые читатели!
На днях на просторах интернета мне попалось условие задачи, которая отличалась от ранее разбираемых задач (формата 34 задачи ЕГЭ по химии). К особенностям задачи можно отнести следующие:
- Нахождение состава смеси из четырех компонентов путем последовательной обработки смеси разными реагентами.
- Компоненты смеси, в зависимости от их химических свойств, можно разделить на 2 группы. Это обусловливает специфику используемых на каждом этапе реагентов.
- Так как количество неизвестных величин в любой задаче равно количеству известных величин, даны 4 числовые характеристики получаемых материальных потоков.
- эти характеристики частично заданы в относительной форме (уменьшение или увеличение массы на ….г), поэтому основой решения являлся материальный баланс для конкретного потока (твердого остатка или раствора)
Текст задачи из интернета был неполным. Я взяла на себя смелость его дополнить ( дополнение выделено курсивом).
Итак, Задача 1
Смесь из цинка, оксида цинка, меди и оксида меди (II) обработали раствором щелочи. Масса смеси уменьшилась на 2,27 г, а масса раствора увеличилась на 2.25 г. Остаток растворили в концентрированной азотной кислоте. При этом выделилось 2,24 л бурого газа, масса раствора увеличилась на 5 г. Найти состав исходной смеси.
Решение.
1. Характеристика процессов, происходящих при взаимодействии смеси с раствором щелочи:
а)Zn+2NaOH+2H2O=H2+Na2(Zn(OH)4) (1)
ZnO+2NaOH+ H2O= Na2(Zn(OH)4) (2)
б) Найдем массы прореагировавших цинка и оксида цинка
Согласно условию:
m(Zn)+m(ZnO)=2,27 г (уменьшение массы смеси, произошло за счет растворения компонентов в щелочи)
2,27- m1 (H2 )=2,25 г(изменение массы раствора, складывается за счет перехода компонентов смеси в раствор и удаления выделяющегося водорода из раствора)
Пусть n(Zn)=x моль, n(ZnO)=у моль,тогда выразим изменения массы смеси и раствора и составим систему:
65х+81у=2,27
2,27- х*2=2,25, откуда n(Zn)=x=0,01 моль, n(ZnO)=у=0,02 моль
m(Zn)=0,01*65=0,65 г, m(ZnO)=0,02*81=1,62 г,
2.Характеристика процессов, происходящих при взаимодействии нерастворившейся смеси с конц. HNO3:
а) Сu +4HNO3 =2NO2+Cu(NO3)2+2H2O (3)
СuO +2HNO3 = Cu(NO3)2+ H2O (4)
б)Найдем массу растворившейся меди:
Согласно условию:
n3(NO2)=2,24/22,4=0,1 моль,
тогда n3(Сu)=0,5*0,1=0,05 моль, m (Сu)=0,05*64=3,2 г
в)Найдем массу растворившегося СuO:
m(Сu)+m(СuO)-m(NO2)=5 г(изменение массы раствора, складывается за счет перехода компонентов смеси в раствор и удаления выделяющегося газа из раствора)
тогда m(СuO)=5+m(NO2)-m(Сu)=5+0,1*46-3,2=6,4 г
3.Состав исходной смеси:
mсмеси=0,65+1,62+3,2+6,4=11,87 г
W(Zn)=0,65/11,87=0,055=5,5%,
W(ZnO)=1,62/11,87=0,136=13,6%,
W(Сu)=3,2/11,87=0,27=27%,
W(СuO)=6,4/11,87=0,539=53,9%.
По мотивам задачи 1 мною была составлена задача 2. В то время, как все количественные характеристики задачи 1 прямо характеризуют процессы, протекающие с компонентами смеси (изменение массы смеси, раствора, объем газа), в задаче 2 одна из характеристик носит опосредованный характер. Это масса серы, выделившейся при взаимодействии газовых потоков. Она является ключом к характеристике процесса растворения железа и хрома в кислоте. Итак,
Задача 2.
Смесь порошков 4 металлов (железо, хром, цинк и магний) смешали с избытком холодной концентрированной серной кислоты. Выделился газ с неприятным запахом. После окончания всех реакций масса раствора увеличилась на 7,2 г, масса смеси металлов уменьшилась на 8,9 г. Нерастворившийся остаток нагревали с концентрированной серной кислотой, при этом выделялся газ с резким запахом. После окончания всех реакций масса раствора уменьшилась на 0,42 г. Газы, выделившиеся на первой и второй стадиях процесса, смешали. При этом образовалось 1,44 г простого вещества желтого цвета. Найти состав исходной смеси металлов (% масс).
Решение.
1. Характеристика процессов, происходящих при взаимодействии смеси с холодной H2SO4 конц:
а)4Zn+5H2SO4 конц=4ZnSO4+H2S+4H2O (1)
4Mg+5H2SO4 конц=4MgSO4+H2S+4H2O (2)
б) Найдем массы прореагировавших цинка и магния и количество выделившегося газа:
Согласно условию:
m(Zn)+m(Mg)=8,9 г (уменьшение массы смеси, произошло за счет растворения компонентов в холодной H2SO4 конц)
8,9- m1+2(H2S)=7,2 г(увеличение массы раствора, складывается за счет перехода компонентов смеси в раствор и удаления выделяющегося газа из раствора )
Пусть n(Zn)=x моль, n(Mg)=у моль,тогда выразим изменения массы смеси и раствора и составим систему:
65х+24у=8,9
8,9-0,25(х+у)*34=7,2, откуда n(Zn)=x=0,1 моль, n(Mg)=у=0,1 моль
m(Zn)=0,1*65=6,5 г, m(Mg)=0,1*24=2,4 г,
n1+2(H2S)=0,25(х+у)=0,25*0,2=0,05 моль
2.Характеристика процессов, происходящих при взаимодействии оставшейся смеси металлов с горячей H2SO4 конц:
а)2Fe+ 6H2SO4 конц=Fe2(SO4)3+3SO2+ 6H2O (3)
2Cr+ 6H2SO4 конц=Cr2(SO4)3+3SO2+6H2O (4)
б) выразим изменение массы раствора и количество выделившегося газа:
Согласно условию:
m3+4(SO2)-m(Fe)-m(Cr)= 0,42 г (изменение (уменьшение) массы раствора, складывается за счет перехода компонентов смеси в раствор и удаления выделяющегося газа из раствора )
Пусть n(Fe)=x моль, n(Cr)=у моль,тогда выразим изменение массы раствора
1,5(х+у)*64-56х-52у=0,42 или 40х+44у=0,42 (5)
n(SO2)=1,5(х+у) (6)
3. Характеристика процессов, происходящих при взаимодействии выделившихся газов:
2H2S+SO2=3S+2H2O (7)
n( S) по условию = 1,44/32=0,045 моль;
n1+2(H2S) =0,05 моль; , H2S- в избытке, SO2 – в недостатке
n(SO2)=1/3n( S)=0,045/3=0,015 моль=1,5(х+у) (6)
4. Найдем массы железа и хрома в исходной смеси
Составим систему из уравнений 5 и 6:
40х+44у=0,42
1,5(х+у)=0,015, откуда х=n(Fe)=0,005 моль, у=n(Cr)=0,005 моль
m(Fe)=0,005*56=0,28 г, m(Cr)=0,005*52=0,26 г.
5.Состав исходной смеси металлов:
mсмеси=6,5+2,4+0,28+0,26=9,44 г
W(Zn)=6,5/9,44=0,689=68,9%,
W(Mg)=2,4/9,44=0,254=25,4%,
W(Fe)=0,28/9,44=0,03=3%,
W(Cr)=0,26/9,44=0,027=2,7%.
В заключение хочу отметить, что любая используемая в рассмотренных задачах количественная характеристика могла бы быть выражена через атомистику. Вариативность данного типа задач может быть реализована и через привлечение в качестве одной из четырех количественных характеристик данных по используемым растворам ( в том числе растворимости).
Заранее благодарна за конструктивные замечания и пожелания.
Всего доброго!
P.S. Ответы на комментарии к статье:
Читатели попросили меня рассмотреть задачу, условие которой приведено в комментариях. Сделаю это ниже. Но прежде всего хочу выразить признательность уважаемой Ирине Козыревой. Предлагаемые ею модификации задач несут в себе определенные инсайты по сравнению с исходными вариантами.
Интересным элементом данной задачи считаю то, что , при указанном соотношении компонентов в смеси, не указано, к какому компоненту какое число относится. Недостатком условия, на мой взгляд, является неопределенность по отношению к том, какое соотношение дано (молярное или какое другое) и неудачный (на мой взгляд) подбор числовой информации, приведший меня к необходимости его изменения.
Надеясь на понимание автора задачи, составила свой вариант условия:
Смесь, состоящая из фосфора, кремния, серы и углерода, прокипятили в щелочи. Выделившаяся смесь имела плотность по водороду, равную 7,85. Масса раствора после реакции изменилась на 2,23 г, масса нерастворенного компонента составляет 0,12 г. Мольное соотношение компонентов в смеси составляет 1:6:2:1. Вычислить массовые доли компонентов смеси.
Итак, решение задачи.
1. Характеристика процесса растворения смеси в щелочи:
а)4P+3NaOH+3H2O=PH3+3NaH2PO2(1)
Si+2NaOH+H2O=2H2+Na2SiO3 (2)
3S+6NaOH=2Na2S+Na2SO3+3H2O (3)
Нерастворенным компонентом является углерод, n(C)=0,12/12=0,01 моль.
б) Найдем количественный состав газовой смеси (PH3 и H2):
М смеси= 7,85 *2=15, 7 г
Пусть в 1 моле смеси содержится х моль Н2 и (1-х) моль РН3, тогда:
2х+34(1-х)=15,7, откуда х =0,57 моль
Т.о., мольная доля Н2 в смеси = 0,57, мольная доля РН3 = 0,43.
в)пусть n2(Si)=x моль, тогда n2(Н2)=2x моль,
пусть n1(Р)=у моль, тогда n1(PH3)=0,25у моль,
n1(PH3)/n2(Н2)=0,43/0,57 , т.е.
0,25у/2x=0,43/0,57, откуда у=6 х (1), т.о. n (Р)= 6n (Si)
2. Найдем состав исходной смеси.
а)Согласно условию мольное соотношение между компонентами 1:6:2:1
n (Р):n (Si)=6:1, n(C)= 0,01 моль,
Возможны 2 варианта состава смеси :
n (Р):n (Si):n(C):n(S)=6:1:2:1, откуда
n (Р)=0,03 моль; n (Si)=0,005 моль, n(S)=0,005 моль,
б) выразим изменение массы раствора:
2,23= n (Р)*31+n (Si)*28+n(S)*32-(2n (Si)*2+0,25*n (Р)*34)
или:
2,23= 0,955 – неверно
Второй вариант состава смеси:
n (Р):n (Si):n(C):n(S)=6:1:1:2, откуда
n (Р)=0,06 моль; n (Si)=0,01 моль, n(S)=0,02 моль,
выразим изменение массы раствора:
2,23= n (Р)*31+n (Si)*28+n(S)*32-(2n (Si)*2+0,25*n (Р)*34)
или:2,23=2,23- верно.
т. о, n (Р)=0,06 моль; n (Si)=0,01 моль, n(S)=0,02 моль, n(C)= 0,01 моль.
в) m смеси= 31*0,06+28*0,01+32*0,02+12*0,01=2,9 г
W(P)=64%, W(Si)=9,7%,W(S)=22%,W(С)=4,3%.
Общее впечатление от задачи – очень понравилась. Разного рода недочеты бывают всегда и у самых маститых авторов. Когда составляешь задачу, без ошибок на первом этапе не обойтись (по крайней мере у меня это так). Но красивых задач с таким элементом неопределенности не припомню. Автору – браво!
Расчет состава смесей по химическим формулам
Смеси бывают двухкомпонентные и многокомпонентные. Среди приемов, которые будут рассмотрены, можно выделить, пригодные только для двухкомпонентных смесей и те, которые подходят для расчета состава смесей с любым количеством компонентов.
Предлагаемые способы решения удобнее рассмотреть на конкретных примерах.
Задача 1.1. В каком объемном соотношении необходимо смешать водород и углекислый газ, чтобы получить газовую смесь по плотности равную воздуху.
А. Квадрат Пирса (правило креста). Как известно (закон Авогадро) , равные количества газов занимают равные объемы. Следовательно, если молярные массы газов равны, значит, равны и их плотности. Поэтому, нужно смешать водород и углекислый газ так, чтобы средняя молярная масса полученной газовой смеси была равна молярной массе воздуха (29 г/моль). Определив молярные массы H2 и СO2 , зная среднюю молярную массу воздуха, расставим их в виде треугольника:
H2 2
воздух 29
СO2 44
Найдем разницу в числах по диагонали 2-29=-27; 44-29=15. Отбросив минус, проставим их, в соответствии с диагональю, по которой они были определены 27 – напротив CO2; 15 – напротив H2:
H2 2 15
воздух 29
CO2 44 27
Cоотношение 15:27 и будет ответом. Ответ: Углекислый газ и водород необходимо смешать в объемном соотношении 15:27.
Б. Введем два неизвестных. Примем количество одного компонента за x, а второго – за y. Воспользуемся формулой n=m/M и, преобразовав, получим Mсм= mсм/nсм . Помня, что mcм=m(H2) + m(CO2), а nсм=n(H2) + n(CO2) получим 29=(2х + 44y)/(x + y). Упростив, получим, что 27х=15y. Полученное соотношение говорит о том что, водород с углекислым газом необходимо смешать в молярном (объемном) соотношении 27:15, что подтверждает ответ, полученный при решении способом А.
В. Примем количество одного из компонентов за 1 моль, а второго – за x. Данный способ позволяет рассчитать количество углекислого газа, требуемого на 1 моль водорода. Преобразования, описанные в Б варианте решения, позволяют получить следующее уравнение: 29=(2 + 44x)/1+x . Р 29 + 29x= 2 + 44x Р 27=15x . Полученное выражение означает, что водород с углекислым газом необходимо смешать в соотношении 27:15.
Г. Примем общее количество реагентов за 1 моль, а первого компонента за Х, следовательно, количество второго компонента будет равно 1-x. Воспользовавшись формулой nсм=mсм/Mсм, получим 1=(2х + 44(1-x))/29, Р 29=2x + 44 – 44x. Совершив необходимые преобразования, получим 42x=15 Р x=15/42, а 1-x=27/42 Р x/(1-x)=15/27. Полученный ответ подтверждает справедливость выбранного способа решения.
Д. Решение задачи с использованием понятия “доля”. Можно воспользоваться следующим правилом: вклад выделенной величины X, характеризующей каждый компонент смеси, в суммарную величину, характеризующую всю смесь, пропорционален его доле (которую в общем виде можно обозначить как e). Для смеси, состоящей из компонентов а, b, …,i, математически это правило можно выделить следующим образом:
X(a)•e(a) + X(b) •e(b) + … + X(i)•e(i)= X(см). (13)
Исходя их определения доли, необходимо помнить, что сумма долей всех компонентов смеси равна 1 или 100% (в зависимости от способа выражения). Выбор вида доли (массовая, объемная, мольная) определяется анализом условия каждой конкретной задачи.
Для решения задачи данным методом нужно определить характеристику, о которой идет речь в задании – это молярная масса смеси и составляющих компонентов. Приняв мольную долю H2 за x, а CO2 – за (1-x) получим выражение 29=2x + 44(1-x). Преобразовав, получим 42 x=15 Р x=15/42; 1-x=27/42, а отношение x/(1-x)=15:27.
Задача 1.2. Природный хлор представлен двумя изотопами 35Сl и 37Сl. Во сколько раз ядер 35Сl больше, чем ядер 37Сl?
Для решения представленной задачи подходят все описанные способы решения (А-Д). Однако, наиболее простым получается решение при использовании правила креста (А).
35Сl 35 1,5
35,5
37Cl 37 0,5
Полученное соотношение 1,5:0,5 свидетельствует, что атомов хлора с массовым числом 35 в три раза больше.
Задача 1.3. Какие массы 96% и 10% серной кислоты необходимо взять для получения 400 г 40% серной кислоты?
Подходят все способы решения (А-Д). Наиболее простым способом для решения задач подобного типа является правило креста (А):
96 30
40
10 56
30: 56 или 15:28 (на 15 массовых частей 96% серной кислоты нужно взять 28 частей 10% кислоты). Т.е. 15x + 28x=400 Р 43x=400, x=9,3. Масса 96% серной кислоты равна 15·9,3=139,5; Масса 10% серной кислоты равна: 28·9,3=260,5.
Рассмотрим способ решения этой задачи через введение двух неизвестных (Б).
Однако, в данном случае, удобнее оперировать с массами. Примем массу 96% серной кислоты за x, а 10% – за y. Тогда, из определения массовой доли (5) получим: 0,4=(0,96x + 0,10y)/(x + y) Р 0,4x + 0,4y = 0,96x + 0,10y Р 0,30y = 0,56x. C другой стороны x + y = 400.
Получив систему уравнений 0,30y = 0,56x
y = 400 – x,
решим ее 0,3 ·(400 – x) = 0,56x Р 120 – 0,3x = 0,56x Р 0,86x = 120 Р x=139,5, что вполне согласуется с ответом, полученным при решении задачи методом креста.
Задача 1.4. Найдите массовую долю этанола в водном растворе спирта, в котором содержание кислорода как элемента составляет 50%.
Подходят все способы, но проще задача решается методом креста:
Определив массовые доли кислорода в этаноле и в воде по уравнению (5).
Расставим их согласно правилу
этанол (wo%) 35 39
смесь (wo%) 50
вода (wo%) 89 15
Полученные значения показывают, что этанол с водой необходимо смешать в массовом соотношении 39:15. Отсюда, массовая доля этанола равна 39/(39+15)=0,722 или 72,2%.
Задача 1.5. Найдите массовую долю формальдегида в формалине (водный раствор формальдегида), в котором на 11 протонов приходится 9 нейтронов.
Решить эту задачу, используя правило креста (А), вряд ли удастся. Тем не менее, для ее решения подойдет любой из методов (Б-Д). Воспользуемся методом В, приняв количество формальдегида за 1, а воды за x. Подсчитаем суммарное количество протонов и суммарное количество нейтронов в означенных количествах веществ (в молекуле формальдегида на 16 протонов приходится 14 нейтронов, а в молекуле воды – на 10 протонов – 8 нейтронов). Суммарное количество протонов будет равно (в молях) (16 + 10x); а нейтронов (14 + 8x). Откуда, (16 + 10x)/(14 + 8x) = 11:9. Преобразовав уравнение, получим 144 + 90x = 154 + 88x Р 2x=10, а x=5. Полученный результат показывает, что на 1 моль формальдегида необходимо взять 5 моль воды. Воспользовавшись уравнением (5) найдем массовую долю формальдегида: w=30/(30 + 5·18)= 0,25 или 25%.
Задача 1.6. Определить объемную долю SO2 в смеси с SO3, в которой на 5 атомов серы приходится 12 атомов кислорода.
Для решения этой задачи подойдут все методы (Б-Д), кроме правила креста. Воспользуемся для ее решения методом Г. Примем общее количество газов за 1 моль, количество SO2 – за x моль, а SO3 – за (1-х)моль. Подсчитаем общее количество атомов серы – (x + (1-x)) и атомов кислорода – (2x + 3(1-x)). Разделив полученные выражения, приравняем их к требуемому значению: 1/(3-x)=5:12. Воспользовавшись правилом пропорции, получим: 15-5x=12 Р 5x=3. Полученное выражение свидетельствует, что мольная (для газов значит и объемная) доля SO2 составляет 3/5, а SO3 – 2/5 (60% и 40%, соответственно).
Задача 1.7: Определить массу 10 л (н. у.) газовой смеси, в которой на 1 молекулу метана приходится 2 молекулы этана, 3 молекулы пропана и 4 молекулы бутана.
1 способ: Для решения этой задачи подходит способ Д. Воспользовавшись уравнением 11, определим среднюю молярную массу смеси. Мольные доли метана, этана, пропана и бутана равны 0.1, 0.2, 0.3 и 0.4 соответственно. Поэтому, уравнение 11 приобретет вид Mсм=0.1·16 + 0.2·30 + 0.3·44 + 0.4·58. Р Мсм=44,8 г/моль. Воспользовавшись уравнениями (1) и (2) определим массу 10 л газовой смеси. m=10:22,4·44,8=20 г.
2 способ: Решение данной задачи возможно и через введение неизвестного. Определим объемы газов. Если, объем метана равен х, тогда объем этана – 2х, пропана – 3х, а бутана – 4х. Тогда х + 2х + 3х + 4х = 10 Р х = 1 л. Определив массы 1 л метана, 2 л этана, 3 л пропана и 4 л бутана, сложим их, найдя массу 10 л газовой смеси: 1:22,4·16 + 2:22,4·30 + 3:22,4·44 + 4:22,4·58 = 20 г.
Задача 1.8. Какую массу 5% раствора сульфата меди и медного купороса CuSO4·5H2O необходимо взять для получения 400 г 10% раствора сульфата меди?
Оптимальный способ решения данной задачи правило креста. Для использования данного способа необходимо определить массовую долю сульфата меди в кристаллогидрате: w=160/250=0,64.
Далее расположим полученные данные в виде креста
5 % р-р 5 54
смесь 10
СuSO4·5H2O 64 5
Находя разницу по диагонали, получим отношение масс при смешении. Таким образом, масса кристаллогидрата будет равна w (СuSO4·5H2O) ·400 = 54/(54+5) · 400= 366,1 г. Следовательно масса 5 %раствора будет равна 400 – 366,1 = 33,9 г
|
Высшая нервная деятельность
Значение коры больших полушарий.Высшая нервная деятельность (ВНД) — это деятельность коры больших полушарий головного мозга и ближайших к ней подкорковых образований, обеспечивающая наиболее совершенное приспособление (поведение) высокоорганизованных животных и человека к окружающей среде. В работе русского физиолога И. М. Сеченова «Рефлексы головного мозга» … |
Тонга
Королевство Тонга расположено на семисоткилометровой цепочке небольших островов в юго-западной части Тихого океана , к северу от Новой Зеландии .Это очень небольшое государство даже по масштабам Океании. Площадь его составляет всего 699 кв.км. |
|
Megrez 72 ED APO
Мы немножечко про него расскажем, и как всегда, покажем. Все фотографии (если находятся на нашем сервере;-)), как обычно, кликабельны и открываются в новом окне. ТТХ: объектив-дублет на особом стекле со следующими параметрами: D=72мм,F=432 мм , т.е. достаточно светосильный F, естественно FMC), весьма компактный ( в сложеном состоянии длина 300 мм) и довольно легковесный (2200 гр) … |
Шолохов М. А
Шолохов Михаил Александрович (1905, хутор Кружилин станицы Вёшенской Области войска Донского — 1984, станица Вёшенская Области войска Донского — 1984, станица Вёшенская Ростовской области), писатель, академик АН СССР (1939), Герой Социалистического Труда (1967, 1980). Автор посвященных драматическим судьбам донского казачества сборников рассказов («Донские рассказы», «Лазоревая степь», оба … |