сколько грамм алюминия в одном молле?
Хочу на море!
Мастер
(1692),
закрыт
12 лет назад
Валентина Вавилова(Серкова)
Гений
(62183)
12 лет назад
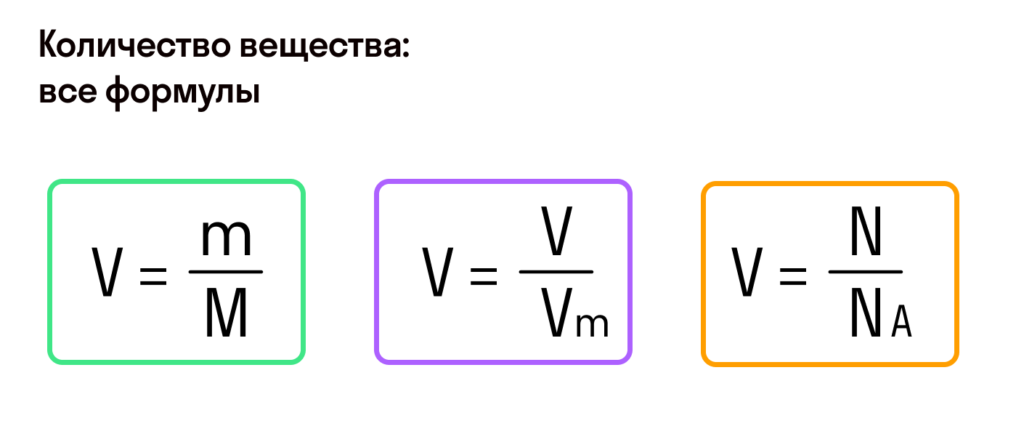
Количество вещества ( число молей) = массу разделить на молярную массу.
v=m / M . ( v (ню) – число молей=1моль, М – молярная масса алюминия ( из таблицы Менделеева ) =0,027кг/моль, m – масса). , выразим массу:
m=v*M . m=1*0,027=0,027кг. ( 27грамм) .
Можно проще молярная масса это масса одного моля, значит если молярная масса=0,027кг/моль, то масса 1 моля = 0,027кг.
Моль — условное количество вещества
Добавлено: 3 октября 2021 в 12:58

Химия — наука, изучающая взаимодействие веществ на атомном и молекулярном уровнях. Эти процессы значительно отличаются от привычного нам макроуровня и поэтому требуют специфических подходов, в том числе к «подсчету» и «взвешиванию».
Школьный курс химии включает понятия «моль» и «молярной массы». Они кажутся сложными, но если разобраться, то вы без труда поймете сущность этих понятий и научитесь ими пользоваться при решении задач.
Моль
Понятие «моль» попытаемся разобрать и, самое главное, понять на примере всем знакомой реакции взаимодействия кислорода и водорода. Когда одна молекула O2 соединяется с двумя молекулами H2, получается две молекулы H2O:
- O2 + 2H2 = 2H2O
То есть, чтобы максимально полно провести химическую реакцию, мы должны взять на каждую молекулу кислорода две молекулы водорода. Итак, у нас есть 100 г кислорода.
Сколько понадобится водорода для протекания процесса? И тут возникает первый вопрос: сколько молекул в 100 г кислорода? Наверное, миллиарды или даже миллиарды миллиардов? И сколько их в 100 г водорода? Уж точно в не в 2 раза меньше.
Как вообще подсчитать молекулы, ведь они бывают совершенно разными, «тяжелыми» и «легкими». Этими вопросами задавались и люди, закладывавшие основу современной химической науки.
Был найден простой выход, который помогает легко и изящно решить проблему. Химики решили взять за единицу измерения не одну молекулу, а определенное их количество, причем очень большое. Таким образом эта единица измерения приводит микроуровень к макроуровню. Она называется «моль».
Моль — это количество вещества из 6,02214076⋅1023 атомов или молекул. Оно не имеет физического смысла и изначально было привязано к массе определенного количества (12 граммов) углерода-12, но позже переопределено, как и многие другие единицы системы СИ.
В школьных расчетах количество структурных единиц в моле, которое также называется постоянной Авогадро, обычно округляют до 6,022⋅1023 и обозначают NA.
С этой величиной связано другое химическое понятие — «количество вещества», то есть количество структурных единиц в определенной его порции. Оно обозначается буквой ν (ню).
Примеры
В стакане содержится 2 моль воды. Сколько молекул воды находится в стакане?
- N = ν⋅ NA =2 ⋅ 6,022⋅1023 = 12,044⋅1023 молекул воды.
Также можно решить обратную задачу. Сколько молей вещества составляют 24,088⋅1023 молекул воды?
- ν⋅ = N / NA = 24,088⋅1023 / 6,022⋅1023 = 4 моля.
Что называется молярной массой
Итак, мы поняли, что моль — условное количество вещества, выбранное для удобства химиков. Это даже не миллиарды миллиардов, как мы предположили ранее, а миллиарды триллионов, что никак не облегчает задачу подсчета этих структурных единиц.
Как же все-таки узнать, сколько атомов или молекул в 100 граммах того или иного вещества? Теперь хорошо бы связать количество вещества и его массу, ведь это не одно и то же. Нам поможет «молярная масса» — 1 моль вещества или 6,022⋅1023 структурных единиц этого вещества.
Итак, масса вещества равна массе порции вещества m к количеству молекул ν в его порции:
- М = m / ν.
Вооружившись этим знанием, мы можем переводить граммы в число молекул и наоборот. При этом следует учесть, что молярная масса численно идентична молекулярной массе (то есть массе молекулы), выраженной в атомных единицах массы, и относительной молекулярной массе.
Пример
Найдем массу 5 моль воды.
Чтобы решить эту задачу, обратимся к формуле молярной массы и выразим из нее массу:
- m = М ⋅ ν
В этой формуле мы знаем количество вещества ν = 5 моль, а молярную массу сложной молекулы нужно определить, как сумму молярных масс составляющих ее химических элементов:
- M (H2O) = 2 ⋅M (H) + M (O)
Где взять молярные массы кислорода и водорода (в соединение входит два атома водорода, поэтому его молярную массу умножаем на 2)?
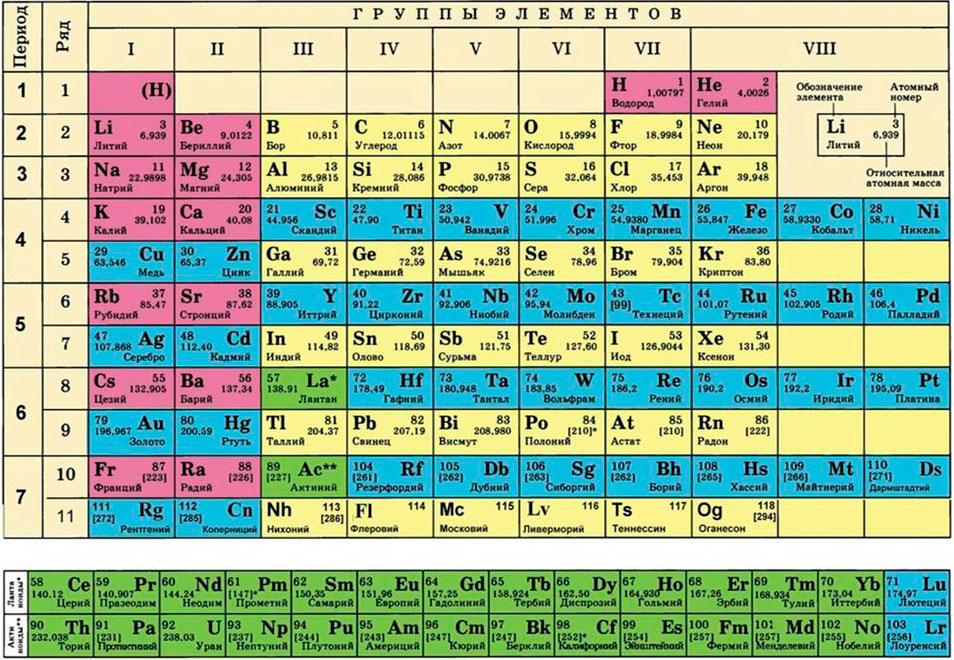
Для этого нам понадобится таблица Менделеева и значение «относительной атомной массы», которая, как мы уже знаем, идентична молекулярной. Это значение приведено для каждого химического элемента и для водорода равно 1,00797 (то есть близко к 1), для углерода — близко к 6, для кислорода — около 16.
Подставим соответствующие значения в исходную формулу и получим:
- M (H2O) = 2 ⋅M (H) + M (O) = 2 ⋅ 1 + 16 = 18 г/моль.
То есть вес 1 моль воды составляет 18 граммов. Теперь можем подсчитать массу 5 моль воды:
- m = М ⋅ ν = 18 ⋅ 5 = 90 г.
Аналогичным образом мы можем подсчитать количество вещества, которое содержится в определенном образце заданной массы. Для примера возьмем оксид алюминия Al2O3 и узнаем, сколько моль в 400 граммах этого вещества. Для этого выразим количество вещества через молярную массу и подставим исходные данные:
- ν = m / М = 400 / (2 ⋅ М (Al) + 3 ⋅ (O)) = 400 / (2 ⋅ 75 + 3 ⋅ 16) = 400 / (150 + 48) = 400 / 198 ≈ 2,02 моль.
Занимайтесь на курсах ЕГЭ и ОГЭ в паре TwoStu и получите максимум баллов на экзамене:

Эксперт по подготовке к ЕГЭ, ОГЭ и ВПР
Задать вопрос
Закончил Московский физико-технический институт (Физтех) по специальности прикладная физика и математика. Магистр физико-математических наук. Преподавательский стаж более 13 лет. Соучредитель курсов ЕГЭ и ОГЭ в паре TwoStu.
Читайте также:
Каждый, кто уже немного продвинулся в изучении химии, сталкивается с понятием «моль». Правда, большинство сразу думает о моли, которая съела за лето шубу в шкафу, но моль в химии – это совсем другая история. И вот сейчас мы в этом разберёмся.
Итак, давайте посмотрим на какую-нибудь химическую реакцию. Например, такую:
Н2+F2=2HF
Здесь 1 молекула водорода H2 реагирует с одной молекулой фтора F2 и получается две молекулы фторида водорода. Напомню, то число молекул или атомов, вступающих в реакцию или получающихся в реакции, определяется коэффициентом, то есть цифрой, стоящей перед формулой вещества. В нашем примере перед водородом не стоит ничего, но на самом деле мы можем поставить здесь единицу, то есть нам нужна 1 молекула водорода. Перед фтором тоже не стоит ничего, значит, нам нужна 1 молекула фтора. А вот перед фторидом водорода HF стоит двойка. Это означает, что у нас получилось 2 молекула фторида водорода. То есть:
Н2 + F2 = 2HF – это то же самое, что и
1 молекула H2 + 1 молекула F2 = 2 молекулы HF.
Но вы знаете, что молекулы так малы, что мы их увидеть не можем. Как же нам считать эти молекулы, вступающие в реакцию? Для этого и ввели понятие МОЛЬ.
Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12.
Это довольно мудрёное определение, но его нужно запомнить. Есть и приятный момент: в одном моле любого вещества содержится число Авогадро частиц. Вот оно, это число:
Такое число представить сложно. Вы только подумайте, миллиард – это 1 000 000 000. А в одном моле частиц 6,02*100 000 000 000 000 000 000 000! (Но чтобы не видеть по ночам кошмаров, просто запомните 6,02*10 в двадцать третьей степени).
Итак, в одном моле любого вещества содержится 6,02*10 в двадцать третьей степени частиц. Но мы же знаем, что атомы разных веществ имеют разное строение, а поэтому и разную массу. Поэтому и массы одного моля у разных веществ различаются. Чтобы разобраться в этом, давайте поедем на дачу и проведём эксперимент.
Мы точно помним, что 1 моль – это всегда одинаковое число частиц (6,02*10 в двадцать третьей степени ). Но в обычной жизни таких чисел нет, поэтому возьмём число поменьше, например, 100. Это будет наш условный экспериментальный моль. Теперь в одну кучу складываем 100 вишен, в другую кучу – 100 груш, в третью – 100 арбузов. Куча – это 1 моль. В каждую кучу мы добросовестно сложили одинаковое число частиц, верно? Но частицы эти разного вида: в одной куче вишни, в другой – груши, в третьей – арбузы. А теперь будем взвешивать. Как вы думаете, будет ли различаться масса 100 вишен, 100 груш и 100 арбузов? Конечно же, будет. При этом обратите внимание: число частиц в каждой куче одинаково, но весят эти кучи по-разному. Почему? Потому что частицы разные!
В химии всё точно так же. Если взять 1 моль водорода, 1 моль кислорода и 1 моль натрия, то масса их будет разной (вспоминаем поездку на дачу). И это важно. Но теперь возникает закономерный вопрос: а как же узнать, какова масса 1 моль водорода, 1 моль кислорода и 1 моль натрия и вообще любого вещества? Для этого вводится понятие молярная масса.
Молярная масса и есть масса 1 моля вещества.
Как её определить? Просто. Это атомная масса или молекулярная масса вещества, которую мы рассчитываем, пользуясь таблицей Менделеева. Молярная масса обозначается буквой М и выражается в г/моль (просто потому, что она показывает сколько граммов вести 1 моль). Примеры из учебника химии.
Пример 1.
Найдите массу одного моля (она же молярная масса) алюминия.
Решаем химию и смотрим в таблицу Менделеева. Видим, что атомная масса алюминия 27. Формула просто вещества алюминия – Al, то есть атом здесь один. Следовательно, молярная масса алюминия совпадает с атомной и равна 27 г/моль.
Пример 2.
Найдите молярную массу фтора.
Фтор у нас в обычных условиях – газ, поэтому молекула фтора состоит из двух атомов и выглядит так: F2. В периодической таблице находим фтор и видим, что его атомная масса 19. Следовательно, молярная масса фтора 2*19=38 г/моль.
Пример 3.
Найдите молярную массу оксида кальция.
Формула оксида кальция СаО. Опять смотрим в таблицу: атомная масса кальция 40, атомная масса кислорода 16. Молярная масса оксида кальция 40+16=56 г/моль.
Пример 4.
Найдите молярную массу оксида кремния.
Формула оксида кремния SiO2. Таблица Менделеева сообщает, что атомная масса кремния 28, кислорода – 16. Будьте внимательны, в этом вопросе подвох! В формуле оксида два атома кислорода, обязательно учтите это, чтобы ответ был верным. И он будет таким: молярная масса оксида кремния 28+16*2=60 г/моль. (16 – масса одного атома кислорода, у нас в формуле их два, поэтому мы и умножили 16 на 2!).
Пример 5.
Сложный пример от репетитора по химии. Но я рекомендую всё-таки вникнуть и разобраться, чтобы прояснить всё окончательно. Итак, ответьте, какова молярная масса серной кислоты.
Здесь придётся сосредоточиться, чтобы не запутаться. Формула серной кислоты H2SO4, то есть у нас имеется:
· 2 атома водорода
· 1 атом серы
· 4 атома кислорода.
Смотрим в периодическую таблицу и определяем атомные массы:
· атомная масса водорода – 1
· атомная масса серы – 32
· атомная масса кислорода – 16.
Переходим к расчёту:
2 атома водорода + 1 атом серы + 4 атома кислорода
2*1 + 1*32 + 4*16
В этом выражении в каждом слагаемом первый множитель – число атомов элемента, второй множитель – атомная масса. Дальше просто математика: 2*1+1*32+4*16=98. И да, молярная масса серной кислоты 98 г/моль.
Уверена, теперь вы различите моль в шкафу и моль в химии. А дальше мы будем разбираться, как взвесить на обычных весах эти моли.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
← Молярная и молекулярная масса
- Относительная молекулярная масса Al: 26.9815386
- Молярная масса Al: 26.9815386 г/моль (0.02698 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| Al (алюминий) | 1 | 26.9815386 | 26.9815386 |
| 26.9815386 |
Расчёт молярной и относительной молекулярной массы Al
- Mr[Al] = Ar[Al] = 26.9815386 = 26.9815386
- Молярная масса (в кг/моль) = Mr[Al] : 1000 = 26.9815386 : 1000 = 0.02698 кг/моль
Электронная конфигурация атома алюминия
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
CH2I2 [267.83552]
C11H10 [142.1971]
Калькулятор молекулярной массы

Решение:
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Как видно из уравнения реакции, 2 моль алюминия будут вступать в реакцию с 3 молями серной кислоты и образованием 1 моля сульфата алюминия.
Найдем количество сульфата алюминия
n (Al2(SO4)3) = m (Al2(SO4)3) / Mr (Al2(SO4)3)
Mr (Al2(SO4)3) = 2*Ar (Al) + 3*Ar (S) + 12*Ar (O) = 342 г/моль
n (Al2(SO4)3) = 3,42 / 342 = 0,01 моль
Алюминия потребовалось в 2 раза больше, чем образовалось сульфата алюминия, т.е. μ (Al) = 0,02 моль
m(Al) = n (Al) * Ar (Al) = 0,02 * 27 = 0,54 г
Ответ: n (Al) = 0,02 моль, m(Al) = 0,54 г
1. В трех сосудах без этикеток находятся белые кристаллы лимонной кислоты, сахара и поваренной соли. Как установить в домашних условиях, где какое вещество?
2. Начертите в тетради приведенную ниже таблицу. В соответствующих графах запишите по три уравнения реакций, в которых участвуют или образуются кислоты.
3. Какие из веществ, формулы которых приведены, реагируют с соляной кислотой: а) CuO; б) Cu; в) Cu(OH)2; г) Ag; д) Al(OH)3?
4. Впишите в схемы химических реакций недостающие формулы веществ.